Профилактика нейтропении и ее инфекционных осложнений - рекомендации
Добавил пользователь Владимир З. Обновлено: 15.01.2026
Рак молочной железы (РМЖ) – самая распространенная форма рака у женщин в промышленно развитых странах. На ранних стадиях этого заболевания успешно используется хирургическое вмешательство с сохранением молочной железы, местная лучевая терапия и системная адъювантная химиотерапия, которая позволяет снизить ежегодный риск рецидива и смерти. Однако проведению адекватной химиотерапии РМЖ могут препятствовать побочные эффекты, в первую очередь нейтропения. Она является причиной снижения дозоинтенсивности химиотерапии, что, в свою очередь, приводит к ухудшению результатов лечения раннего РМЖ.
В ряде исследований показано, что уменьшить риск осложнений и способствовать проведению химиотерапии в запланированных дозах может профилактическое назначение гранулоцитарного/гранулоцитарно-макрофагального колониестимулирующего фактора (Г/ГМ-КСФ). Изучение действия миелоцитокинов привело к созданию новых форм этих препаратов с замедленным выведением, удобных для амбулаторного применения.
- КЛЮЧЕВЫЕ СЛОВА: рак молочной железы, химиотерапия, онкология
Рак молочной железы (РМЖ) – самая распространенная форма рака у женщин в промышленно развитых странах. В США ежегодно отмечается более 190 000 новых случаев и 40 000 смертей от РМЖ [1]. В Российской Федерации заболеваемость на 2010 г. составила 57 200 новых случаев при стандартизованных показателях заболеваемости 42 и смертности 17,4 случая на 100 000 населения [2]. Суммарно данная форма рака в РФ составляет 21% от всех онкологических заболеваний. Немаловажным фактором является тенденция роста заболеваемости РМЖ и повышение медианы возраста заболевших (61 год).
У большинства больных в РФ (63,2% в 2010 г.) рак был диагностирован на I–II стадиях. Стандартным подходом к лечению ранних стадий РМЖ в настоящее время является хирургическое вмешательство с сохранением молочной железы, местная лучевая терапия и системная адъювантная химиотерапия. По данным метаанализа Trialists’ Collaborative Group (Объединенная группа исследователей), проведение адъювантной химиотерапии позволяет снизить ежегодный риск рецидива и смерти на 23,5 и 14,3% соответственно, причем этот эффект отмечается среди пациентов в возрасте до 70 лет [3]. Несмотря на доказанную пользу адъювантной химиотерапии, сохраняются вопросы, связанные с эффективностью и токсичностью ее различных режимов. В частности, пока не вполне ясно, в какой степени интенсивность лечения влияет на показатели выживаемости.
Результаты проведенных клинических исследований подтверждают, что важно придерживаться полной запланированной дозоинтенсивности в адъювантной химиотерапии раннего РМЖ. Значительная доказательная база свидетельствует о том, что существует порог относительной интенсивности дозы (отношение реальной дозы цитостатиков, полученных в единицу времени, к расчетной идеальной дозе), снижение которого существенно ухудшает или даже полностью нивелирует клинический эффект [4–7]. Таким образом, сокращение относительной дозоинтенсивности (ОДИ) может поставить под угрозу результаты химиотерапии. Многие врачи стараются придерживаться критерия, принятого G. Bonadonna и соавт., показавшими, что ОДИ менее 85% от запланированной ведет к значимому снижению результатов лечения раннего РМЖ [8].
1. Jemal A., Siegel R., Ward E. et al. Cancer statistics, 2009 // C.A. Cancer J. Clin. 2009. Vol. 59. № 4. P. 225–249.
2. Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2008 г. // Вестник РОНЦ им. Н.Н. Блохина РАМН. 2010. Т. 21. № 2. Прилож. С. 52–86.
3. Early Breast Cancer Trialists’ Collaborative Group. Polychemotherapy for early breast cancer: an overview of the randomised trials // Lancet. 1998. Vol. 352. № 9132. P. 930–942.
5. Henderson I.C., Berry D.A., Demetri G.D. et al. Improved outcomes from adding sequential Paclitaxel but not from escalating Doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer // J. Clin. Oncol. 2003. Vol. 21. № 6. P. 976–983.
6. Wood W.C., Budman D.R., Korzun A.H. et al. Dose and dose intensity of adjuvant chemotherapy for stage II, node-positive breast carcinoma // N. Engl. J. Med. 1994. Vol. 330. № 18. P. 1253–1259.
7. Chang J. Chemotherapy dose reduction and delay in clinical practice. evaluating the risk to patient outcome in adjuvant chemotherapy for breast cancer // Eur. J. Cancer. 2000. Vol. 36. Suppl. 1. P. S11–S14.
8. Bonadonna G., Valagussa P., Moliterni A. et al. Adjuvant cyclophosphamide, methotrexate, and fluorouracil in node-positive breast cancer: the results of 20 years of follow-up // N. Engl. J. Med. 1995. Vol. 332. № 14. P. 901–906.
9. Lyman G.H., Dale D.C., Crawford J. Incidence and predictors of low dose-intensity in adjuvant breast cancer chemotherapy: a nationwide study of community practices // J. Clin. Oncol. 2003. Vol. 21. № 24. P. 4524–4531.
10. Mayers C., Panzarella T., Tannock I.F. Analysis of the prognostic effects of inclusion in a clinical trial and of myelosuppression on survival after adjuvant chemotherapy for breast carcinoma // Cancer. 2001. Vol. 91. № 12. P. 2246–2257.
11. Budman D.R., Berry D.A., Cirrincione C.T. et al. Dose and dose intensity as determinants of outcome in the adjuvant treatment of breast cancer. The Cancer and Leukemia Group B // J. Natl. Cancer Inst. 1998. Vol. 90. № 16. P. 1205–1211.
12. Crivellari D., Bonetti M., Castiglione-Gertsch M. et al. Burdens and benefits of adjuvant cyclophosphamide, methotrexate, and fluorouracil and tamoxifen for elderly patients with breast cancer: the International Breast Cancer Study Group Trial VII // J. Clin. Oncol. 2000. Vol. 18. № 7. P. 1412–1422.
13. Dees E.C., O’Reilly S., Goodman S.N. et al. A prospective pharmacologic evaluation of age-related toxicity of adjuvant chemotherapy in women with breast cancer // Cancer Invest. 2000. Vol. 18. № 6. P. 521–529.
14. Extermann M., Balducci L., Lyman G.H. What threshold for adjuvant therapy in older breast cancer patients? // J. Clin. Oncol. 2000. Vol. 18. № 8. P. 1709–1717.
15. Balducci L., Yates J. General guidelines for the management of older patients with cancer // Oncology (Williston Park). 2000. Vol. 14. № 11A. P. 221–227.
16. Crawford J., Ozer H., Stoller R. et al. Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer // N. Engl. J. Med. 1991. Vol. 325. № 3. P. 164–170.
17. Bretzel R.L. Jr., Cameron R., Gustas M. et al. Dose intensity in early-stage breast cancer: a community practice experience // J. Oncol. Pract. 2009. Vol. 5. № 6. P. 287–290.
18. Bronchud M.H., Potter M.R., Morgenstern G. et al. In vitro and in vivo analysis of the effects of recombinant human granulocyte colony-stimulating factor in patients // Br. J. Cancer. 1988. Vol. 58. № 1. P. 64–69.
19. Klastersky J. Current attitudes for therapy of febrile neutropenia with consideration to cost-effectiveness // Curr. Opin. Oncol. 1998. Vol. 10. № 4. P. 284–290.
20. Chevallier B., Chollet P., Merrouche Y. et al. Lenograstim prevents morbidity from intensive induction chemotherapy in the treatment of inflammatory breast cancer // J. Clin. Oncol. 1995. Vol. 13. № 7. P. 1564–1571.
21. Johnston E., Crawford J., Blackwell S. et al. Randomized, dose-escalation study of SD/01 compared with daily filgrastim in patients receiving chemotherapy // J. Clin. Oncol. 2000. Vol. 18. № 13. P. 2522–2528.
22. Vogel C.L., Wojtukiewicz M.Z., Carroll R.R. et al. First and subsequent cycle use of pegfilgrastim prevents febrile neutropenia in patients with breast cancer: a multicenter, double-blind, placebo-controlled phase III study // J. Clin. Oncol. 2005. Vol. 23. № 6. P. 1178–1184.
23. Green M.D., Koelbl H., Baselga J. et al. A randomized double-blind multicenter phase III study of fixed-dose single-administration pegfilgrastim versus daily filgrastim in patients receiving myelosuppressive chemotherapy // Ann. Oncol. 2003. Vol. 14. № 1. P. 29–35.
24. Von Minckwitz G., Kümmel S., du Bois A. et al. Pegfilgrastim +/- ciprofloxacin for primary prophylaxis with TAC (docetaxel/doxorubicin/cyclophosphamide) chemotherapy for breast cancer. Results from the GEPARTRIO study // Ann. Oncol. 2008. Vol. 19. № 2. P. 292–298.
25. Almenar D., Mayans J., Juan O. et al. Pegfilgrastim and daily granulocyte colony-stimulating factor: patterns of use and neutropenia-related outcomes in cancer patients in Spain--results of the LEARN Study // Eur. J. Cancer Care (Engl.). 2009. Vol. 18. № 3. P. 280–286.
26. Kuderer N.M., Dale D.C., Crawford J. et al. Impact of primary prophylaxis with granulocyte colony-stimulating factor on febrile neutropenia and mortality in adult cancer patients receiving chemotherapy: a systematic review // J. Clin. Oncol. 2007. Vol. 25. № 21. P. 3158–3167.
27. Lyman G.H., Dale D.C., Wolff D.A. et al. Acute myeloid leukemia or myelodysplastic syndrome in randomized controlled clinical trials of cancer chemotherapy with granulocyte colony-stimulating factor: a systematic review // J. Clin. Oncol. 2010. Vol. 28. № 17. P. 2914–2924.
28. Silber J.H., Fridman M., Shpilsky A. et al. Modeling the cost-effectiveness of granulocyte colony-stimulating factor use in early-stage breast cancer // J. Clin. Oncol. 1998. Vol. 16. № 7. P. 2435–2444.
Библиотека
Инфекционные осложнения у пациентов с ослаблением защитных механизмов могут вызывать представители нормальной флоры кожи и слизистых, а также представители экзогенной флоры, попадающие в организм при употреблении контаминированной пищи или жидкости. Организм препятствует инвазии экзогенных микроорганизмов, если их количество ниже минимального порога, требующегося для колонизации. Опасность представляют повторные и более длительные контакты с патогеном, особенно при повреждении физических защитных барьеров, как, например, при наличии язвы на слизистой или кожного дефекта (сосудистого катетера).
Пациенты со значительным и продолжительным снижением защитных механизмов (глубокая длительная нейтропения) нуждаются в ограничении контактирования с микробами окружающей среды. С этой целью их помещают в чистые или стерильные палаты с ламинарным потоком фильтруемого воздуха (особенно в случае аллогенной трансплантации костного мозга) и исключают прием пищевых продуктов, не прошедших термообработку. Для предотвращения инвазии резидентной флоры с кожи, слизистой дыхательных путей и алиментарного тракта у таких пациентов профилактически применяют противомикробные препараты. Это позволяет снизить риск развития инфекции.
Средства контроля инфекции, передающейся воздушным путем, применяются лишь у пациентов с тяжелыми нарушениями иммунитета (трансплантация костного мозга). Необходимо учитывать сохранение жизнеспособности грамположительных бактерий (стафилококки) и, в особенности, спор грибов (Aspergillus spp.) в воздушной среде в течение нескольких недель. Споры грибов представляют наибольшую опасность, так как они могут концентрироваться в параназальных синусах и, формируя участки роста, вызывать заражение нижнего респираторного тракта. Эта опасность значительно возрастает при строительстве вблизи стационара, когда земляные работы способствуют попаданию спор грибов из почвы с пылью в воздух. Избежать этого можно путем фильтрации воздуха, позволяющей удалить сверхмелкие частицы, с последующей подачей его ламинарным (несмешивающимся) потоком в палату. Существует и более экономичный метод, когда фильтруемый воздух подается в палату под избыточным давлением, препятствуя забросу не стерильного воздуха.
Безусловно, следует исключать прямой контакт персонала, имеющего признаки вирусных простудных заболеваний, с пациентами. Во всех палатах с подачей фильтруемого воздуха регламентируется процедура входа для персонала. В частности, обязательной является обработка рук антисептиками, одевание маски и специальной обуви.
Влажные поверхности способствуют размножению бактерий, особенно таких, как синегнойная палочка. Данный микроорганизм способен выживать в раковинах, унитазах и даже в некоторых дезрастворах. Мытье раковин, унитазов, полов и поверхностей в чистых и стерильных палатах должно осуществляться с использованием дезрастворов, сохраняющих бактерицидные свойства в присутствии биологических жидкостей (кровь, стул и др.). После мытья все предметы должны быть тщательно просушены. Обработка предметов в сухожаровом шкафу при температуре 70-80С помогает значительно снизить их обсемененность синегнойной палочкой и другими бактериями.
Свежие фрукты и овощи нередко загрязнены микроорганизмами почвы, а в некоторых случаях и такими фекальными бактериями как кишечная палочка, клебсиела и синегнойная палочка. Штаммы кишечной палочки, резистентные к различным антибиотикам, выделяются у 50-80% людей в нормальной популяции. Эти микробы могут являться резервуаром плазмид, переносящих резистентность к антибиотикам на другие аэробные бактерии кишечника. Таким образом, свежие овощи и фрукты могут даваться пациентам с нейтропенией только после тщательного мытья и обработки.
4.2 Применение миелостимуляторов для профилактики нейтропении и нейтропенической инфекции после химиотерапии.
Существует прямая зависимость риска развития фебрильной нейтропении от длительности и выраженности снижения лейкоцитов. В связи с этим в последние годы большое внимание уделялось профилактическому применению препаратов, способных уменьшить продолжительность и выраженность нейтропении. Эти препараты, называемые миелоцитокинами, появились в клинической практике в начале 1980х годов. Миелоцитокины - гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (Г-КСФ и ГМ-КСФ) - представляют собой полипептиды, ускоряющие образования и созревание нейтрофилов, эозинофилов и моноцитов. Г-КСФ способен также ускорять выход созревших нейтрофилов из депо костного мозга. Использование этих препаратов позволяет стимулировать гранулоцитопоэз и сократить длительность критической нейтропении. Контролируемые исследования по профилактическому назначению Г-КСФ и ГМ-КСФ показали их высокую эффективность в предотвращении числа инфекционных эпизодов у больных солидными опухолями и лимфомами, получавшими гемодепрессивную химиотерапию. В то же время смертность от инфекции в большинстве случаев не изменилась.
Скорее всего, это определялось общей низкой инфекционной летальностью при стандартной химиотерапии. Напротив, у пожилых больных с острыми лейкозами ранняя постхимиотерапевтическая летальность достигает 30-50%, что в значительной степени обусловлено тяжелой нейтропенической инфекцией. В контролируемом исследовании профилактическое назначение ГМ-КСФ у пожилых больных (55-70 лет) с острыми нелимфобластными лейкозами позволило в 2 раза сократить частоту тяжелой инфекции и ранней летальности после химиотерапии. Это увеличило общую выживаемость в сравнении с контрольной группой. [Rowe J.M., Blood, 1995, 86, 457-462]. Аналогичное исследование, проведенное у больных с нелимфобластными лейкозами и стандартным риском, получавших профилактически Г-КСФ, выявило сокращение длительности глубокой нейтропении и госпитализации, а также уменьшило необходимость проведения противогрибковой терапии. Это позволило значительно сократить затраты на лечение.
Таблица 4
Показания для назначения миелоцитокинов при профилактике нейтропении и нейтропенической инфекции.
4.3 Профилактическое назначение антибиотиков при нейтропении.
4.3.1 Подгруппы больных с нейтропенией, которым показана химиопрофилактика инфекции
Профилактическое назначение антибиотиков может принести пользу в случае высокого риска быстротекущей и потенциально жизнеопасной инфекции. Однако эффективность антибактериальной профилактики нельзя преувеличивать. К недостаткам профилактики относят повышение токсичности лечения и возможность суперинфекции резистентными штаммами бактерий и грибов (особенно при длительных профилактических курсах). Это соображение легло в основу принципа использования профилактики только у пациентов с наибольшим риском инфекции и в ограниченный период времени.
- глубокую нейтропению (ниже 0.1х109/л),
- поражение кожи и слизистых (сосудистый катетер, выраженный мукозит),
- при эндоскопических исследованиях (гастроскопия и бронхоскопия),
- перидонтальные и одонтогенные инфекционные процессы и опухолевую обструкцию бронхов.
Могут также быть приняты во внимание индивидуальные обстоятельства (уровень гигиенических навыков пациента, нахождение в период цитопении в больнице или в домашних условиях).
Таблица 5
Показания для профилактики инфекций различной этиологии
4.3.2 Химиопрофилактика инфекций у онкологических больных
Существует взаимосвязь между колонизацией ротоглотки и нижних отделов желудочно-кишечного тракта грамотрицательными аэробными бактериями и последующей бактериемией. Одна только изоляция пациента и снижение поступления бактерий с пищей недостаточна, вследствие чего у этих больных применяют деконтаминацию кишечника. С этой целью применялись режимы, включающие энтеральное назначение не абсорбирующихся антибиотиков, активных, главным образом, в отношении грамотрицательных аэробных возбудителей. Исторически часто использовалась комбинация гентамицина, ванкомицина и нистатина. Данный режим нередко вызывал диспептические явления у пациентов и, кроме того, снижал колонизационную резистентность кишечника вследствие повреждения анаэробной флоры. Сохранить колонизационную резистентность позволили разработанные в последующем методы селективной деконтаминации.
4.3.3 Селективная пероральная антимикробная деконтаминация
- не абсорбирующиеся препараты (фрамицидин или неомицин) вместе с колистином или полимиксином В в комбинации с противогрибковыми антибиотиками (нистатином или амфотерицином В).
- абсорбирующиеся препараты, например ко-тримоксазол или фторхинолоны в монотерапии
- комбинации абсорбирующихся и не абсорбирующихся препаратов (ко-тримоксазол и полимиксин В).
Подобные комбинации сочетают местное и системное действия. Применение ко-тримоксазола получило распространение также в связи с его способностью предотвращать инфекции, вызываемые пневмоцистами и активностью против широкого спектра патогенов, вызывающих респираторные инфекции, включая пневмококки и гемофилюс. Кроме того, он обладает активностью в отношении золотистого стафилококка и грамотрицательных бактерий кишечника. Плацебо контролируемые исследования, проводимые на небольшом количестве пациентов, свидетельствовали о преимуществе ко-тримоксазола при селективной профилактике. К недостаткам относили риск развития резистентности и отсутствие активности в отношении синегнойной палочки, что требовало его комбинации с колистином. Применение ко-тримоксазола у 2-5% пациентов осложняется кожными реакциями, что может встречаться чаще при применении цитозара. Кроме того, ко-тримоксазол может задерживать восстановление гемопоэза у пациентов после трансплантации костного мозга.
Введение в клиническую практику новых фторхинолонов, таких как ципрофлоксацин, норфлоксацин, офлоксацин и пефлоксацин, еще более расширили группу препаратов, используемых для профилактики. Это объясняется лучшей переносимостью этих препаратов и отсутствием отрицательного влияния на гемопоэз. Из этой группы препаратов наибольшее распространение получили ципрофлоксацин и офлоксацин благодаря наиболее выраженной антисинегнойной активности. Спектр активности этих фторхинолонов включает возбудителей большинства инфекций (грамотрицательные бактерии, золотистый стафилококк, многие из коагулазонегативных стафилококков). Зеленящие стрептококки и энтерококки погранично чувствительны к офлоксацину и ципрофлоксацину. Пефлоксацин и, особенно, норфлоксацин практически не активны в отношении грамположительных возбудителей.
Метаанализ 2027 случаев профилактического применения фторхинолонов у пациентов с нейтропенией показал достоверное снижение развития микробиологически документированной грамотрицательной инфекции, а также смертности от инфекционных осложнений в сравнении с группой принимавших ко-тримоксазол, не абсорбирующиеся антибиотики или плацебо. Использование фторхинолонов для профилактики встречает некоторые возражения, одним из которых является невозможность использовать в последующем эти высокоэффективные препараты для лечения тяжелых инфекций. Следует также помнить, что максимальная концентрация ципрофлоксацина и офлоксацина снижается на 40-20% при нейтропении и поражении слизистой алиментарного тракта [J. Antimicrob. Chemother. 1990, 32, 117].
Таблица 6
Режимы селективной деконтаминации
4.3.4 Специальные показания для деконтаминации
У некоторых пациентов с нейтропенией даже при проведении системной антибиотикотерапии такими препаратами широкого спектра действия, как цефтазидим (Фортум, Тазицеф) или имипенем (Тиенам), показана постоянная пероральная селективная деконтаминация. К этой группе пациентов относятся больные с колонизацией кишечника Entrobacter spp., Stenotrophomonas maltophilia.
Для микроорганизмов рода Entrobacter характерна быстрая селекция устойчивости на фоне терапии цефалоспоринами III поколения, особенно цефтазидимом, что может привести к развитию молниеносного сепсиса. При этом указанные микроорганизмы практически всегда сохраняют чувствительность к полимиксину В.
Stenotrophomonas maltophilia - микроорганизм, обладающий природной устойчивостью к карбапенемам и другим беталактамам. Применение этих препаратов создает селективные преимущества для данного вида микроорганизмов с высоким риском последующего развития тяжелой инфекции. Ко-тримоксазол является одним из немногих препаратов, активных в отношении Stenotrophomonas maltophilia.
Аналогичное преимущество у больных, получающих имипенем, может иметь Pseudomonas aeruginosa. У пациентов с колонизацией кишечника синегнойной палочкой и снижением противоинфекционных защитных механизмов часто требуется назначение полимиксина В.
Таблица 7
Специальные показания для деконтаминации у больных с нейтропенией
4.3.5 Профилактика грибковой инфекции
Обсуждая специфические методы профилактики грибковых и прочих инфекций, следует помнить о простейших правилах гигиены, позволяющих снизить вероятность их возникновения. В первую очередь это мытье рук при контакте с больными, ограничение применения антацидных средств, способствующих колонизации кишечника различными представителями рода кандида.
В связи с увеличением заболеваемости системными микозами, особенно у пациентов со сниженным иммунным ответом, широко исследуются возможности профилактики этих инфекций. С этой целью были проведены многочисленные исследования, в которых использовался нистатин, амфотерицин В (Фунгизон), миконазол, клотримазол (Канестен), кетоконазол (Низорал), флуконазол (Дифлюкан) и итраконазол (Орунгал). Большинство из этих режимов показало снижение частоты развития инвазивных инфекций, вызванных грибами рода кандида [J. Antimicrob. Chemother. 1993, 31, 973]. Частота инфекций, вызванных аспергиллами, значительно не менялась. Несколько рандомизированных контролируемых исследований по применению флуконазола показало его эффективность в профилактике инвазивного и поверхностного кандидоза. В то же время эти и другие исследования продемонстрировали изменение спектра грибковых патогенов, выделяемых у пациентов, получающих профилактику в сторону увеличения числа резистентных к флуконазолу видов (T. glabrata, C. krusei, C. parapsilosis, Aspergillus.spp.) [New Engl J Med 1991, 325, 274].
Флуконазол является лучшим препаратом для профилактики диссеминированных кандидозных инфекций у пациентов после трансплантации костного мозга [New Engl J Med 1992, 326, 845]. При этом у больных с острым лейкозом данный препарат не изменил частоту системных грибковых инфекций и не снизил смертность [Eur J Clin Microbiol Infect Dis 1994, 13, 3]. Решение о профилактическом применении флуконазола или прочих противогрибковых препаратов у пациентов, не получавших трансплантацию костного мозга, должно решаться, исходя из конкретной ситуации. Например, наличие поверхностного кандидоза при проведении химиотерапии с предполагаемым повреждением слизистой (режимы, содержащие цитозар или антрациклины) может решить вопрос в пользу проведения профилактики системного распространения инфекции. Обычно для профилактического использования применяются дозы флуконазола 150-200 мг (в некоторых исследованиях 400 мг) в сутки перорально. Доза 50 мг в сутки, по-видимому, является недостаточной, так как может способствовать селекции слабо чувствительных штаммов.
Таблица 8
Показания для противогрибковой профилактики у больных с нейтропенией
4.3.6 Противовирусная профилактика
У пациентов с поражением иммунитета возможна реактивация вируса простого герпеса с появлением характерной "лихорадки" на губах, явлений мукозита ротовой полости, эзофагита, энцефалита или пневмонита. Профилактическое назначение ацикловира перорально в дозе 200 мг 4-5 раз в день или 5 мг/кг 2 раза в день внутривенно способно успешно предотвратить эти осложнения у больных с нейтропенией после трансплантации костного мозга [Transplantation, 1987, 43, 654-8]. Эффективным также является назначение ацикловира у пациентов серопозитивных к вирусу простого герпеса в случае назначения у них химиотерапии, приводящей к выраженным мукозитам (антрациклины, амсакрин, цитозар) даже если она не вызывает глубокой нейтропении. Следует отметить, что формирование герпетических язв на слизистой рта или пищевода может служить входными воротами для кандидозной инфекции.
В отношении вируса опоясывающего герпеса активная и адекватная терапия имеет преимущество над профилактикой, так как высок риск развития резистентности возбудителей. Вирус опоясывающего герпеса в 50 - 100 раз менее чувствителен к ацикловиру чем вирус простого герпеса и введение адекватной дозы может приводить к нефротоксичности. В случае глубокого иммунодефицита (при трансплантации костного мозга) с высоким риском реактивации опоясывающего герпеса может быть рекомендована кратковременная его профилактика ацикловиром в дозе 600-800 мг 4 раза в день перорально.
В отношении инфекции цитомегаловируса наиболее эффективной профилактикой при трансплантации костного мозга и солидных органов является использование серонегативных доноров и продуктов крови. Ацикловир не обладает активностью in vitro против цитомегаловируса и мало эффективен в клинике у больных с клинически манифестированной инфекцией. Несмотря на это, отмечено значительное снижение частоты ЦМВ инфекции у реципиентов костного мозга и почки от серопозитивных доноров, получавших ацикловир в высокой дозе профилактически [JAMA 1986, 255, 387].
Ганцикловир значительно более активен против цитомегаловирусов, но этот препарат обладает выраженной токсичностью, что препятствует его рутинному использованию для профилактики. У пациентов с ВИЧ инфекцией и ретинитом, вызванным цитомегаловирусом, ганцикловир с успехом используется для поддерживающего лечения перорально в дозе 1 г 3 раза в день.
4.3.7 Химиопрофилактика кожной инфекции
Рутинная профилактика кожной инфекции применяется редко. Колонизация кожи грамотрицательными бактериями может быть значительно снижена при обработке повидоном иодида и хлоргексидином. Мазь с мупироцином (Бактробан) эффективно снижает колонизацию слизистой оболочки полости носа золотистым стафилококком.
4.3.8 Профилактика катетер-ассоциированных инфекций
Таблица 9
Активность препаратов, применяемых при профилактике инфекции у больных с нейтропенией в отношении отдельных возбудителей
Материалы конгрессов и конференций
Связь нейтропении (в основном при лейкозах или агранулоцитозах) и инфекции была впервые отмечена более 100 лет назад. В 1960-х годах некоторыми исследователями была показана количественная взаимосвязь глубины и длительности падения содержания циркулирующих нейтрофильных лейкоцитов с числом развивающихся инфекционных эпизодов. В то же время изолированная нейтропения (врожденная, циклическая, идиопатическая) встречается достаточно редко. Чаще всего это состояние развивается наряду с анемизацией и тромбоцитопенией как одно из проявлений депрессии костного мозга у пациентов, получающих цитостатики или облучение по поводу опухолевых заболеваний. Нейтропения при этом сочетается с той или иной степенью поражения кожных покровов и слизистых, а также некоторых звеньев гуморального иммунитета. Учитывая высокую опасность инфекции у больных с нейтропенией, важным представляется рассмотреть все аспекты, влияющие на ее возникновение, характер протекания и лечение.
Физические барьеры на пути инфекции и их повреждение.
Основными физическими барьерами на пути микробного проникновения в организме являются кожа и слизистые. Здоровая кожа эффективно препятствует инвазии микроорганизмов. Значительно нарушают проницаемость кожных покровов постоянные сосудистые катетеры. Даже при наличии имплантируемого порта катетера кожная флора (в основном коагулазонегативные стафилококки) при инъекциях может проникать в кровоток. Чаще всего встречается инфекция внутренней поверхности катетера. Внутривенные катетеры нередко являются входными воротами для инфекции, вызванной коагулазонегативными стафилококками, грибами рода Candida и, реже, Aspergillus spp.
Слизистая ротовой полости часто повреждается при проведении цитостатической или лучевой терапии, особенно в случае нейтропении. Участки повреждения могут стать входными воротами для таких микроорганизмов, вегетирующих в полости рта, как зеленящие стрептококки, Stomatococcus mucilaginosus, Capnocytophaga spp., а также грибы.
В кишечнике содержится огромное количество микроорганизмов. Преобладают в этом сообществе анаэробы, препятствующие появлению экзогенных, потенциально более опасных микробов, что получило название колонизационной резистентности. Применение антибактериальных препаратов часто приводит к нарушению колонизационной резистентности вследствие изменения в микробном соотношении алиментарного канала. Снижение данного вида резистентности приводит к повышенному росту дрожжеподобных грибов, к колонизации госпитальными штаммами грамотрицательных бактерий и энтерококками.
Нарушение фагоцитарной защиты.
Нейтрофильные лейкоциты, фагоцитируя патогены, проникшие через физические защитные барьеры, являются критическим компонентом естественной защиты организма. Нейтропения приводит к тому, что бактериальные и грибковые возбудители, попадая во внутреннюю среду, получают возможность беспрепятственно размножаться, формировать локальный очаг, распространяться и вызывать быстротекущий сепсис. Клинически это было подтверждено в исследовании J.P.Bodey, показавшем, что риск инфекционных осложнений превышает 50% при уменьшении числа нейтрофилов в крови ниже 0,5х10 9 /л.
Активированные тканевые макрофаги представляют еще один важный элемент защиты организма в отношении таких внутриклеточных микроорганизмов как микобактерии, листерии, бруцеллы и токсоплазмы. Содержание макрофагов меньше подвержено колебаниям при химиотерапии, но в случае повреждения их функции, что наблюдается при применении стероидов, первичная резистентность в отношении этих патогенов значительно снижается.
Профилактика бактериальной инфекции
Профилактическое назначение антибиотиков при нейтропении.
Профилактическое назначение антибиотиков может принести пользу в случае высокого риска быстротекущей и потенциально жизнеопасной инфекции. К недостаткам профилактики относят повышение токсичности лечения и возможность суперинфекции резистентными штаммами бактерий и грибов. Это соображение легло в основу принципа использования профилактики только у пациентов с наибольшим риском инфекции и в ограниченный период времени.
К такой группе больных, возможно нуждающихся в профилактическом назначении антибиотиков, относят в первую очередь тех, кто имеет глубокую нейтропению (ниже 100 клеток в 1 мкл), поражение кожи и слизистых (сосудистый катетер, выраженный мукозит), а также подвергаемых эндоскопическим исследованиям (гастроскопия и бронхоскопия), имеющих перидонтальные и одонтогенные инфекционные процессы и опухолевую обструкцию бронхов.
В последнее время чаще применяется абсорбирующиеся препараты, обладающие системным действием. Это может быть ко-отримоксазол (Бисептол, Котрим) в дозе 960 мг 2 раза в сутки, а также такие фторхинолоны как офлоксацин (Таривид) 4 мг 2 раза в сутки или ципрофлоксацин (Ципробай, Цифран) 500 мг 2 раза в сутки.
Диагностика и лечение инфекции у больных с нейтропенией
Особенности нейтропенической инфекции
Течение инфекции у больных с нейтропенией отличается тяжестью и быстрым прогрессированием. Даже небольшая отсрочка введения противоинфекционных препаратов значительно ухудшает прогноз лечения. Другой особенностью протекания инфекции в условиях нейтропении является скудность ее клинических проявлений. Повышение температуры зачастую является единственным проявлением текущего инфекционного процесса. Для характеристики данной группы пациентов широко используется термин фебрильная нейтропения. Согласно критериям Американского общества инфекционных заболеваний фебрильную нейтропению определяют как однократное повышение температуры тела, измеренной в ротовой полости пациента, более 38.3 0 С или ее двукратное повышение более 38.0 0 С с интервалом в 1 час при содержании нейтрофилов крови менее 1000 клеток в 1 мкл. В случае возникновения данного осложнения доктор должен решить вопрос о немедленном начале антибиотикотерапии.
Лечение фебрильной нейтропении
В подавляющем большинстве случаев лечение фебрильной нейтропении начинается эмпирически, то есть до получения подтверждения инфекции бактериологическими методами, в связи с чем используются антибиотики широкого спектра действия. Обязательным является применение препаратов, направленных против опасных грамотрицательных возбудителей (в том числе синегнойной палочки) ввиду остроты и тяжести инфекционных осложнений, вызываемых этими патогенами. Помимо антибиотиков в последние годы большое внимание стали также уделять применению гранулоцитарного и гранулоцитарно-макрофагального колониестимулирующих факторов, способных уменьшить глубину и длительность нейтропении.
Применение комбинированной антибиотикотерапии
Исторически при лечении инфекции у пациентов с нейтропенией часто использовались комбинации беталактамных антибиотиков и аминогликозидов, активных против различных грамотрицательных возбудителей и обладающих синергизмом in vitro. В то же время использование аминогликозидсодержащих комбинаций увеличивает риск нефротоксичности. Клиническое преимущество таких комбинаций показано только при инфекциях, обусловленных грамотрицательными бактериями у пациентов с длительной гранулоцитопенией. Число таких больных невелико и составляет менее 5 % по данным трех последних исследований EORTC. В остальных случаях при отсутствии грамотрицательной бактериемии в гемокультуре эмпирическое назначение аминогликозида можно быстро прекратить.
Монотерапия
Появление в клинической практике активных антибиотиков с широким спектром действия, таких как цефтазидим (Фортум, Тазицеф), имипенем (Тиенам), меропенем (Меронем), цефепим (Максипим), пиперациллин/тазобактам (Тазоцин), открыло новые возможности терапии. Использование одного антибиотика у больных с нейтропенической инфекцией могло бы снизить токсичность и уменьшить затраты на лечение. Первое сравнительное клиническое исследование с цефтазидимом показало, что его применение не менее эффективно, чем использование комбинации карбенициллина, цефалотина и гентамицина. Эффективность комбинации имипенема и амикацина оказалась соотносимой с эффективностью монотерапии имипенемом (76% и 72% соответственно). Аналогичные данные были получены при сравнении эффективности монотерапии меропенемом с комбинацией цефтазидима и амикацина у больных с нейтропенической инфекцией. Несколько исследований проводилось с цефалоспоринами 4 генерации. Эффективность цефепима при сравнительных исследованиях оказалась не меньшей, чем у комбинации цефтазидима с амикацином и пиперациллина с гентамицином. В одном крупном контролируемом исследовании применение монотерапии пиперациллином/тазобактамом у больных с фебрильной нейтропенией оказалось не менее эффективным, чем комбинированная терапия цефтазидимом и амикацином.
В цитируемых исследованиях многие эпизоды нейтропенической лихорадки возникали у пациентов с лимфомами и солидными опухолями, получающих менее агрессивную цитостатическую терапию, чем больные лейкозами. У значительной части из них не удавалось выявить микробиологических или клинических признаков инфекции (за исключением лихорадки в период нейтропении), и эмпирическая антибиотикотерапия в данной группе, как правило, была высоко эффективна. Нет сомнений, что у этих пациентов монотерапия антибиотиком широкого спектра действия (цефепимом, цефтазидимом, имипенемом или меропенемом) на первом этапе вполне адекватна, и ее модифицирование необходимо лишь при получении клинических или микробиологических данных. Подобная схема не всегда применима к подгруппе пациентов с глубокой длительной нейтропенией. У части этих пациентов монотерапия может быть эффективна, однако, ввиду высокой опасности инфекции, обусловленной грамотрицательными бактериями, комбинированную терапию целесообразно назначить уже на первом этапе лечения.
Модифицирование первоначальной схемы противоинфекционной терапии
В этом случае, как правило, проводят модифицирование первоначальной схемы с учетом вероятности возбудителя. Частота грамположительной флоры, резистентной к антибиотикам первой линии терапии, достаточно высока. При отсутствии результатов бактериологического исследования к проводимой терапии добавляют гликопептиды (ванкомицин или тейкопланин), обладающие высокой активностью в отношении полирезистентной грамположительной флоры. Эти препараты обычно не включают в первую линию терапии по двум причинам: во-первых, отсрочка их назначения не ухудшает окончательных результатов лечения, а, во-вторых, гликопептиды обладают определенной нефротоксичностью. В некоторых центрах, широко применяющих гликопептидные антибиотики, появление ванкомицинрезистентных энтерококков создает серьезную проблему селекции крайне опасного возбудителя. Все эти соображения позволяют в большинстве случаев отложить начало применения гликопептидов до получения результатов бактериологических исследований или выявления неэффективности первой схемы.
Грибы являются второй частой причиной инфекционных осложнений, требующей модифицирования первоначальной схемы лечения. По данным различных контролируемых исследований, раннее эмпирическое назначение Амфотерицина В (Фунгизон) позволяет ликвидировать признаки инфекции приблизительно у 10% пациентов, лихорадящих на фоне антибиотикотерапии широкого спектра действия в течение 4-5 суток. Токсичность Амфотерицина В существенна, и в последние годы для лечения нейтропенической лихорадки используют азоловые препараты (флуконазол и итраконазол). Недостатком эмпирического использования флуконазола является отсутствие эффекта в отношении грибов рода Aspergillus. Итраконазол обладает более широким спектром активности, однако он не имеет парентеральной формы, а его фармакокинетические параметры при пероральном приеме нестабильны. Второй проблемой является рост числа резистентных к азоловым препаратам форм кандиды, развивающийся при широком их использовании. Поэтому в настоящее время, несмотря на определенную токсичность, основным препаратом для эмпирической терапии грибковых инфекций остается Амфотерицин В благодаря наиболее широкому спектру активности, проявляемой, в том числе в условиях нейтропении.
Улучшить переносимость Амфотерицина В позволяет создание липосомальных, менее токсичных и более эффективных форм препарата. Особенно это важно при лечении аспергиллезных инфекций, когда требуется вводить его высокие дозы. Исследование по применению липосомальной формы Амфотерицина В (Амбисома) показало, что его использование не менее эффективно и значительно менее токсично, чем применение Амфотерицина В.
Применение современных схем лечения фебрильной нейтропении позволило в десять раз сократить смертность от этого грозного осложнения, составлявшую в 1960-х годах до 50-70%. Это расширило возможности химиотерапии за счет более безопасного ее проведения.
Профилактика нейтропении и ее инфекционных осложнений - рекомендации
Возбудители инфекций при нейтропении - бактерии, вирусы, грибы
Большинство инфекционных осложнений у больных с онкогематологическими новообразованиями вызывается эндогенной флорой, существенная доля которой представлена больничными патогенами, попадающими в организм после госпитализации. В основном это бактериальные инфекции, хотя доля грибов и вирусов в генезе инфекционных осложнений существенна. До начала широкого применения цитостатиков в гематологии стафилококки были основными возбудителями бактериальных и иных инфекций у больных с нейтропенией.
В конце 60-х годов по мере внедрения программной химиотерапии, вызывающей выраженную гемодепрессию, начинают доминировать грамотрицательные бактерии (особенно синегнойная и кишечная палочки).
Если в первых исследованиях, организованных Европейской организацией исследования и лечения раковых заболеваний (EORTC) в начале 1970 г., доля грамотрицательных возбудителей при бактериемии у больных с нейтропенией составляла 70 %, то в 90-х годах она сократилась до 30 %. По данным РОНЦ РАМН, в начале 90-х годов доля грамотрицательных бактерий у больных с гематологическими новообразованиями составляла 27 %, а грамположительных 73 %. Многие из грамположительных возбудителей, выделенных у больных с инфекцией при нейтропении, резистентны к беталактамным антибиотикам (пенициллины, цефалоспорины, карбапенемы) и проявляют чувствительность только к гликопептидам (ванкомицин и тейкопланин), линезолиду или синерциду (хинупристин-дальфопрестин).
Отказ многих центров от профилактического использования фторхинолонов в конце 90-х годов привел к повторному увеличению частоты грамотрицательной бактериемии. Так, в университетском госпитале Лозанны прекращение применения фторхинолонов для профилактики бактериальной инфекции увеличило долю грамотрицательных возбудителей, выделенных из крови больных с нейтропенией, с 26 до 82 %.
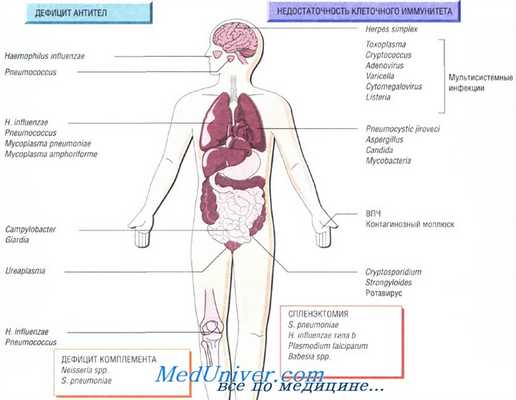
Причины инфекций при иммунодефиците
За последние десятилетия в генезе инфекционных осложнений у больных с нейтропенией увеличилась роль грибковых патогенов. В связи с трудностями культивирования грибов результаты анализа гемокультур часто не отражают частоты фунгемии. При исследовании, умерших от инфекции отмечается значительное увеличение частоты инвазивных микозов на протяжении последних 20 лет. По данным международного исследования вскрытий, системная грибковая инфекция обнаружена у 25 % умерших с лейкозами и у 12 % с лимфомами.
Чаще всего у больных с грибковой инфекцией на фоне нейтропении выявляются грибы рода кандида и аспергиллы. Эти два вида составляют до 90 % от общего числа возбудителей. Риск грибковых инфекций возрастает пропорционально продолжительности нейтропении. Например, при увеличении длительности глубокой нейтропении с 17 до 32 дней значительно (с 0,3 до 17 %) возрастает частота аспергиллеза. По данным РОНЦ РАМН, в последние годы частота выделения грибковых возбудителей у пациентов с гематологическими новообразованиями также увеличивается.
При сравнении двух временных периодов (1985—1989 и 1990—1996) выявлено увеличение частоты микозов в 1,4 раза. Среди грибковых патогенов возрастает доля дрожжеподобных форм, резистентных к азоловым противогрибковым препаратам
Инфекции, вызванные вирусом простого герпеса и цитомегаловирусом, достаточно часто регистрируются у пациентов с нейтропенией, особенно после аллогенной трансплантации костного мозга. Возбудителями могут быть и другие вирусы: аденовирусы, вирусы Эпштейна—Барр и варицелла зостер.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Назначение миелоцитокинов после курса химиотерапии с ожидаемой глубокой нейтропенией относят к первичной профилактике. Как правило, первичную профилактику проводят после миелосупрессив-ной химиотерапии для сокращения периода нейтропении и уменьшения риска инфекции.
Несколько контролируемых исследований, в том числе охватывающие наибольшее количество пациентов (американское и европейское), проведенные с использованием Г-КСФ (филграстим—нейпоген) после интенсивной химиотерапии доксорубицином, циклофосфамидом и этопозидом, показали достоверное (с 57 до 28 %) снижение частоты фебрильной нейтропении во время 1-го курса. Защитное действие Г-КСФ сохранялось на всех последующих курсах химиотерапии. За счет этого суммарно в 2,8 (американское исследование) и в 2,1 раза (европейское исследование) уменьшилось число больных с фебрильной нейтропенией по сравнению с контрольной группой. Необходимость в повторных госпитализациях и потребность в анти-биотикотерапии в группе получавших Г-КСФ также снизилась почти в 2 раза.
Применние ПЭГ-филграстима (нейласт) после химиотерапии однократно в двух контролируемых рандомизированных исследованиях оказалось не менее эффективным, чем использование нативного филграстима на протяжении 11 дней. В одном из них частота возникновения фебрильной нейтропении у больных после химиотерапии циклофосфамидом и доксорубицином в группе леченных ПЭГ-филграстимом была в 2 раза ниже, чем в группе получавших Г-КСФ по стандартной схеме (9 % против 18 %;р = 0,029).
Два аналогичных крупных исследования проведены с ленограстимом (Г-КСФ). Частота фебрильной нейтропении в этих исследованиях не различалась в группах плацебо и Г-КСФ, но возникновение более тяжелой и микробиологически доказанной инфекции, длительность госпитализации и антибиотикотерапии были статистически значимо ниже у пациентов, получавших миелоцитокин.
Исследования по первичной профилактике с ГМ-КСФ (молграмостим и сарграмостим) показали его эффективность в снижении числа эпизодов нейтропенической лихорадки. Результаты проведенных исследований показали, что Г-КСФ позволяет достоверно чаще вовремя назначать химиопрепараты в полных дозах. Так, в европейском исследовании 90 % больных получили запланированные дозы цитостатиков против 65 % в группе плацебо. Аналогичные результаты получены и в других исследованиях. В то же время ни в одном из контролируемых исследований улучшения общей и безрецидивной выживаемости выявлено не было, что, возможно, объясняется резистентностью включаемых в них неоплазий.
Существуют опухоли, при которых снижение интенсивности химиотерапии значительно ухудшает результаты лечения. Анализ результатов лечения 115 первичных больных с диффузной крупноклеточной лимфомой показал, что снижение дозоинтенсивности в первые 12 нед терапии является независимым отрицательным прогностическим фактором. Этот фактор ухудшал прогноз более выраженно, чем плохой статус больного на момент начала лечения или большое число экстранодальных поражений.

Стоимость рекомбинантных миелоцитокинов достаточно высока, поэтому профилактически назначать их всем больным, имеющим риск фебрильной нейтропении после химиотерапии, нецелесообразно по экономическим соображениям. Лечение каждого эпизода фебрильной нейтропении стоит дороже профилактики за счет антибиотиков, средств поддерживающей терапии и госпитальных затрат, поэтому профилактика может стать стоимостно эффективной при высокой частоте этого осложнения. Иными словами, при проведении интенсивной химиотерапии с высокой вероятностью фебрильной нейтропении экономия на ее лечении может покрыть расходы на профилактику.
Основываясь на модели, учитывающей стоимость лечения больных фебрильной нейтропенией, стоимость и эффективность профилактического назначения Г-КСФ и ГМ-КСФ, было показано, что экономически выгодно проводить профилактику при риске возникновения этого осложнения 40 % и выше. Данная величина была принята Американским обществом клинических онкологов (ASCO) за основу при разработке рекомендаций для использования миелоцитокинов в клинической практике. Недавно проведен повторный экономический анализ, учитывающий современные цены на препараты. В этом анализе граница целесообразности проведения профилактики снижена до 23 %. Это значительно увеличивает контингент больных, у которых первичная профилактика фебрильной нейтропении может считаться экономически оправданной.
Экспертная комиссия ASCO в 2006 г. изменила рекомендации по применению миелоцитокинов для первичной профилактики осложнений нейтропении. В соответствии с этими рекомендациями профилактику целесообразно проводить, если риск фебрильной нейтропении применяемого режима химиотерапии превышает 20 %. В ряде исследований показано, что у больных с лимфомами старше 60 лет и особенно старше 70 лет значительно более высок риск нейтропении и тяжелой инфекции при проведении курсов химиотерапии средней интенсивности типа CHOP, чем у молодых пациентов. При анализе данных 577 больных с неходжкинскими лимфомами было установлено, что возраст старше 65 лет ассоциируется с более высокой необходимостью госпитализаций для лечения фебрильной нейтропении (28 % против 16 %) и снижением дозоинтенсивности лечения менее 80 % (33 % против 15 %).
Применение Г-КСФ у этой категории пациентов позволило на 30—50 % снизить риск нейтропении и инфекции. Полученные данные легли в основу рекомендаций Международного общества гериатрической онкологии (SIOG) и Американского обучающего онкологического общества (NCCN) проводить первичную профилактику фебрильной нейтропении всем больным старше 70 лет при среднеинтенсивной химиотерапии. В рекомендациях ASCO 2006 г. эта граница возраста соответствует 65 годам.
Первичная профилактика фебрильной нейтропении у больных лейкозами
У подавляющего большинства больных острыми лейкозами, получающих программную химиотерапию, развиваются длительная нейтропения и инфекция, требующие госпитализации и назначения антибиотиков. Применение миелоцитокинов для первичной профилактики в этой группе пациентов позволяет снизить длительность нейтропении.
В частности, результаты многоцентрового контролируемого исследования по использованию Г-КСФ (филграстим) и плацебо в период индукции и последующей консолидации ремиссии у 521 больного острыми нелимфобластными лейкозами показали значимое снижение длительности нейтропении (20 дней против 25 дней), госпитализации (20 дней против 25 дней) и антибиотикотерапии (15 дней против 18,5 дня) в группе получавших цитокин. Затраты на лечение в группе получавших Г-КСФ оказались ниже на 2,8—8,1 % во всех 5 странах, в которых проводилось это исследование.
Общая и безрецидивная выживаемость в группах не различалась.
Интерес представляют результаты рандомизированного исследования восточной кооперативной онкологической группы США (ECOG) по применению ГМ-КСФ (сарграмостим) после индукционной химиотерапии у пожилых больных (55—70 лет) острыми нелимфобластными лейкозами. Было выявлено значимое сокращение общей токсической смертности и смертности от инфекции в группе получавших цитокин. Медиана общей выживаемости оказалась значимо выше в группе леченных ГМ-КСФ, чем в группах получавших плацебо, — 10,6 и 4,8 мес соответственно (р = 0,048). Возможно, более высокая опасность инфекции у пожилых больных сказалась на реализации защитного эффекта ГМ-КСФ. Исследование, проведенное по аналогичной схеме группой по изучению лейкозов и рака США (CALGB) и Европейской кооперативной группой по изучению рака (EORTC), не установило улучшения общей выживаемости в группе пожилых больных, получавших ГМ-КСФ.
В этих исследованиях, различающихся по схеме назначения миелоцитокина, также не было выявлено значимого сокращения срока госпитализации и антибиотикотерапии.
Вторичная профилактика нейтропении и связанной с ней инфекции
Некоторые больные больше подвержены постцитостатической нейтропении и инфекции, однако это не всегда можно предугадать. Если 1-й курс химиотерапии сопровождался нейтропенией и повышением температуры тела, вероятность инфекционных осложнений при последующем лечении очень велика. Назначение в таких случаях миелоцитокинов называют вторичной профилактикой.
В двух контролируемых исследованиях Г-КСФ (филграстим) и ГМ-КСФ (сарграмостим) назначали после 2-го курса химиотерапии, если на первом аналогичном курсе отмечалась фебрильная нейтропения. Назначение миелоцитокинов сопровождалось 3—5-кратным снижением частоты этого осложнения. Альтернативным подходом может быть редукция доз цитостатиков. При необходимости поддержания заданной интенсивности химиотерапии ASCO рекомендует проводить вторичную профилактику не только при фебрильной нейтропении, развившейся во время предшествующего курса химиотерапии, но и в случае длительной нейтропении без лихорадки.
Читайте также:
- Птицы. Развитие эмбриона птиц. Эмбриогенез птиц.
- Поверхностный гастрит как разновидность хронического гастрита - симптомы, лечение, диета при поверхностном гастрите
- Примеры эндогенного эндофтальмита симулирующего ретинобластому
- Дерматомиозит: атлас фотографий
- Спермонедостаточные расстройства. Влияние тестикулярного фактора на здоровье
