Пузырно-влагалищный свищ при раке шейки матки, эндометрия, яичника
Добавил пользователь Cypher Обновлено: 28.01.2026
Обструкция мочеточников при раке шейки матки, эндометрия, яичника
Обструкция мочеточников характерна для местнораспространенного рака шейки матки (РШМ) и реже встречается при других злокачественных новообразованиях женских половых органов, включая рак эндометрия (РЭ) и рак яичника (РЯ). Наиболее широко распространенный признак обструкции мочеточников - повышенный уровень сывороточного креатинина, а не жалобы на анурию. Из-за ряда причин, которые необходимо рассмотреть, может возникнуть острая почечная недостаточность.
Мочеточник может быть закупорен вследствие местного распространения злокачественного новообразования, или метастазов в забрюшинных лимфоузлах, или в результате внешней компрессии большой опухолью. На сегодня вторичная уремия при двусторонней обструкции мочеточников встречается редко, но ее необходимо немедленно распознать и вовремя начать лечение. При повышении уровня креатинина следует избегать использования нефротоксичных внутривенных контрастных средств для оценки состояния мочеточников.
Альтернативные методы включают сцинтиграфию почек после введения фуросемида или УЗИ почек. Если поставлен диагноз двусторонней обструкции мочеточников, до проведения какого-либо вмешательства необходимо провести срочное обследование больной, чтобы определить точный размер злокачественного новообразования. При местном распространении злокачественной опухоли и отсутствии метастазов устранить обструкцию мочеточников можно с помощью цистоскопии и стентирования мочеточника.
Если стентирование было безуспешным, необходимо установить подкожную нефростому (ПКН). В особых случаях, когда невозможно устранить обструкцию, требуется диализ. Через несколько дней после устранения обструкции мочеточников необходимо провести тщательную оценку диуреза и коррекцию баланса электролитов.
В результате установления подкожной нефростомы (ПКН) могут возникнуть такие осложнения, как пиелонефрит (70 %), закупорка катетера (65 %) и кровотечение (28 %). У 70 % больных после установки ПКН почечная функция восстанавливается (Dudley et al.).
Необходимо обратить внимание на две группы обстоятельств, когда решение необходимо принимать совместно с врачом, больной и ее семьей, т. к. устранение обструкции мочеточников может быть бесполезным или принести вред больной. Такие клинические ситуации включают следующее:
• Если у больной метастатическое злокачественное новообразование и существует малая вероятность того, что терапия будет успешной.
• Если больная ранее подвергалась лечению по поводу рака шейки матки (РШМ) и вторично имеет двустороннюю обструкцию вследствие рецидива; в этом случае возникает ситуация, при которой никакая терапия не в силах значительно продлить нормальную жизнь. Необходима тщательная оценка для подтверждения, что обструкция не есть следствие фиброза забрюшинного пространства из-за ЛТ.
Часто у больных с двусторонней обструкцией мочеточников наблюдаются уремические и коматозные состояния. В этом случае решение относительно лечения и ухода ложится на ближайших родственников, которые должны сделать трудный выбор: разрешить хирургическое вмешательство, чтобы вывести больную из состояния уремии, допуская при этом, что она может погибнуть из-за других осложнений, вызванных злокачественным новообразованием, или позволить ей спокойно умереть в состоянии уремической комы. При таких трудных обстоятельствах решающими оказываются консультация и совет опытного онкогинеколога.
При односторонней обструкции мочеточника во время первичного исследования может не потребоваться установка стента или подкожной нефростомы (ПКН), если почки больной нормально функционируют и есть предпосылки того, что терапия (например, ЛТ органов таза) позволит уменьшить размер злокачественного новообразования и устранить непроходимость. В таких случаях установка подкожной нефростомы (ПКН) или стента должна компенсировать возможные осложнения, которые может вызвать задержка или прерванная терапия.
Обструкцию уретры злокачественным новообразованием, которое проросло в переднюю стенку влагалища (злокачественные опухоли влагалища, вульвы или шейки матки), можно, как правило, скорректировать введением баллонного катетера Фоли. Если его нельзя установить, следует рассмотреть возможность применения надлобкового катетера или установки ПКН.
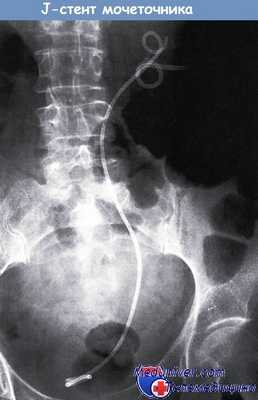
Двойной J-стент, введенный в правую почку, мочеточник и мочевой пузырь посредством подкожной нефростомии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мочеточниково-влагалищный свищ
МКБ-10
Общие сведения
В структуре урогенитальных фистул мочеточниково-вагинальные свищи занимают 25-30%. Чаще всего их диагностируют у женщин, которые перенесли радикальные вмешательства с удалением матки или прямой кишки. По результатам исследований в области современной урологии, акушерства и гинекологии, травматическое повреждение мочеточников с формированием фистульных ходов и мочевыделением во влагалище наблюдается у 3-15% таких пациенток.
Причины
Формирование патологического соустья между мочеточником и вагиной обусловлено повреждением стенок этих органов или нарушением их развития в эмбриогенезе. Согласно клиническим наблюдениям, большинство мочеточниково-влагалищных фистул имеют травматическое происхождение. В числе причин, приводящих к возникновению дефекта, называют:
Патогенез
При случайном пересечении мочеточника или некрозе его стенки вследствие лучевых воздействий, опухолевой деструкции, нарушения кровоснабжения из-за сепарации на большом протяжении моча начинает поступать в окружающие ткани. Ее оттоку в вагину могут способствовать несостоятельность послеоперационных швов, повреждение прорастающей опухолью, рентгеновскими лучами. Постоянное мочевыделение препятствует восстановлению целостности тканей. В течение 10-21 дня между влагалищем и мочеточником формируется фистульный ход, выстланный эпителием, реже — грануляционной тканью.
Механизм образования мочеточнико-влагалищного свища при врожденной эктопии устья обусловлен нарушением миграции мезодермальных протоков к месту типичного впадения в мочевик и их имплантацией во влагалище. В зависимости от особенностей травматического повреждения или нарушений эмбриогенеза фистулы бывают односторонними и двухсторонними (билатеральными).
Симптомы
Осложнения
При сужении уретерального просвета в месте впадения во влагалище ухудшается отток мочи, что сопровождается развитием уретерогидронефроза, а в последующем — хронической почечной недостаточности. Постоянное влагалищное мочевыделение снижает качество интимной жизни, раздражает слизистые, нарушает нормальную реакцию вагинального секрета, провоцирует начало воспалительных процессов (кольпита, бактериального вагиноза, вульвита, уретрита).
Диагностика
Диагностический поиск при подозрении на мочеточниково-влагалищную фистулу направлен на выявление свищевого хода, определение его точной локализации и топографии, комплексную оценку функционального состояния мочевыделительных органов. Пациенткам с жалобами на жидкие влагалищные выделения с запахом мочи рекомендованы следующие методы исследования:
- Гинекологический осмотр. При осмотре с помощью зеркал зачастую удается визуализировать свищевое отверстие в области свода (культи) вагины. Его выявлению способствуют воронкообразные втяжения и ритмичное мочевыделение. При наличии грубых рубцовых изменений обнаружение свища может быть затруднено. В некоторых случаях при влагалищном осмотре через фистулу удается катетеризировать мочеточник и даже почечную лоханку.
- Эндоскопическое исследование. Цистоскопия информативна для дифференциальной диагностики с пузырно-влагалищными свищами. Устье пораженного мочеточника при полном свище выглядит неподвижным, при неполном — изредка сокращается, выделение красителя при индигокарминовой пробе нарушено или отсутствует. Хромоцистоскопию сочетают с введением тампона во влагалище и при возможности дополняют уретероскопией.
- Катетеризация мочеточника. Обычно введение катетера затруднено или невозможно из-за наличия препятствия на расстоянии 3-5 см от его устья, которое иногда удается преодолеть при неполной фистуле. В ряде случаев удается проникнуть через свищ во влагалище. Чтобы исключить прохождение в параметрий, катетеризацию мочеточника рекомендуется проводить под рентген-контролем. Для выявления уровня поражения исследование сочетают с ретроградной уретеропиелографией.
- Экскреторная урография. Внутривенная урография позволяет выявить сужение и фиброз в зоне повреждения, расширение мочеточника и почечной лоханки, обнаружить снижение выделительной функции почек. При нефункционирующей почке дополнительно проводится антеградная пиелоуретерография, направленная на получение более точных сведений об анатомо-топографических особенностях свищевого хода, уретера, лоханок.
В сложных случаях для исключения пузырно-вагинальных свищевых ходов и выявления сочетанных мочеточниково-пузырно-влагалищных свищей выполняют пробу с двумя красителями — кармином, инстиллируемым в мочевой пузырь, и индигокармином, вводимым внутривенно. Для уточнения анатомической локализации фистулы и особенностей строения свищевого хода дополнительно назначаются вагинография, МРТ, КТ.
Поскольку при уретеро-влагалищных свищах часто нарушаются функции почек, рекомендованы биохимические анализы крови и мочи, пробы Реберга и Зимницкого, нефросцинтиграфия. При помощи рентгенокинематографии оценивается сократительная способность мочеточника и лоханки. Проведение общего анализа мочи и посева на микрофлору позволяет вовремя выявить воспалительный процесс.
Уретеро-влагалищные свищи дифференцируют с различными видами урогенитальных фистул, вагинитом, бактериальным вагинозом, эндоцервицитом, другими воспалительными заболеваниями половых органов, доброкачественными и злокачественными неоплазиями влагалища и матки. Пациентке показаны консультации врача-уролога, нефролога, онколога, инфекциониста, дерматовенеролога.
Лечение мочеточниково-влагалищных свищей
При выявлении повреждений уретеральной стенки до рубцевания (в течение 6-8 суток после операции или травмы) возможно заживление раны на постоянном уретеральном катетере (стенте), установленном через мочевой пузырь или антеградно. Одновременно назначаются кортикостероидные и рассасывающие препараты для размягчения рубцовой ткани, дополнительно возможна разгрузка почки через наложенную нефростому. При неэффективности консервативной терапии и выявлении гидронефроза рекомендованы хирургические методы лечения:
- Уретероцистоанастомоз. При расположении свищевого хода в юкставезикальном отделе возможна реимплантанция мочеточника в стенку мочевого пузыря - наложение уретероцистоанастомоза. В ходе операции удаляется участок, который сообщается с влагалищем, оставшаяся часть проводится в подслизистом туннеле стенки мочевика, формируется новое устье.
- Операция Боари. Выполняется при разрушении всего тазового отдела мочеточника и недостаточности его длины для создания нового уретероцистоанастомоза. При операции Боари после удаления поврежденных тканей из мочевого пузыря иссекается лоскут, формируется недостающая уретеральная часть и мочеточниково-пузырный анастомоз.
- Уретеропластика. Кишечная пластика мочеточника рекомендована женщинам со значительным повреждением органа или резко уменьшенной емкостью мочевого пузыря. Для восстановления нормального пассажа мочи используется изолированный сегмент тонкой кишки, заменяющий дефект одного или обоих мочеточников.
Альтернативным вмешательством при невозможности быстрого восстановления нормального мочевыделения при помощи указанных операций является аутотрансплантация почки с ее низведением в малый таз, а при значительной деструкции почечной ткани — нефрэктомия. Для профилактики вероятных инфекционных осложнений в послеоперационном периоде проводится антибиотикотерапия.
Прогноз и профилактика
1. Мочеполовые свищи/ Пушкарь Д.Ю., Раснер П.И., Гвоздев М.Ю.// Рууский медицинский журнал. – 2013. - №34.
3. Эндоскопические методы диагностики и лечения ятрогенных повреждений мочеточников и мочеточниково-влагалищных свищей/ Глыбочко П.В., Аляев Ю.Г., Газимиев М.А., Акопян Г.Н., Руденко В.И., Иноятов Ж.Ш., Сорокин Н.И.// Медицинский вестник Башкортостана. – 2011.
Пузырно-влагалищный свищ
Распространенность пузырно-влагалищных свищей (фистул) составляет 0,3-2% и существенно отличается в разных странах. Более высокие показатели зафиксированы в государствах с малодоступной или некачественной медицинской помощью. 9 из 10 случаев заболевания являются ятрогенными осложнениями, возникают после патологических родов или оперативных вмешательств на органах малого таза. Актуальность своевременной диагностики и лечения расстройства связана с существенным ухудшением качества жизни пациентки, нарушением сексуальной и репродуктивной функции, высоким риском рецидива после поздней операции на фиброзно-измененных тканях.
Причины пузырно-влагалищного свища
- Гинекологические оперативные вмешательства. До 70% пузырно-вагинальных фистул становятся следствием гистерэктомии при доброкачественных фибромиомах матки. К их формированию также приводят непредумышленные повреждения при кесаревом сечении, хирургическом лечении эндометриоза, рака матки, других заболеваний тазовых органов.
- Патологические роды. Длительное сдавливание мягких тканей родовых путей при затяжных родах, вторичной слабости родовых сил, прохождении крупного плода, узком тазе матери вызывает ишемический некроз с последующим образованием свищевого хода. Травматические повреждения возникают при неправильном наложении щипцов и разрывах тканей.
- Случайные травмы. В небольшом количестве случаев пузырно-генитальные свищи формируются после травматических разрывов тканей из-за ДТП, несчастных случаев на производстве и быту, изнасилований. Возможна перфорация стенок влагалища, мочевого пузыря во время мастурбации с введением в вагину или уретральный канал острых предметов.
- Онкологические заболевания репродуктивных органов. Стенки вагины, мочевого пузыря могут разрушаться из-за прорастания опухолью при раке шейки матки, влагалища, других злокачественных новообразованиях. Одними из наиболее сложных для лечения считаются фистульные ходы, образовавшиеся после лучевой терапии онкологической патологии.
- Воспалительные процессы. Во влагалище, мочевой пузырь могут прорываться абсцессы малого таза с образованием свищей. Свищевые ходы между этими органами появляются вследствие повреждения их стенок при некоторых инфекционных болезнях — венерической лимфогранулеме, шистоматозе, актиномикозе, туберкулезе мочевыделительных органов.
Начальным этапом образования пузырно-вагинальных свищей становится прободение тканей, которые разделяют влагалище и мочевой пузырь. Если такое повреждение не было вовремя замечено и ушито, существующая разница давлений между органами и постоянное подтекание мочи не позволяют отверстию зарубцеваться. В результате за 7-14 дней возникает фистульный ход, выстланный эпителиальной тканью. Ситуация усугубляется при наличии воспалительных или деструктивных процессов в области свищевого канала. В 65-66% случаев мочепузырно-влагалищные фистулы проявляются в первые 10 дней после травмы, а окончательно формируются за 3-5 месяцев.
Классификация
Современная систематизация везико-вагинальных свищей наиболее полно отображает характеристики фистул и является эффективным инструментом выбора оптимального хирургического вмешательства, прогнозирования особенностей послеоперационного периода. В основу классификации положены три ключевых критерия, позволяющие полностью описать свищ:
- Протяженность фистулы. В зависимости от расстояния между наружным и внутренним отверстием различают свищи длиной свыше 35, 26-35, 15-25, короче 15 мм.
- Диаметр свищевого канала. Показатель оценивается по максимальному поперечнику пузырно-влагалищной фистулы и может составлять до 15, 15-30, более 30 мм.
- Стадия рубцевания. Различают свищи без фиброза или с его начальными проявлениями, умеренным или тяжелым фиброзом, особыми обстоятельствами (послелучевыми изменениями и др.).
Также рекомендуется учитывать рубцовую деформацию органов, между которыми сформировался урогенитальный свищ. При начальных нарушениях длина влагалища не изменена или составляет не меньше 6,0 см, емкость мочевого пузыря сохранена. О более сложном расстройстве свидетельствует укорочение влагалища менее 6 см и уменьшение интравезикальной емкости.
Симптомы пузырно-влагалищного свища
У части пациенток единственной жалобой является увеличение количества жидких влагалищных выделений и появление примеси крови в моче во время месячных. При большом свищевом отверстии самостоятельное мочеиспускание полностью прекращается, а вся моча непрерывно отходит через вагину при фактически пустом мочевом пузыре. Раздражение промежности вследствие подтекания мочи вызывает зуд и изъязвление тканей. Присоединение вторичных воспалительных процессов проявляется учащением мочеиспускания, болями и резью в уретре. Возможно возникновение болезненных ощущений в надлобковой области. Рубцевание тканей вокруг свища часто сопровождается сужением влагалища, снижением эластичности его стенок, что провоцирует боль при половом акте.
При свищевом соединении мочевого пузыря и вагины возрастает вероятность хронических воспалительных заболеваний мочевыводящих органов (цистита, уретрита), в том числе восходящей инфекции, вызывающей уретериты и пиелонефриты. Поступление мочи в полость влагалища зачастую сопровождается изменением кислотности влагалищного секрета, развитием вагинозов, кольпитов, экзоцервицитов. В свою очередь, это повышает риск возникновения эндоцервицитов, эндометритов, сальпингитов, аднекситов, вызванных активировавшейся условно-патогенной флорой. Увеличивается вероятность неопластических процессов. Зачастую у женщин нарушается сексуальная жизнь, наступает бесплодие. Наличие стойких выделений с характерным запахом, зуд в области половых органов ухудшают качество жизни пациенток, провоцируя невротические расстройства — невротическую экскориацию, ипохондрию, субдепрессивные состояния.
Поскольку расстройство часто осложняется другими урогенитальными заболеваниями, на этапе диагностики важно выявить возможные нарушения со стороны репродуктивной и мочевыводящей систем. Для скрининга подобных осложнений обычно проводят УЗИ тазовых органов и почек, выполняют общие анализы мочи и крови, определяют уровень креатинина, мочевины и мочевой кислоты в крови. К ведению пациентки, кроме гинеколога, как правило, привлекают уролога. При необходимости больную консультируют нефролог, хирург, онколог. Дифференциальную диагностику проводят со специфическими кольпитами, эндоцервицитами, эндометритами, при которых наблюдается увеличение объема влагалищных выделений, спонтанным опорожнением гидросальпинкса, недержанием мочи, острыми уретритами, циститами.
Лечение пузырно-влагалищного свища
Медикаментозных методов терапии расстройства не предложено. Самопроизвольное заживление фистулы, соединяющей вагину с мочевым пузырем, наблюдается у 2-3% больных женщин при небольшом размере свищевого отверстия. Ускорению процессов регенерации в подобных случаях способствует отвод мочи с помощью постоянного уретрального катетера. У некоторых пациенток эффективной оказывается коагуляции краев свища электротоком или препаратами серебра со стороны влагалища или мочевого пузыря. В остальных случаях рекомендовано одно из хирургических вмешательств по восстановлению поврежденной стенки влагалища.
По мнению большинства урогинекологов, наиболее оправдана отсроченная фистулопластика, которая выполняется спустя 4-6 месяцев после образования свища. За это время максимально стихают воспалительные процессы, вызванные травмирующим воздействием, может быть проведена качественная предоперационная подготовка — удалены лигатурные камни, санированы мочевой пузырь и влагалище, восстановлено кровоснабжение тканей. При выборе конкретной техники учитывают размеры и место расположения свища, наличие рубцовых изменений, удаленность от устьев мочеточников, эластичность влагалищных стенок. Наиболее распространены:
- Влагалищное иссечение свища. Операция отличается физиологичностью, малой травматичностью, сохранением целостности мочевого пузыря, более простым способом ушивания фистульного хода, сравнительно быстрым выздоровлением и отсутствием тяжелых осложнений. Метод показан для иссечения небольших неосложненных свищей при хорошей подвижности и растяжимости тканей влагалища. Ограничениями для проведения таких операций служат грубые рубцовые изменения вагины и глубокое залегание фистульного канала, при устранении которого может повредиться интравезикальный участок с устьями мочеточников.
- Трансабдоминальное иссечение свища. Закрытие дефекта через разрез передней брюшной стенки и мочевого пузыря показано при наличии больших по размеру фистул, вовлечении мочеточников, обнаружении комбинированных свищей, сопутствующей кишечной патологии. При более высокой травматичности преимуществами способа считаются хороший доступ и достаточный обзор для эффективного удаления измененных тканей, сохранение нормальной уродинамики после операции, возможность ликвидации даже сравнительно больших и сложных дефектов с качественным ушиванием вовлеченных органов.
- Реконструктивная пластика. Наиболее сложными являются операции по восстановлению целостности пузырно-влагалищной перегородки после радиотерапии. У таких пациенток ткани, окружающие свищ, фибротизированы, неэластичны, имеет ограниченную васкуляризацию и плохо заживают. Дефект закрывают методом тканевой интерпозиции трансплантатом — фрагментом тонкой или малой мышцы бедра, фиброзно-жировым лоскутом из большой половой губы, брюшиной, серозно-мышечным кишечным лоскутом, сегментом сальника или желудочной стенки. Операция требует тщательной подготовки во избежание рецидива.
Риск повторного образования свища после оперативного лечения удается снизить за счет правильной предоперационной подготовки и соблюдения техники вмешательства. Наиболее высокая частота рецидивирования — от 15% до 70% — наблюдается при постлучевых пузырно-влагалищных фистульных ходах. При травматических свищах эффективность фистулопластики достигает 92-96%. Планирование беременности после операции допускается не ранее чем спустя 1,5-2 года с родоразрешением методом кесарева сечения. В целях профилактики расстройства рекомендованы регулярные осмотры у гинеколога для раннего выявления заболеваний, требующих хирургического лечения, своевременная постановка на учет для снижения риска осложнений в родах, бережное ведение родов, технически точное выполнение гинекологических, урологических операций.
Рак шейки матки
Рак шейки матки – опухолевое поражение нижнего отдела матки, характеризующееся злокачественной трансформацией покровного эпителия (экто- или эндоцервикса). Специфическим проявлениям рака шейки матки предшествует бессимптомное течение; в дальнейшем появляются контактные и межменструальные кровянистые выделения, боли в животе и крестце, отеки нижних конечностей, нарушения мочеиспускания и дефекации. Диагностика при раке шейки матки включает проведение осмотра в зеркалах, расширенной кольпоскопии, исследования цитологического соскоба, биопсии с гистологическим заключением, эндоцервикального кюретажа. Лечение рака шейки матки проводят с учетом гистологической формы и распространенности с помощью хирургического вмешательства, лучевой терапии, химиотерапии или их комбинации.
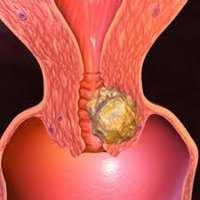
Рак шейки матки (цервикальный рак) составляет около 15% среди всех злокачественных поражений женской репродуктивной системы, занимая третье место вслед за раком молочной железы и раком эндометрия. Несмотря на то, что рак шейки матки относится к заболеваниям «визуальной локализации», у 40% женщин эта патология диагностируется на поздней (III - IV) стадии. В России ежегодно выявляется около 12000 случаев цервикального рака. Основной категорией служат пациентки в возрасте 40-50 лет, хотя в последние годы отмечается рост заболеваемости раком шейки матки среди женщин младше 40 лет.

Причины РШМ
Ключевая роль в канцерогенезе отводится папилломавирусной инфекции, обладающей тропностью к эпителию шейки матки. Серотипы ВПЧ высокого онкогенного риска (16, 18) обнаруживаются в 95% случаев рака шейки матки: при плоскоклеточном цервикальном раке чаще выявляется ВПЧ 16 типа; при аденокарциноме и низкодифференцированной форме - ВПЧ 18 типа. Серотипы ВПЧ «низкого» онкогенного риска (6, 11, 44) и среднего риска (31, 33, 35) преимущественно вызывают образование плоских и остроконечных кондилом, дисплазию и редко – рак шейки матки.
Среди других ИППП, повышающих риски развития рака шейки матки, выделяют генитальный герпес, цитомегаловирусную инфекцию, хламидиоз, ВИЧ. Из всего вышесказанного следует, что вероятность развития рака шейки матки больше у женщин, часто меняющих половых партнеров и пренебрегающих барьерными методами контрацепции. Кроме того, при раннем начале сексуальной жизни (в возрасте 14-18 лет) незрелый эпителий шейки матки обладает особой восприимчивостью к воздействию повреждающих агентов.
Факторы риска
К факторам риска по развитию рака шейки матки относят ослабление функции иммунной системы, курение, возраст старше 40 лет, диеты с малым содержанием фруктов и овощей, ожирение, недостаток витаминов А и С. Также доказано, что вероятность развития рака шейки матки увеличивается при длительном (свыше 5 лет) приеме оральных контрацептивов, многочисленных родах, частых абортах. Одним из факторов позднего обнаружения рака шейки матки является низкая медицинская культура, нерегулярное прохождение женщинами профилактических осмотров с исследованием мазка из цервикального канала на онкоцитологию.
К фоновым заболеваниям, предрасполагающим к развитию рака шейки матки, в гинекологии относят лейкоплакию (интраэпителиальную неоплазию, CIN), эритроплакию, кондиломы, полипы, истинную эрозию и псевдоэрозию шейки матки, цервициты.
По гистологическому типу, в соответствии с двумя видами эпителия, выстилающего шейку матки, различают плоскоклеточный цервикальный рак с локализацией в эктоцервиксе (85-95%) и аденокарциному, развивающуюся из эндоцервикса (5-15%). Плоскоклеточный рак шейки матки, в зависимости от степени дифференцировки, может быть ороговевающим, неороговевающим и низкодифференцированным. К редким гистотипам рака шейки матки относятся светлоклеточная, мелкоклеточная, мукоэпидермоидная и др. формы. С учетом типа роста различают экзофитные формы рака шейки матки и эндофитные, встречающиеся реже и имеющие худший прогноз.
Для оценки распространенности в клинической гинекологии используются классификации рака шейки матки по двум системам: FIGO, принятой Международной федерацией акушеров и гинекологов, и ТNМ (где T – распространенность опухоли; N – вовлеченность регионарных лимфоузлов; M – наличие отдаленных метастазов).
Стадия 0 (FIGO) или Тis (ТNМ) расценивается как преинвазивный или внутриэпителиальный рак шейки матки (in situ).
Стадия I (FIGO) или T1 (ТNМ) - опухолевая инвазия ограничивается шейкой матки, без перехода на ее тело.
- I A1 (T1 А1) – микроскопически определяемый рак шейки матки с глубиной инвазии до 3 мм с горизонтальным распространением до 7 мм;
- I A2 (T1 А2) – прорастание опухоли в шейку матки на глубину от 3 до 5 мм с горизонтальным распространением до 7 мм.
- I B1 (T1 В1) – макроскопически определяемый цервикальный рак, ограниченный шейкой матки, либо микроскопически выявляемые поражения, превышающие IA2 (T1А), не превышающее в максимальном измерении 4 см;
- I B2 (T1 В2) - макроскопически определяемое поражение, превышающее в максимальном измерении 4 см.
Стадия II (FIGO) или T2 (ТNМ) характеризуется распространением рака за пределы шейки матки; нижняя треть влагалища и стенки таза интактны.
- II A (T2 А) – опухоль инфильтрирует верхнюю и среднюю треть влагалища или тело матки без прорастания параметрия;
- II B (T2 В) – опухоль инфильтрирует параметрий, но не доходит до стенок таза.
Стадия III (FIGO) или T3 (ТNМ) характеризуется распространением рака за пределы шейки матки с прорастанием параметрия до стенок таза либо вовлечением нижней трети влагалища, либо развитием гидронефроза.
- III A (T3 А) – опухоль захватывает нижнюю треть влагалища, но не прорастает в стенки таза;
- III B (T3 В) – опухоль переходит на стенки таза либо вызывает гидронефроз, или вторичное поражение почки.
Стадия IV А (FIGO) или T4 (ТNМ) характеризуется распространением рака шейки матки в смежные органы либо распространением за пределы таза. Стадия IV B (T4 M1) свидетельствует о наличии отдаленных метастазов.
Симптомы рака шейки матки
Клинические проявления при карциноме in situ и микроинвазивном раке шейки матки отсутствуют. Появление жалоб и симптоматики свидетельствует о прогрессировании опухолевой инвазии. Наиболее характерным проявлением рака шейки матки служат кровянистые выделения и кровотечения: межменструальные, постменопаузальные, контактные (после полового акта, осмотра гинекологом, спринцевания и т. д.), меноррагии. Больные отмечают появление белей - жидких, водянистых, желтоватого или прозрачного цвета влагалищных выделений, обусловленных лимфореей. При распаде раковой опухоли выделения принимают гноевидных характер, иногда имеют цвет «мясных помоев» и зловонный запах.
При прорастании опухоли в стенки таза или нервные сплетения появляются боли в животе, под лоном, в крестце в покое или во время полового акта. В случае метастазирования рака шейки матки в тазовые лимфоузлы и сдавливания венозных сосудов могут наблюдаться отеки ног и наружных гениталий.
Если опухолевая инфильтрация затрагивает кишечник или мочевой пузырь, развиваются нарушения дефекации и мочеиспускания; появляется гематурия или примесь крови в кале; иногда возникают влагалищно-кишечные и влагалищно-пузырные свищи. Механическая компрессия метастатическими лимфоузлами мочеточников приводит к задержке мочи, формированию гидронефроза с последующим развитием анурии и уремии. К общим симптомам рака шейки матки относятся общая слабость, повышенная утомляемость, лихорадка, похудание.
Основу раннего выявления микроинвазивного цервикального рака составляют регулярные онкопрофилактические осмотры с цитологическим исследование соскоба шейки матки. Пап-тест (мазок по Папаниколау) позволяет выявлять предраковые процессы, раковые клетки при преинвазивном росте опухоли. Схема обследования включает:
- Осмотр шейки матки в зеркалах. Визуальный гинекологический осмотр в ранней стадии позволяет обнаружить или заподозрить РШМ по внешнем признакам: изъязвлениям, изменению окраски шейки матки. В инвазивной стадии при экзофитном типе роста рака на поверхности шейки матки определяются фибринозные наложения, опухолевидные разрастания красноватого, белесоватого, розовато-серого цвета, которые легко кровоточат при прикосновении. В случае эндофитного роста цервикального рака шейка становится увеличенной, приобретает бочковидную форму, неровную бугристую поверхность, неравномерную розово-мраморную окраску. При ректо-вагинальном исследовании в параметрии и малом тазу могут определяться инфильтраты.
- Кольпоскопия. С помощью кольпоскопии при увеличении изображения в 7,5- 40 раз возможно более детально изучить шейку матки, обнаружить фоновые процессы (дисплазию, лейкоплакию) и начальные проявления рака шейки матки. Для исследования зоны трансформации эпителия используют проведение пробы с уксусной кислотой и Шиллер-теста (йодной пробы). Атипия при раке шейки матки выявляется по характерной извитости сосудов, менее интенсивному окрашиванию патологических йоднегативных очагов. При подозрении на рак шейки матки показано исследование опухолеассоциированного антигена плоскоклеточных карцином – онкомаркера SCC (в норме не превышает 1,5 нг/мл).
- Биопсия шейки матки. Кольпоскопия дает возможность выявить участок трансформации и произвести прицельную биопсию шейки матки для гистологического исследования забранных тканей. Ножевая биопсия шейки матки с выскабливанием цервикального канала обязательна при подозрении на цервикальный рак. Для определения степени инвазии рака производится конизация шейки матки – конусовидное иссечение кусочка тканей. Решающим и окончательным методом в диагностике рака шейки матки является морфологическая интерпретация результатов биопсии.
Дополнительно при раке шейки матки проводится УЗИ малого таза, позволяющее стадировать опухолевый процесс и планировать объем вмешательства. Для исключения прорастания опухоли в смежные органы и отдаленного метастазирования прибегают к выполнению УЗИ мочевого пузыря и почек, цистоскопии, внутривенной урографии, УЗИ брюшной полости, рентгенографии легких, ирригоскопии, ректоскопии. При необходимости пациентки с выявленным раком шейки матки должны быть проконсультированы урологом, пульмонологом, проктологом.

Лечение рака шейки матки
Хирургическое лечение
Все операции при раке шейки матки делятся на органосохраняющие и радикальные. Выбор тактики зависит от возраста женщины, репродуктивных планов, распространенности онкопроцесса. В онкогинекологии применяется:
- Органосохраняющая тактика. При преинвазивном раке у молодых женщин, планирующих деторождение, выполняются щадящие вмешательства с удалением начально измененных участков шейки матки в пределах здоровых тканей. К таким операциям относят конусовидную ампутацию (конизацию) шейки матки, электрохирургическую петлевую эксцизию, высокую ампутацию шейки матки. Экономные резекции при раке шейки матки позволяют соблюсти онкологическую радикальность и сохранить репродуктивную функцию.
- Радикальная тактика. При более выраженных изменениях и распространенности опухолевого процесса показано удаление матки с транспозицией яичников (выведением их за пределы таза) или с овариэктомией. При раке шейки матки в стадии I B1 стандартным хирургическим объемом является пангистерэктомия – экстирпация матки с аднексэктомией и тазовой лимфодиссекцией. При переходе опухоли на влагалище показано проведение радикальной гистерэктомии с удалением части влагалища, яичников, маточных труб, измененных лимфоузлов, парацервикальной клетчатки.
Противоопухолевое лечение
Хирургический этап лечения рака шейки матки может сочетаться с лучевой или химиотерапией, либо с их комбинацией. Химио- и радиотерапия могут проводиться на дооперационном этапе для уменьшения размеров опухоли (неоадъювантная терапия) или после операции для уничтожения возможно оставшихся опухолевых тканей (адъювантная терапия). При запущенных формах рака шейки матки выполняются паллиативные операции – выведение цистостомы, колостомы, формирование обходных кишечных анастомозов.
Прогноз
Лечение рака шейки матки, начатое на I стадии, обеспечивает 5-летнюю выживаемость у 80-90% пациенток; при II ст. выживаемость через пять лет составляет 60-75%; при III ст. - 30-40%; при IV ст. – менее 10%. При осуществлении органосберегающих операций по поводу рака шейки матки шансы на деторождение сохраняются. В случае проведения радикальных вмешательств, неоадъювантной или адъювантной терапии фертильность полностью утрачивается.
При выявлении рака шейки матки при беременности, тактика зависит от сроков гестации и распространенности опухолевого процесса. Если срок гестации соответствует II-III триместру, беременность возможно сохранить. Ведение беременности при раке шейки матки осуществляется под повышенным медицинским наблюдением. Методом родоразрешения в этом случае обычно служит кесарево сечение с одновременным удалением матки. При сроке гестации менее 3-х месяцев производится искусственное прерывание беременности с немедленным началом лечения рака шейки матки.
Профилактика
Основной профилактической мерой рака является массовый онкологический скрининг с помощью цитологического исследования соскобов с шейки матки и из цервикального канала. Обследование рекомендуется начинать после начала половой жизни, но не позднее возраста 21 года. В течение первых двух лет мазок сдается ежегодно; затем, при отрицательных результатах – 1 раз в 2-3 года.
Профилактика рака шейки матки требует раннего выявления и лечения фоновых заболеваний и половых инфекций, ограничения числа сексуальных партнеров, использования барьерной контрацепции при случайных половых связях. Пациенткам групп риска необходимо прохождения осмотра гинеколога не реже 1 раза в полгода с проведением расширенной кольпоскопии и цитологического мазка. Девочкам и молодым женщинам в возрасте от 9 до 26 лет показано проведение профилактической вакцинации против ВПЧ и рака шейки матки препаратами Церварикс или Гардасил.
Рак эндометрия (рак тела матки) - симптомы и лечение
Что такое рак эндометрия (рак тела матки)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ильина Антона Алексеевича, онколога-гинеколога со стажем в 13 лет.
Над статьей доктора Ильина Антона Алексеевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Рак эндометрия (endometrial cancer) — это злокачественная опухоль, которая развивается из клеток внутреннего слоя матки. Основным симптомом, который появляется уже на начальной стадии болезни, являются кровянистые выделения из половых путей.
Рак эндометрия ещё называют раком тела матки и аденокарциномой эндометрия.
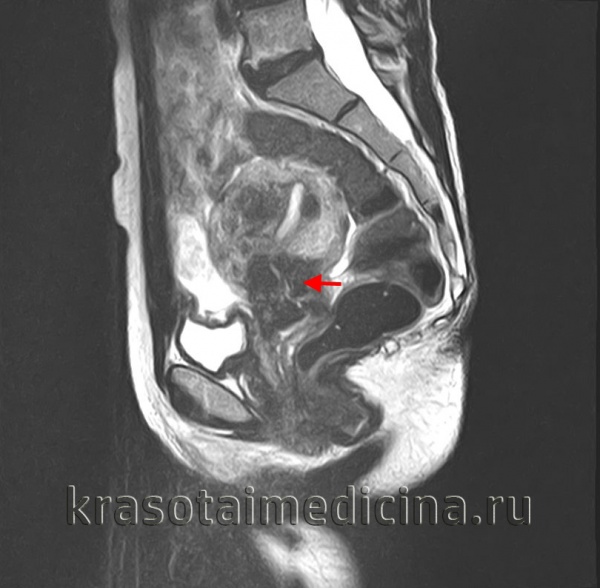
Распространённость
Рак эндометрия — это самая частая злокачественная опухоль женских половых органов. Но если болезнь выявлена своевременно и проведено адекватное лечение, большинство пациенток выздоравливает [1] .
В основном раком эндометрия заболевают женщины в постменопаузе: более 90 % случаев диагностируются после 50 лет. Чаще всего болезнь встречается среди пациенток в возрасте 65–69 лет — заболеваемость среди них составляет 98,1 на 100 тыс. женщин. Средний возраст на момент начала болезни — 63 года. До 49 лет рак эндометрия встречается относительно редко: в 4–5 % от всех случаев [11] .
Около 5 % случаев рака эндометрия имеют наследственный характер. Злокачественная опухоль эндометрия может развиться при наследственном неполипозном колоректальном раке (синдроме Линча) [12] . Болезнь возникает из-за поломки генов MLH1, MSH2, MSH6 или PMS2. При таких мутациях риск развития рака эндометрия и колоректального рака составляет 24–51 %, рака яичников — 11–15 % [13] .
Помимо генетической предрасположенности, на заболеваемость влияют следующие факторы:
- лишний вес (риск развития рака эндометрия повышается в 1,32 раза); (в 2,54 раза); (в 2,1 раза);
- раннее начало и позднее прекращение менструаций: до 10–12 и после 55 лет (в 2,1 раза); (в 2,9 раза);
- приём Тамоксифена — гормонального препарата для лечения рака молочной железы (в 2,5 раза);
- монотерапия эстрогенами более пяти лет (в 10–30 раз); ;
- лучевая терапия на органы малого таза.
Ожирение является одним из основных факторов риска. Жировая ткань преобразует в эстрогены другие гормоны — андрогены. Если уровень эстрогенов значительно повышен, то риск развития опухолей эндометрия также увеличивается. Получается, чем больше жировой ткани, тем выше вероятность заболеть раком эндометрия.
Тамоксифен — это препарат, который используется при лечении рака груди. В ткани молочной железы он действует как антиэстроген, но в матке механизм действия иной, аналогичный гормону эстрогену. При лечении Тамоксифеном рекомендуется ежегодно наблюдаться у гинеколога.
При синдроме поликистозных яичников значительно повышается уровень андрогенов и эстрогена, а также снижается уровень прогестерона. Изменение соотношения эстрогена и прогестерона является одной из основных причин развития рака эндометрия.
Предшествующая лучевая терапия. Радиация используется для лечения некоторых типов опухолей. При облучении сложно, а иногда невозможно не затронуть смежные органы. Радиация повреждает ДНК здоровых тканей и может приводить к развитию рака в прежде здоровых органах.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака эндометрия
Эффективных программ скрининга рака эндометрия пока не существует. Единственный способ обнаружить заболевание на ранней стадии — это ежегодно посещать гинеколога. Также к доктору нужно обратиться, если болит низ живота или появились кровянистые выделения из половых путей между менструациями или в постменопаузе. Кровянистые выделения при раке эндометрия встречаются у 90 % пациенток. Чаще всего выделения слабые или умеренные, их характер зависит от распространения опухоли.
Признаком злокачественной опухоли также может быть изменение характера выделений, даже без примеси крови [2] . Боль, потеря веса и тяжесть в животе появляются уже на поздних стадиях болезни.
Патогенез рака эндометрия
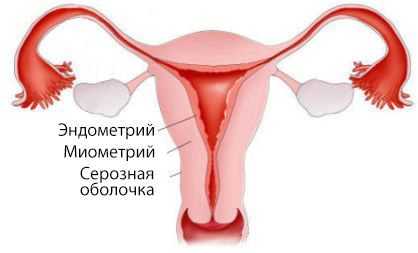
Матка состоит из двух частей: тела и шейки. В теле матки выделяют три слоя:
- наружный — серозная оболочка;
- средний — миометрий, или мышечный слой;
- внутренний — эндометрий, который частично отторгается вместе с кровью при каждой менструации.
Аденокарцинома развивается непосредственно из эндометрия.
В 1963 году была предложена и обоснована теория о двух основных типах аденокарциномы матки. Первый вариант наблюдается у 60–70 % пациенток и протекает с нарушениями углеводного и жирового обмена на фоне избыточного количества эстрогенов [14] [15] . Женщины с этим типом рака страдают маточными кровотечениями, бесплодием, ожирением и сахарным диабетом. У них поздно наступает менопауза и развиваются гиперпластические процессы в эндометрии (качественно-количественное изменение его клеток).
Второй патогенетический вариант болезни встречается у 30–40 % пациенток. У них описанные выше нарушения выражены слабо или отсутствуют [14] [15] . Изменения в эндометрии носят атрофичный характер, развиваются полипы, атипическая гиперплазия и рак.
Отнести заболевание к первому типу можно в следующих случаях:
- присутствует более половины перечисленных признаков;
- симптомы гиперэстрогении (болезненные менструации и маточные кровотечения вне их) сочетаются с обменными нарушениями, например с ожирением и сахарным диабетом.
Согласно другому разделению, к первому типу рака эндометрия относят эндометриоидный рак, ко второму — неэндометриоидный (серозный или светлоклеточный). Они встречаются в 80–90 % и 10–20 % случаев соответственно [3] . Такое разделение связано с различиями в молекулярном профиле опухолей, методах лечения и прогнозе.
Чаще всего раковые опухоли образуются из-за повреждения гена-супрессора PTEN, который подавляет развитие и рост раковых клеток. Данная аномалия встречается у 83 % пациенток с раком эндометрия [4] .
Болезнь также может развиваться при поломке в системе репарации (т. е. исправления) ошибок спаривания нуклеотидов. Эта система отвечает за важный этап нормального деления здоровых клеток. Рак эндометрия первого типа, как правило, связан с мутациями в генах KRAS и CTNNB. Второй тип часто протекает на фоне хромосомной нестабильности, генетических расстройств и мутации в гене р53.
Классификация и стадии развития рака эндометрия
В онкологии существуют две системы TNM, т. е. стадирования рака — FIGO (International Federation of Gynecology and Obstetrics) и AJCC (American Joint Committee on Cancer). Обе системы используют следующие ключевые параметры для описания рака и установки стадии:
- размер опухоли (Tumor);
- наличие или отсутствие опухоли в лимфатических узлах (Node);
- наличие или отсутствие метастазов опухоли (Metastasis) [5] .
Исходя из этих признаков, выделяют четыре основные стадии. Чем меньше стадия, тем лучше прогноз. Рак обычно стадируется дважды. Первый раз — до лечения, такое стадирование называется клиническим. Второй раз — после операции, такое стадирование называется патологоанатомическим и считается более точным и окончательным. Со временем опухоль может расти или распространяться на органы, в которых её раньше не было, а также повторно развиваться после полного излечения. В этом случае стадия, установленная однажды, меняться не будет.
Стадии рака эндометрия по системе TNM
Более схематично стадии рака эндометрия отражены на рисунке:
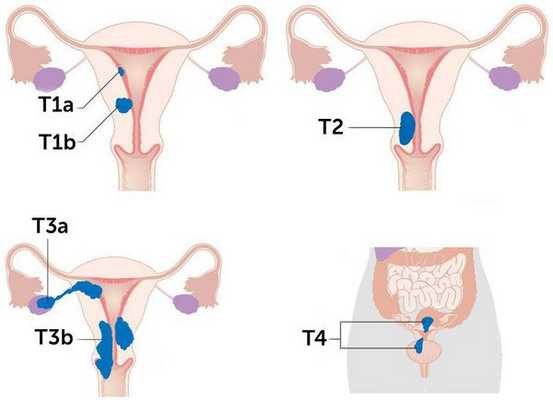
Согласно международной гистологической классификации рака тела матки, выделяют несколько видов опухолей:
- Злокачественные эпителиальные опухоли. В эту группу входят различные виды рака, среди которых эндометриальная аденокарцинома, серозный и светлоклеточный рак.
- Злокачественные смешанные эпителиальные и мезенхимальные опухоли — аденосаркома и карциносаркома.
- Мезенхимальные опухоли — леймиосаркома, эпителиоидная и миксоидная леймиосаркома, эндометриальная стромальная саркома низкой и высокой степени злокачественности.
Лучший прогноз имеет эндометриоидная форма, худший — серозная и светлоклеточная, но основным прогностическим критерием является стадия заболевания. Например, выживаемость с IV стадией эндометриоидного рака ниже, чем с I стадией светлоклеточного.
Рак тела матки также классифицируется на основании вида клеток, из которых он развился. Чтобы установить разновидность рака и его дифференцировку, исследуются удалённые органы или их части. Тип опухоли устанавливает эксперт-патолог, работающий с тканями под микроскопом.
Дифференцировка — это схожесть раковой клетки со здоровой. Она отражает, насколько быстро опухоль может расти и распространяться. Описаны три степени дифференцировки: G1, G2, G3, где G3 — самая неблагоприятная с быстрым ростом опухоли. Сейчас чаще выделяют только два класса: низкой злокачественности (low grade) и высокой (high grade). Low grade включает G1 и G2, a high grade — G3.
Осложнения рака эндометрия
Без специализированного лечения рак эндометрия неизбежно прогрессирует: боль и кровотечение из половых путей усиливаются, мочевой пузырь и прямая кишка сдавливаются, их функции нарушаются. У пациенток учащается мочеиспускание и стул либо, наоборот, возникают запоры.
Если опухоль проросла в мочевой пузырь и кишку, в моче и кале может появиться кровь. Очаги опухоли могут также образоваться в других органах и тканях: печени, лёгких и брюшной полости. При метастазах в лёгких появляется кашель, боль в грудной клетке и одышка; метастазы в печени проявляются болью в правом подреберье [6] .
Диагностика рака эндометрия
В отличие от рака шейки матки для рака эндометрия не существует программ скрининга. Диагноз устанавливается после комплексного обследования, которое включает:
- осмотр на гинекологическом кресле;
- подтверждение наличия опухолевых клеток;
- магнитно-резонансную томографию (МРТ) с контрастированием;
- ультразвуковое исследование (УЗИ);
- компьютерную томографию (КТ).
Осмотр на гинекологическом кресле позволяет оценить, где расположена и насколько распространилась опухоль, а также выявить, поражены ли смежные органы малого таза.
Подтверждение наличия опухолевых клеток, или верификация, — это необходимый компонент обследования. Получить клетки можно двумя способами:
- Пайпель-биопсия — процедура, при которой эндометрий забирается из полости матки с помощью тонкого зонда. Не требует общего наркоза и специальных условий.
- Гистерорезектоскопия — операция, при которой перед забором эндометрия врач может осмотреть полость матки. Гистероскопия предпочтительна при безоперационном лечении, проводится под наркозом и редко занимает более 15 минут. Точность гистероскопии выше, чем пайпель-биопсии, и составляет около 72 % [7] .
Ультразвуковое исследование может быть выполнено через брюшную стенку и интравагинально, т. е. через влагалище. Интравагинальное УЗИ позволяет лучше оценить состояние эндометрия, аномальное утолщение которого может косвенно указывать на онкологическое заболевание. Данная процедура является относительно простой и не требует специальной подготовки, поэтому часто назначается пациенткам на первом этапе диагностики. Правильно интерпретировать результаты УЗИ может только врач-онкогинеколог.
Магнитно-резонансная томография с контрастированием является более точным методом диагностики по сравнению с УЗИ. МРТ назначается при планировании лечения и позволяет определиться с объёмом операции.
Компьютерную томографию (КТ) с контрастированием применяют, чтобы определить, есть ли метастазы в органах грудной клетки и брюшной полости.
Специфических онкомаркеров для диагностики рака эндометрия не существует. Один из немногих маркеров с относительной чувствительностью — Са-125, но такой анализ не входит в стандартное обследование. Этот онкомаркер выявляется при лимфоме, раке яичников, поджелудочной и молочной железы. Также его уровень может повышаться при беременности, различных воспалительных заболеваниях или доброкачественных образованиях, например кистах яичников и миоме матки.
Лечение рака эндометрия
Основной метод лечения рака эндометрия — это операция, при которой удаляются тело и шейка матки с придатками.
Операция может проводиться через три вида доступа:
- лапаротомный (разрез передней брюшной стенки);
- лапароскопический (через проколы 5–10 мм);
- влагалищный.
Чаще всего применяется лапароскопия, так как после неё пациентки быстрее всего восстанавливаются.
Необходимость лимфодиссекции (удаления лимфатических узлов) зависит от наличия факторов риска метастазирования опухоли, результатов морфологического заключения и данных инструментальной диагностики. При удалении лимфатических узлов важно оценить, есть ли в них опухолевые клетки, что имеет решающее значение при планировании лечения после операции.
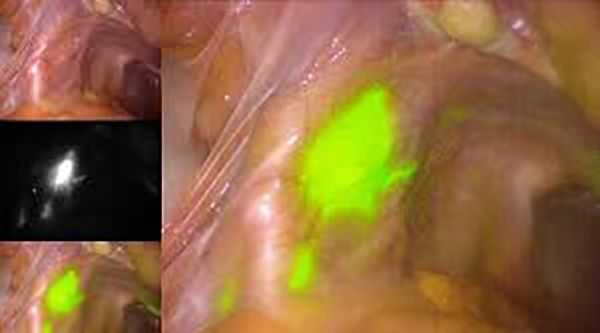
Чем больше объём операции, тем выше риски послеоперационных осложнений. При удалении лимфоузлов примерно в половине случаев образуются лимфокисты — отграниченные скопления лимфатической жидкости в малом тазу [8] . Чтобы минимизировать риски их развития и избежать лимфодиссекции, в некоторых клиниках используется технология определения сигнальных лимфоузлов (СЛУ). Во время процедуры в шейку матки вводится краситель, который по лимфатическим сосудам попадает в лимфоузлы. Затем хирург находит лимфоузлы, в которых накопился краситель, и удаляет узел, расположенный ближе всего к матке. Далее, непосредственно во время операции, проводится гистологическое исследование, позволяющее подтвердить или исключить наличие метастазов в СЛУ и избежать их полного удаления.
Если женщина планирует беременность, то в некоторых случаях допустимо безоперационное лечение. Оно возможно при эндометриоидном типе рака, стадии IA и высокой дифференцировке. Лечение проводится гормональными препаратами, которые блокируют работу яичников и оказывают терапевтический эффект на опухоль. Применяются два основных препарата: Мегестрола ацетат и Медроксипрогестерон.
Продолжительность гормонального лечения, как правило, составляет 6–12 месяцев. Затем при хорошем эффекте врач может разрешить беременность. После родов зачастую рекомендуется удалить матку, так как опухоль часто развивается повторно.
Лучевая терапия или химиотерапия на первом этапе менее эффективны, чем хирургическое лечение. Они назначаются, если нельзя провести операцию, например при тяжёлых хронических заболеваниях, распространённости опухоли и лечении рецидивов.
Чтобы предотвратить повторное появление опухоли, после операции могут проводиться дистанционное облучение малого таза и брахитерапия (контактная лучевая терапия, при которой источник излучения вводится внутрь поражённого органа).
Метод подбирается врачом в зависимости от типа и стадии рака, состояния лимфатических узлов. Например, при неэндометриоидном раке после операции назначается химиотерапия в сочетании с брахитерапией, а при эндометриальном раке I стадии может быть достаточно брахитерапии или наблюдения.
Прогноз. Профилактика
Без лечения рак эндометрия неизбежно прогрессирует и со временем приводит к гибели пациентки.
Для оценки прогнозов в онкологии используется термин «пятилетняя выживаемость», который сравнивает пациентов с конкретной стадией болезни с людьми из общей популяции. Например, если пятилетняя выживаемость при первой стадии болезни достигает 95 %, то такие пациенты по сравнению со здоровыми людьми с вероятностью 95 % проживут пять лет.
При своевременном выявлении и лечении рак эндометрия имеет самые благоприятные прогнозы среди всех злокачественных опухолей женских половых органов:
- для I стадии пятилетняя выживаемость составляет 85–95 %;
- для II — 65–70 %;
- для III — 29 % [9] .
Стадия болезни является самым значимым фактором при определении прогноза, но далеко не единственным. Онкологи оценивают гистологический тип опухоли, её дифференцировку, размеры, расположение в матке, прорастание или метастазирование в другие органы и лимфатические узлы. Точный прогноз врач сможет дать только после всестороннего анализа этих параметров.
Читайте также:
- Миелома и плазмоцитома позвоночника - лечение, прогноз
- Морфология острой недостаточности коры надпочечников. Патологическая анатомия синдрома Ватерхайза — Фридрихсена
- Влияние алкоголя на потребление кислорода. Снижение потребления кислорода при алкоголизме
- Пороги стимуляции и чувствительности кардиостимулятора - оценка, регуляция
- Симптомы передозровки магния (гипермагниемии) и ее лечение
