Реконструкция левого желудочка. Показания к реконструкции левого желудочка
Добавил пользователь Alex Обновлено: 29.01.2026
Термин «ремоделирование сердца» был предложен N. Sharp в конце 70-х годов прошлого века для обозначения структурных и геометрических изменений после острого инфаркта миокарда (ОИМ). Затем он получил более широкое толкование.
Ишемическое ремоделирование – динамический, обратимый процесс изменения толщи миокарда,
размера и формы камер сердца, дисфункции левого желудочка (ЛЖ).
Гипертрофия левого желудочка – начальный этап ремоделирования при артериальной гипертензии (АГ),
зависит не столько от уровня АД – гемодинамическая перегрузка, сколько от активности РААС.
Риск развития хронической сердечной недостаточности (ХСН) увеличивается в 15 раз. ГЛЖ развивается по концентрическому типу (добавление саркомеров внутри кардиомиоцита). А11 стимулирует рост мышечных волокон, альдостерон изменяет внутриклеточный матрикс с формированием диастолической дисфункции – ДД.
ДД – ранний этап ремоделирования ЛЖ, маркер фиброза миокарда.
Расслабление – наиболее энергозависимый процесс, при ГЛЖ страдает в первую очередь. Наибольшую гемодинамическую перегрузку при ДД испытывает ЛП. Дилатация ЛП вызывает митральную регургитацию.
Важный этап – переход концентрической ГЛЖ в эксцентрическую. К систолической перегрузке давлением добавляется диастолическая перегрузка объемом. Дилатация ЛЖ сопровождается систолической дисфункцией. А это увеличивает летальность на 50%. ХСН движется к финишной стадии.
ИАПФ вызывают регресс концентрической гипертрофии, уменьшая толщину стенок ЛЖ; нормализуют диастолу Уменьшается объем мышечных волокон и миокардиальный фиброз.
На стадии эксцентрической гипертрофии ИАПФ препятствует истончению миокарда, уменьшают миокардинальный стресс. ИАПФ увеличивают ФВ, уменьшают объем ЛЖ, улучшают локальную сократимость – уменьшают индекс асинергии. Острый ИМ В первые 72 часа ОИМ наступает раннее ремоделирование - растяжение и истончение миокарда, дилатация и сферификация ЛЖ. При обширном трансмуральном ИМ происходит серьезная
архитектурная перестройка, определяющая прогноз заболевания. После повреждения и гибели части кардиомиоцитов и в нормальной, и поврежденной зоне идет процесс склерозирования. Миоциты гипертрофируются, меняется их взаимное расположение; нарушается соотношение: «основание/верхушка». Активизируются процессы поддержания сердечного выброса и нормализации напряжения стенки ЛЖ. Изменяется радиус кривизны стенок ЛЖ, от которого зависит разная жесткость стенок ЛЖ и распределение внутрижелудочкового объема. Механизм поддержания сердечного выброса и нормализации напряжения стенки ЛЖ реализуется через РААС и гипертрофию не поврежденных сегментов миокарда.
В 1978 г. G. Hutchius и B. Bulkley описали процесс острого увеличения и истоньчения зоны инфаркта без дополнительного некроза миокарда. В первые часы после гибели миоцитов отек и воспаление локализуют зону инфаркта. Дальше наблюдается пролиферация фибробластов и замещение этого участка коллагеном. Зона инфаркта может истончаться и расширяться. Длина сариомеров не изменяется. Таким образом, увеличение объема ЛЖ происходит вследствие перегруппировки миофибрилл без их растяжения. Стенка истончается из-за скольжения мышечн.ых волокон друг относительно друга в результате ослабления связей между миоцитами в инфарктной зоне. При ЭХО КГ определяется увеличение зоны акинезии без ферментативного сдвига.
Экспансия вероятнее всего при трансмуральном ИМ и заканчивается ХСН, аневризмой и разрывом миокарда. Передне-верхушечная область более уязвимая, так как она наиболее изогнута. Возможна дилатация непораженной зоны с тотальным расширением ЛЖ.
Постинфарктное ремоделирование ЛЖ (ПРЛЖ)
Резкое растяжение жизнеспособного миокарда по закону Франка – Старлинга, увеличение
хроно-ино-тропных эффектов при стимуляции адренорецепторов поддерживает насосную
функцию в условиях уменьшения сокращающейся части миокарда. При поражении более
20% массы ЛЖ компенсация будет неадекватной.
Увеличение полости ЛЖ помогает восстановить УО на фоне снижения ФВ.
Дилатация увеличивает миокардиальный стресс, порочный круг замыкается. В качестве компенсации наступает гипертрофия миоцитов: до 78% от исходного объема.
Гипертрофия может быть концентрическая без увеличения полости и эксцентрическая с дилатацией Гипертрофия может восстановить напряжение стенки ЛЖ При обширном ИМ дилатация не пропорциональна приросту массы миокарда
Роль цитокинов. Цитокины – маркеры ХСН
Развитие ХСН сопровождается увеличением провоспалительных цитокинов – интерлейкина-- – 1,6; в плазме крови и в миокарде. Без увеличения антивоспалительных цитокинов, что приводит к усилению воспаления. Экспрессия цитокинов и их рецепторов на мембранах кардиомиоцитов подтверждает центральную роль цитокинов в патогенезе ХСН.
Уровень фактора некроза опухоли (ФНО) прямо зависит от ФК ХСН. Иммуномодуляторы повышают уровень противовоспалительных мЕДИаторов. ВНУТРИвенное введение пентоксифиллина , иммуноглобулина увеличивает ФВ и снижает ФНО – альфа
Натрий – уретический .пептид – (НП)
В норме вырабатывается кардиомиоцитами предсердий и регулирует водно-солевое равновесие и снижает АД. При уменьшении сердечного выброса у больных асимптоматической дисфункцией ЛЖ и ФК I ХСН растет синтез НП в желудочках сердца. Это блокирует активность циркулирующего звена РААС и компенсирует состояние больных. Прогрессирование ХСН активизирует РААС. Снижается натрий-уретический ответ на рост активности НП. Это приводит к задержке натрия и воды, системной и почечной вазоконстрикции.
Постинфарктная аневризма ЛЖ
Хирургическим методом лечения является реваскуляризация миокарда и пластика
ЛЖ. Прогностически неблагоприятны ранние аневризмы при переднем ИМ.
- более 2-х ИМ в анамнезе;
- приступы сердечной астмы -- III, IY ФК по NYHA;
- КДД >24 мм. рт. ст.;
- стеноз ствола ЛКА;
- поражение трех основных бассейнов коронарных артерий.
Прогноз ремоделирования ЛЖ
Рентгенологически видимое увеличение ЛЖ неблагоприятно и увеличивает летальность в 3 раза, прогнозирует развитие ХСН. Подъем с. SТ со снижением или отсутствием з. R на ЭКГ помогает не только диагностировать ИМ, определить его размеры, но и предполагать ремоделирование ЛЖ. Компенсаторные процессы зависят от состояния коронарного кровотока уцелевшего миокарда, при неадекватном кровоснабжении дилатация больше, выше летальность. Стеноз артерий ограничивает компенсаторную гипертрофию миокарда и повышенную нагрузку. Дилатация полостей прямо коррелирует с риском фатальных аритмий.
Первичная профилактика не вызывает сомнений: это наиболее раннее и адекватное восстановление перфузии у больных ОКС. Профилактика ХСН начинается в первые часы ОИМ. Надо ограничить зону некроза: тромболитики, нитраты. БАБ, антиагреганты.
1 Доказан эффект ИАПФ: предпочтительны пролонгированные препараты и действующие на тканевой АПФ. Летальность от ХСН достоверно снижается, ФВ – увеличивается.
ИАПФ более эффективны при переднем ИМ. Терапия ИАПФ назначается в первые сутки
2 БАБ оказывают не только антиаритмическое действие, но и тормозят ремоделирование ЛЖ. K. Shiono не отметил эффект от атенолола. Метопролол вызывает редукцию объема и регрессию массы ЛЖ; улучшает геометрию ЛЖ.
3 Эффективны антагонисты кальция: амподипин, дилтиазем и изоптин, но лечение
должно быть длительным.
4 Нитраты ограничивают раннее постинфарктное ремоделирование ЛЖ.
5 Дигоксин в результате инотропной стимуляции при переднем ИМ может увеличивать инфарктное выпячивание ЛЖ без снижения содержания коллагена.
6 L- карнитин в остром и отдаленном периоде ИМ уменьшал дилатацию ЛЖ (S. Iliceto).
Реконструкция левого желудочка. Показания к реконструкции левого желудочка
Протезирование аортального клапана. Показания к операции на аортальном клапане
Данная статья посвящен аортальному протезированию у пациентов с патологией аортального клапана и желудочковой дисфункцией или СН. У пациентов с аортальным стенозом иногда может развиваться дисфункция ЛЖ с низким аортальным градиентом. Протезирование АК у таких пациентов оправдано, если дисфункция ЛЖ развивается вторично на фоне аортального стеноза. Следовательно, у пациентов с аортальным стенозом и низким сердечным выбросом необходимо различать псевдообструкцию со снижением функции ЛЖ, приводящей к недостаточному открытию АК, и истинный аортальный стеноз с первичной обструкцией выносящего тракта и дисфункцией ЛЖ.
С целью дифференциальной диагностики полезна стресс-ЭхоКГ с добутамином. В прошлом таким пациентам отказывали в хирургическом лечении в связи с высоким риском интраоперационной смерти, но сейчас ясно, что прогноз у таких больных в случае отказа в протезировании АК крайне неблагоприятный (выживаемость составляет 62,32 и 18% при Т, 5- и 10-летнем наблюдении соответственно). Более того, проводимая у этих пациентов фармакотерапия не влияла на выживаемость. Исследования выявилили, что оперативное лечение у таких пациентов возможно и исходы его лучше, чем только при ЛТ.
В исследовании, проведенном в клинике Кливленда, внутрибольничная смертность в группе оперированных пациентов составила 8% в течение первого года по сравнению с 82% vs 41% в группе пациентов, получавших только ЛТ, а выживаемость в течение 4 лет составляла 78% vs 15% соответственно. Допуская, что у пациента настоящий аортальный стеноз со сниженным сердечным выбросом и низким градиентом, соотношение риска и пользы в данном случае перевешивает в сторону проведения операции, но только у пациентов с отсутствием сопутствующей патологии.
Пациенты с тяжелой аортальной регургитацией и дисфункцией ЛЖ — другая проблема. В исследовании, проведенном в клинике Кливленда, некоторым пациентам с прогрессирующей СН проводили трансплантацию сердца, т.к. дисфункция ЛЖ считалась необратимой. Несмотря на то что послеоперационная летальность в этой группе была достаточно высокой, исследование показало, что у пациентов с изолированной АР с 1985 г. летальность составляла незначительный процент.
В серии исследований в Кливленде у большинства пациентов после операции наблюдалось снижение массы и сокращение объемных характеристик ЛЖ. Возможно, что отсроченная выживаемость у этих пациентов не такая хорошая, как в группе больных с нормальной функцией ЛЖ и тяжелой аортальной недостаточностью, но клинический исход лучше, чем в случае трансплантации сердца или продолжительной ЛТ. В рекомендациях АСС/АНА таким пациентам показано оперативное лечение (класс I).
Итак, реконструкция МК на фоне нарушения функции ЛЖ и MP может быть проведена в специализированном кардиохирургическом центре пациентам, которым необходимо АКШ, а также в отдельных случаях пациентам с идиопатической КМП, если, несмотря на максимально корректно подобранную лекарственную терапию, продолжают прогрессировать симптомы болезни.
Операции на аортальном клапане целесообразно проводить у пациентов с тяжелой левожелудочковой дисфункцией и СН даже при более высоком риске смерти, т.к. в экспериментальных исследованиях было показано, что после операции клинический исход лучше, чем в случае лекарственной терапии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Хирургическое лечение сердечной недостаточности. Ишемическая кардиомиопатия
В настоящее время, несмотря на наличие современных методов лечения сердечной недостаточности, практикующие врачи часто сталкиваются с пациентами, у которых на фоне оптимально подобранного лечения продолжают прогрессировать симптомы СН. Действительно, вопреки многообразию существующих схем лекарственной терапии и таких электрофизиологических методов лечения, как двухкамерная стимуляция, ИКД, у многих пациентов так и не удается достичь оптимального качества жизни и хорошего прогноза.
Хирургические методы лечения СН могут быть полезными в следующих случаях: (1) с целью уменьшения ишемии миокарда; (2) для коррекции дисфункции клапанного аппарата; (3) с целью восстановления или уменьшения механических последствий ремоделирования миокарда; (4) для выполнения трансплантации сердца, когда остальные методы лечения были неэффективны.
Исторически к хирургическим вмешательствам у пациентов с СН и низкой фракцией выброса левого желудочка (ФВ ЛЖ) относились как к операциям очень высокого риска. Тем не менее современные исследования выявили, что у таких пациентов в раннем послеоперационном периоде количество осложнений и летальность могут находиться на допустимом уровне, а эффективность лечения и выживаемость на поздних стадиях заболевания значительно улучшаются.

В статьях будут рассмотрены все возможные методы хирургической коррекции при СН: реваскуляризация КА, реконструктивные операции на клапанах сердца, реконструкция ЛЖ, использование устройств для пассивной поддержки сердечной деятельности и трансплантация сердца. Для получения положительного эффекта некоторым пациентам достаточно выполнить только одну операцию (например, АКШ или реконструкцию клапана), тогда как у других необходимо применить несколько методов одновременно (например, АКШ в сочетании с реконструкцией митрального и трехстворчатого клапанов либо с реконструкцией ЛЖ при апикальной аневризме ЛЖ).
Ишемическая кардиомиопатия
Термин ишемическая кардиомиопатия используют для описания миокардиальной дисфункции, развивающейся вторично на фоне окклюзирующего и/или обструктивного поражения коронарного русла. Несмотря на то что ранее ишемическую кардиомиопатию считали второй по значимости причиной развития СН (после гипертензии), результаты Framingham Study показали, что именно ИКМП является основной причиной СН. Данный раздел посвящен хирургической реваскуляризации КА у пациентов с ИКМП.
Ишемическая кардиомиопатия можно представить как взаимосвязь трех патофизиологических процессов: (1) гибернации миокарда, определяемой как постоянное нарушение сократимости миокарда в покое, вызванное снижением коронарного кровотока, которое может быть частично или полностью обратимо посредством реваскуляризации миокарда; (2) «оглушения» миокарда (или станнинга) — относительно продолжительного или транзиторного состояния жизнеспособного миокарда, развивающегося в результате реперфузии за счет притока свободных радикалов кислорода и потери сократительными белками чувствительности к кальцию; (3) необратимой смерти КМЦ, приводящей к ремоделированию желудочка и нарушению сократительной функции.
Хирургическое лечение осложненных форм ишемической болезни сердца (ИБС) остается актуальной проблемой современной кардиохирургии. Среди различных осложнений ИБС особое место занимает постинфарктная аневризма левого желудочка (ЛЖ), что обусловлено высокой частотой развития этого осложнения (10—35% после перенесенного трансмурального инфаркта миокарда — ИМ) и неблагоприятным прогнозом [1, 2]. Пятилетняя выживаемость при естественном течении заболевания колеблется от 25 до 60% [3, 4].
В последние годы в лечении этого осложнения достигнут значительный прогресс, тем не менее операции у таких больных продолжают ассоциироваться с высоким риском развития острой послеоперационной сердечной недостаточности, особенно у пациентов с крайне низкими функциональными резервами миокарда ЛЖ — фракция выброса (ФВ) ЛЖ менее 30%. Многие исследования свидетельствуют о периоперационной летальности, которая в этой группе может достигать 20%, что дает все основания считать хирургическое лечение этого осложнения ИБС одной из актуальных проблем современной кардиохирургии [5].
Приводимый клинический пример демонстрирует успешную реконструкцию ЛЖ на работающем сердце у пациента с крайне низкими функциональными резервами миокарда ЛЖ (ФВ ЛЖ 7%).
Больной В., 67 лет, в июне 2016 г. с острым коронарным синдромом поступил в одну из клиник Москвы, где по данным коронароангиографии выявлен критический стеноз проксимального сегмента передней нисходящей артерии. Других изменений коронарных артерий не выявлено. Выполнены баллонная ангиопластика и стентирование передней нисходящей артерии. В удовлетворительном состоянии пациент выписан, однако через 2 мес после операции его состояние резко ухудшилось, в связи с чем он госпитализирован в ГКБ по месту жительства. После проведения диагностики, включающей коронароангиографию, выявлен переднебоковой крупноочаговый ИМ на фоне тромбоза стента. Ранний постинфарктный период осложнился прогрессированием сердечной недостаточности в результате формирования аневризмы Л.Ж. После проведения курса медикаментозной терапии и относительной стабилизации гемодинамики в октябре 2016 г. пациент переведен в кардиохирургическое отделение ЦКБ с поликлиникой У.Д. Президента Р.Ф..
Состояние больного на момент поступления крайне тяжелое. Положение горизонтальное. Любая физическая нагрузка, включая переход в вертикальное положение, приводит к выраженной одышке. Клинически значимые сопутствующие заболевания: бронхиальная астма, нефропатия смешанного генеза, хроническая болезнь почек III стадии (скорость клубочковой фильтрации 63 мл/мин), хронический вирусный гепатит В.
Данные инструментальных методов диагностики
Трансторакальная ЭхоКГ (ТТЭхоКГ): конечный диастолический размер (КДР) ЛЖ до 13,3 см по наружному контуру с включением тромба. Конечный диастолический объем (КДО) ЛЖ (без учета тромба) 456 мл, конечный систолический объем (КСО) ЛЖ (без учета тромба) 422 мл в трехмерном режиме. Конфигурация полости ЛЖ сферическая, представляет собой гигантскую аневризму с массивным пристеночным тромбом толщиной до 4 см. Глобальная сократимость ЛЖ резко снижена — ФВ ЛЖ 7%. Локальная сократимость миокарда ЛЖ сохранена в базальных сегментах, остальные сегменты гипо- и акинетичны. Правый желудочек в пределах нормы. Объем левого предсердия 70 мл, незначительно увеличен. Объем правого предсердия 28 мл. Утолщение створок митрального клапана (МК), митральная регургитация I—II степени. Трикуспидальная регургитация до I степени. Систолическое давление в легочной артерии 50 мм рт.ст.
Коронароангиография: ствол левой коронарной артерии проходим, отмечаются неровности контуров. Передняя межжелудочковая ветвь окклюзирована от устья, дистальные отделы не прослеживаются. Огибающая артерия, правая коронарная артерия имеют неровности контуров, проходимы.
Функция внешнего дыхания: обструкция бронхов с резким снижением объема форсированного выдоха за 1 с 28%, значительное снижение индекса Тиффно (49%), резкое снижение жизненной емкости легких 42%.
Рентгенологическое исследование органов грудной клетки: тень сердца резко увеличена за счет левых отделов, двусторонний гидроторакс.
МРТ сердца: обширные рубцовые изменения миокарда ЛЖ переднеперегородочной, боковой и верхушечной локализаций с наличием массивного пристеночного тромбоза в области рубца. Площадь рубцовой трансформации миокарда составила 85% площади ЛЖ. КДО ЛЖ до 750 мл, КДР ЛЖ 11,5 мм, КСР ЛЖ 11,2 мм. Критическое снижение сократимости миокарда ЛЖ (рис. 1).
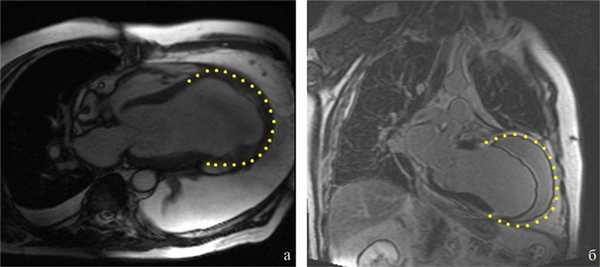
Рис. 1. МРТ сердца до операции. а — четырехкамерная проекция; б — двухкамерная проекция. Желтая пунктирная линия — границы рубцовой ткани.
Согласно классификации W. Stoney (1973 г.), в соответствии с функциональным состоянием миокарда неаневризматической части ЛЖ у пациента II тип аневризмы с гипокинезией сегментов жизнеспособного миокарда и сниженной насосной функцией Л.Ж. Расчетная Ф.В. сокращающихся сегментов неаневризматической части ЛЖ составила 30—35%. Риск хирургического вмешательства по шкале Euroscore II 72,6% (крайне высокий).
Ход операции. После установки внутриаортального баллонного контрпульсатора выполнена срединная стернотомия. В перикарде выраженный рубцово-спаечный процесс. Частичный кардиолиз с освобождением аорты и правых отделов сердца. После подключения сердца к аппарату искусственного кровообращения (ИК) и начала ИК кардиолиз завершен. При ревизии практически вся поверхность ЛЖ представлена гигантской мешковидной аневризмой (рис. 2). Аневризмотомия на работающем сердце. Полости аневризмы и частично ЛЖ заполнены старыми и свежими тромботическими массами, весившими после их удаления 280 г (рис. 3). После завершения тромбэктомии выполнена резекция аневризматического мешка (рис. 4). Профилактика материальной и воздушной эмболии. Формирование кисетного шва по Fontan нитью пролен 2/0 на границе рубцовой ткани и здорового миокарда Л.Ж. Геометрическая реконструкция ЛЖ синтетической заплатой из политетрафторэтилена размером 8×5 см (рис. 5). Герметизация полости ЛЖ двухрядным непрерывным швом (пролен 2/0). Начало внутриаортальной баллонной контрпульсации (ВАБК) в режиме 1:1 с постепенным снижением производительности и отключением аппарата И.К. Гемостаз, ушивание операционной раны. Длительность И.К. составила 147 мин.

Рис. 2. Интраоперационное фото. Аневризма левого желудочка после кардиолиза.
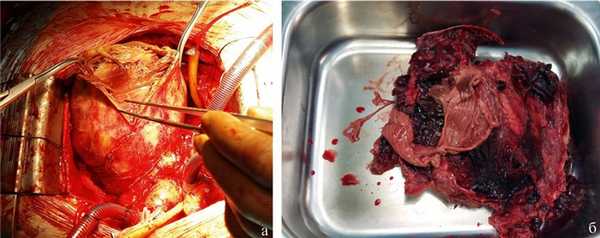
Рис. 3. Интраоперационное фото. а — тромб в полости левого желудочка; б — тромботические массы после удаления.

Рис. 4. Интраоперационное фото. Полость левого желудочка после тромбэктомии, резекции аневризматического мешка.
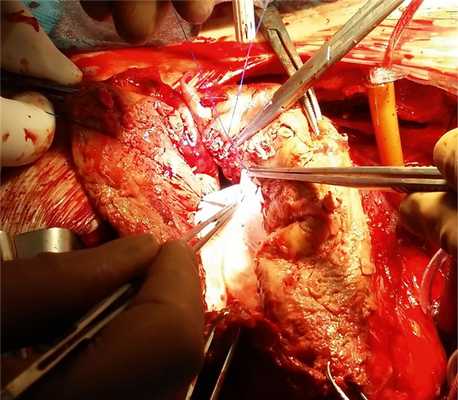
Рис. 5. Интраоперационное фото. Геометрическая реконструкция левого желудочка синтетической заплатой из ПТФЭ.
Интраоперационная чреспищеводная ЭхоКГ: КДО ЛЖ 150—160 мл, КСО ЛЖ 100—110 мл, ударный объем (УО) 50 мл, ФВ 33% (режим ВАБК 1:1). Недостаточность М.К. I степени.
В раннем послеоперационном периоде в течение первых 2 сут использовали охранительную медикаментозную седацию и искусственную вентиляцию легких. Гемодинамику поддерживали умеренными дозами кардиотонических и вазопрессорных препаратов, а также ВАБК в режиме 1:1.
На 3-и сутки после прекращения медикаментозной седации пациент пришел в сознание без неврологического дефицита, экстубирован после восстановления мышечного тонуса. Постепенное снижение доз кардиотонической поддержки, перевод ВАБК на режим 1:2.
На 4-е сутки ВАБК прекращена. Контрольная ТТЭхоКГ после удаления внутриаортального баллонного контрпульсатора: КДО ЛЖ 130—140 мл, КСО ЛЖ 103 мл, УО 40 мл, ФВ 26%. Недостаточность М.К. I—II степени. Локальная сократимость ЛЖ без изменений. На 6-е сутки пациент переведен в общую палату.
В ходе дальнейшего послеоперационного наблюдения пациенту выполнено суточное мониторирование ЭКГ, при котором выявлена желудочковая эктопия 5-й градации по Lown—Wolff—Rayn, пробежки ускоренного желудочкового ритма. Для профилактики внезапной сердечной смерти (класс показаний IA AHA) больному имплантирован двухкамерный кардиовертер-дефибриллятор.
На 12-е сутки после операции пациент в удовлетворительном состоянии выписан под наблюдение кардиолога по месту жительства. К моменту выписки больной освоил ходьбу без одышки до 500 м.
При контрольном осмотре через 2 мес после операции состояние больного удовлетворительное, жалоб не предъявляет. Физическая нагрузка — ходьба около 2000 м без одышки. МРТ и ТТЭхоКГ: КДО ЛЖ 144 мл, КСО ЛЖ 93 мл, УО 50 мл, ФВ 35%. Недостаточность М.К. I—II степени (рис. 6).

Рис. 6. МРТ сердца после операции. a — четырехкамерная проекция; б — двухкамерная проекция.
Реконструкция постинфарктной аневризмы ЛЖ, особенно у пациентов с критическим снижением функциональных резервов миокарда (ФВ менее 30%), ассоциирована с высоким уровнем послеоперационных осложнений и летальности. По некоторым данным, хирургическая летальность в этой группе больных может достигать 20%, наиболее частой ее причиной является острая левожелудочковая недостаточность [5]. C. Athanasuleas и соавт. [6] в своей работе указывают на то, что 19% больных с низкими функциональными резервами миокарда после пластики ЛЖ нуждаются в ВАБК.
В связи с этим хирурги ведут поиски методик, которые бы позволили существенно уменьшить количество таких осложнений и соответственно уровень хирургической летальности. Реконструкция Л.Ж. на работающем сердце в условиях вспомогательного ИК рассматривается рядом авторов как один из методов хирургического вмешательства у этой категории больных. По их мнению, такой подход позволяет минимизировать ишемию миокарда, избежать реперфузионных осложнений, следовательно, и синдрома малого сердечного выброса [8, 10]. X. Wang и соавт. [7] провели сравнение течения раннего послеоперационного периода после пластики ЛЖ на работающем и остановленном сердце. Летальность по группам составила 3 и 12% соответственно, а показатели кардиоспецифичного тропонина I были на 27% выше в группе операций с использованием кардиоплегии.
Дополнительным преимуществом операции на работающем сердце является возможность визуальной и пальпаторной оценки миокарда во время сердечных сокращений, что позволяет эффективно определить границы резекции и максимально удалить рубцовую ткань, не затрагивая зоны функционирующего миокарда [8, 9].
В качестве недостатка операции указывается высокий риск материальной или воздушной эмболии, хотя при сравнении результатов операций на работающем сердце и в условиях кардиоплегии достоверной разницы по числу эмболических осложнений не отмечено [7, 10]. Также не отмечено разницы при оценке выживаемости пациентов в отдаленном периоде наблюдения [2, 10].
Таким образом, приведенный клинический пример наглядно демонстрирует возможность безопасной реконструкции левого желудочка на работающем сердце в условиях вспомогательного искусственного кровообращения у больных с выраженным постинфарктным ремоделированием его полости и крайне низкими функциональными резервами миокарда. Эта методика позволяет нивелировать стресс, который переживает жизнеспособный, функционально активный миокард левого желудочка, во время кардиоплегии, что является одним из основных пусковых факторов развития острой сердечной недостаточности в интра- и раннем послеоперационном периоде. Операция реконструкции левого желудочка на работающем сердце может быть альтернативой трансплантации сердца у пациентов с критическим снижением его функции.
Реваскуляризация миокарда и реконструкция клапанов улучшает состояние многих пациентов, тем не менее существуют больные, у которых дилатация и нарушение функции ЛЖ настолько выражены, что для оптимизации сердечной деятельности им требуется непосредственная хирургическая коррекция самого ЛЖ. У таких пациентов на фоне трансмурального ИМ развиваются дилатация и ремоделирование ЛЖ, в результате давление на стенку ЛЖ увеличивается, а функция ЛЖ падает. Запускается каскад патофизиологических событий: увеличение потребления кислорода миокардом в ответ на увеличение напряжения стенок ЛЖ; повышение уровней нейрогормонов и цитокинов; постнагрузочное несоответствие сократительной способности миокарда и суб-эндокардиальная гипоперфузия.
В сущности, все реконструктивные операции направлены на устранение рубцового сегмента с целью уменьшения объема и индекса сферичности ЛЖ, снижения давления на стенку ЛЖ, уменьшения нейрогормональной активности и улучшения оксигенации миокарда. Одновременно с пластикой желудочка часто проводят АКШ, а также коррекцию МК при выраженной MP. Такого типа сочетанные вмешательства носят различные названия, но чаще их обобщают термином «метод Dor» (в честь Vincent Dor), под которым подразумевают реконструкцию аневризмы или зоны акинезии обычно посредством лоскута (внутрижелудочковая пластика лоскутом), хирургическую реконструкцию желудочка, или реконструкцию ЛЖ.
Типичным примером такой операции является создание двойного Z-образного серкляжа для формирования перешейка между инфарктным и интактным миокардом, иссечение или отграничение рубцового сегмента (возможно при наличии достаточно толстой стенки оставшегося рубца или мышцы) с последующим реконструированием без использования лоскута. Эффективность реконструкции ЛЖ продолжает изучаться в рамках исследования STICH в группах пациентов Б и В.
Стандартные показания для проведения реконструктивных операций на ЛЖ в настоящее время не определены. В клинике Northwest Memorial Hospital такие операции выполняют пациентам с ИКМП на фоне дилатации камер и с наличием отграниченного рубца, проникающего частично или насквозь через стенку миокарда, одного или нескольких сегментов (как правило, через переднюю стенку). Иногда эту операцию выполняют пациентам с СН в рамках прямого показания к хирургическому лечению. В другом случае она может быть одним из этапов комплексного хирургического вмешательства при СН.
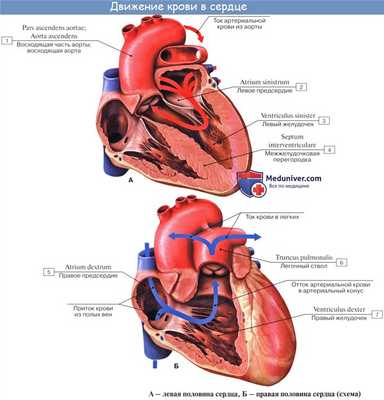
А иногда при операции на сердце (например, АКШ или коррекции МК) пациенту с отсутствием симптомов недостаточности кровообращения коррекцию аневризмы ЛЖ выполняют во вторую очередь. Риск такой процедуры не велик, если ее проводят опытные специалисты.
Общая выживаемость в течение 5 лет была 68 ± 2,8%, а доля пациентов, которым в течение этого периода не потребовалась госпитализация по поводу СН, — 78%. Регрессионный анализ данных показал, что ФВ ЛЖ < 30%, индекс конечного систолического объема ЛЖ >80 мл/м2, а также высокий ФК NYHA и возраст > 75 лет являются факторами риска летального исхода. Реконструкция ЛЖ привела к значительному снижению индекса КСО ЛЖ (с 80,0 ± 51 до 56,0 ± 34,3 мл/м2) и заметному увеличению ФВ ЛЖ (с 29 ± 11,0 до 39 ± 12,3%). До операции 67% пациентов относили к III/IV ФК NYHA, а после операции 85% пациентов перешло в I/II ФК NYHA. В другом исследовании в течение первых 30 сут смертность составила 1%, а выживаемость в течение 1, 3 и 5 лет — 92, 90 и 80% соответственно.
С помощью математического моделирования было доказано, что общее влияние реконструктивных операций на показатели насосной функции определяется дифференциальным эффектом на конечные систолические и диастолические характеристики, которые в свою очередь зависят от свойств удаленного при операции участка миокарда. В результате анализа было выявлено положительное влияние на данное соотношение при резекции дискинетичного участка миокарда, неоднозначный эффект был получен при удалении рубцового сегмента миокарда (обычно во время операции этот участок имеет мраморную окраску, и видно, как мышечные волокна переплетаются с соединительной тканью), а отрицательное воздействие оказывала резекция рабочего миокарда.
Различие в распределении показателей периоперационной летальности и отдаленных исходов, полученных в клинических исследованиях в настоящее время, объясняется отсутствием единого стандарта для включения пациентов в исследования. Другие данные показывают, что при наличии выраженной правожелудочковой недостаточности, при высоком систолическом давлении в ЛА (> 60 мм рт. ст.) и в отсутствие тяжелой MP реконструктивных операций на ЛЖ следует по возможности избегать.
Итак, положительный эффект операций по реконструкции ЛЖ заключается в снижении ФК NYHA, увеличении ФВ ЛЖ и уменьшении объемных характеристик ЛЖ, а также в сдерживании гиперактивации нейрогормонов. До настоящего времени не разработаны стандартные показания к проведению реконструкции ЛЖ. Считается, что результаты исследования STICH помогут более точно оценить эффект реконструктивных и реваскуляризирующих вмешательств у пациентов с СН.
Читайте также:
- Клиника цитомегаловирусной инфекции - поражения органов
- Микропротеин в биотехнологии. Микропротеин как источник белка одноклеточных.
- Раннее выявление анемии. Скрининг населения на анемию.
- Признаки изменения сосудистой резистентности. Упругость и эластичность сосудов
- Лучевые признаки расщепления кистей, стоп у плода
