Рекрутирование фолликулов. Влияние гонадотропинов на фолликулогенез
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Количественные нарушения фолликулогенеза в яичниках при тяжелых формах эндометриоза могут быть обусловлены, во-первых, наличием и разрастанием эндометриоидных гетеротопий на ткани яичника (эндометриомы), во-вторых, оперативными вмешательствами на яичнике.
Для описания репродуктивного потенциала яичников используется термин овариальный резерв. С целью оценки овариального резерва используются оценка числа антральных фолликулов (ЧАФ) в обоих яичниках при ультразвуковом исследовании (проводится на 2-3 день менструального цикла), базального уровня уровень ФСГ в сыворотке крови на 2-3 день менструального цикла и содержание антимюллерова гормона (АМГ) в сыворотке крови.
Непосредственное влияние эндометриомы на фертильность трудно адекватно оценить, так как изолированно, при отсутствии очагов на брюшине, эндометриомы встречаются крайне редко. Негативное влияние эндометриоидных кист яичника может быть обусловлено воспалительной реакцией и нарушением роста, развития фолликула и последующим нарушением овуляции [11].
Теория патогенеза эндометриоидных кист представляется предметом дискуссий. В оригинальной статье Sampson [163] говорится, что перфорация так называемой эндометриоидной кисты ведет к распространению очагов эндометриоза по брюшине. В статье Hughesdon [91], напротив, указывается на то, что эндометриоидные гетеротопии и сращения не следствие, а причина формирования эндометриом. Согласно Hughesdon и соавт. [91] большинство эндометриоидных кист формируется в результате инвагинации коры яичника вследствие накопления продуктов менструальноподобной реакции эндометриодных имплантов, расположенных на поверхности яичника в сращениях с брюшиной. Эти данные подтверждены более поздними исследованиями Brosens и соавт. [34]. В настоящее время наибольший интерес представляет теория метаплазии целомического эпителия вследствие инвагинации эпителия брюшины.
Так обнаружены инвагинации мезотелия в тканях яичника плода и взрослого человека [117], которые под влиянием неизвестных до настоящего времени факторов способны трансформироваться в эндометриомы яичника. По данным Donnez и соавт. в 33% случаях обнаруживаются вторичные инвагнации эндометриоидных кист, формирующие глубокий эндометриоз яичников, что представляет собой растяжение стенки яичника [117].
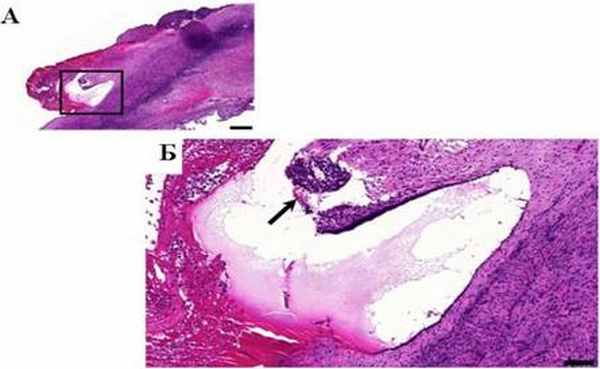
Рисунок 1- Корковый слой яичника с поверхностным очагом эндометриоза и инвагинацией поверхностного эпителия, Kitajima и соавт., 2014
Разрастание ткани кисты влечет за собой нарушение васкуляризации и атрофию коркового слоя яичника, а следовательно уменьшение числа антральных фолликулов. В настоящее время нет достоверных данных, позволяющих понимать, что ведет к большему снижению числа фолликулов: оперативное лечение или непосредственное влияние эндометриомы. Было доказано, что яичники, содержащие эндометриому, имеют худшую васкуляризацию и меньшее число антральных фолликулов по сравнению с другими доброкачественными кистами яичников [136].
В исследовании Schmidt и соавт. показано, что в яичнике, пораженном эндометриомой, плотность распределения фолликулов в корковом слое значительно ниже, чем в противоположном яичнике без эндометриомы. Г истологические изменения в корковом слое яичника, такие как фиброз и потеря корковой стромы, положительно коррелировали со снижением плотности распределения фолликулов. В «здоровом» яичнике этот показатель варьировался в значительной степени среди исследуемых пациенток, однако при сравнении с поражённым яичником всегда был значительно больше. Плотность расположения фолликулов не специфичный показатель и уменьшается с возрастом женщины [45]. Несмотря на то, что снижение плотности распределения фолликулов не точный предиктор снижения овариального резерва, в исследованиях Kitajima M. и Maneschi подтверждено снижение овариального резерва в яичнике, пораженном эндометриомой.
Размер кисты также может коррелировать с длительностью и выраженностью воспаления воздействующего на здоровую ткань яичника [64]. Однако потеря овариального резерва может происходить и при небольшом размере эндометриомы. Помимо местной воспалительной реакции, оксидативный стресс может явиться причиной истощения яичников. В исследованиях, проведенных in vitro, показано, что оксидативный стресс является причиной апоптоза и некроза примордиальных фолликулов [155]. Dolmans и соавт. в исследованиях по ксенотрансплантации ткани яичника человека обнаружили ускоренную активацию роста фолликулов и быстрое снижение числа примордиальных фолликулов как следствие недостатка васкуляризации и гипоксического стресса [168]. Результаты данного исследования могут говорить о схожем механизме, имеющем место при наличии эндометриомы. В основу объяснения механизмов снижения овариального резерва при эндометриозе легла теория «выгорания» (burnout theory).
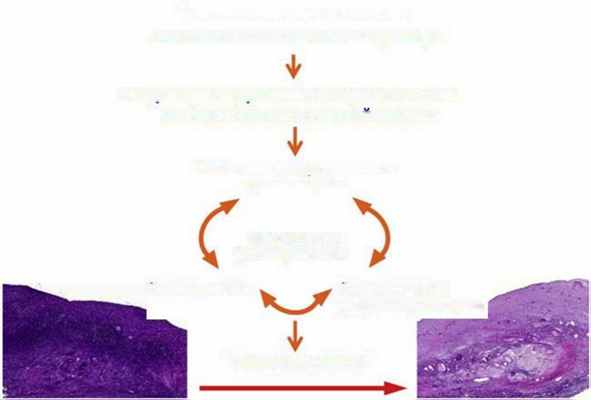
Формр ов ание эндометриомы Локальная воспалительная реакция
Разрушение окружающего коркового слоя
Фиброз и потеря корковой стромы
Увеличение рекрутирования и атрезии ооцитов
ф о лликул ог енез а
Рисунок 2 - теория «выгорания» Kitajima и соавт, 2014 г.
Наличие эндометриомы является одним из факторов снижения ответа яичников на стимуляцию суперовуляции. В исследовании Somigliana et al. показано значительное снижение (25%) ответа на стимуляцию гонадотропинами в яичниках, содержащих эндометриому, по сравнению со здоровым яичником [187].
При получении небольшого количества ооцитов, несмотря на
использование больших доз рекомбинантных гонадотропинов частота наступления беременности значительно ниже, чем при “нормальном” ответе на стимуляцию. В метаанализе, проведенном Gupta и соавт., показано, что количество фолликулов в момент введения триггера овуляции, и количество полученных ооцитов при пункции значительно меньше в сравнении с контрольной группой без поражения яичников [86].
Также большую роль в снижении овариального резерва играет двухстороннее поражение яичников. При изучении ответа яичников у женщин с монолатеральным поражением яичников отмечено значительное снижение количества полученных ооцитов в пораженном яичнике по сравнению со здоровым [42, 172]. В большинстве случаев эндометриомы яичников
Качественные нарушения обусловлены влиянием эндометриомы на рост и развитие фолликулов в яичнике и как следствие на «качество» ооцитов и ранний эмбриогенез. В яичниках, содержащих эндометриому, происходит ранняя активация развития фолликулов и усиление атрезии фолликулов, апоптоза ооцитов и как следствие ускоренное истощение овариального запаса. Изначальная преждевременная активация клеток гранулёзы фолликула приводит к несвоевременному созреванию фолликула и гибели ооцита. Клетки эндометриомы секретируют большое количество цитокинов и хемокинов. Цитокины (интерлейкин 1-Р (IL-1 Р),интерлейкин 6 (IL-6), фактор некроза опухоли (TNF), хемокины (интерлейкин 8 (IL-8), моноцитарный хемотаксический протеин-1, RANTES) провоцируют активацию гранулезных клеток и преждевременное созревание фолликула. Посредством прямого воздействия хемокины и цитокины могут влиять на ключевые сигнальные пути в фолликулах, такие как ц-АМФ/протеин киназа А, Янус киназа(Jak)/сигнальные трансдукторы и активаторы транскрипции(STAT), ядерный фактор kB(NFkB),
фосфатидилинозитол 3-киназа, внутриклеточные пути мобилизации кальция.
Простагландины синтезируются в больших количествах эндометриоидной тканью.
Простагландин E2 через ц-АМФ (сАМР)/протеин киназу-А (PKA) или протеин киназу-С (PKC) активирует терминальную митоген-активированную протеин киназу (Р38), Jun NH2- киназу(ІКК) и клетки теки и гранулезы фолликула. Считается, что простагландин Е2 и другие эйкозаноиды, синтезирующиеся при воспалении, вызванном эндометриомой, могут влиять на активацию и атрезию фолликулов, а также качество яйцеклеток[152].
В исследовании Adashi EY и соавт. доказано, что инсулиноподобный фактор роста (IGF)/IGF-связываюший белок - регулируют важные сигнальные пути, такие как фостфатидилинозитол 3-киназа (PI3K)/AKT - киназа, которые нарушены в эндометриоидной ткани. Так как сигнальные пути ИПФ взаимодействуют с ФСГ в отношении регуляции активации клеток гранулезы и теки фолликула, можно предположить, что присутствие эндометриомы нарушает нисходящие сигнальные пути, регулируемые ИПФ в соседних с эндометриомой фолликулах, и вызывает их преждевременную активацию[98], (рис 3).
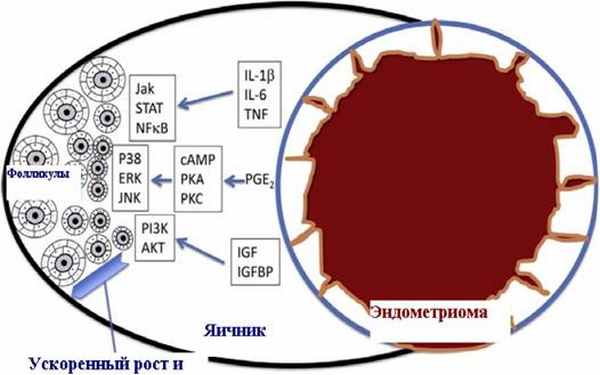
Рисунок 3 - Влияние эндометриомы на фолликулогенез в яичнике. Serdar E^ соавт. 2014
При анализе литературы обнаружено всего два исследования, описывающих вляние эндометриоидных кист яичников на ранний эмбриогенез. В ретроспективном анализе Pellicer и соавт. оценили качество эмбрионов, полученных у 36 женщин с эндометриозом, и сравнили с эмбрионами, полученными у 34 женщин с трубным фактором бесплодия в протоколах ЭКО. Эмбрионы оценивались после 48 и 72 часов по числу бластомеров и степени фрагментации. Остановкой развития эмбрионов считалось наличие от 1 до 2 бластомеров через 72 часа после оплодотворения. Никаких различий не было отмечено между группами по возрасту, количеству ооцитов, количеству оплодотворённых ооцитов, и среднему число бластомеров после 48 часов в исследуемых группах. Однако после 72 часов развития в группе женщин с эндометриоз-ассоциированным бесплодием среднее количество бластомеров у эмбрионов было значительно (р
Рекрутирование фолликулов. Влияние гонадотропинов на фолликулогенез
Рекрутирование фолликулов. Влияние гонадотропинов на фолликулогенез
Примордиальные фолликулы с находящимися внутри них нерастущими ооцитами диаметром около 12 мкм у мышей составляют пул покоящихся фолликулов. Во время первичного рекрутирования когорты фолликулов из покоящегося пула, постоянно индуцируемые паракринными сигналами яичника, вступают в синхронный рост. Рекрутированные растущие фолликулы называют первичными фолликулами, но эта фаза их роста довольно протяженная, из-за чего примордиальные и первичные фолликулы трудно различимы. Впоследствии они развиваются во вторичные и антральные.
У половозрелых мышей ооцит растет с 12 до 80 мкм — состояние ооцита перед формированием антрального фолликула. Говоря в общем, антральные фолликулы запрограммированы на атрезию, которая инициируется апоптозом гранулезных клеток, в случае если их развитие не поддерживается повышающимся содержанием ФСГ в процессе эстрального цикла у мышей или менструального — у человека.
Циклическое рекрутирование антральных фолликулов приводит к продолжению развития сразу нескольких фолликулов, но у человека, как правило, только один (доминирующий) фолликул доходит до периовуляторной стадии. Хотя у человека после полового созревания начинается циклическое рекрутирование, большая часть антральных фолликулов в конце концов подвергается атрезии, приводящей к гибели ооцита.
Считают, что примордиальные фолликулы, не подвергшиеся рекрутированию, остаются в покоящемся состоянии и могут быть рекрутированы в будущем. В связи с этим поддержание пула покоящихся ооцитов необходимо для сохранения нормальной продолжительности репродуктивного периода. Начиная с перинатального периода, мюллерова ингибирующая субстанция (МИС), или антимюллеров гормон (АМГ), — представитель надсемейства ТФР-b, чья регулирующая роль в половой дифференцировке репродуктивной системы в процессе онтогенеза хорошо известна, экспрессируется гранулезными клетками растущих фолликулов. В процессе фолликулогенеза он ингибирует рекрутирование при-мордиальных фолликулов в пул растущих фолликулов за счет снижения чувствительности зернистых клеток к ФСГ.
АМГ является важным клиническим маркером овариального резерва.
Влияние гонадотропинов на фолликулогенез
Развитие преантральных фолликулов, при котором происходит рост преимущественно ооцита с ограниченной пролиферацией гранулезных клеток, регулируется главным образом паракринными и аутокринными сигналами. Хотя для раннего развития фолликулов in vivo гонадотропины не нужны, in vitro фолликулы могут развиваться в ответ на стимуляцию ФСГ. Тем не менее гонадотропины необходимы для формирования полости (аптрума) и ускоренной пролиферации гранулезных клеток при образовании антрального фолликула и граафова пузырька.
Рост фолликулов от стадии первичных и вторичных до антральных занимает несколько недель у мышей и несколько месяцев у более крупных организмов, включая человека. У мышей граафов пузырек может превышать в диаметре 600 мкм и содержать более 50 000 гранулезных клеток.
Гранулезные клетки можно разделить на два подтипа: кумулюсные и пристеночные (муральные), которые отличаются морфологически и функционально. Пристеночные гранулезные клетки, расположенные в периантральной области и области наружной мембраны, экспрессируют рецептор ФСГ, ФСГ-чувствительны.
Рецептор ФСГ содержит крупный внеклеточный домен, с высокой аффинностью связывающий ФСГ, и трансмембранный домен, который через гетеродимерные G-протеины активирует сигнальную систему, связанную с циклической аденилатциклазой. Мыши с дефицитом b-субъединицы ФСГ, которая в норме образует гетеродимеры с а-субъединицей, оказывались бесплодными из-за остановки развития фолликулов до формирования антрума.
Мыши с нокаутированными рецепторами ФСГ (FORKO-мыши) также бесплодны, что свидетельствует о важнейшей роли рецепторов к ФСГ в передаче его сигнала. На 2-й день после рождения у этих мышей преобладают растущие фолликулы, но к 24-му дню жизни снижается количество как покоящихся, так и растущих фолликулов. Следовательно, после рождения происходит патологическое ускорение рекрутирования покоящихся фолликулов в пул растущих, сопровождаемое прекращением рекрутирования у этих мышей в дальнейшем.
Ко всему прочему, у них не обнаруживают антральных фолликулов. Кроме того, что эти модели мышей подтверждают важность ФСГ для фолликулогенеза после преантральной стадии, фенотип FORKO-мышей свидетельствует о важной роли сигнальной функции рецепторов ФСГ в регуляции времени и интенсивности рекрутирования фолликулов. В отличие от FORKO-мышей, мыши с выключением рецепторов ЛГ (LuRKO-мыши) бесплодны в основном из-за нарушений на поздних стадиях фолликулогенеза: фолликулы развиваются вплоть до ранней антральной стадии, но преовуляторные фолликулы и желтые тела уже не образуются.
Запускаемая ФСГ и его рецептором внутриклеточная сигнальная система приводит к изменению экспрессии генов и синтеза протеинов, влияющих на функционирование гранулезных клеток. К примеру, у FORKO-мышей значительно изменена экспрессия АМГ, участвующего в рекрутировании примордиальных фолликулов. Несмотря на то что рекрутирование клеток theca и экспрессия генов рецептора ЛГ и Р450 ароматазы не зависит от ФСГ, экспрессия этих генов в гранулезных клетках, ФСГ-зависима.
Аналогично гены, кодирующие субъединицы ингибина и активина, гомо- и гетеродимеры которых считают важнейшими пара- и аутокринными медиаторами роста фолликулов, демонстрируют сниженную экспрессию в гранулезных клетках у мышей с инактивированным геном b-субъединицы ФСГ. К другим генам, регуляция которых оказалась измененной в связи с дефицитом b-субъединицы ФСГ, относятся гены, кодирующие АР, ЭРb и циклин D2; все они играют важную роль на завершающих стадиях фолликулогенеза.
Фолликулогенез
Хотя процесс похож на многих животных, в этой статье мы будем рассматривать исключительно человеческий фолликулогенез. Порядок изменений в яичнике. 1 - Менструация. 2 - Развивающийся фолликул. 3 - Зрелый фолликул. 4 - Овуляция. 5 - Желтое тело. 6 - Ухудшение желтого тела
В биологии, фолликулогенез - это созревание фолликула яичника, плотно упакованной оболочки соматических клеток, которая содержит незрелые ооцит. Фолликулогенез описывает прогрессирование ряда маленьких примордиальных фолликулов в большие преовуляторные фолликулы, которое частично происходит во время менструального цикла.
В отличие от мужского сперматогенеза, который может длиться бесконечно, фолликулогенез заканчивается, когда оставшиеся фолликулы в яичниках неспособны реагировать на гормональные сигналы, которые ранее заставляли некоторые фолликулы созревать. Это истощение запасов фолликулов сигнализирует о начале менопаузы.
Содержание
- 1 Обзор
- 2 Фазы развития
- 2.1 Первичный
- 2.2 Первичный
- 2.3 Вторичный
- 2.4 Формирование антрального отдела желудка
- 2,5 Ранний третичный
- 2,6 Поздний третичный и преовуляторный (фолликулярная фаза менструального цикла)
Обзор
Основная роль фолликула - ооцит Поддержка. От рождения яичники человеческой женщины содержат ряд незрелых, примордиальных фолликулов. Каждый из этих фолликулов содержит аналогичный незрелый первичный ооцит. В половом созревании сцепление фолликулов начинается фолликулогенезом, вступая в структуру роста, которая заканчивается смертью (апоптоз) или овуляцией (процесс, при котором ооцит покидает фолликул).
Во время развития фолликулов примордиальные фолликулы претерпевают ряд критических изменений характера, как гистологических, так и гормональных. Сначала они превращаются в первичные фолликулы, а затем во вторичные фолликулы. Затем фолликулы переходят в третичные или антральные фолликулы. На этой стадии развития они становятся зависимыми от гормонов, особенно от ФСГ, что приводит к значительному увеличению скорости их роста. Поздний третичный или преовуляторный фолликул разрывает и выделяет ооцит (который стал вторичным ооцитом ), завершая фолликулогенез.
Схема фолликулогенеза, начиная с преантрального (позднего вторичного), любезно NCBI
Фазы развития
Фолликулогенез непрерывен, что означает, что в любое время яичник содержит фолликулы на многих стадиях развития. Большинство фолликулов умирают и никогда не завершают свое развитие. Некоторые из них полностью развиваются, чтобы произвести вторичный ооцит, который высвобождается при разрыве фолликула в процессе, называемом овуляцией.
Растущий фолликул проходит через следующие отдельные стадии, которые определяются определенными структурными характеристиками:
В более широкой перспективе весь фолликулогенез, от примордиального до преовуляторного фолликула, относится к стадии оотидогенеза оогенеза.
Стадия Описание Размер Первобытный Спящие, маленькие, только один слой плоских гранулезных клеток Примордиальных фолликулов около 0,03-0,05 мм в диаметре. Первичные митотические клетки, кубовидные гранулезные клетки диаметром почти 0,1 мм Вторичные Наличие клеток тека, несколько слоев гранулезных клеток Фолликул теперь имеет диаметр 0,2 мм. Ранний третичный фолликул Ранний третичный фолликул условно разделен на пять классов. Фолликулы класса 1 имеют диаметр 0,2 мм, класса 2 - около 0,4 мм, класса 3 - около 0,9 мм, класса 4 - около 2 мм и класса 5 - около 5 мм. Поздний третичный период Полностью сформированный антральный отдел, без дальнейшей цитодифференцировки, без нового прогресса Фолликулы класса 6 имеют диаметр около 10 мм, класс 7 - около 16 мм, и 8 класс около 20 мм. Недоминантные фолликулы обычно вырастают за пределы класса 5, но редко бывает более одного фолликула класса 8. Preovulatory Рост концентрации эстрогена, все другие фолликулы атретические или мертвые Кроме того, фолликулы, которые сформировали антральное отверстие, называются антральные фолликулы или фолликулы Граафа. Определения различаются в зависимости от того, где происходит этот сдвиг в приведенной выше стадии: одни утверждают, что это происходит при переходе на вторичную стадию, а другие утверждают, что это происходит при переходе на третичную стадию.
До преовуляторной стадии фолликул содержит первичный ооцит, который задерживается в профазе мейоза I. Во время поздней преовуляторной стадии ооцит продолжает мейоз и становится вторичным ооцитом, остановленным в метафазе II.
Первичный
На 18–22 неделе после зачатия в коре женского яичника (плод женского яичника) максимальное количество фолликулов (примерно от 4 до 5) миллионов в среднем, но индивидуальные пиковые популяции колеблются от 6 до 7 миллионов). Эти примордиальные фолликулы содержат незрелые ооциты, окруженные плоскими плоскими гранулезными клетками (поддерживающими клетками), которые отделены от среды ооцита базальной пластинкой. Они находятся в состоянии покоя, практически не проявляя биологической активности. Поскольку примордиальные фолликулы могут находиться в спящем состоянии у человека до 50 лет, продолжительность овариального цикла не включает это время.
Количество фолликулов немного уменьшается до рождения и в среднем до 180 000 к половому созреванию (популяция в период полового созревания колеблется от 25 000 до 1,5 миллиона). Из-за «неэффективного» характера фолликулогенеза (обсуждается позже) только 400 из этих фолликулов когда-либо достигнут преовуляторной стадии. При менопаузе остается только 1000 фолликулов. Кажется вероятным, что ранняя менопауза возникает у женщин с низкой популяцией при рождении, а поздняя менопауза наступает у женщин с высокой популяцией при рождении, но пока нет клинических доказательств этого.
Процесс, посредством которого первичные клетки «пробуждение» известно как первоначальный набор. Исследования показали, что первоначальное рекрутирование опосредуется уравновешиванием различных стимулирующих и ингибирующих гормонов и локально продуцируемых факторов роста.
Первичный
Во время активации фолликула яичника клетки гранулезы примордиальных фолликулов меняют форму с плоской на кубовидную, отмечая начало первичного фолликула. Геном ооцита активируется, и гены становятся транскрибируемыми. Формируются рудиментарные паракринные сигнальные пути, которые имеют жизненно важное значение для связи между фолликулом и ооцитом. И ооцит, и фолликул резко растут, увеличиваясь почти до 0,1 мм в диаметре.
Первичные фолликулы в это время вырабатывают рецепторы к фолликулостимулирующему гормону (ФСГ), но они не зависят от гонадотропина до антральной стадии. Однако исследования показали, что присутствие ФСГ ускоряет рост фолликулов in vitro.
Капсула из гликопротеинового полимера, называемая пеллюцида, образуется вокруг ооцита, отделяя его от окружающих клеток гранулезы. Пеллюцидная зона, которая остается с ооцитом после овуляции, содержит ферменты, которые катализируют сперматозоиды, обеспечивая проникновение.
Вторичные
стромоподобные клетки теки рекрутируются посредством сигналов, секретируемых ооцитами. Они окружают самый внешний слой фолликула, базальную пластинку, и подвергаются цитодифференцировке, чтобы стать theca externa и theca interna. Между этими двумя текальными слоями образуется сложная сеть капиллярных сосудов, по которым кровь начинает циркулировать к фолликулу и от него.
Поздний вторичный фолликул отмечен гистологически и структурно полностью выросшим ооцитом, окруженным блестящей оболочкой, примерно девятью слоями гранулезных клеток, базальной пластинкой, внутренней текой, капиллярной сеткой и текой. externa. Развитие антрального отдела также начинается на стадии вторичного фолликула
Образование антрального отдела
Формирование заполненной жидкостью полости рядом с ооцитом, называемой антрумом, обозначает фолликул как антральный фолликул, в отличие от так называемого преантрального фолликула, в котором все еще отсутствует антральный отдел. Антральный фолликул также называют фолликулом Граафа.
Определения различаются относительно того, на какой стадии происходит этот сдвиг: одни обозначают фолликулы на вторичной стадии как антральные, а другие - как преантральные.
Ранние третичные
В третичный фолликул, основная структура зрелого фолликула сформировалась, и новые клетки не обнаруживаются. Клетки гранулезы и теки продолжают митотизировать, одновременно с увеличением объема антрального отдела. Третичные фолликулы могут достигать огромных размеров, чему препятствует только доступность ФСГ, от которой они теперь зависят.
Под действием морфогенного градиента, секретируемого ооцитами, клетки гранулезы третичного фолликула подвергаются дифференцировке на четыре различных подтипа: лучевая коронка, окружающая пеллюцидную оболочку; мембрана, внутренняя по отношению к базальной пластинке; периантральный, прилегающий к антральному отделу и кумулюсу оофористому, который соединяет мембрану и клетки гранулезной короны радиата. Каждый тип клеток по-разному реагирует на ФСГ.
Клетки Theca interna экспрессируют рецепторы лютеинизирующего гормона (LH ). ЛГ индуцирует продукцию андрогенов клетками теки, в первую очередь андростендиона, которые ароматизируются клетками гранулезы с образованием эстрогенов, в первую очередь эстрадиола. Следовательно, уровень эстрогена начинает расти.
Поздняя третичная и преовуляторная (фолликулярная фаза менструального цикла)
На этом этапе большая часть группы фолликулов, которая начала расти, погибла. Этот процесс гибели фолликула известен как атрезия, и он характеризуется радикальным апоптозом всех составляющих клеток и ооцита. Хотя неизвестно, что вызывает атрезию, было показано, что присутствие высоких концентраций ФСГ предотвращает ее.
Повышение уровня ФСГ в гипофизе, вызванное распадом желтого тела в конце менструального цикла, ускоряет набор от пяти до семи фолликулов класса 5 для участия в следующем цикле. Эти фолликулы входят в конец предыдущего менструального цикла и переходят в фолликулярную фазу следующего. Выбранные фолликулы, называемые антральными фолликулами, конкурируют друг с другом за индуцирующий рост ФСГ.
Модель появления когорты из пяти-семи антральных фолликулов обсуждается. Существуют теории непрерывного рекрутирования антральных фолликулов, теории единственного эпизода рекрутирования в конце лютеиновой фазы, а в последнее время появились доказательства модели рекрутирования, отмеченной 2-3 волнами рекрутирования и развития фолликулов во время менструального цикла. (только одна из которых на самом деле является овуляторной волной).
В ответ на повышение ФСГ антральные фолликулы начинают секретировать эстроген и ингибин, которые имеют отрицательный эффект обратной связи на ФСГ. Фолликулы с меньшим количеством рецепторов ФСГ не смогут развиваться дальше; они покажут замедление темпов роста и станут атретичными. В конце концов, жизнеспособен будет только один фолликул. Этот оставшийся фолликул, называемый доминантным фолликулом, будет быстро и резко расти - до 20 мм в диаметре - и превратиться в преовуляторный фолликул.
Примечание: многие источники искажают скорость роста фолликула, некоторые даже предполагают, что примордиальному фолликулу требуется всего четырнадцать дней, чтобы стать преовуляторным. Фактически, фолликулярная фаза менструального цикла означает время между выделением третичного фолликула и его последующим ростом в преовуляторный фолликул. Фактическое время развития фолликула варьируется.
Рост доминантного фолликула во время фолликулярной фазы составляет около 1,5 мм в день (± 0,1 мм) как в естественных циклах, так и для любого доминирующего фолликула, развивающегося при одновременном приеме пероральные противозачаточные таблетки. Выполнение контролируемой гиперстимуляции яичников приводит к большему привлечению фолликулов, которые растут примерно на 1,6 мм в день.
Овуляция и желтое тело
К концу фолликулярного ( или пролиферативная) фазы тринадцатого дня менструального цикла, слой кумулюса преовуляторного фолликула образует отверстие, или стигму, и выделяет ооцит с набором кумулюсных клеток в процессе, называемом овуляция. В естественных циклах овуляция может происходить в фолликулах размером не менее 14 мм.
Ооцит технически все еще является вторичным ооцитом, взвешенным в метафазе II мейоза. Он разовьется в яйцеклетку, а затем быстро в яйцеклетку (через завершение мейоза II) только после оплодотворения. Теперь ооцит будет перемещаться по одной из маточных труб, чтобы в конечном итоге выйти через менструальный цикл в случае, если он неоплодотворен или если он не был успешно имплантирован в матку (если ранее оплодотворенный ).
Разорванный фолликул претерпит резкую трансформацию в желтое тело, стероидиогенный кластер клеток, который поддерживает эндометрий матки за счет секреции большого количества прогестерон и незначительные количества эстрогена.
Эти два этапа, хотя и не являются частью фолликулогенеза, включены для полноты. Они полностью обсуждаются в соответствующих статьях и рассматриваются в статье менструальный цикл. Рекомендуется рассмотреть эти три темы.
Гормональная функция
Как и большинство вещей, связанных с репродуктивной системой, фолликулогенез контролируется эндокринной системой. Пять гормонов участвуют в сложном процессе положительной и отрицательной обратной связи, регулируя фолликулогенез. Это:
ГнРГ стимулирует высвобождение ФСГ и ЛГ из передней доли гипофиза, которые позже будут оказывать стимулирующее действие на рост фолликулов (однако не сразу, потому что только антральные фолликулы являются зависит от ФСГ и ЛГ). Когда в третичном фолликуле образуются клетки теки, количество эстрогена резко увеличивается (андроген, полученный из теки, ароматизируется в эстроген клетками гранулезы).
В низкой концентрации эстроген подавляет гонадотропины, но высокая концентрация эстрогена их стимулирует. Кроме того, чем больше эстрогена секретируется, тем больше рецепторов ЛГ вырабатывается клетками тека, побуждая клетки тека производить больше андрогена, который впоследствии станет эстрогеном. Эта положительная обратная связь вызывает резкое повышение уровня ЛГ, и именно этот всплеск вызывает овуляцию.
После овуляции ЛГ стимулирует образование желтого тела. С тех пор эстроген упал до отрицательного стимулирующего уровня после овуляции и, следовательно, служит для поддержания концентрации ФСГ и ЛГ. Ингибин, который также секретируется желтым телом, способствует ингибированию ФСГ.
Эндокринная система совпадает с менструальным циклом и проходит тринадцать циклов (и, следовательно, тринадцать всплесков ЛГ) в ходе нормального фолликулогенеза. Однако скоординированная передача сигналов фермента и зависящая от времени экспрессия гормональных рецепторов гарантируют, что рост фолликулов не будет нарушен во время этих преждевременных всплесков.
Количество фолликулов
Недавно в двух публикациях оспаривается идея о том, что конечное количество фолликулов формируется во время рождения. Сообщалось о восстановлении фолликулов яичников из стволовых клеток зародышевой линии (происходящих из костного мозга и периферической крови) в постнатальном яичнике мыши. Исследования, пытающиеся воспроизвести эти результаты, продолжаются, но исследование популяций в 325 яичниках человека не обнаружило подтверждающих доказательств пополнения фолликулов.
В 2010 году исследователи из Эдинбургского университета определили, что когда женщинам исполняется 30 лет, остается только 10% их нерастущих фолликулов (NGF). При рождении у женщин есть все свои фолликулы для фолликулогенеза, и они неуклонно сокращаются до менопаузы.
истощения яичникового резерва
По мере того как женщины (и мыши) стареют, двухцепочечные разрывы накапливаются в их первичных резерв фолликула. Эти фолликулы содержат первичные ооциты, которые задерживаются в профазе первого деления клеток мейоза. Двухцепочечные разрывы точно восстанавливаются во время мейоза путем поиска и построения соответствующей цепи (это называется «гомологичная рекомбинационная репарация»). Titus et al. (2013) обнаружили, что с возрастом людей (и мышей) экспрессия четырех ключевых генов репарации ДНК, необходимых для гомологичной рекомбинационной репарации, снижается в ооцитах. Они предположили, что репарация двухцепочечных разрывов ДНК жизненно важна для поддержания резерва ооцитов, и что снижение эффективности репарации с возрастом играет ключевую роль в истощении резерва яичников (старение яичников).
Антимюллеров гормон и его прогностическая значимость для оценки качества ооцитов
![Обложка]()
В статье систематизирована информация о диагностических возможностях современных клинико-лабораторных маркеров овариального резерва. Обсуждены диагностические возможности антимюллерова гормона (АМГ) в качестве маркера овариального резерва, позволяющие проводить подбор дозы гормональных препаратов и прогнозировать ответ яичника на стимуляцию в программах вспомогательных репродуктивных технологий. В работе впервые обсуждается роль АМГ в оценке качества ооцитов и последующих эмбрионов. Несмотря на недостаточные литературные данные, дальнейшее изучение АМГ, а также проведение полномасштабных исследований в данном направлении представляется крайне перспективным.
Ключевые слова
Полный текст
Введение
Антимюллеров гормон (АМГ, AMH) в настоящее время считается самым ранним и наиболее чувствительным маркером овариального резерва. Преимуществами данного маркера по сравнению с другими маркерами овариального резерва, такими как фолликулостимулирующий гормон (ФСГ) и количество антральных фолликулов (КАФ), являются возможность проводить анализ в любой день менструального цикла, практически отсутствие вариабельности результатов у разных исследователей и высокая надежность, несмотря на отсутствие международных стандартов диагностического теста [1]. АМГ впервые обнаружен Альфредом Жостом в 1947 г. как тестикулярный фактор, отличный от тестостерона, который отвечает за регрессию мюллерова протока в ходе развития плода. Изначально считалось, что функция АМГ ограничена лишь внутриутробной половой дифференциацией плода. Исследования конца XX в. показали, что АМГ играет важную роль в постнатальной биологии яичников. О его клинической ценности как прогностического фактора ответа яичников в циклах вспомогательных репродуктивных технологий (ВРТ) впервые сообщалось в 2002 г. [2]. Точность АМГ в прогнозировании ответа яичников на контролируемую овариальную стимуляцию (КОС) послужило его широчайшему клиническому применению в современной практике для персонализации протоколов стимуляции ВРТ, подбора оптимальной дозы и профилактики риска гиперстимуляции яичников.
Помимо возможности прогнозирования результатов ВРТ АМГ имеет и другие клинически значимые области применения в репродуктивной медицине. Установлено, что АМГ также является прогностическим маркером времени наступления менопаузы [3], а у женщин репродуктивного возраста с низким уровнем АМГ он ассоциирован с риском ранней менопаузы. Кроме того, измерение уровня АМГ также применяется для диагностики синдрома поликистозных яичников (СПКЯ), при котором уровни АМГ коррелируют со степенью тяжести проявлений СПКЯ и риском синдрома гиперстимуляции яичников (СГЯ) [4]. Анализ уровня АМГ у женщин с впервые выявленными онкологическими заболеваниями является ценным инструментом при разработке стратегий сохранения фертильности. Наконец, определение уровня АМГ помогает разработать стратегию сохранения фертильности у женщин перед оперативным вмешательством на органах малого таза, в программах отложенного материнства, при диагностике преждевременной недостаточности яичников и др. Учитывая, что клинические факторы риска при преждевременной недостаточности яичников выявляются лишь у 50% женщин, мониторирование уровня АМГ у женщин репродуктивного возраста может своевременно диагностировать снижение овариального резерва и ориентировать пациенток на реализацию репродуктивной функции или криоконсервацию ооцитов/эмбрионов.
Для прогнозирования ответа яичников на КОС применяется несколько клинических маркеров, включая возраст женщины, уровни ФСГ и эстрадиола, а также КАФ. Так, аналитическая работа A. La Marca и соавт. показала, что АМГ в целом является лучшим прогностическим маркером ответа яичников на КОС, чем возраст, уровни ФСГ, эстрадиол и ингибин B [5]. Последующие проспективные многоцентровые исследования продемонстрировали также преимущество АМГ по сравнению с КАФ в прогнозировании ответа яичников на стимуляцию. Зависимое от возраста снижение успешности ВРТ в основном обусловлено снижением не только количества, но и качества ооцитов. И если в случае количественной оценки овариального резерва мы ориентируемся на ряд параметров (возраст женщины, уровень АМГ, ФСГ, эстрадиола, КАФ), то оценка качества полученных ооцитов проводится лишь по субъективным параметрам – на основании установленных морфологических критериев. В идеале же оценка качества ооцитов должна проводиться на основании объективных маркеров, поэтому в последнее время все большее количество исследований посвящается изучению взаимосвязи различных маркеров и качества ооцитов, в том числе и АМГ.
Цель обзора – обобщение современных данных по клинической ценности АМГ в прогнозировании не только количественных, но и качественных результатов ВРТ.
АМГ и физиология яичников
АМГ представляет собой гликопротеин, принадлежащий к суперсемейству трансформирующих факторов роста b, который продуцируется у женщин исключительно гранулезными клетками мелких и крупных преантральных и мелких антральных фолликулов яичников. Это суперсемейство включает активины, ингибины, костные морфогенетические белки, а также факторы роста и дифференциации. АМГ влияет на экспрессию более 700 генов и действует опосредовано через рецепторы АМГ 2-го типа, BMPR 1a (Alk3), BMPR 1b (Alk6) или ACVR 1 (Alk2). Этот маркер участвует в регуляции активации и роста фолликулов и скорости возобновления мейоза ооцитов.
Яичники плода женского пола начинают продуцировать АМГ примерно на 36-й неделе внутриутробного развития, затем уровень повышается на протяжении пубертатного периода, достигая пика в возрасте 25 лет, после чего начинает постепенно снижаться практически до недиагностируемых уровней в период менопаузы [6].
Как известно, у человека пол формируется непосредственно в момент оплодотворения, а вот эмбриональная половая дифференциация начинается на 6-й неделе гестации. У эмбриона мужского пола клетки Сертоли яичек секретируют АМГ и андрогены, под воздействием последних из вольфовых протоков формируется половая система по мужскому типу. АМГ вызывает необратимую регрессию мюллерова протока, которая завершается к концу 9-й недели гестации. В отсутствие АМГ мюллеровы протоки дифференцируются в матку, фаллопиевы трубы и верхнюю часть влагалища. У эмбрионов женского пола дефицит АМГ позволяет мюллерову протоку развиваться дальше, в то время как недостаток андрогенов вызывает регрессию вольфовых протоков, что приводит к формированию внутренних органов половой системы по женскому типу.
АМГ также регулирует процессы фолликулогенеза за счет сдерживания рекрута примордиальных и преантральных фолликулов. Это происходит опосредованно за счет снижения экспрессии фактора роста фибробластов, фактора роста кератиноцитов, фактора стволовых клеток в фолликулах. Когда преантральные фолликулы превращаются в более крупные антральные фолликулы, продукция АМГ снижается, фолликулы становятся более чувствительными к ФСГ, и формируется доминантный фолликул. A. Durlinger и соавт. [7] продемонстрировали, что у мышей с дефицитом АМГ отмечается усиление рекрутирования примордиальных фолликулов c одновременным усилением атрезии и ранним истощением овариального резерва фолликулов. Так как АМГ экспрессируется на фолликулах, у которых отсутствуют рецепторы к ФСГ, то его уровень относительно независим от уровня гонадотропинов, что позволяет определять уровень АМГ в любой день менструального цикла. Некоторые исследования показывают, что значения АМГ могут незначительно колебаться на протяжении менструального цикла, при этом наибольшие отклонения отмечаются у молодых женщин с более высоким базальным АМГ по сравнению с женщинами старшего репродуктивного возраста, у которых выявляются более низкие базальные уровни АМГ [8]. Возможны также незначительные колебания уровня АМГ при измерении этого параметра в различные менструальные циклы.
На уровень АМГ оказывает влияние целый ряд факторов. Так, например, при СПКЯ диагностируются повышенные уровни AMГ [9], причина данного факта до конца не изучена. Повышенное содержание этого параметра в сыворотке может быть следствием воздействия ряда факторов, играющих ведущую роль в патогенезе СПКЯ, например гиперандрогенемии. Помимо гиперандрогенемии, гиперинсулинемия может выступить фактором повышенного синтеза АМГ. Принимая во внимание тот факт, что при СПКЯ происходит усиленная секреция андрогенов клетками гранулезы и теки под воздействием инсулина [10], нельзя исключить опосредованное влияние инсулина на синтез АМГ. Прием комбинированных оральных контрацептивов или введение агонистов гонадотропин-рилизинг-гормона могут снижать уровень АМГ, который обычно возвращается к исходным значениям через 3–4 мес после отмены препаратов. К факторам, снижающим уровень АМГ, относят эндометриоз, операции на органах малого таза (яичниках), генетические факторы (как премутация FMR1 и мутация BRCA1) [11–13]. Кроме того, на уровень АМГ могут оказывать влияние факторы окружающей среды и образ жизни пациентки. Так у курящих женщин отмечено более раннее начало менопаузы и более быстрое снижение уровня АМГ, предположительно, за счет истощения антральных фолликулов [14]. Отмечена также прямая зависимость между концентрацией АМГ в сыворотке и уровнем 25-гидроксивитамина D [15], что позволяет предположить участие витамина D в регуляции овариального резерва.
Прогнозирование количественных результатов ВРТ
В 2002 г. D. Seifer и соавт. впервые сообщили о взаимосвязи между уровнем циркулирующего АМГ и ответом яичников на лечение гонадотропином. Они обнаружили, что более высокий уровень АМГ в сыворотке в 3-й день стимуляции коррелировал с бóльшим количеством полученных ооцитов. В частности, у женщин с хорошим ответом на КОС (получено ≥11 ооцитов) средние концентрации АМГ в сыворотке в 2,5 раза выше таковых, чем у женщин, у которых получено ≤6 ооцитов [16]. Позднее многочисленные исследования подтвердили, что уровни АМГ в сыворотке сильно коррелируют с количественными результатами ВРТ [17].
На протяжении последнего десятилетия увеличивается доля пациенток в программах ВРТ с бедным ответом яичников на КОС [18], который может быть обусловлен как снижением овариального резерва, так и недостаточным ответом яичников на стимуляцию при сохранном овариальном резерве. В любом случае, у пациенток отмечается более низкая частота наступления беременности после экстракорпорального оплодотворения (ЭКО) по сравнению с женщинами того же возраста с нормальным ответом. Возможность точно просчитать слабый ответ на КОС критически важна, так как она помогает врачам надлежащим образом прогнозировать сниженную вероятность наступления беременности, а также оптимизировать протоколы для слабого ответа с целью улучшения результатов. Метаанализ 28 исследований с участием женщин, проходивших программу ЭКО, показал, что уровень АМГ является более точным прогностическим маркером бедного ответа на овариальную стимуляцию по сравнению с возрастом женщины [19]. Сочетание двух показателей (АМГ и возраст) не дало повышения точности прогноза. Дальнейшее углубленное изучение прогностической значимости АМГ с участием более 700 пациенток показало, что этот маркер более достоверен в прогнозировании слабого ответа яичников на стимуляцию по сравнению с КАФ и ингибином В (p<0,001) [20].
Особый интерес у репродуктологов вызывает возможность прогнозирования результатов КОС у женщин со сниженным овариальным резервом. Систематический обзор, проведенный A. La Marca и соавт., показал, что низкие пороговые значения АМГ (0,1–1,66 нг/мл) демонстрируют чувствительность, равную 76%, и специфичность – 79% [21]. Недостаточно высокий уровень специфичности может приводить к ложным прогнозам на КОС, поэтому уровень АМГ не должен использоваться как повод для отказа женщине в лечении.
Избыточный ответ яичников на стимуляцию гонадотропинами возникает примерно в 7% циклов ЭКО, а у женщин моложе 30 лет риск гиперстимуляции возрастает до 15% [22]. Установлено, что факторами риска развития СГЯ являются низкий индекс массы тела, молодой возраст и СПКЯ, но наиболее прогностически ценным фактором является наличие 15 и более фолликулов диаметром более 10 мм в день введения триггера хорионического гонадотропина человека [23]. Применение маркеров овариального резерва, таких как АМГ, для прогнозирования гиперстимуляции яичников может помочь репродуктологу в выборе соответствующего протокола КОС и при необходимости скорректировать дозу гонадотропина, а также своевременно проводить профилактические мероприятия СГЯ, такие как замена триггера, сегментация цикла и т.д.
В систематическом обзоре четырех исследований, в которых на основании уровня АМГ проводилось прогнозирование чрезмерного ответа на стимуляцию гонадотропинами, установлено, что высокие пороговые значения АМГ (3,36–5,0 нг/мл) обладают достаточной чувствительностью и специфичностью (53–90,5 и 70–94,9% соответственно) для прогнозирования СГЯ [24]. Метаанализ данных более 1 тыс. женщин, проведенный S. Broer и соавт., показал, что АМГ является надежным прогностическим маркером избыточного ответа яичников на стимуляцию даже в случаях назначения низких доз гонадотропинов [25]. Полученные результаты свидетельствуют о надежности АМГ в качестве прогностического маркера КОС на введение гонадотропинов и подбора персонализированных протоколов овариальной стимуляции.
Особый интерес, на наш взгляд, представляют исследования, в которых анализируется взаимосвязь между уровнем АМГ и качеством ооцитов, эмбрионов и последующая частота имплантации, что позволяет позиционировать АМГ как маркер качества ооцитов.
Качество ооцитов и эмбрионов
Целый ряд исследований посвящен изучению взаимосвязи уровня АМГ с качеством ооцитов, качеством эмбрионов и/или частотой имплантации [26, 27]. В одном из первых исследований, изучавших потенциальную связь между АМГ и качеством ооцитов в циклах ЭКО/интрацитоплазматической инъекции сперматозоида (ИКСИ), T. Ebner и соавт. обнаружили, что высокие и низкие уровни АМГ ассоциированы со сниженным качеством ооцитов. В группе пациенток с нормальным уровнем АМГ регистрировалось 50% ооцитов высокого качества, тогда как в группах пациенток c высоким и низким уровнем АМГ – лишь 30%.
При морфологическом исследовании ооцитов в группе пациенток с низким уровнем АМГ обнаруживалась темная центральная грануляция в цитоплазме, тогда как у пациенток с высоким уровнем АМГ отмечена агрегация гладкого эндоплазматического ретикулума. В том же исследовании обнаружили, что уровни АМГ не коррелировали с частотой оплодотворения или качеством эмбрионов, оцениваемых на стадии дробления или бластоцисты [28]. Взаимосвязь между уровнем АМГ с качеством ооцитов, частотой оплодотворения ооцитов и последующей имплантацией эмбрионов подтверждена в работе E. Borges и соавт. Уровень АМГ в сыворотке ассоциирован такими морфологическими характеристиками ооцитов, как присутствие агрегатов гладкого эндоплазматического ретикулума, крупного перивителлинового пространства, гранулярности перивителлинового пространства и др. [29].
Интересно, что в двух недавних исследованиях продемонстрирована взаимосвязь между уровнем АМГ и плоидностью эмбриона. Так A. La Marca и соавт. [30] сообщали о сильной взаимосвязи, которая не зависела от возраста пациентки, между уровнем АМГ и частотой формирования эуплоидных бластоцист в программах ЭКО/ИКСИ. Увеличение уровня АМГ на 1 нг/мл повышало на 27% вероятность получения эуплоидной бластоцисты для последующего переноса в полость матки. В своем исследовании X. Jiang и соавт. [31] выявили закономерность, что сниженный уровень АМГ (35 лет), у более молодых женщин такой закономерности не выявлено. Возможно, данный факт связан с большей вероятностью получения анеуплоидных эмбрионов у женщин старше 35 лет. Полученные данные свидетельствуют о том, что низкий уровень АМГ может быть прогностическим фактором риска анеуплоидии эмбрионов. Возможно, что низкие уровни АМГ отражают не только сокращение фолликулярного резерва, но также снижение продукции АМГ отдельными фолликулами, что может указывать на низкое качество ооцитов. Так, исследовательской группой под руководством R. Fanchin и соавт. при изучении взаимосвязи между способностью гранулезных клеток продуцировать АМГ и имплантационным потенциалом последующего эмбриона установлено наличие выраженной корреляции между фолликулярным уровнем АМГ и имплантацией эмбрионов [32]. Более того, несмотря на то, что АМГ секретируется в основном гранулезными клетками преантральных и мелких антральных фолликулов, экспрессия АМГ отмечается в кумулюсных клетках, окружающих преовуляторный ооцит. Кумулюсные клетки, как известно, также информативны в отношении оценки качества ооцита, так как их профиль экспрессии генов, уровень апоптоза и длина теломер ассоциированы с качеством последующих эмбрионов и их имплантационным потенциалом. Кроме того, нужно отметить, что установлена также взаимосвязь между базальными уровнями АМГ и целостностью и жизнеспособностью ДНК кумулюсных клеток, что также свидетельствует о возможности маркера прогнозировать качество ооцитов.
Очевидно, что представленные данные не являются достаточными, и необходимо проводить дальнейшие исследования по изучению роли АМГ в оценке качества ооцитов и эмбрионов.
Диагностические тест-системы для определения уровня АМГ
Заключение
В последние 15 лет AMГ завоевал лидерство в качестве наиболее информативного биохимического маркера, отражающего состояние яичников. Он считается самым ранним и наиболее чувствительным маркером репродуктивного старения, коррелируя с пулом первичных фолликулов, помогает определить стартовую дозу гонадотропинов при КОС. Точность AMГ в прогнозировании реакции яичников на стимуляцию, возможно, привела к его наиболее широкому использованию в клинике на сегодняшний день: индивидуализация подбора протоколов стимуляции и профилактика рисков гиперстимуляции яичников, консультирование по планированию беременности и сохранению фертильности.
Несмотря на подтвержденную способность АМГ предоставлять количественную информацию о состоянии яичников, в настоящее время лишь накапливаются знания о его возможности отражать качество ооцитов. Углубленное изучение патофизиологии AMГ, возможно, приведет к разработке новых фармакологических подходов к лечению с использованием агонистов и/или антагонистов AMГ для решения широкого спектра проблем в области репродукции. Необходимо также проводить дальнейшее изучение роли АМГ при различных гинекологических заболеваниях, затрагивающих гормональную функцию яичников.
Об авторах
Наталья Владимировна Александрова
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России
Россия, 117997, г. Москва, ул. акад. Опарина, 4
Список литературы
Эта статья доступна по лицензии Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.Читайте также:

