Рыхлая соединительная ткань при лучевой болезни. Дистрофия соединительной ткани под воздействием радиации
Добавил пользователь Валентин П. Обновлено: 18.01.2026
Скелетные мышцы при лучевой болезни. Изменения мышечной ткани после радиационного поражения
У людей, погибших от острой лучевой болезни в результате взрывов атомных бомб (1945) или во время производственных аварий, тоже были отмечены грубые структурные изменения скелетных мышц, особенно на участках тела, подвергшихся облучению в массивных дозах. Обнаруженные изменения скелетных мышц были сходны с наблюдаемыми у животных после локального или общего облучения организма.
Вместе с тем, судя по литературным данным, при действии ионизирующих излучений высоких энергий, особенно быстрых нейтронов, поражение мышечной ткани может быть, наиболее тяжелым и значимым для течения и исхода острой лучевой болезни в целом. Как известно, 97% массы скелетных мышц составляют водород, азот, углерод и кислород, т. е. именно те химические вещества, за счет которых в основном осуществляется эффект вторичной ионизации при воздействии нейтронов. Учитывая, что скелетные мышцы составляют 40—47% всего тела человека, нетрудно представить значения возникающих в них структурных нарушений для развития токсемии, которой придается большое значение в патогенезе «токсемической» формы острой лучевой болезни [Гуськова А. К-, Байсоголов Г. Д., 1971].
При патологоанатомическом исследовании в случае гибели организма в разгар острой лучевой болезни, вызванной облучением быстрыми нейтронами или гамма-лучами высоких энергий, обращает на себя внимание полнокровие и отек скелетных мышц, а также кровоизлияние, особенно в местах инъекций или механической травмы. При микроскопическом исследовании на первый план тоже выступают полнокровие капилляров и кровеносных сосудов, отек и высокое содержание кислых мукополисахаридов в основном веществе межуточной ткани и стенок кровеносных сосудов.

На этом фоне в мышечных волокнах обнаруживаются волны сокращения, признаки дискоидного и фибриллярного распада, миолиза. В большинстве мышечных волокон отсутствует поперечная исчерченность, выявляется фуксинофнлия и неспецифическая пиронинофилия, свидетельствующая о белковой дегенерации миолазмы, низкая активность цитохромоксидазы и сукцинатдегидрогеназы, небольшое содержание ДНК, РНК и гликогена, повышенная активность щелочной фосфатазы, увеличение свободных липидов и значительное уменьшение фосфолипидов. Определяются и более грубые изменения в виде вакуолизации, глыбчатого распада, наличия крупных капель жира в миоплазме, растворения и распада ядер. Встречается большое количество волокон с неразделившимися ядрами, а также с цепочками гиперхромных мелких ядер, преимущественно в пиронинофильных волокнах.
Общее однократное воздействие излучений высоких энергий вызывает значительные морфологические нарушения иннервациоиного аппарата скелетной мускулатуры в виде явлений раздражения, дистрофических изменений и распада [Зайратьянц В. Б., 1957], Наиболее грубые нарушения выявляются в претерминальных отделах мякотных нервных волокон и в концевых нервных приборах чувствительных и двигательных окончаний [Сутулов Ю, Л., Загребин А. М., 1977].
В поздние сроки, через 30—40 дней и более после облучения, наряду с дистрофическими изменениями мышечных волокон различаются признаки склероза межуточной ткани в виде накопления нейтральных мукополисахаридов в основном веществе, огрубения и увеличения коллагеновых волокон, гиалиноза стенок кровеносных сосудов без выраженной фибробластической реакции.
Таким образом, имеется достаточно оснований считать, что в скелетных мышцах возникают значительные морфологические изменения при воздействии на организм ионизирующего излучения высокой энергии. Это хорошо подтверждается наблюдениями И. В. Торопцева и соавт. (1972), которые обнаружили описанные выше структурные изменения в скелетных мышцах уже в первые часы после облучения в дозе 25 000—30 000 рад на бетатроне в 25 мэВ.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Рыхлая соединительная ткань при лучевой болезни. Дистрофия соединительной ткани под воздействием радиации
Костный мозг при острой лучевой болезни. Морфология лучевого поражения костного мозга
В самом начале острой лучевой болезни макроскопически костный мозг выглядит неизмененным. При микроскопическом исследовании пунктатов или срезов уже в первые часы развития заболевания (200Р и более) в костном мозге обычно обнаруживаются явления резкого полнокровия, очаговые диапедезные кровоизлияния, плазматическое пропитывание стромы и достаточное количество клеточных элементов.
Однако при цитологическом исследовании обращает на себя внимание уменьшение числа сегменто-ядерных лейкоцитов при относительном преобладании миелоцитов, юных и палочкоядреных форм, а также относительное увеличение числа клеток красной крови.
Это свидетельствует об ускорении созревания и интенсивном переходе лейкоцитов из кроветворной ткани в периферическую кровь [Краевский Н. А., 1957, 1962; Fliedner Т. М. et al., 1961] вследствие нарушения проницаемости костномозговых синусоидов. Значительная часть белого и красного ростков крови в это время находится в состоянии некробиоза, вплоть до полного разрушения ядер.
Как показывают электронно-микроскопические исследования, некробиотические изменения в клетках всех 3 ростков костного мозга выявляются уже через 1 ч после облучения в виде вакуолей в ядрах, смещения ядрышек, нарушения цитоплазматической сети, образования выступов цитоплазмы типа псевдоподии и большого количества вакуолей в цитоплазме, нарушения мембран митохондрий. Причем ультраструктурные изменения в плазматических клетках наступают значительно позже, что подтверждает существующее в литературе представление об их устойчивости к действию излучения [Шурьян И. М., Андрюшенко В. В., 1964; Bari A., Sorenson G., 1965; Токин И. Б., 1974; Марков В. И. и др., 1978].
Установлено, что миелоидные клетки разрушаются вследствие гибели их ультраструктуры, а эритроидные элементы — путем пикноза [Пискарёв В. И. и др., 1978]. В тромбоцитах выявляется увеличенное, число а-гранул, концентрация их в центре клетки, снижение общего количества лизосом, содержащих серотонин, увеличение числа «старых» тромбоцитов [Нестайко Г. В. и др., 1971]. Говоря о ранних изменениях клеток крови, следует напомнить о появлении микроочагов некроза, обнаруживаемых с помощью люминесцентной микроскопии в гистологических препаратах, обработанных акридином оранжевым [Мейсель М. Н., Сондак В. А., 1956; Поздняков А. Л., 1959]. Количество таких микронекрозов нарастает в течение первых 3 ч после облучения, а затем постепенно уменьшается.
Кроме того, отмечается изменение люминесценции значительной части, клеток костного мозга, выявляемое уже через 10—15 мин после облучения в смертельных дозах. В основе данного явления лежит нарушение клеточных мембран [Черникова В. Е., Тарханова М. В., 1965], главным образом ядерной оболочки и митохондрий, а также нуклеопротеидных структур [Зотиков Л. А. и др., 1978], хотя в лимфоцитах человека, облученных in vitro в летальной дозе, наиболее грубые ультраструктурные изменения обнаруживаются в цитоплазматических мембранах клеток [Stefani S. et a]., 1977].
Сравнительно рано обнаруживается изменение содержания нуклеиновых кислот в цитоплазме и ядрах клеток костного мозга. Уменьшается содержание РНК [Носелевич О. М., Колесникова Г. С, 1961], что связано не только с изменением клеточного состава костного мозга, но и с нарушением функции клеток. Изменение ДНК возникает несколько позже, когда убывает количество незрелых клеточных форм. В первые часы после облучения в лейкоцитах снижается активность щелочной фосфатазы и значительно увеличивается содержание гликогена в результате накопления его в клетках во время прохождения их через печень и вследствие активности гидролитических ферментов [Губин В. А., 1959; Bartnikowa W., 1973].
Вместе с тем изменение SH-групп и уменьшение пероксидазной зернистости отмечается только в отдельных клетках миелоидного ряда. Интенсивность соответствующих гистохимических реакций снижается только по мере нарастания признаков массовой гибели клеток.
Жировые клетки, коллагеновые волокна при лучевой болезни. Лучевое поражение скелетных мышц
При острой лучевой болезни, заканчивающейся смертью через 1—2 нед после облучения, заметных изменений в жировых клетках не наблюдается. В случае затянувшегося течения лучевой болезни уменьшается содержание в них липидов. Одновременно с изменением клеточных элементов рыхлой соединительной ткани при лучевой болезни происходит нарушение волокнистых элементов и основного межуточного вещества.
Коллагеновые волокна после облучения несколько уплотняются и дают интенсивную метахромазию при окраске то-лундиновым синим или пикрофуксином. В разгар лучевой болезни, особенно у погибших животных, интенсивность мета-хромазии несколько снижается, коллагеновые волокна слабее окрашиваются фуксином [Шиходыров В. В., 1957].
Аргирофильные волокна тоже претерпевают довольно ранние и глубокие изменения. В первые сутки после облучения общее количество аргирофильных волокон уменьшается. Вместо четкой, хорошо различимой сети тонких волоконец обнаруживаются поля, состоящие из аргирофильной зернистости, а более толстые аргирофильные волокна подвергаются фрагментации и распаду.
Такие же изменения аргирофильного каркаса наблюдаются при лучевой болезни в соединительной ткани внутренних органов. Эластические волокна морфологически изменяются сравнительно мало.
С первых же дней после облучения возникает своеобразный мукоидный отек соединительной ткани за счет накопления и деполимеризации мукополнсахаридов [Upton A., Gude W., 1954].

У животных, переживших острую лучевую болезнь, в пепериод выздоровления клеточно-волокнистый состав рыхлой соединительной ткани восстанавливается. Регенерация клеточных элементов начинается с увеличения числа камбиальных клеток и дифференцировки их в фибробласты и макрофаги. Увеличивается количество лаброцитов. Расплавленные массы коллагена рассасываются. Одновременно наблюдается уменьшение массы межуточного вещества, новообразование аргнрофильных волокон, нормализация коллагеновых волокон. Однако уже с конца 1-х и начала 2-х суток происходит интенсивное набухание и гомогенизация коллагеновых волокон, которые превращаются в массы аморфного коллагена [Шиходыров В. В., 1960].
Даже через 1—2 года после облучения в рыхлой соединительной ткани клеточный состав полностью не восстанавливается. Общее количество клеток остается уменьшенным главным образом за счет фибробластических элементов и вместе с тем отмечается значительное образование коллагеновых волокон.
В литературе давно уже существует мнение о радиорезистентности скелетных мышц. Однако большая часть соответствующих морфологических данных получена при местном облучении рентгеновскими лучами. Отмечено, что выраженные структурные изменения в облученных мышцах возникают только после воздействия в дозах более 2000 Р. По мнению некоторых исследователей [Клишов А. А., 1965; Тужилкова Т. Н., 1969], вначале это проявляется в виде воспалительной клеточной инфильтрации эндомизия, активации амитотического деления мышечных, ядер и уменьшения в них хроматина, а впоследствии в дискоидном распаде, атрофии отдельных мышечных волокон и тоже воспалительной реакции.
Через несколько месяцев обнаруживаются атрофическне изменения и гибель мышечных, волокон, огранизацня клеточного детрита и склеротическое разрастание межуточной ткани. Однако следует заметить, что ранняя инфильтрация эндомизия полиморфно-ядерными лейкоцитами скорее всего не воспалительного происхождения, а связана с перераспределительным лейкоцитозом, который, как известно, возникает в ранние сроки после облучения в больших дозах. Воспалительная реакция в поздние сроки после облучения может возникать как вторичная реакция на гибель мышечных волокон. Что касается изменения скелетных мышц после общего внешнего облучения, то такие экспериментальные наблюдения немногочислены и далеко неоднозначны.
Например, В. Б. Заратьяиц (1957) отмечала у различных животных после общего облучения рентгеновскими лучами в дозах от 600 до 2000 Р отек межуточной ткани и исчезновение поперечной исчерченности мышечных волокон с последующим нарастанием дистрофически-атрофических изменений. Вместе с тем J. Allen и соавт. (1963) не обнаружили выраженных структурных изменений в мышцах, обезьян, облученных в дозе 800 Р. По данным Н. В. Козловой (1961), у мышей после облучения гамма-лучами в дозе 1500 Р определялись лишь реактивные изменения в виде полнокровия капилляров эндомизия, перегруппировки ядер в мышечных волокнах.
Как указывалось выше, тяжесть структурных изменений и заживлений некротическиязвенных дефектов облученной кожи во многом зависят от сохранности пластических свойств подкожной клетчатки и прежде всего рыхлой соединительной ткани. Изменения, возникающие в последней при типичной форме острой лучевой болезни, вызванной рентгеновским облучением в минимальной смертельной дозе, носят фазный характер. Вначале происходит выраженная активация жизнедеятельности рыхлой соединительной ткани.
Камбиальные клетки усиленно делятся и подвергаются интенсивной дифференцировке на фибробласты и макрофаги. В результате этого в 1,5—2 раза увеличивается количество молодых фибробластов и особенно макрофагов. Изменяется и структура клеток. В экзоплазме зрелых фнбробластов появляется большое количество вакуолей. Цитоплазма макрофагов вспенивается, в них появляются вакуоли и псевдоподии. В лаброцитах изменяется четкая структура цитоплазмы: гранулы секрета склеиваются между собой в конгломераты или вследствие разрыва оболочки клеток выходят в окружающую среду.
При флюоресцентном исследовании рыхлой соединительной ткани [Поздняков А. Л., 1975] можно видеть, что уже через 1 ч после облучения изменяется свечение гранул лаброцитов: в норме оранжевые, они становятся кирпично-красными при нарушений мукопротеидного обмена клетки. Вместе с тем волокнистые элементы рыхлой соединительной ткани изменяются незначительно.
Продолжительность описанных изменений зависит от дозы и характера радиационного воздействия. Так, например, при облучении собак в дозах 400—600 Р эта фаза заболевания продолжается до 12 ч, а при облучении в дозах 20000— 3000 Р активация начинается в ходе облучения, но имеет слабую выраженность и продолжается не более 30 мин [Шиходыров В. В., 1958].

Вторая фаза изменения рыхлой соединительной ткани после облучения характеризуется появлением дистрофических изменений во всех ее компонентах. Начинается данная фаза в конце первых суток и продолжается либо до момента гибели животного, либо до его выздоровления. В это время наблюдается уменьшение общего количества клеточных элементов за счет фибробластов, макрофагов и камбиальных элементов.
Значительные изменения претерпевают фибробласты: количество молодых клеток уменьшается, а количество старых и распадающихся фибробластов значительно увеличивается. Старые фибробласты имеют большие гомогенные ядра и широкий, бледно окрашивающийся экзоплазматический ободок цитоплазмы с низким содержанием РНК.
В то же время в цитоплазме макрофагов происходят глубокие изменения, которые впоследствии приводят к их распаду. В результате этого уменьшается общее количество клеточных элементов. Так, например, на высоте лучевой болезни (облучение собак в дозах 400—500 Р) остается лишь 2—3% макрофагов, часть из которых находится в состоянии распада. В то же время у здоровых собак макрофаги составляют около 15% клеточных элементов рыхлой соединительной ткани [Шиходыров В. В., 1958]. Существенно, что уменьшение количества макрофагов в рыхлой соединительной ткани происходит одновременно с убылью этих клеток я понижением их фагоцитарной функции в других органах [Фриденштейи А, Я., 1958; Иванов А. Е., Куршакова Н. Н., 1959].
В соединительной ткани наступает усиленный распад лаброцидов. Вокруг кровеносных сосудов остаются лишь единичные клеточные элементы. Однако на границе лучевых ожогов и язвенных дефектов кожи у людей, погибших от острой лучевой болезни, количество лаброцитов может быть значительным [Liebow A. et al., 1949].
Анатомо-гистологические изменения сосудов в патогенезе лучевой болезни
Лучевая болезнь — комплекс общих и местных реактивных изменений, обусловленных воздействием повышенных доз ионизирующего излучения на клетки, ткани и среды организма (100 Р и более). Этиология заболевания может связана также с прямым попаданием внутрь организма человека радионуклидных соединений. Облучение возможно даже в случае небольшого попадания на кожу радиоактивных лучей. В этом случае признаки заболевания проявляются на поражённом участке кожи.
Лучевая болезнь может развиваться у медицинского персонала отделений лучевой диагностики и терапии (рентгенологов, радиологов), больных, подвергающихся частым рентгенологическим и радионуклидным исследованиям. Основными или общими симптомами лучевой болезни будут являться:
1) головная боль, головокружением;
2) тошнота и рвота;
3) носовое кровотечение;
4) слабость и вялость;
7) гиперемия кожи и зуд [4].
Частные симптомы будут отражать действие поражающих лучей на системы органов, таких как желудочно-кишечный тракт, центральная нервная система, эндокринная система, система кроветворения, сердечно-сосудистая система
Сердечно — сосудистая система всегда находится «под прицелом» повреждающих факторов, так как является жизненно важным комплексом органов.
В норме сосуд имеет следующее строение:
1) Эндотелий (интима) — внутренняя, гладкая поверхность сосудов, состоящая преимущественно из одного слоя плоских клеток, основной мембраны и внутренней эластической пластинки
2) Средняя оболочка — состоит из нескольких взаимопроникающих мышечных слоев между внутренней и внешней эластичными пластинками
3) Эластические волокна -расположены во внутренней, средней и наружной оболочках и образуют относительно густую сеть (особенно в интиме), легко могут быть растянуты в несколько раз и создают эластическое напряжение
4) Коллагеновые волокна — расположены в средней и наружной оболочках, образуют сеть, оказывающую растяжению сосуда гораздо большее сопротивление, чем эластические волокна, но, имея складчатое строение, противодействуют кровотоку только в том случае, если сосуд растянут до определенной степени
5) Гладкомышечные клетки- образуют среднюю оболочку, соединены друг с другом и с эластическими и коллагеновыми волокнами, создают активное напряжение сосудистой стенки (сосудистый тонус)
6) Адвентициальная оболочка — является наружной оболочкой сосуда и состоит из рыхлой соединительной ткани (коллагеновых волокон), фибробластов. тучных клеток, нервных окончаний, а в крупных сосудах дополнительно включает мелкие кровеносные и лимфатические капилляры, в зависимости от типа сосудов имеет различную толщину, плотность и проницаемость [3].
На первых этапах заболевания происходят изменения в составе крови, что дает основание говорить о дальнейших патологиях сосудов.
Рис. 1. Нормальное строение сосуда
Изменение со стороны сосудов начинают проявляться в третьем периоде, характеризующимся клиническим проявлениями. Отличительной особенностью этого периода является кровоточивость. Это может быть обусловлено изменившимся составом крови, в результате которого будет уменьшаться скорость свертывания крови, а с другой стороны изменением строения самого сосуда, характеризующимся изменением проницаемостью сосудов в результате сдвига ферментных систем. Повышенную проницаемость рассматривают как результат действия на сосуды [1].
Большему изменению подлежит эндотелий сосуда, поэтому будут изменяться его структуры, а именно:
1) В подэндотелиальном слое будет изменяться работа эластических и коллагеновых волокон;
2) Звездчатые малодифференцированные клетки подэндотелиального слоя не успевают дифференцироваться в другие формы (стадии) клеток;
В патогенезе лучевой болезни нарушение строения эндотелия капилляра происходит в несколько стадий:
1) повышение синтетической активности клеток эндотелия (тельца Вейбеля-Паладе, содержащие фактор VIII свертывающей системы крови, перициты и адвентициальные клетки)
2) нарушение сбалансированной секреции фактора, регулирующих тонус сосудов (серотонин), систему гемостаза, процессы межклеточного взаимодействия; на этой стадии нарушается естественная барьерная функция эндотелия, повышается его проницаемость для различных компонентов плазмы. Также проницаемость может зависеть от активации фермента гиалуронидазы.
3) истощение эндотелия, сопровождающаяся гибелью клеток и замедленными процессами регенерации эндотелия.
Также при длительном изменении структуры сосуда, эндотелий начинает участвовать в активизации ренин- ангиотензивной и симпатической системы, переключением активности эндотелия на синтез оксидантов, вазоконстрикторов, а самое главное- тромбогенных факторов, а также уменьшение деактивности эндотелиальных активных веществ из-за повреждения эндотелия и его структур.
Средняя оболочка, обладающая эластическим каркасом, принимает в основном круговые напряжения стенок артерий. Но при заболевании она претерпевает ряд изменений: изменяется соотношения окончатых мембран, различных структур.
Из-за частой кровоточивости нарушается работа внутренней эластической мембраны.
В норме мышечные клетки, сокращаясь, могут изменять диаметр сосуда. При лучевой болезни происходит нарушение тонуса гладкомышечных клеток среднего и наружного слоёв артерии, что ведет к расширению просвета сосудов или иными словами, на сосуды будет действовать миопаралитический эффект. Имеются продольные пучки, мало фибробластов и коллагеновых волокон [3].
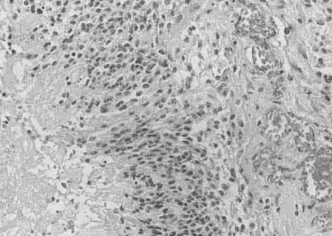
Рис. 2. Микроскопические изменения сосуда
Таким образом, имеет место изнашивание сосудов, ухудшением их функционирования, особенно на участках, которые особенно подвержены воздействию ионизирующего излучения.
- Аграненко В. А. Дифференциальная диагностика гемотрансфузионных осложнений.- Вестник службы крови. 2015. № 1. — С. 8–9.
- Артамонова В. Г., Шаталов Н. Н. Профессиональные болезни: Учебник. — 2-е изд., перераб. и доп. — М.: Медицина, 1988. — 416с.
- Быков В. Л. Частная гистология человека. — СПб.: Сотис, 1999.- 301 с.
- Цыган В.Н, Казаченко А. И., Куправа М. В. [и др.]. Патофизиология лучевой болезни: учеб. пособие.— СПб,2017. — 63 с.
Основные термины (генерируются автоматически): лучевая болезнь, клетка, VIII, волокно, ионизирующее излучение, наружная оболочка, сосуд.
Читайте также:
- Микробиологическая диагностика эпидемического сыпного тифа. Лечение эпидемического сыпного тифа. Профилактика эпидемического сыпного тифа.
- Постменопауза: причины, симптомы и лечение
- Средние отиты при скарлатине. Туберкулезный средний отит
- Общий аномальный легочный венозный возврат
- Диагностика шизофрении. Проблемы диагностики шизофрении
