Септический шок. Этиология ( причины ) септического шока. Патогенез септического шока.
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Септический шок — это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока.
Причины и патогенез развития септического шока:
Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать.
Тому причинами являются:
1. Все более широкое использование для интенсивной терапии инвазивных устройств, то есть внутрисосудистых катетеров и др.
2. Распространенное применение цитотоксических и иммуносупрессивных средств (при злокачественных заболеваниях и трансплантациях), которые вызывают приобретенный иммунодефицит.
3. Рост продолжительности жизни больных сахарным диабетом и злокачественными опухолями, у которых высок уровень предрасположенности к сепсису.
Бактериальная инфекция — это наиболее частая, причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60% больных в состоянии септического шока. У 10-30% больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии — это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация.
В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов, взаимодействия клеток и молекул систем врожденного иммунитета и, соответственно, иммуно-компетентных клеток.
Сепсис, системная воспалительная реакция и септический шок — это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия — это патологический рост содержания в крови агентов ауто- паракриннои регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции.
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов.
Критический дефицит эффекторов обуславливает множественную системную недостаточность.
Симптомы и признаки септического шока:
О развитии системной воспалительной реакции говорит наличие двух или более следующих признаков:
• Температура тела более высокая, чем 38 о С, или на уровне ниже 36 о С.
• Частота дыханий выше 20/минуту. Дыхательный алкалоз при напряжении углекислого газа в артериальной крови ниже 32 мм рт. ст.
• Тахикардия при частоте сердечных сокращений большей 90/минуту.
• Нейтрофилия при росте содержания полиморфноядерных лейкоцитов в крови до уровня выше 12х10 9 /л, или нейтропения при содержании нейтрофилов в крови на уровне ниже 4х10 9/ л.
• Сдвиг лейкоцитарной формулы, при котором палочкоядерные нейтрофилы составляют более 10% общего числа полиморфноядерных лейкоцитов.
О сепсисе свидетельствуют два или более признаков системной воспалительной реакции при подтвержденном данными бактериологических и других исследований наличии патогенных микроорганизмов во внутренней среде.
Течение септического шока
При септическом шоке гиперцитокинемия повышает активность синтетазы оксида азота в эндотелиальных и других клетках. В результате снижается сопротивление резистивных сосудов и венул. Снижение тонуса данных микрососудов уменьшает общее периферическое сосудистое сопротивление. Часть клеток организма при септическом шоке страдает от ишемии, обусловленной расстройствами периферического кровообращения. Расстройства периферического кровообращения при сепсисе и септическом шоке — это следствия системной активации эндотелиоцитов, полиморфоядерных нейтрофилов и мононуклеарных фагоцитов.
Воспаление данного генеза имеет сугубо патологический характер, происходит во всех органах и тканях. Критическое падение числа структурно-функциональных элементов большинства органов-эффекторов составляет основное звено патогенеза так называемой множественной системной недостаточности.
Согласно традиционным и верным представлениям, сепсис и системную воспалительную реакцию вызывает патогенное действие грамотрицательных микроорганизмов.
В возникновении системной патологической реакции на инвазию во внутреннюю среду и кровь грамотрицательных микроорганизмов определяющую роль играют:
• Эндотоксин (липид А, липополисахарид, ЛПС). Этот термостабильный липополисахарид составляет наружное покрытие грамотрицательных бактерий. Эндотоксин, воздействуя на нейтрофилы, вызывает высвобождение полиморфноядерными лейкоцитами эндогенных пирогенов.
• ЛПС-связывающий белок (ЛПССБ), следы которого определяют в плазме в физиологических условиях. Данный протеин образует с эндотоксином молекулярный комплекс, циркулирующий с кровью.
• Рецептор клеточной поверхности мононуклеарных фагоцитов и эндотелиальных клеток. Его специфическим элементом является молекулярный комплекс, состоящий из ЛПС и ЛПССБ (ЛПС-ЛПССБ).
В настоящее время растет частота сепсиса, обусловленного инвазией во внутреннюю среду грамположительных бактерий. Индуцирование сепсиса грамположительными бактериями обычно не связано с высвобождением ими эндотоксина. Известно, что предшественники пептидогликана и другие компоненты стенок грамположительных бактерий вызывают высвобождение клетками систем иммунитета фактора некроза опухолей-альфа и интерлейкина-1. Пептидогликан и другие компоненты стенок грамположительных бактерий активируют систему комплемента по альтернативному пути. Активация системы комплемента на уровне всего организма вызывает системное патогенное воспаление и вносит свой вклад в эндотоксикоз при сепсисе и системной воспалительной реакции.
Ранее считалось, что септический шок всегда вызывается эндотоксином (липополисахаридом бактериального происхождения), который высвобождается грамотрицательными бактериями. Теперь общепризнанным является тот факт, что менее чем в 50% случаев септический шок вызывается грамположительными возбудителями.
Расстройства периферического кровообращения при септическом шоке, адгезия активированных полиморфоядерных лейкоцитов к активированным эндотелиоцитам — все это ведет к выходу нейтрофилов в интерстиций и воспалительной альтерации клеток и тканей. Одновременно эндотоксин, фактор некроза опухолей-альфа, а также интерлейкин-1 повышают образование и высвобождение эндотелиальными клетками тканевого фактора свертывания. В результате активируются механизмы внешнего гемостаза, что вызывает отложение фибрина и диссеминированное внутрисосудистое свертывание.
Артериальная гипотензия при септическом шоке в основном представляет собой следствие снижения общего периферического сосудистого сопротивления. Гиперцитокинемия и рост концентрации в крови оксида азота при септическом шоке обуславливает расширение артериол. При этом посредством тахикардии компенсаторно растет минутный объем кровообращения. Артериальная гипотензия при септическом шоке возникает, несмотря на компенсаторный рост минутного объема кровообращения. Общее легочное сосудистое сопротивление при септическом шоке растет, что можно отчасти связать с адгезией активированных нейтрофилов к активированным эндотелиоцитам легочных микрососудов.
Выделяют следующие основные звенья патогенеза расстройств периферического кровообращения при септическом шоке:
1)рост проницаемости стенки микрососудов;
2) рост сопротивления микрососудов, который усиливается клеточной адгезией в их просвете;
3) низкая реакция микрососудов на вазодилатирующие влияния;
4) артериоло-венулярное шунтирование;
5) падение текучести крови.
Гиповолемия — это один из факторов артериальной гипотензии при септическом шоке.
Выделяют следующие причины гиповолемии (падения преднагрузки сердца) у больных в состоянии септического шока:
1) дилатация емкостных сосудов;
2) потеря жидкой части плазмы крови в интерстиций из-за патологического роста проницаемости капилляров.
Можно считать, что у большинства больных в состоянии септического шока падение потребления кислорода организмом преимущественно обусловлено первичными нарушениями тканевого дыхания. При септическом шоке умеренный лактатный ацидоз развивается при нормальном напряжении кислорода в смешанной венозной крови.
Лактатный ацидоз при септическом шоке считают следствием снижения активности пируватдегидрогеназы и вторичной аккумуляции лактата, а не падения тока крови на периферии.
Расстройства периферического кровообращения при сепсисе носят системный характер и развиваются при артериальной нормотензии, которую поддерживает рост минутного объема кровообращения. Системные нарушения микроциркуляции проявляют себя снижением рН в слизистой оболочке желудка и падением насыщения кислородом гемоглобина крови в печеночных венах. Гипоэргоз клеток кишечного барьера, действие иммуносупрессивных звеньев патогенеза септического шока — все это снижает защитный потенциал кишечной стенки, что служит еще одной из причин эндотоксемии при септическом шоке.
Диагноз септического шока
- Септический шок - сепсис (синдром системной воспалительной реакции плюс бактериемия) в сочетании со снижением АД сист. менее 90 мм рт. ст. при отсутствии видимых причин для артериальной гипотензии (дегидратация, кровотечение). Наличие признаков гипоперфузии тканей несмотря на проведение инфузионной терапии. Перфузионные нарушения включают ацидоз, олигурию, острые нарушения сознания. У пациентов, получающих инотропные препараты, перфузионные нарушения могут сохраняться при отсутствии артериальной гипотензии.
- Рефрактерный септический шок - септический шок, продолжающийся более одного часа, рефрактерный к инфузионной терапии.
Лечение септического шока:
1. Инфузионная терапия
- Катетеризация двух вен.
- 300-500 мл раствора кристаллоидов в/в в виде болюса, затем 500 мл раствора кристаллоидов в/в капельно в течение 15 минут. Оценить венозную гипертензию и наличие сердечной декомпенсации.
- При наличии сердечной недостаточности целесообразна катетеризация a. pulmonalis катетером Swan-Ganz для оценки волемического статуса: оптимальное PCWP = 12 мм рт. ст. при отсутствии ОИМ и 14-18 мм рт. ст. при наличии ОИМ;
- если после инфузионного болюса величина PCWP превысит 22 мм рт. ст., то следует предположить прогрессирование сердечной недостаточности и прекратить активную инфузию кристаллоидов.
- Если, несмотря на высокие значения давления заполнения левого желудочка, артериальная гипотензия сохраняется - допамин 1-3-5 и более мкг/кг/мин, добутамин 5- 20 мкг/кг/мин.
- Бикарбонат натрия в расчетной дозе с целью коррекции метаболического ацидоза.
2. Терапия гипоксемии/РДСВ - оксигенотерапия, ИВЛ с использование PEEP.
3. Терапия сниженной контрактильной способности миокарда - строфантин К 0,5 мг 1-2 раза в сутки в/в в 10-20 мл 5- 20 %-ного раствора глюкозы или физиологического раствора; дигоксин 0,25 мг 3 раза в сутки per os в течение 7- 10 суток, затем 0,25-0,125 мг в сутки; добутамин 5- 20 мкг/кг/мин в/в.
6. Эмпирическая антибиотикотерапия (учитывается локализация источника септического процесса и предполагаемый спектр возможных микроорганизмов).
7. Хирургическое дренирование очагов инфекции.
8. Препараты, эффективность которых не подтверждена:
Септический шок является осложнением многих заболеваний, связанных с инфекцией, особенно хирургических. В нашей практике септический шок встречается при лечении больных с диабетической флегмоной, гангреной. Иногда сепсис развивается у пациентов с нагноением сосудистых протезов.
Наиболее тяжелым течением сепсис отличается при развитии госпитальной инфекции, когда процесс развивается, как осложнение после проведенных операций. Для предупреждения подобного осложнения применяются меры асептики и антисептики, профилактическое назначение антибиотиков.
Септический шок ( Инфекционно-токсический шок )
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.
Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Шоковое состояние классифицируется по патогенетическому и клиническому принципу. Патогенетически болезнь может быть «теплой» и «холодной». Тёплый шок характеризуется увеличением сердечного выброса на фоне снижения общего сосудистого тонуса, эндогенной гиперкатехоламинемией и расширением внутрикожных сосудов. Явления органной недостаточности выражены умеренно. Холодная разновидность проявляется снижением сердечного выброса, резким ослаблением тканевой перфузии, централизацией кровообращения и тяжелой ПОН. По клиническому течению септический шок подразделяется на следующие разновидности:
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
Диагноз устанавливается врачом анестезиологом-реаниматологом. Предположение строится на клинических данных, однако с точностью определить имеющееся состояние можно только при наличии результатов аппаратного и лабораторного исследований. При подозрении на септический шок все анализы делаются в экстренном режиме, «по cito». Реанимационные мероприятия следует начинать, не дожидаясь окончания работы вспомогательных служб. Комплексное обследование, необходимое для определения и подтверждения ИТШ, включает в себя:
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Сепсис
Сепсис - общая гнойная инфекция, развивающаяся вследствие проникновения и циркуляции в крови различных возбудителей и их токсинов. Клиническая картина сепсиса складывается из интоксикационного синдрома (лихорадки, ознобов, бледно-землистой окраски кожных покровов), тромбогеморрагического синдрома (кровоизлияний в кожу, слизистые, конъюнктиву), метастатического поражения тканей и органов (абсцессов различных локализаций, артритов, остеомиелитов и др.). Подтверждением сепсиса служит выделение возбудителя из культуры крови и локальных очагов инфекции. При сепсисе показано проведение массивной дезинтоксикационной, антибактериальной терапии, иммунотерапии; по показаниям – хирургическое удаление источника инфекции.
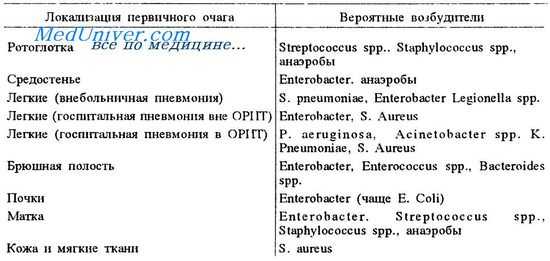
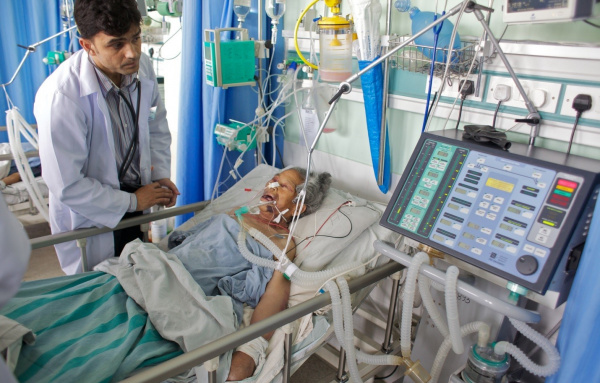
Сепсис (заражение крови) – вторичное инфекционное заболевание, вызванное попаданием патогенной флоры из первичного локального инфекционного очага в кровяное русло. Сегодня ежегодно в мире диагностируется от 750 до 1,5 млн. случаев сепсиса. По статистике, чаще всего сепсисом осложняются абдоминальные, легочные и урогенитальные инфекции, поэтому данная проблема наиболее актуальная для общей хирургии, пульмонологии, урологии, гинекологии. В рамках педиатрии изучаются проблемы, связанные с сепсисом новорожденных. Несмотря на использование современных антибактериальных и химиотерапевтических препаратов, летальность от сепсиса остается на стабильно высоком уровне – 30-50%.
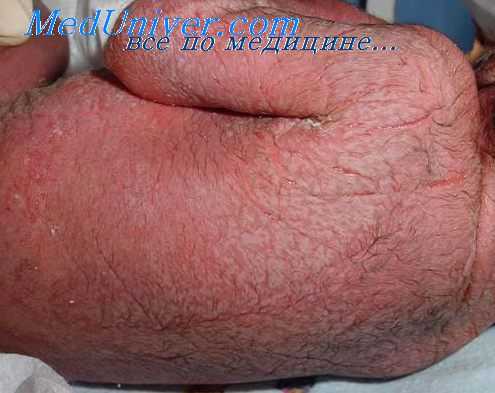
Причины сепсиса
Важнейшими факторами, приводящими к срыву противоинфекционной резистентности и развитию сепсиса, выступают:
- со стороны макроорганизма - наличие септического очага, периодически или постоянно связанного с кровяным или лимфатическим руслом; нарушенная реактивность организма
- со стороны инфекционного возбудителя – качественные и количественные свойства (массивность, вирулентность, генерализация по крови или лимфе)
Ведущая этиологическая роль в развитии большинства случаев сепсиса принадлежит стафилококкам, стрептококкам, энтерококкам, менингококкам, грамотрицательной флоре (синегнойной палочке, кишечной палочке, протею, клебсиелле, энтеробактер), в меньшей степени - грибковым возбудителям (кандидам, аспергиллам, актиномицетам).
Выявление в крови полимикробных ассоциаций в 2,5 раза увеличивает уровень летальности больных сепсисом. Возбудители могут попадать в кровь из окружающей среды или заноситься из очагов первичной гнойной инфекции.
Велико значение внутрибольничной инфекции: ее росту способствует широкое применение инвазивных диагностических процедур, иммуносупрессивных лекарственных препаратов (глюкокортикоидов, цитостатиков). В условиях иммунодефицита, на фоне травмы, операционного стресса или острой кровопотери инфекция из хронических очагов беспрепятственно распространяется по организму, вызывая сепсис. Развитию сепсиса более подвержены недоношенные дети, больные, длительно находящиеся на ИВЛ, гемодиализе; онкологические, гематологические пациенты; больные сахарным диабетом, ВИЧ-инфекцией, первичными и вторичными иммунодефицитами.
Механизм развития сепсиса многоступенчатый и очень сложный. Из первичного инфекционного очага патогены и их токсины проникают в кровь или лимфу, обуславливая развитие бактериемии. Это вызывает активацию иммунной системы, которая реагирует выбросом эндогенных веществ (интерлейкинов, фактора некроза опухолей, простагландинов, фактора активации тромбоцитов, эндотелинов и др.), вызывающих повреждение эндотелия сосудистой стенки. В свою очередь, под воздействием медиаторов воспаления активизируется каскад коагуляции, что в конечном итоге приводит к возникновению ДВС-синдрома. Кроме этого, под влиянием высвобождающихся токсических кислородсодержащих продуктов (оксида азота, перекиси водорода, супероксидов) снижается перфузия, а также утилизация кислорода органами. Закономерным итогом при сепсисе является тканевая гипоксия и органная недостаточность.

Формы сепсиса классифицируются в зависимости от локализации первичного инфекционного очага. На основании этого признака различают первичный (криптогенный, эссенциальный, идиопатический) и вторичный сепсис. При первичном сепсисе входные ворота обнаружить не удается. Вторичный септический процесс подразделяется на:
- хирургический – развивается при заносе инфекции в кровь из послеоперационной раны
- акушерско-гинекологический – возникает после осложненных абортов и родов
- уросепсис – характеризуется наличием входных ворот в отделах мочеполового аппарата (пиелонефрит, цистит, простатит)
- кожный – источником инфекции служат гнойные заболевания кожи и поврежденные кожные покровы (фурункулы, абсцессы, ожоги, инфицированные раны и др.)
- перитонеальный (в т. ч. билиарный, кишечный) – с локализацией первичных очагов в брюшной полости
- плевро-легочный – развивается на фоне гнойных заболеваний легких (абсцедирующей пневмонии, эмпиемы плевры и др.)
- одонтогенный– обусловлен заболеваниями зубочелюстной системы (кариесом, корневыми гранулемами, апикальным периодонтитом, периоститом, околочелюстными флегмонами, остеомиелитом челюстей)
- тонзиллогенный – возникает на фоне тяжелых ангин, вызванных стрептококками или стафилококками
- риногенный – развивается вследствие распространения инфекции из полости носа и придаточных пазух, обычно при синуситах
- отогенный - связан с воспалительными заболеваниями уха, чаще гнойным средним отитом.
- пупочный– встречается при омфалите новорожденных
По времени возникновения сепсис подразделяется на ранний (возникает в течение 2-х недель с момента появления первичного септического очага) и поздний (возникает позднее двухнедельного срока). По темпам развития сепсис может быть молниеносным (с быстрым развитием септического шока и наступлением летального исхода в течение 1-2 суток), острым (длительностью 4 недели), подострым (3-4 месяца), рецидивирующим (продолжительностью до 6 месяцев с чередованием затуханий и обострений) и хроническим (продолжительностью более года).
Сепсис в своем развитии проходит три фазы: токсемии, септицемии и септикопиемии. Фаза токсемии характеризуется развитием системного воспалительного ответа вследствие начала распространения микробных экзотоксинов из первичного очага инфекции; в этой фазе бактериемия отсутствует. Септицемия знаменуется диссеминацией возбудителей, развитием множественных вторичных септических очагов в виде микротромбов в микроциркуляторном русле; наблюдается стойкая бактериемия. Для фазы септикопиемии характерно образование вторичных метастатических гнойных очагов в органах и костной системе.
Симптомы сепсиса
Симптоматика сепсиса крайне полиморфна, зависит от этиологической формы и течения заболевания. Основные проявления обусловлены общей интоксикацией, полиорганными нарушениями и локализацией метастазов.
Состояние больного сепсисом быстро утяжеляется. Кожные покровы приобретают бледновато-серый (иногда желтушный) цвет, черты лица заостряются. Могут возникать герпетические высыпания на губах, гнойнички или геморрагические высыпания на коже, кровоизлияния в конъюнктиву и слизистые оболочки. При остром течении сепсиса у больных быстро возникают пролежни, нарастает обезвоживание и истощение.
В условиях интоксикации и тканевой гипоксии при сепсисе развиваются полиорганные изменения различной степени тяжести. На фоне лихорадки отчетливо выражены признаки нарушения функций ЦНС, характеризующиеся заторможенностью или возбуждением, сонливостью или бессонницей, головными болями, инфекционными психозами и комой. Сердечно-сосудистые нарушения представлены артериальной гипотонией, ослаблением пульса, тахикардией, глухостью сердечных тонов. На этом этапе сепсис может осложниться токсическим миокардитом, кардиомиопатией, острой сердечно-сосудистой недостаточностью.
На происходящие в организме патологические процессы дыхательная система реагирует развитием тахипноэ, инфаркта легкого, респираторного дистресс-синдрома, дыхательной недостаточности. Со стороны органов ЖКТ отмечается анорексия, возникновение «септических поносов», чередующихся с запорами, гепатомегалии, токсического гепатита. Нарушение функции мочевыделительной системы при сепсисе выражается в развитии олигурии, азотемии, токсического нефрита, ОПН.
В первичном очаге инфекции при сепсисе также происходят характерные изменения. Заживление ран замедляется; грануляции становятся вялыми, бледными, кровоточащими. Дно раны покрывается грязно-сероватым налетом и участками некрозов. Отделяемое приобретает мутный цвет и зловонный запах.
Метастатические очаги при сепсисе могут выявляться в различных органах и тканях, что обусловливает наслоение дополнительной симптоматики, свойственной гнойно-септическому процессу данной локализации. Следствием заноса инфекции в легкие служит развитие пневмонии, гнойного плеврита, абсцессов и гангрены легкого. При метастазах в почки возникают пиелиты, паранефриты. Появление вторичных гнойных очагов в опорно-двигательной системе сопровождается явлениями остеомиелита и артрита. При поражении головного мозга отмечается возникновение церебральных абсцессов и гнойного менингита. Возможно наличие метастазов гнойной инфекции в сердце (перикардит, эндокардит), мышцах или подкожной жировой клетчатке (абсцессы мягких тканей), органах брюшной полости (абсцессы печени и др.).
Осложнения сепсиса
Основные осложнения сепсиса связаны с полиорганной недостаточностью (почечной, надпочечниковой, дыхательной, сердечно-сосудистой) и ДВС-синдромом (кровотечения, тромбоэмболии).
Тяжелейшей специфической формой сепсиса является септический (инфекционно-токсический, эндотоксический) шок. Он чаще развивается при сепсисе, вызванном стафилококком и грамотрицательной флорой. Предвестниками септического шока служат дезориентация больного, видимая одышка и нарушение сознания. Быстро нарастают расстройства кровообращения и тканевого обмена. Характерны акроцианоз на фоне бледных кожных покровов, тахипноэ, гипертермия, критическое падение АД, олигурия, учащение пульса до 120-160 уд. в минуту, аритмия. Летальность при развитии септического шока достигает 90%.

Диагностика сепсиса
Распознавание сепсиса основывается на клинических критериях (инфекционно-токсической симптоматике, наличии известного первичного очага и вторичных гнойных метастазов), а также лабораторных показателях (посев крови на стерильность).
Вместе с тем, следует учитывать, что кратковременная бактериемия возможна и при других инфекционных заболеваниях, а посевы крови при сепсисе (особенно на фоне проводимой антибиотикотерапии) в 20-30% случаев бывают отрицательными. Поэтому посев крови на аэробные и анаэробные бактерии необходимо проводить минимум трехкратно и желательно на высоте лихорадочного приступа. Также производится бакпосев содержимого гнойного очага. В качестве экспресс-метода выделения ДНК возбудителя сепсиса используется ПЦР. В периферической крови отмечается нарастание гипохромной анемии, ускорение СОЭ, лейкоцитоз со сдвигом влево.
Дифференцировать сепсис необходимо от лимфогранулематоза, лейкемии, брюшного тифа, паратифов А и В, бруцеллеза, туберкулеза, малярии и других заболеваний, сопровождающихся длительной лихорадкой.
Лечение сепсиса
Пациенты с сепсисом госпитализируются в отделение интенсивной терапии. Комплекс лечебных мероприятий включает в себя антибактериальную, дезинтоксикационную, симптоматическую терапию, иммунотерапию, устранение белковых и водно-электролитных нарушений, восстановление функций органов.
С целью устранения источника инфекции, поддерживающего течение сепсиса, проводится хирургическое лечение. Оно может заключаться во вскрытии и дренировании гнойного очага, выполнении некрэктомии, вскрытии гнойных карманов и внутрикостных гнойников, санации полостей (при абсцессе мягких тканей, флегмоне, остеомиелите, перитоните и др.). В некоторых случаях может потребоваться резекция или удаление органа вместе с гнойником (например, при абсцессе легкого или селезенки, карбункуле почки, пиосальпинксе, гнойном эндометрите и др.).
Борьба с микробной флорой предполагает назначение интенсивного курса антибиотикотерапии, проточное промывание дренажей, местное введение антисептиков и антибиотиков. До получения посева с антибиотикочувствительностью терапию начинают эмпирически; после верификации возбудителя при необходимости производится смена противомикробного препарата. При сепсисе для проведения эмпирической терапии обычно используются цефалоспорины, фторхинолоны, карбапенемы, различные комбинации препаратов. При кандидосепсисе этиотропное лечение проводится амфотерицином В, флуконазолом, каспофунгином. Антибиотикотерапия продолжается в течение 1-2 недель после нормализации температуры и двух отрицательных бакпосевов крови.
Дезинтоксикационная терапия при сепсисе проводится по общим принципам с использованием солевых и полиионных растворов, форсированного диуреза. С целью коррекции КОС используются электролитные инфузионные растворы; для восстановления белкового баланса вводятся аминокислотные смеси, альбумин, донорская плазма. Для борьбы с бактериемией при сепсисе широко используются процедуры экстракорпоральной детоксикации: плазмаферез, гемосорбция, гемофильтрация. При развитии почечной недостаточности применяется гемодиализ.
Иммунотерапия предполагает использование антистафилококковой плазмы и гамма-глобулина, переливание лейкоцитарной массы, назначение иммуностимуляторов. В качестве симптоматических средств используются сердечно-сосудистые препараты, анальгетики, антикоагулянты и др. Интенсивная медикаментозная терапия при сепсисе проводится до стойкого улучшения состояния больного и нормализации показателей гомеостаза.
Исход сепсиса определяется вирулентностью микрофлоры, общим состоянием организма, своевременностью и адекватностью проводимой терапии. К развитию осложнений и неблагоприятному прогнозу предрасположены больные пожилого возраста, с сопутствующими общими заболеваниями, иммунодефицитами. При различных видах сепсиса летальность составляет 15-50%. При развитии септического шока вероятность летального исхода крайне высока.
Профилактические меры в отношении сепсиса состоят в устранении очагов гнойной инфекции; правильном ведении ожогов, ран, локальных инфекционно-воспалительных процессов; соблюдении асептики и антисептики при выполнении лечебно-диагностических манипуляций и операций; предупреждении госпитальной инфекции; проведении вакцинации (против пневмококковой, менингококковой инфекции и др.).
Акушерский сепсис ( Родильная горячка )
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
Акушерский сепсис (родильная горячка) – угрожающее жизни состояние, характеризующееся нарушениями гемодинамики, метаболизма, свертывания крови, полиорганной недостаточностью и возникающее в ответ на инфекционное воспаление в половых и мочевыделительных органах, а также в молочной железе в гестационном, родовом и послеродовом периодах. Устаревший синоним сепсиса «заражение крови» ныне неактуален: проникновение инфекционного агента в кровь не является обязательным условием развития септического процесса – бактериемия регистрируется только у 50% больных. Сепсис развивается у одной из 5000 беременных и родящих и сопровождается септическим шоком в 10% случаев, доля заболевания в структуре материнской смертности составляет 12%. В 44% случаев сепсис регистрируется на этапе беременности (с равномерным распределением по периодам гестации), в 10% - в родах, в 46% - в послеродовом периоде.
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
При отсутствии лечения нарастает интоксикация организма и развивается тяжёлая форма с шоковым синдромом. В ранней («тёплой») фазе прогрессирует слабость, отмечается головокружение. Одновременно до нормы или субфебрильных величин снижается температура, нарастает тахикардия. Слизистые оболочки и ногтевые ложа приобретают синюшный оттенок, кожные покровы гиперемированы. Наблюдается возбуждение, сознание может быть ясным или спутанным, нередки психозы, галлюцинации. Средняя продолжительность ранней стадии составляет 5-8 часов, реже – до двух суток. В случае грамотрицательной инфекции эта фаза может длиться несколько минут.
Поздняя («холодная») стадия знаменуется усилением или ослаблением сердцебиения с переходом в брадикардию, падением температуры ниже нормы, значительным затруднением дыхания. Беспокойство и возбуждение усиливается, затем сменяется адинамией, сознание затемняется. Кожа приобретает землистый оттенок, покрывается липким холодным потом, на ногах проступает цианотично-мраморный рисунок, особенно выраженный в области колен. Развивается олигурия, иногда появляется желтуха.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Читайте также:
- Кожа пациента. Придатки кожи пациента
- Обследование при сердечной недостаточности. Гемодинамика при острой сердечной недостаточности.
- Зависимость секреции почками протонов. Механизмы секреции протонов в почечных канальцах
- Принципы лечения повреждений SLAP плечевого сустава
- Лечение отравления ветеринарными препаратами
