Синдром длительного сдавливания. Плазмаферез при синдроме длительного сдавливания
Добавил пользователь Alex Обновлено: 27.01.2026
Синдром длительного сдавливания (СДС) или краш-сивдром развивается вследствие длительной компрессии мягких тканей и характеризуется сложным патогенезом.
Особенно тяжелые патогенетические изменения в процессе компрессии происходят в тканях, подвергающихся непосредственному сдавливанию, а также в тканях находящихся дистальнее от места приложения сдавливающей силы.
В этих тканях, как правило, почти полностью отсутствуют гемоциркуляция и отток лимфы. В условиях продолжительной ишемии очень быстро истощаются возможности анаэробного типа тканевого дыхания, происходит накопление недоокисленных продуктов обмена, главным образом, молочной и пировиноградной кислот, развивается метаболический ацидоз. Затруднение притока артериальной крови ведет к нарушению микроциркуляции. Развиваются признаки повышенной свертываемости крови в капиллярах.
Спустя 4—6 ч от начала компрессии в месте приложения сдавливающего фактора и дистальнее него в тканях наступают процессы деструкции вплоть до их распада. Наблюдается распространенный ко- ликвационный некроз мышечных волокон по дискоидному типу, проявляющийся резкой релаксацией волокон с лизисом инотро- пных дисков, деструкцией внутриклеточных мембран и цитолеммы. Степень дегенеративно-некротических изменений в тканях и скорость их развития зависят от силы сдавливания и времени воздействия сдавливающего фактора.
Общие изменения, характерные для синдрома длительного сдавливания, сводятся к снижению гемоперфузии, тканевой и органной гипоксии. Под влиянием нервно-рефлекторных и нейрогумо- ральных механизмов возникает выраженный прекапиллярный стаз в коже, скелетной мускулатуре, органах живота, забрюшинном пространстве. В межклеточных пространствах накапливаются недооки- сленные продукты обмена, вазоактивные вещества. Повышается свертывающая активность крови. Уменьшается объем циркулирующей крови и плазмы.
Выделяют четыре основные причины возникновения эндотоксикоза при синдроме длительного сдавливания:
• задержка в организме конечных продуктов метаболизма;
• избыточное накопление промежуточных продуктов метаболизма;
• всасывание продуктов распада тканей;
Ведущую роль при этом играет метаболический эндотоксикоз. Токсемия служит основной причиной необратимых изменений в организме пострадавшего, вплоть до летального исхода. Пиком токсического воздействия является декомпенсация пострадавших тканей.
Из разрушенных при раздавливании тканей в общий кровоток поступают такие биологически активные вещества, как лизосо- мальные ферменты, гепарин, серотонин, гистамин, тканевый фактор и фактор некроза опухоли, крупные полипептиды, обладающие высоким токсическим действием. Основным источником токсемии считают поврежденную мышечную ткань, при распаде которой образуется значительное количество ионов калия, неорганического фосфора, белков, компонентов остаточного азота, гистамина. Токсическими свойствами обладает миоглобин (высокомолекулярное соединение — 16700 Дальтон), выделяющийся из разрушенных мышечных волокон. В кислой среде миоглобин выпадает в осадок в виде солянокислого миоптобина. Это соединение может блокировать почечные канальцы, провоцируя возникновение острой почечной недостаточности.
В генезе эндотоксикоза при СДС большое значение также имеют токсины средней молекулярной массы, обладающие высокой биологической активностью и оказывающие угнетающее действие на основные физиологические и биологические процессы организма. В зависимости от тяжести поражения уровень среднемолекулярных токсинов при СДС возрастает более чем в два раза.
Кроме того, выраженные токсические свойства имеют продукты нарушенного свободнорадикального окисления липидов, возникающего в условиях ишемии при СДС.
Особое значение в патогенезе СДС придают нарушению сосудистой проницаемости, в результате которого происходит массивная потеря плазмы, нередко являющаяся причиной гибели пострадавшего.
После освобождения тканей от компрессии в общий кровоток поступают токсичные продукты из поврежденных тканей, которые вместе с вазоактивными веществами и протеолитически- ми ферментами оказывают повреждающее воздействие на эндотелий микроциркуляторного русла и форменные элементы крови. Активируется гемокоагуляция за счет тромбопластина, выделяемого поврежденными тканями и форменными элементами. Возрастает риск развития ДВС-синдрома. В крови появляются частички дезэмульгированного жира, что тоже усугубляет расстройства микроциркуляции, гемокоагуляции, ведет к блокаде легочных капилляров. Развивается прогрессирующая тканевая гипоксия, вплоть до гибели клеток мозга, легких, печени, почек, кардиомиофибрилл. Возникает угроза развития поли- ортанной недостаточности.
Полиорганные изменения при СДС начинают формироваться уже в раннем его периоде, до наступления декомпрессии. При этом существенную роль играют нарушения центральной гемодинамики и регионарного кровотока. Выраженность начальных полиорганных изменений зависит от продолжительности сдавливания и масштабов повреждения мягких тканей.
Восстановление кровотока в ишемизированном сегменте приводит к резкому нарастанию эндотоксикоза и ухудшению функции органов и систем, особенно сердца, печени, почек. Вторичный иммунодефицит создает условия для развития гнойно-септических осложнений. Таким образом, тяжесть полиорганных расстройств, особенно печеночно-почечных, определяет не только характер течения СДС, но и его исход.
Патогенетическое лечение СДС требует устранения первичных источников интоксикации, ликвидации токсемии и коррекции тканевого метаболизма. Одним из наиболее важных направлений в терапии СДС является профилактика осложнений и борьба с эндогенной интоксикацией, обусловленной поступлением в кровеносное русло из поврежденных, ишемизированных тканей продуктов аутолиза и других токсических веществ.
Комплекс различных методов экстракорпоральной детоксикации занимает в лечении СДС одно из ведуцих мест.
При этом большое значение имеет своевременность проведения детоксикации еще до наступления выраженных структурных изменений в жизненно важных органах.
Комплекс детоксикационных мероприятий должен проводиться с учетом состояния пострадавшего, характера повреждения, времени, прошедшего с момента травмы, длительности сдавливания, степени кровопотери и обезвоживания организма, выраженности токсемии, наличия гнойно-септических и других осложнений.
При проведении детоксикации у пострадавших с умеренными проявлениями токсемии без признаков печеночно-почечной недостаточности можно ограничиться консервативными методами. К ним относят управляемую гемодилюцию и стимуляцию диуреза, проводимые на фоне интенсивной инфузионной и ге мок вантовой терапии (ультрафиолетового облучения крови) и сеансов гипербари- ческой оксигенации.
У пострадавших с СДС средней степени тяжести и явными признаками эндогенной интоксикации, но с сохраненными функциями печени и почек методом выбора является обменный плазмаферез.
Проведение ПФ позволяет предупредить развитие полиорганной дисфункции. Эффективность ПФ повышается при сочетании его с фильтрационными методами детоксикации, что позволяет ускорить процесс элиминации из кровеносного русла токсических веществ низкой и средней молекулярной массы.
У пострадавших с клиникой печеночно-почечной недостаточности с высоким уровнем азотемии, гиперкалиемии, миогло- бинемии, гнойной интоксикации, трудно корригируемыми нарушениями кислотно-основного состояния, гипергидратацией показаны различные методы заместительной почечной терапии в сочетании с обменным плазмаферезом. Могут бьггь эффективны ультрафильтрация с последующим плазмаферезом или гемосорбцией или ПФ с последующей гемосорбцией и гемодиализом. При выраженной гипергицратации показана ультрафилырация. А затем гемофильтрация, гемосорбция или гемодиализ. В случае развернутой картины ПОН показаны гемодиафильтрация или гемодиализ с гемосорбцией. Возможно использование лимфогенных методов детоксикации (лимфосорбция, лимфодиализ, ультрафиолетовое облучение лимфы).
Плазмаферез зарекомендовал себя как один из наиболее эффективных методов детоксикации при СДС. Он позволяет в достаточно короткие сроки удалить плазму больного со всеми содержащимися в ней токсическими субстратами и предотвратить развитие полиорганных расстройств. Плазмаферез рекомендуется практически всем пациентам с СДС в ранние сроки после декомпрессии пораженной конечности. Основные показания к ПФ при краш-синдроме можно сформулировать следующим образом:
• высокое содержание миоглобина в жидких средах организма.
В отношении последнего следует исходить из того, что миоглобинурия появляется тогда, когда содержание свободного миоглобина в крови превышает 30 мг/л. Таким образом, уровень миоглобина в крови, близкий к этому значению, является показанием к обязательному началу эфферентной терапии, а именно — плазмаферезу.
Проведению ПФ должны предшествовать мероприятия, направленные на стабилизацию гемодинамики, коррекцию электролитного баланса, кислотно-основного баланса.
Адекватное проведение сеансов ПФ приводит к выраженному эффекту. Отмечается улучшение самочувствия, снижение температуры тела, частоты сердечных сокращений, частоты дыхания. Снижается токсичность плазмы на 30—65 %, в том числе токсинов средней молекулярной массы. Отмечается улучшение показателей лейкоцитарной формулы, снижается СОЭ, улучшается функциональная активность гуморальных звеньев иммунитета. Удаление из кровяного русла свободного миоглобина способствует коррекции энцефалопатии, улучшению диуретической функции почек.
В ряде случаев ранний ПФ позволяет предупредить развитие острой почечной недостаточности. Это происходит за счет уменьшения воздействия токсических веществ на канальцевый аппарат почек, улучшения почечного кровотока, особенно в микроциркулятор- ном русле. У некоторой категории больных проведение ПФ способствует переходу стадии ал игурии сразу в стадию полиурии, минуя клинически тяжелую стадию анурии.
Если ПФ начать в первые сутки по- сле устранения сдавливающего фактора, то количество показаний к гемодиализу существенно снизится.
ПФ имеет важное значение для профилактики и лечения ДВС- синдрома, который также может быть осложнением СДС. На фоне ПФ происходит удаление из плазмы крупнодисперсных комплексов тканевого распада, удаляется фактор агрегации тромбоцитов, активируется фибринолиз, снижается содержание фибриногена уменьшается вязкость крови.
ПФ способствует нормализации детоксикационной и белковосинтетической функций печени.
ПФ пострадавшим от СДС также следует выполнять в режиме плазмообмена, замещая удаляемую плазму свежезамороженной донорской. Для сохранения собственных белков организма ПФ целесообразно сочетать с плазмасорбцией. При этом в каждом литре сепарированной плазмы содержится 60—80 г белка и только 1 г токсических веществ. Для более полного удаления токсичных веществ у больных СДС ПФ можно сочетать с гемосорбцией и заместительной почечной терапией. Интервал между процедурами должен составлять 6—24 ч, что обусловлено выбросом токсичных веществ из поврежденных тканей.
Длительная компрессия мягких тканей у больных в коматозном состоянии является предрасполагающим фактором для возникновения сицдрома позиционного сдавливания (СПС). Это один из частных вариантов синдрома д лительного сдавливания, развивающийся в основном у пациентов, находящихся в состоянии глубокой наркотической, алкогольной или смешанной интоксикации. Развивающийся при СПС отек мягких тканей, с последующей деструкцией миофибрилл и выходом в микроциркуляторное русло миоглоби- на, может приводить к острой почечной недостаточности (ОПН).
Почти в 80 % случаев к ОПН присоединяется печеночная, сердечно-сосудистая и легочная дисфункции. Течение заболевания осложняется имеющимися в анамнезе алкогольным (у 50 % больных) или вирусным гепатитом (у 30 %). Водно-электролитные нарушения при СПС характеризуются гипергидратацией легких II—III степени и гиперкалиемией.
В качестве меры профилактики ОПН на ранних этапах лечения синдрома позиционного сдавливания также рекомендуется мембранный или гравитационный плазмаферез. Если экстракорпоральная терапия начата при сформировавшейся клинике ОПН, используются методы заместительной почечной терапии и плазмосорбция.
Для максимального снижения миоглобинемии и эндотоксикоза целесообразна следующая схема ЭКД: у всех больных с синдромом позиционного сдавливания: в первый день следует выполнять плазмаферез или плазмаферез в сочетании с плазмосорб- цией, затем для максимального удаления токсинов низкой и средней молекулярной массы — ГДФ и ГД. У пациентов с клиникой ОПН уже с первых суток следует прибегнуть к ГД или ГДФ. Такие меры позволяют эффективно уменьшить интоксикацию, корригировать КЩС, проводить адекватную инфузион- но-трансфузионную терапию и парентеральное питание; в результате вероятность развития ОПН существенно снижается, ускоряется процесс выздоровления. Таким образом, раннее использование ПФ является оптимальным решением проблемы ЭК терапии как при синдроме длительного сдавливания, так и при позиционном сдавливании тканей.
Синдром длительного сдавливания. Плазмаферез при синдроме длительного сдавливания
Синдром длительного сдавливания. Плазмаферез при синдроме длительного сдавливания
Синдром длительного сдавливания (СДС) или краш-синдром развивается вследствие длительной компрессии мягких тканей и характеризуется сложным патогенезом.
Особенно тяжелые патогенетические изменения в процессе компрессии происходят в тканях, подвергающихся непосредственному сдавливанию, а также в тканях находящихся дистальнее от места приложения сдавливающей силы. В этих тканях, как правило, почти полностью отсутствуют гемоциркуляция и отток лимфы. В условиях продолжительной ишемии очень быстро истощаются возможности анаэробного типа тканевого дыхания, происходит накопление недоокисленных продуктов обмена, главным образом, молочной и пировиноградной кислот, развивается метаболический ацидоз. Затруднение притока артериальной крови ведет к нарушению микроциркуляции. Развиваются признаки повышенной свертываемости крови в капиллярах.
Спустя 4—6 ч от начала компрессии в месте приложения сдавливающего фактора и дистальнее него в тканях наступают процессы деструкции вплоть до их распада. Наблюдается распространенный коликвационный некроз мышечных волокон по дискоидному типу, проявляющийся резкой релаксацией волокон с лизисом инотропных дисков, деструкцией внутриклеточных мембран и цитолеммы. Степень дегенеративно-некротических изменений в тканях и скорость их развития зависят от силы сдавливания и времени воздействия сдавливающего фактора.
Общие изменения, характерные для синдрома длительного сдавливания, сводятся к снижению гемоперфузии, тканевой и органной гипоксии. Под влиянием нервно-рефлекторных и нейрогуморальных механизмов возникает выраженный прекапиллярный стаз в коже, скелетной мускулатуре, органах живота, забрюшинном пространстве. В межклеточных пространствах накапливаются недоокисленные продукты обмена, вазоактивные вещества. Повышается свертывающая активность крови. Уменьшается объем циркулирующей крови и плазмы. Скорость кровотока в магистральных сосудах снижается вдвое.
Выделяют четыре основные причины возникновения эндотоксикоза при синдроме длительного сдавливания:
• задержка в организме конечных продуктов метаболизма;
• избыточное накопление промежуточных продуктов метаболизма;
• всасывание продуктов распада тканей;
• микробный токсикоз.
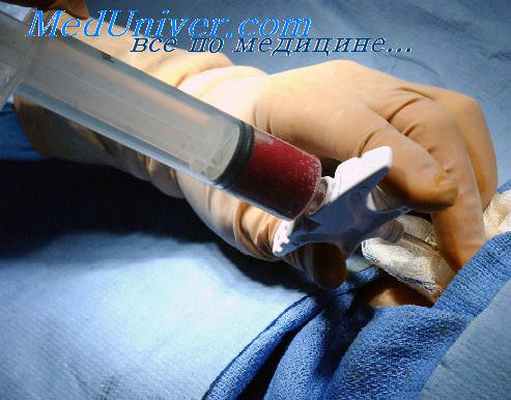
Ведущую роль при этом играет метаболический эндотоксикоз. Токсемия служит основной причиной необратимых изменений в организме пострадавшего, вплоть до летального исхода. Пиком токсического воздействия является декомпенсация пострадавших тканей.
Из разрушенных при раздавливании тканей в общий кровоток поступают такие биологически активные вещества, как лизосо-мальные ферменты, гепарин, серотонин, гистамин, тканевый фактор и фактор некроза опухоли, крупные полипептиды, обладающие высоким токсическим действием. Основным источником токсемии считают поврежденную мышечную ткань, при распаде которой образуется значительное количество ионов калия, неорганического фосфора, белков, компонентов остаточного азота, гистамина. Токсическими свойствами обладает миоглобин (высокомолекулярное соединение — 16700 Дальтон), вьщеляющийся из разрушенных мышечных волокон. В кислой среде миоглобин выпадает в осадок в виде солянокислого миоглобина. Это соединение может блокировать почечные канальцы, провоцируя возникновение острой почечной недостаточности.
В генезе эндотоксикоза при синдроме длительного сдавливания большое значение также имеют токсины средней молекулярной массы, обладающие высокой биологической активностью и оказывающие угнетающее действие на основные физиологические и биологические процессы организма. В зависимости от тяжести поражения уровень среднемолекулярных токсинов при СДС возрастает более чем в два раза.
Кроме того, выраженные токсические свойства имеют продукты трушенного свободнорадикального окисления лшгидов, возникающего в условиях ишемии при СДС.
Особое значение в патогенезе синдрома длительного сдавливания придают нарушению сосудистой проницаемости, в результате которого происходит массивная потеря плазмы, нередко являющаяся причиной гибели пострадавшего.
После освобождения тканей от компрессии в общий кровоток поступают токсичные продукты из поврежденных тканей, которые вместе с вазоактивными веществами и протеолитическими ферментами оказывают повреждающее воздействие на эндотелий микроциркуляторного русла и форменные элементы крови. Активируется гемокоагуляция за счет тромбопластина, выделяемого поврежденными тканями и форменными элементами. Возрастает риск развития ДВС-синдрома. В крови появляются частички дезэмульгированного жира, что тоже усугубляет расстройства микроциркуляции, гемокоагуляции, ведет к блокаде легочных капилляров. Развивается прогрессирующая тканевая гипоксия, вплоть до гибели клеток мозга, легких, печени, почек, кардиомиофибрилл. Возникает угроза развития полиорганной недостаточности.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром длительного сдавления

Синдром длительного сдавления (СДС) – это тяжёлое патологическое состояние, возникающее в результате закрытого повреждения больших участков мягких тканей под влиянием большой и/или длительно действующей механической силы, сопровождающийся комплексом специфических патологических расстройств (шок, нарушения сердечного ритма, острого повреждения почек, компартмент-синдром), чаще всего в конечностях на срок более 2 часов.
Впервые СДС был описан Пироговым Н. И. в 1865 году в «Началах общей военно-полевой хирургии» как «местная асфиксия» и «токсическое напряжение тканей». Особое внимание привлек к себе СДС во время Второй мировой войны. В 1941 году английские учёные Bywaters Е. и Beall D. , принимая участие в лечении жертв бомбардировок Лондона немецкой авиацией, выделили этот синдром в отдельную нозологическую единицу. У жителей Лондона, пострадавших от фашистских бомбардировок, СДС регистрировался в 3, 5-5% случаев и сопровождался высокой летальностью. В 1944 году Bywaters Е. и Beall D. определили, что миоглобин играет ведущую роль в развитии почечной недостаточности.
В отечественной литературе СДС впервые под названием «синдром размозжения и травматического сжатия конечностей» описал в 1945 году Пытель А. Я. На основании материалов Ашхабадского землетрясения 1948 года Еланским Н. Н. в 1950 году была подробно описана клиническая картина и лечение синдрома длительного раздавливания, и высказано мнение о ведущей роли токсикоза в развитии клинической картины.
В мирное время наиболее часто СДС возникает у пострадавших во время землетрясений и техногенных катастроф (табл. 1).
Частота развития СДС при землетрясениях
Место землетрясения, год, автор
Ашхабад, 1948 г. (Кузин М. И. )
Марокко, 1960 г. (Шутеу Ю. и соавт. )
Италия, 1980 г. (Santangeio М. et al. )
Армения, 1988 г. (Нечаев Э. А. )
Чаще всего (79, 9% случаев) СДС встречается при закрытой травме мягких тканей нижних конечностей, в 14% - при повреждении верхних и в 6, 1% - при одновременном повреждении верхних и нижних конечностей.
В таблице 2 приведены основные причины, приводящие к СДС.
Основные этиологические факторы СДС
Электротравма, ожоги, отморожения, тяжёлая сочетанная травма
Синдром позиционного сдавления, «турникетный синдром», тромбоз, артериальная эмболия
Гипоксический (перенапряжение и выраженная гипоксия мышечной ткани)
Избыточные физические нагрузки, «маршевая миоглобинурия», столбняк, судороги, озноб, эпилептический статус, белая горячка
Пиомиозит, сепсис, бактериальные и вирусные миозиты
Гипокалиемия, гипофосфатемия, гипокальциемия, гиперосмолярность, гипотиреоз, сахарный диабет
Укусы змей и насекомых, лекарственная токсичность (амфетамин, барбитураты, кодеин, колхицин, комбинация «ловастатин–итраконазол», комбинация циклоспорин–симвастатин), героин, N, N-диэтиламид лизергиновой кислоты, метадон
Болезнь МакАрдла (нехватка фосфорилазы в мышечной ткани), болезнь Таруи (отсутствие фосфофруктокмазы)
В результате сдавления тканей происходит нарушение кровотока в сосудах и накопление продуктов жизнедеятельности тканей. После восстановления кровотока продукты клеточного распада (миоглобин, гистомин, серотонин, олиго– и полипептиды, калий) начинают поступать в системный кровоток. Патологические продукты активируют свёртывающую систему крови, что приводит к развитию ДВС-синдрома. Необходимо отметить, что ещё одним повреждающим фактором является депонирование воды в повреждённых тканях и развитие гиповолемического шока. Высокая концентрация миоглобина в почечных канальцах в условиях кислой среды приводит к формированию нерастворимых глобул, вызывающих внутриканальцевую обструкцию и острый канальцевый некроз.
В результате гиповолемии, ДВС-синдрома, поступающих в кровоток продуктов цитолиза, в частности миоглобина, развивается полиорганная недостаточность, ведущее место в которой занимает острое повреждение почек (ОПП).
В зависимости от обширности и длительности сдавления тканей выделяют три степени тяжести течения СДС (табл. 3).
Классификация СДС по степени тяжести
Область сдавления конечности
СДС лёгкой степени
Небольшая (предплечье или голень)
Не более 2-3 часов
Эндогенная интоксикация незначительная, олигурия устраняется через несколько суток
СДС средней тяжести
Более обширные участки сдавления (бедро, плечо)
От 2-3-х до 6 часов
Умеренный эндотоксикоз и ОПП в течение недели и более после травмы
Определяется сроками и качеством первой помощи и лечения с ранним применением экстракорпоральной детоксикации
СДС тяжелой степени
Сдавление одной или двух конечностей
Быстро нарастает тяжёлая эндогенная интоксикация, развивается полиорганная недостаточность, включая ОПП
При отсутствии своевременного интенсивного лечения с использованием гемодиализа прогноз неблагоприятен
Клиническая картина СДС имеет чёткую периодичность.
Первый период (от 24 до 48 часов после освобождения от сдавления) характеризуется развитием отёка тканей, гиповолемическим шоком и болевым синдромом.
В третьем периоде (с 3-4 недели заболевания) наблюдаются клинические проявления полиорганной недостаточности, включающие ОПП, острое повреждение лёгких, сердечную недостаточность, ДВС-синдром и желудочно-кишечное кровотечение. В данный период возможно присоединение гнойной инфекции, что может привести к развитию сепсиса и летальному исходу.
Завершается СДС периодом реконвалесценции и восстановлением утраченных функций. Данный период начинается с непродолжительной полиурии, что свидетельствует о разрешении ОПП. Постепенно восстанавливается гомеостаз.
Диагностика СДС основывается на анамнестических и клинико-лабораторных данных.
Лабораторные признаки СДС складываются из повышения уровня креатинфосфокиназы, метаболического ацидоза, гиперфосфатемии, мочевой кислоты и миоглобина. Доказательством тяжёлого повреждения почек является кислая реакция мочи, появление крови в моче (макрогематурия). Моча становится красной, её относительная плотность значительно увеличивается, определяется белок в моче. Признаками ОПП служат снижение диуреза до олигурии (суточный диурез менее 400 мл), повышение уровня мочевины, креатинина, калия сыворотки крови.
Лечебные мероприятия должны начинаться на догоспитальном этапе и включают в себя обезболивание, внутривенную инфузию жидкости, введение гепарина. Пострадавший должен быть доставлен в стационар в кратчайшие сроки. При наблюдении и лечении больных необходимо учитывать риск развития гиперкалиемии вскоре после высвобождение пострадавшей конечности, проводить тщательный мониторинг в отношении развития шока и метаболических расстройств.
В стационаре по показаниям проводится хирургическая обработка поражённых участков, включая «лампасные» разрезы с обязательным рассечением кожи, подкожной клетчатки и фасций в пределах отёчных тканей. Это необходимо для снятия вторичной компрессии поражённых тканей. В случае выявления некроза только части мышц конечности выполняется их иссечение – миэктомия. Нежизнеспособные конечности с признаками сухой или влажной гангрены, а также ишемического некроза (мышечная контрактура, полное отсутствие чувствительности, при диагностическом рассечении кожи – мышцы тёмные или наоборот обесцвеченные, желтоватые, при надрезе не сокращаются и не кровоточат) подлежат ампутации выше уровня границы сдавления, в пределах здоровых тканей.
Обязательными является проведения массивной инфузионной терапии. Инфузионная терапия направлена на коррекцию водно-электролитных нарушений, шока, метаболического ацидоза, профилактику ДВС-синдрома и уменьшения или предотвращения ОПП.
Антибактериальная терапия должна начинаться, как можно раньше и использована не только для лечения, но, прежде всего, для профилактики инфекционных осложнений. При этом необходимо исключить применение нефро- и гепатотоксичных препаратов.
Более 10% пострадавших нуждаются в проведении экстракорпоральной детоксикации. Анурия в течение суток при неэффективности консервативной терапии, гиперазотемия (мочевина более 25 ммоль/л, креатинин более 500 мкмоль/л), гиперкалиемия (более 6, 5 ммоль/л), сохраняющиеся гипергидратация и метаболический ацидоз требуют незамедлительного начала заместительной почечной терапии – гемодиализа, гемофильтрации, гемодиафильтрации. Методы заместительной почечной терапии позволяют удалять из кровотока средне- и низкомолекулярные токсические вещества, устранять нарушения кислотно-основного состояния и водно-электролитные нарушения.
В первые сутки показано проведение плазмафереза (ПФ). Согласно данным, представленным Воробьёвым П. А. (2004), ПФ показал высокую эффективность при лечении больных пострадавших в результате землетрясения в Армении в 1988 г. Проведение ПФ в первые сутки после декомпрессии позволило снизить частоту возникновения ОПП до 14, 2%. Эффективность ПФ связана с быстрым удалением миоглобина, тканевого тромбопластина и других продуктов клеточного распада.
СДС в настоящее время имеет тенденцию к росту во всём мире. Это связано, в том числе с увеличением пострадавших в результате дорожно-транспортных происшествий. Прогнозировать течение заболевания достаточно сложно, так как большинство данных поступают из очагов землетрясений и других техногенных катастроф. Согласно имеющимся данным летальность зависит от сроков начала лечения и составляет от 3 до 50%. В случае развития ОПП летальность может достигать 90%. Применение методов заместительной почечной терапии позволило снизить летальность до 60%.
Синдром длительного раздавливания
Синдром длительного раздавливания – это шокоподобное состояние, наступающее после длительного сдавления туловища, конечностей или их сегментов тяжелыми предметами. Проявляется болью, ухудшением состояния, отеком пораженных отделов тела, острой почечной недостаточностью. Без медицинской помощи пациенты погибают от ОПН, нарастающей интоксикации, легочной или сердечно-сосудистой недостаточности. Лечение включает дезинтоксикационную и плазмозаменяющую инфузионную терапию, экстракорпоральную гемокоррекцию, антибиотикотерапию, иссечение участков некроза или ампутацию раздавленной конечности.
МКБ-10
Общие сведения
Синдром длительного раздавливания (СДР), другие названия – травматический токсикоз, краш-синдром, синдром Байуотерса, миоренальный синдром – патологическое шокоподобное состояние, наступающее после длительного сдавления туловища, конечностей или их сегментов тяжелыми предметами. Краш-синдром развивается сразу после освобождения больного и восстановления крово- и лимфотока в пораженных частях тела. Сопровождается ухудшением общего состояния, развитием токсемии и острой почечной недостаточности, при большой площади поражения нередко заканчивается смертью пациента. В травматологии и ортопедии выделяют бытовую разновидность краш-синдрома – так называемый синдром позиционного сдавления (СПС), который развивается в результате длительного (более 8 часов) сдавливания частей тела во время неподвижного положения человека на твердой поверхности.
Причины СДР
Обычно синдром длительного раздавливания возникает у пострадавших во время оползней, землетрясений, обвалов в шахтах, строительных работ, дорожных аварий, заготовки леса, взрывах и разрушениях зданий в результате бомбардировки.
Синдром позиционного сдавления обычно выявляется у пациентов, которые на момент травмы находились в состоянии отравления снотворными препаратами, наркотического или алкогольного опьянения. Чаще страдают подвернутые под туловище верхние конечности. По причинам развития, симптомам и методам лечения синдром позиционного сдавления практически не отличается от синдрома длительного раздавливания, однако, обычно протекает более благоприятно вследствие меньшей площади поражения.
Патогенез
Возникновение синдрома длительного раздавливания обусловлено сочетанием трех факторов:
- болевого синдрома;
- массивной потери плазмы, обусловленной выходом жидкой части крови через стенки сосудов в поврежденные ткани;
- травматической токсемии (интоксикации организма продуктами тканевого распада).
Продолжительное болевое раздражение при краш-синдроме приводит к развитию травматического шока. Потеря плазмы становится причиной сгущения крови и вызывает тромбоз мелких сосудов. Травматическая токсемия при краш-синдроме развивается вследствие всасывания в кровь продуктов тканевого распада травмированных мышц. Сразу после освобождения конечности из поврежденных тканей в сосудистое русло поступает значительное количество ионов калия, которые могут вызвать аритмию, а в тяжелых случаях – прекращение работы легких и сердца.
В дальнейшем раздавленные мышечные ткани пациента с краш-синдромом теряют до 66% калия, 75% миоглобина, 75% фосфора и 70% креатинина. Продукты распада поступают в кровь, вызывая ацидоз и нарушения гемодинамики (в том числе – резкое сужение сосудов почечных клубочков). Миоглобин повреждает и закупоривает почечные канальцы. Все это приводит к развитию острой почечной недостаточности, угрожающей жизни больного краш-синдромом.
Классификация
По степени тяжести:
- Легкая форма краш-синдрома. Возникает при раздавливании сегментов конечности в течение 4 и менее часов.
- Среднетяжелая форма краш-синдрома. Развивается в результате раздавливания одной конечности в течение 4-6 часов. При своевременном начале лечения прогноз благоприятный.
- Тяжелая форма краш-синдрома. Возникает при раздавливании одной конечности в течение 6-8 часов. Сопровождается расстройствами гемодинамики и острой почечной недостаточностью. При своевременном начале лечения прогноз относительно благоприятный.
- Крайне тяжелая форма краш-синдрома. Развивается в результате раздавливания двух и более конечностей в течение 6 и более часов. Сопровождается тяжелым шоком. Прогноз неблагоприятный.
По клинической симптоматике:
- ранний период (с момента освобождения до 3 суток);
- токсический период (начинается на 4-5 сутки);
- период поздних осложнений (развивается, спустя 20-30 суток с момента травмы).
Симптомы СДР
Сразу после устранения сдавления общее состояние пострадавшего улучшается. Пациента с синдромом длительного раздавливания беспокоит боль и ограничение движений в раздавленной конечности. В течение первых часов после освобождения постепенно нарастает отек пострадавшего участка, который становится плотным, деревянистым. На коже конечности образуются пузыри с серозно-геморрагическим содержимым. При осмотре поврежденной части тела выявляется ослабление пульсации артерий, снижение чувствительности и местной температуры.
Нарастает общая симптоматика. Состояние пострадавшего с краш-синдромом ухудшается. После короткого периода возбуждения пациент становится вялым, заторможенным. Отмечается снижение артериального давления и температуры тела, аритмия, тахикардия, выраженная бледность кожных покровов. Кожа больного краш-синдромом покрыта липким холодным потом. Возможна потеря сознания, непроизвольная дефекация и мочеиспускание. Иногда развивается отек легких. Уменьшается количество выделяемой мочи. Без адекватной врачебной помощи есть вероятность смертельного исхода в течение 1 или 2 суток.
На раздавленной конечности формируются очаги некроза. При отторжении мертвых тканей обнажаются мышцы, имеющие характерный вид вареного мяса. Развивается нагноение ран и эрозированных поверхностей. Появляется и постепенно нарастает острая почечная недостаточность. На 5-6 сутки у больных с синдромом длительного раздавливания развивается уремический синдром. Повышение уровня калия в крови вызывает аритмию и брадикардию.
На 5-7 сутки выявляются признаки легочной недостаточности. Нарастающая интоксикация, обусловленная поступлением в кровоток продуктов тканевого распада и бактериальных токсинов из раздавленной конечности, вызывает токсический гепатит. Возможен эндотоксический шок. Явления полиорганной недостаточности у пациентов с краш-синдромом постепенно уменьшаются в течение 2-3 недель.
Острая почечная недостаточность при краш-синдроме купируется примерно через месяц после травмы. Состояние пациента улучшается, температура его тела нормализуется. Уменьшаются боли и отек конечности. Некротизированные мышцы замещаются соединительной тканью, что приводит к атрофии мышц и развитию контрактур. При неблагоприятном развитии событий возможны местные (нагноение) и общие (сепсис) осложнения.
Диагностика
Патология диагностируется врачом-травматологом на основании характерного анамнеза (продолжительного сдавливания части тела), жалоб и данных внешнего осмотра. Для оценки общего состояния назначают комплекс лабораторных анализов. Для своевременного выявления и лечения ОПН осуществляют лабораторный мониторинг функции почек.
Лечение СДР
Перед освобождением конечности на нее необходимо наложить жгут выше места повреждения. После устранения сдавления конечность туго бинтуют и фиксируют на шине. Раны и поверхностные повреждения кожи обрабатывают по общим правилам. Пациенту с синдромом длительного раздавливания вводят наркотические анальгетики. Конечность обкладывают грелками со льдом. Если это возможно, выполняют футлярную новокаиновую блокаду раздавленной конечности или паранефральную блокаду по Вишневскому. Пострадавшего срочно доставляют в стационар.
Для улучшения микроциркуляции, борьбы с шоком и острой почечной недостаточностью в стационаре проводится инфузионная терапия (под контролем диуреза и центрального венозного давления). Для детоксикации и возмещения плазмопотери пациенту с краш-синдромом вводят 5% раствор глюкозы, солевые растворы, замороженную плазму, физ. раствор и раствор альбумина. Для улучшения микроциркуляции назначают гепарин (5000 ЕД) и реополиглюкин.
В целях компенсации метаболического ацидоза больному краш-синдромом капельно вводят 4% раствора гидрокарбоната натрия. Назначают антибиотики широкого спектра действия внутримышечно. Проводят симптоматическую терапию (диуретики, анальгетики, антигистаминные и противоаритмические препараты). При синдроме длительного раздавливания экстракорпоральную гемокоррекцию (гемодиализ, плазмаферез, плазмо- и гемосорбцию) проводят в как можно более ранние сроки.
При сохранении жизнеспособности мышечных тканей и выраженном субфасциальном отеке с нарушением местного кровообращения травматолог выполняет фасциотомию с ревизией и иссечением некротизированных мышечных пучков. Если нет нагноения, рану ушивают на 3-4 день, после уменьшения отека и улучшения общего состояния больного краш-синдромом.
В случаях необратимой ишемии проводят ампутацию конечности выше места наложения жгута. В других случаях показано иссечение некротизированных участков с сохранением жизнеспособных мышечных пучков. Жизнеспособность мышц определяют в ходе хирургического вмешательства. Критериями жизнеспособности является сохранение нормальной окраски, способность к кровоточивости и сокращению. После иссечения тканей рану обильно промывают антисептиками. Швы не накладывают. Рана заживает вторичным натяжением.
В отдаленном периоде больным с синдромом длительного раздавливания показаны курсы реабилитационного лечения (массаж, ЛФК), направленные на восстановление мышечной силы и устранение контрактур.
1. Диагностика и патогенетическое лечение синдрома длительного сдавления / Нечаев Э.А., Савицкий Г.Г. - 1992
3. Рекомендации ERBP по оказанию помощи пострадавшим с синдромом длительного сдавления при массовых катастрофах / перевод Камышовой Е.С. под ред.Захаровой Е.В. // Нефрология и диализ - 2015 - Т.17, №3
Профессор Павел Воробьёв: землетрясение в Армении и медицинская помощь
Павел Андреевич Воробьёв — профессор, доктор медицинских наук, в 1998–2018 годах заведовал кафедрой гематологии и гериатрии ИПО Первого МГМУ им. Сеченова. В 1988 году участвовал в оказании помощи пострадавшим во время землетрясения в Армении. На основе его исследований были проведены медицинские процедуры, благодаря которым удалось спасти многие жизни. В беседе с Армянским музеем Москвы Павел Андреевич рассказал, как оказывалась помощь пострадавшим, каких побед в медицине удалось достичь и какой опыт был извлечен врачами.

Я занимался такой методикой лечения больных, как плазмаферез. Суть ее заключается в очищении крови: это метод удаления жидкой части крови (плазмы), посредством которого выводятся патологические вещества, накопившиеся в ней. Где-то в 1987 году у меня был пациент с синдромом длительного сдавления [Синдром длительного сдавления — заболевание, вызванное длительным сдавливанием конечностей с нарушением в них кровообращения. — Прим. ред.]. Лечил его я с помощью плазмафереза: удаленная плазма была заменена донорской, тем самым было ликвидировано нарушение кровотока в почках.
О случившейся трагедии я узнал, как и, наверное, многие, из средств массовой информации. Я выяснил, что бригада Института гематологии, который возглавлялся моим отцом Андреем Ивановичем Воробьёвым, уже вылетела в Ереван. Я тогда в Первом медицинском работал. Попросил присоединить меня к этой бригаде.
Вылетал я спецрейсом спустя несколько дней после землетрясения, с посадкой в Сухуми. До нас летел самолет Горбачёва, и потому был освобожден пролет. Когда я прилетел в Ереван, то благодаря тому, что я уже был знаком с Институтом Микаеляна, я сразу поехал туда. Первое, что мне было поручено директором, это возглавить на ночь Институт. Люди, врачи, были истощены и морально, и физически. Они вместе с бригадой из Москвы уже несколько дней и ночей работали там непрерывно. Было очень трудно: шел непрерывный поток пострадавших в операционную, где производились так называемые «лампасные разрезы» (фасциотомия), когда рассекается кожа, чтобы высвободить отечные ткани для предотвращения вторичного сдавливания поврежденной конечности.
Моя задача, которую передо мною поставил Александр Львович Микаелян, заключалась в организации транспорта пострадавших в Москву. Как вы знаете, был такой вылет вместе с министром здравоохранения СССР Евгением Чазовым. Несколько десятков человек были вывезены в Москву. Вторая моя задача — организация непрерывного круглосуточного диализа [Диализ — искусственная очистка крови от вредных веществ в случае прекращения функционирования почек, обычное осложнение при синдроме длительного сдавления. — Прим. ред.]. У Микаеляна были очень старые аппараты для гемодиализа. В частности, они не подходили для детей, а дети у нас были. Я выстоял эту ночь, наутро вернулись отдохнувшие врачи, и мы продолжили лечение дальше.
Пострадавшие поступали к нам до двух недель. К концу первой недели поток пострадавших ослабел. Ко второй недели прибыло подкрепление — врачи из Германии, Шотландии. Привезли дополнительные аппараты для гемодиализа, современные, новые. «Микаеляновские» аппараты были заменены на них.
Плазмаферез мы делали всем, кого доставляли из Спитака и Ленинакана в первые сутки после извлечения из завала. Для этого из Москвы были доставлены несколько центрифуг (донорских пунктов), которые одновременно использовались и для получения плазмы от доноров. Мы также нашли центрифуги в Ереване, в научно-исследовательских институтах. У нас прошли плазмаферез около 300 человек.
Нам удалось сделать две фантастические вещи. Во-первых, у нас было очень мало почечных недостаточностей — 10% по тем расчетам, которые мы потом произвели (проведенный в первые сутки после извлечения из завала плазмаферез позволяет предупредить развивающуюся почечную недостаточность). За счет той терапии, которую я фактически придумал случайно в Москве, мы получили потрясающий результат. И второе — мы не ампутировали ни одной конечности. Тут играли роль и лампасные разрезы, и гипербарическая оксигенация, которая была доступна в институте, — метод, позволяющий обогатить клетки организма кислородом.
Эти результаты, насколько мне известно, не были воспроизведены нигде. Почему? Потому что мы были фактически «первой рукой», то есть люди доставались из-под завалов и тут же привозились в Ереван к нам. И мы сразу в течение суток могли сделать им эти процедуры. Гипербарическая оксигенация позволила избежать анаэробной инфекции, неприятного, практически смертельного осложнения, которого у нас практически не наблюдалось. Это были реальные победы в медицине. В Ереване нашей бригадой были написаны методические рекомендации Минздрава СССР по лечению синдрома длительного сдавления.
Считаю важным отметить участников нашей бригады, вылетевшей в Ереван. Это профессор Юрий Николаевич Андреев, академик Владимир Матвеевич Городецкий, Павел Иванович Максимов. Тех, кто в этом активно принимал участие. По-моему, они были едва ли не впервые в Ереване. Конечно, наших ереванских коллег. До последнего времени мы каждый год собирались нашей бригадой во главе с моим отцом Андреем Ивановичем, вспоминали эти дни. Это была у нас такая традиция. Для нас для всех это было очень большим эмоциональным потрясением, переживанием.
Читайте также:
