Синдромом Морганьи. Ранняя диагностика эндокринной патологии. Синдром Марфана. Синдром Клиппель—Феиля.
Добавил пользователь Alex Обновлено: 30.01.2026
Деформация ногтей больного. Диагностика болезни по деформациям ногтей у больного.
Эти деформации особенно типичны при двух внутренних заболеваниях.
1) Тонкие, ломкие, расщепляющиеся на пластинки ногти (ложкообразные ногти) или coilonychia характерны для железодефицитных анемий. Однако сходные изменения ногтей могут быть и при отсутствии других клеточных катализаторов (витамина В1). Они наблюдаются и при функциональных нарушениях щитовидной железы (как гипо- так и гиперфункции).
2) Ногти в виде часовых стекол и «барабанные пальцы» на руках и ногах являются выражением гипертрофической остеоартропатии Пьер Мари (Pierre Marie), которая наблюдается при длительных нарушениях газрвого обмена на почве хронических поражений легких, т. е. особенно часто при бронхоэктазах и гораздо реже при эмфиземе, туберкулезе легких, гнойном плеврите и абсцессе легких.
При опухолях легких (бронхогенный рак) и обширных метастазах в легкие ногти в виде часовых стекол — важный симптом. Из заболеваний системы кровообращения такая деформация наиболее выражена при врожденных пороках сердца (прежде всего при шунте справа налево, т. е. при цианотической группе этих заболеваний) и реже при медленно протекающем затяжном септическом эндокардите. Приобретенные пороки сердца почти никогда не сопровождаются «барабанными пальцами».
При аневризмах аорты и подключичной артерии «барабанные пальцы» иногда втречаются только с одной стороны.
Также и при некоторых болезнях печени, прежде всего при билиарном циррозе, и при спру могут наблюдаться «барабанные пальцы» и ногти в виде часовых стекол. Такие ногти, если они наблюдаются у нескольких членов семьи, конечно, патологического значения не имеют.
3) Поперечные бороздки или поперечные выемки [линии Бо (Beau)] на ногтях пальцев рук наблюдаются также при трофических расстройствах различного рода: например после тяжелых инфекционных болезней, при тетании, болезни Рейно, сирингомиелии и длительном недоедании.
Белые поперечные полоски (lunula) — признак нарушения скорости роста ногтей при отравлении таллием (Moeschlin) и мышьяком, но бывают также и при тяжелых инфекционных болезнях и лимфогранулематозе. Поэтому эти линии (Meess) мало характерны. Они указывают исключительно на нарушения роста в связи'с общим заболеванием организма.
Не патогномоничны также и продольные бороздки: они наблюдаются при различных болезнях.
Похожие на псориатические изменения ногтей наблюдаются при гипопаратиреозе.
Облитерирующие сосудистые процессы ведут к замедлению роста и образованию ненормально утолщенных ногтей.
Нейронихия наблюдается при психоневрозах.
Типичное положение большого пальца ноги является симптомом фридрейховской атаксии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром Клиппеля-Фейля
Синдром Клиппеля-Фейля — генетически детерминированная аномалия строения шейного отдела позвоночника, включающая уменьшение количества и сращение позвонков. Клинически проявляется визуально определяемым укорочением шеи, низким расположением границы роста волос на затылке, ограничением движений головой. Как правило, синдром Клиппеля-Фейля сочетается с другими врожденными аномалиями скелета и соматических органов. В диагностике участвуют различные узкие специалисты, проводится рентгенография, КТ и МРТ позвоночника, генетический анализ, расширенное обследование внутренних органов (сердца, почек, легких, головного мозга). Консервативное лечение проводится средствами массажа, ЛФК и физиотерапии. Возможно хирургическое лечение — операция цервикализации.
МКБ-10
Общие сведения
Синдром Клиппеля-Фейля — врожденная, генетически обусловленная патология шейного отдела позвоночника, заключающаяся в сращении (синостозе) и уменьшении количества позвонков. Наиболее типичным и постоянным признаком синдрома является выраженное укорочение шеи, в связи с чем в медицинской практике он также упоминается как синдром короткой шеи. В большинстве случаев сочетается с другими аномалиями развития костно-мышечной системы (кривошеей, сколиозом, болезнью Шпренгеля, гипоплазией верхней конечности, синдактилией) и врожденными пороками внутренних органов (почек, сердечно-сосудистой системы, легких). Синдром Клиппеля-Фейля относится к редким заболеваниям. Частота его встречаемости — примерно 1 случай на 120 тыс. новорожденных детей. Впервые синдром был описан в 1812 г. во Франции неврологом Клиппелем и рентгенологом Фейлем, имена которых легли в основу его названия.
Современная клиническая неврология классифицирует синдром Клиппеля-Фейля на 3 типа. Первый тип — KFS1 — характеризуется уменьшенным количеством шейных позвонков. В норме у человека в шейном отделе 7 позвонков, при KFS1 обычно 4-5. Второй тип — KFS2 — синостоз всех позвонков шейного отдела, их спаянность с затылочной костью и верхнегрудными позвонками. Третий тип — KFS3 — представляет собой комбинацию первого или второго со сращением позвонков в нижнем грудном и поясничном отделах. Зачастую в шейном отделе наблюдаются добавочные ребра и spina bifida — незаращение позвонковых дужек.
Причины
Наиболее изученным является ген GDF6, ответственный за возникновение KFS1. Мутации в этом гене приводят к нарушению синтеза белка, участвующего в формировании костно-суставного аппарата путем создания разграничения между отдельными костями. В зависимости от типа синдром Клиппеля-Фейля имеет различный механизм наследования: для KFS1 и KFS3 он аутосомно-доминантный, для KFS2 — аутосомно-рецессивный.
Симптомы
Основной клинической триадой, характеризующей синдром Клиппеля-Фейля, выступает укорочение шеи, смещение границы роста волос вниз по задней поверхности шеи, нарушение подвижности позвоночника в шейном отделе. Выраженность укорочения шеи может варьировать, в наиболее тяжелом варианте мочки ушей достают плеч, а подбородок — грудины, затруднено глотание и дыхание. Характерно широкое разведение лопаток и зачастую их укорочение. Может наблюдаться типичное для болезни Шпренгеля высокое стояние одной из лопаток. В ряде случаев отмечаются аномалии мускулатуры плечевого пояса и складки на шее. В редких случаях возникает корешковый синдром — боли, связанные со сдавлением шейных спинномозговых корешков.
В 50-60% случаев синдром Клиппеля-Фейля сочетается со сколиозом, в 25% случаев — с костным вариантом кривошеи. Возможно сочетание синдрома короткой шеи с аномалиями верхних конечностей (полидактилией, синдактилией, врожденными ампутациями), деформацией стоп, пороками ребер, аномалиями зубов, асимметрией лица, дальнозоркостью. У 45% пациентов диагностируется дистопия, аплазия или гипоплазия почек, возможен гидронефроз, эктопия мочеточников. У 25% больных выявляется врожденная глухота, у 20% — волчья пасть, у 15% — врожденные пороки сердца (открытый артериальный проток, ДМЖП, ДМПП, декстрапозиция аорты). Может наблюдаться аплазия или гипоплазия легких.
Со стороны нервной системы бывает олигофрения (умственная отсталость), эпилепсия, гидроцефалия, спинно-мозговая грыжа, микроцефалия, глазодвигательные расстройства (косоглазие, птоз, синдром Горнера). С раннего возраста характерна мышечная слабость в конечностях и синкинезии — непроизвольные одновременные движения обеих рук, чаще только кистей. Со временем могут возникать спастические и вялые пара- и тетрапарезы.
Диагностика
Верификация диагноза проводится на основании наблюдаемой с рождения типичной триады признаков, данных осмотра, семейного анамнеза, результатов инструментальных и генетических исследований. Установить синдром Клиппеля-Фейля с подробным указанием имеющихся сопутствующих аномалий возможно только в результате совместной работы многих узких специалистов: невролога, ортопеда, генетика, кардиолога, нефролога, пульмонолога, офтальмолога.
В первую очередь проводится рентгенография шейного отдела позвоночника в 2-х проекциях. При KFS1 на рентгенограммах в большинстве случаев определяется полный синостоз 4-5 позвонков в единый малодифференцированный конгломерат. В ряде случаев между позвонками находятся узкие светлые полоски, соответствующие недоразвитым дискам, что говорит о частичном синостозе, который по мере роста ребенка приводит к искривлению позвоночника. Синдром Клиппеля-Фейля II типа рентгенологически характеризуется сочетанием синостозов 7 шейных позвонков с ассимиляцией атланта и сращением верхних грудных позвонков. Для исключения KFS3 проводят рентгенографию грудного и поясничного отделов позвоночника.
Более полную информацию о костных аномалиях дает КТ позвоночника. Однако ее применение в раннем детском возрасте ограниченно из-за сопутствующей исследованию лучевой нагрузки. При необходимости для оценки состояния мягкотканных структур пораженного отдела (корешков, спинного мозга) возможно проведение МРТ позвоночника. Дифференцировать синдром Клиппеля-Фейля следует от врожденной мышечной кривошеи и туберкулеза позвоночника.
Диагностический алгоритм также включает обследование состояния внутренних органов: нейросонографию, МРТ головного мозга, УЗИ брюшной полости, УЗИ сердца, ЭКГ, УЗИ или КТ почек, экскреторную урографию, рентгенографию органов грудной полости. Проводится консультирование у генетика с анализом генеалогического древа и ДНК-тестированием.
Лечение синдрома Клиппеля-Фейля
Осуществляются преимущественно консервативные лечебные мероприятия, направленные на предупреждение развития деформаций позвоночника и увеличение объема движений в шее. Проводят массаж шейного отдела и воротниковой зоны, плечевого пояса и верхних конечностей. Рекомендованы регулярные занятия лечебной физкультурой. Возможно применение физиотерапии. По показаниям проводят симптоматическое лечение нарушений в работе соматических органов. При корешковых болях назначают анальгетики, ношение воротника Шанца.
Стойкий болевой синдром, обусловленный компрессией корешков верхними ребрами, является показанием к проведению операции. Хирургическое вмешательство проводится согласно технике Бонола и представляет собой т. н. цервикализацию путем резекции верхних 4-х ребер. Доступ осуществляют через паравертебральный разрез, идущий параллельно внутреннему краю лопатки. Операция выполняется в 2-этапа, отдельно на каждой стороне.
Прогноз
Сам по себе синдром Клиппеля-Фейля имеет благоприятный витальный прогноз. Наличие пороков развития соматических органов значительно осложняет ситуацию и может выступать причиной преждевременной смерти. В функциональном отношении прогноз неблагоприятный, несмотря на проводимые консервативные мероприятия, у пациентов сохраняется выраженное ограничение движений головой, степень которого зависит от типа и тяжести синдрома. Течение заболевания может усугубиться происходящими в позвоночнике дегенеративными изменениями.
Синдромом Морганьи. Ранняя диагностика эндокринной патологии. Синдром Марфана. Синдром Клиппель—Феиля.
Синдромом Морганьи (Morgagni) называют сочетание ожирения, hyperostosis frontalis interna, гипертрихоза и часто нарушения психики.
Относительно adipositas dolorosa (болезнь Деркума) см. главу «Боли в конечностях».
Истощение чаще всего является также выражением особой, непатологической, конституции.
Эндокринные нарушения ведут к ненормальному исхуданию при тиреотоксикозе, аддисоновой болезни и болезни Симмондса. Отграничение последней формы от психогенной анорексии (на почве вторичной гипофункции гипофиза) чревато многими дифференциально-диагностическими трудностями.
Патологическое истощение является также часто выражением тяжелого общего заболевания самого различного происхождения (туберкулез, злокачественные опухоли, болезни крови).

От собственно истощения надо отличать редкие случаи далеко зашедшей липодистрофии, которая обычно поражает только отдельные части тела. Местное исчезновение жира особенно часто наблюдается у больных диабетом, леченных инсулином (necrobiosis lipoidica diabeticorum) (Urbach—Oppenheim)
Диагностика с первого взгляда при эндокринных заболеваниях. Очень многие нарушения внутренней секрециив случаях особенно выраженных распознаются с первого взгляда по внешнему виду больных. Следует вспомнить о гипер- и гипотиреозе, акромегалии, об опухолях коры надпочечников, преждевременном развитии вторичных половых признаков (pubertas рrаесох при опухолях половых желез, гиперфункции коры надпочечников и изменениях гипоталамуса), болезни Иценко—Кушинга , аддисоновой болезни, кахексии Симмондса.
Диагностика с первого взгляда при некоторых конституциональных заболеваниях:
Синдром Марфана (Marfan) (арахнодактилия, «паукообразные пальцы») в комбинации с нарушениями в подвешивающем аппарате хрусталика (смещение хрусталика и его дрожание). В отдельных случаях этого доминантно наследуемого страдания наблюдаются одновременно и другие врожденные пороки развития (врожденные пороки сердца, spina bifida и т. д.). Чрезвычайно часто в этих случаях наблюдается aneurysma dissecans (внезапная смерть от ее разрыва). Вероятно, на почве слабости соединительнотканного аппарата при этой болезни отмечаются также сильные изменения костей (искривления позвоночника и воронкообразная грудь).
При нейрофиброматозе Реклингаузена наблюдаются более или менее многочисленные небольшие и более крупные опухоли, разбросанные по туловищу и конечностям. Эти фибромы, как правило, сопровождаются naevi. Заболевание может указывать на наличие таких же изменений во внутренних органах, особен-но в центральной нервной системе, что может явиться причиной тяжелых соcтояний. Фиброма кишечника может в редких случаях вызвать инвагинацию (собственное наблюдение).
Синдром Клиппель—Феиля (Klippel—Feil) характеризуется отсутствием или уменьшением числа шейных позвонков («человек без шеи»). Вообще большинство пороков развития распознается с первого взгляда.
Синдром Марфана
Синдром Марфана - дифференцированная форма врожденной соединительнотканной недостаточности, характеризующаяся разнообразными проявлениями скелетной, сердечно-сосудистой и глазной патологии. У больных с синдромом Марфана отмечаются гигантизм, долихостеномелия и арахнодактилия, аневризмы аорты, миопия, эктопия хрусталика, деформация грудины, кифосколиоз, плоскостопие, протрузия вертлужной впадины, эктазия твердой мозговой оболочки. Диагноз синдрома Марфана основан на семейном анамнезе, результатах функционального, офтальмологического, рентгенологического и генетического исследований. Лечение при синдроме Марфана включает консервативную и хирургическую коррекцию сердечно-сосудистых нарушений, поражений скелета и органа зрения.
Синдром Марфана - системное недоразвитие соединительной ткани в эмбриональном и постнатальном периодах, обусловленное структурными дефектами коллагена и сопровождающееся преимущественным поражением опорно-двигательного аппарата, глаз, сердечно-сосудистой системы. Синдром Марфана - одна из наиболее распространенных наследственных коллагенопатий синдромального характера. Частота встречаемости синдрома Марфана в популяции невысока: по данным различных авторов составляет 1 случай на 10000-20000 человек, без расовой и половой детерминированности.
Причины синдрома Марфана
Синдром Марфана относится к врожденным аномалиям, наследуемым по аутосомно-доминантному типу, с выраженным плейотропизмом, варьирующей экспрессивностью и высокой пенетрантностью. В основе синдрома Марфана лежат мутации в гене FBN1, отвечающем за синтез фибриллина – важнейшего структурного белка межклеточного матрикса, придающего эластичность и сократимость соединительной ткани. Аномалия и дефицит фибриллина при синдроме Марфана приводят к нарушению формирования волокнистых структур, потере прочности и упругости соединительной ткани, невозможности выдерживать физиологические нагрузки. Гистологическим изменениям в большей степени подвержены стенки сосудов эластического типа и связочный аппарат (в первую очередь, аорта и цинновая связка глаза, содержащие наибольшее количество фибриллина).
Широкий фенотипический спектр синдрома Марфана (от легких форм, трудно отличимых от нормы до тяжелых, быстропрогрессирующих) объясняется разнообразием мутаций в гене FBN1 (более 1000 видов), а также присутствием мутаций в других генах (например, в гене трансформирующего фактора роста - TGFBR-2). При генетическом исследовании в 75% случаев синдрома Марфана выявляется семейный тип наследования, в остальных - первичная мутация. Риск рождения ребенка с синдромом Марфана возрастает с увеличением возраста отца (особенно после 35 лет).
Классификация синдрома Марфана
В зависимости от количества пораженных систем выделяют несколько форм синдрома Марфана:
- стертую - со слабо выраженными изменениями в 1-2-х системах
- выраженную - со слабо выраженными изменениями в 3-х системах; выраженными изменениями хотя бы в 1-ой системе; выраженными изменениями в 2-3-х и более системах.
Степень тяжести изменений при синдроме Марфана может быть легкой, средней и тяжелой. По характеру течения дифференцируют прогрессирующий и стабильный синдром Марфана.
Симптомы синдрома Марфана
Синдром Марфана характеризуется сочетанным поражением скелета, глаз, сердечно-сосудистой и нервной систем; многообразием проявлений, варьированием сроков появления первых признаков заболевания; хроническим прогредиентным течением.
Больные синдромом Марфана, как правило, отличаются высоким ростом, относительно коротким туловищем с непропорционально длинными тонкими конечностями (долихостеномелией) и удлиненными паукообразными пальцами (арахнодактилией); астеническим телосложением со слаборазвитой подкожной клетчаткой и мышечной гипотонией; длинным и узким лицевым скелетом (долихоцефалией); наличием высокого аркообразного неба и нарушения прикуса (прогнатии). Средняя длина тела при рождении у мальчиков с синдромом Марфана составляет 53 см, окончательный рост – 191 см; у девочек - соответственно 52,5 см и 175 см.
При синдроме Марфана отмечаются нарушение функции суставов (гипермобильность); деформация грудной клетки (воронкообразная или килевидная форма), деформация позвоночника (сколиоз, кифоз, кифосколиоз, подвывихи и вывихи шейного отдела, спондилолистез), а также плоскостопие и протрузия вертлужной впадины.
Сердечно-сосудистая патология, доминирующая в клинической картине синдрома Марфана и часто определяющая его исход, проявляется дефектами структуры стенок сосудов эластического типа, особенно аорты и крупных ветвей легочной артерии, пороками развития клапанного аппарата и перегородок сердца. Изменения аорты у больных синдромом Марфана характеризуются прогрессирующим расширением ее восходящей части и клапанного кольца (дилатацией, аннулоаортальной эктазией) и аневризмами; поражение митрального клапана - миксоматозной дегенерацией створок, патологическим удлинением и разрывом створочных хорд, обызвествлением клапанного кольца. У плода с синдромом Марфана возможно формирование врожденных пороков сердца - коарктации аорты, стеноза легочной артерии, ДМПП и ДМЖП. Органические и функциональные изменения сердца и сосудов у больных синдромом Марфана часто сопровождаются нарушением ритма (наджелудочковой и желудочковой тахикардией, фибрилляцией предсердий) и развитием инфекционного эндокардита.
Самая неблагоприятная неонатальная форма синдрома Марфана проявляется в классическом варианте уже при рождении, приводит к прогрессирующей сердечной недостаточности и летальному исходу на первом году жизни ребенка.
Для большинства случаев синдрома Марфана характерна патология органа зрения, включающая близорукость, вывих/подвывих (эктопию) хрусталика, уплощение и увеличение размера роговицы, гипоплазию радужной оболочки и цилиарной мышцы, косоглазие, изменение калибра сосудов сетчатки. Эктопия хрусталика при синдроме Марфана имеет двухсторонний характер, часто развивается в возрасте до 4-х лет и устойчиво прогрессирует, ухудшая зрительную функцию.
При синдроме Марфана наблюдается поражение других систем и органов: нервной (эктазия твердой мозговой оболочки, в т. ч. пояснично-крестцовое менингоцеле), бронхолегочной (спонтанный пневмоторакс, эмфизема легких, дыхательная недостаточность), кожи и мягких тканей (атрофические стрии), рецидивирующие паховые и бедренные грыжи, вывихи и разрывы связок, а также эктопия почек, опущение мочевого пузыря и матки, варикозное расширение вен и др.
Характерный для синдрома Марфана высокий выброс адреналина может способствовать постоянному нервному возбуждению, гиперактивности, а иногда развитию неординарных способностей и умственной одаренности.
Диагноз синдрома Марфана основывается на семейном анамнезе, наличии у больного типичных диагностических признаков по результатам физикального осмотра, ЭКГ и ЭхоКГ, офтальмологического и рентгенологического обследования, молекулярно-генетического анализа и лабораторных исследований.
За диагностические критерии синдрома Марфана берутся характерные изменения в различных системах и органах; главными (большими) из них считаются: дилатация корня/расслоение восходящей части аорты, эктопия хрусталика и эктазия твердой мозговой оболочки; килевидная/воронкообразная деформация грудной клетки, требующая хирургического лечения; отношение длины верхнего сегмента тела к нижнему 1,05; сколиоз (> 20˚) или спондилолистез; ограничение разгибания в локтевом суставе (
Также применяются фенотипические диагностические тесты, определяющие соотношение кисть/рост (при синдроме Марфана > 11%); длину среднего пальца (> 10 см); индекс телосложения Варги – (масса тела, г/(рост, см)x2 – возраст, годы/100, должно быть
ЭКГ при синдроме Марфана позволяет определить нарушение ритма сердца, выраженную гипертрофию миокарда; ЭхоКГ - обнаружить клапанную регургитацию, увеличение размеров левого желудочка, пролапс митрального клапана, разрывы хорд, дилатацию аорты. На рентгенографии грудной клетки можно увидеть расширение корня и дуги аорты, увеличение размеров сердца; на КТ и МРТ сердца и сосудов - выявить дилатацию и аневризмы аорты.
Аортография показана при подозрении на аневризму и расслоение аорты. Наличие эктопии хрусталика уточняют с помощью биомикроскопии и офтальмоскопии; протрузию вертлужной впадины устанавливают методом рентгенографии тазобедренных суставов; эктазию твердой мозговой оболочки – МРТ позвоночника.
При синдроме Марфана определяется возрастание (в 2 раза и более) почечной экскреции метаболитов соединительной ткани: глюкозоаминогликанов и их фракций. Метод прямого автоматического секвенирования ДНК позволяет провести генетическую идентификацию мутаций в гене FBN1.
Необходима дифференциальная диагностика с заболеваниями, внешне напоминающими синдром Марфана: гомоцистинурией, врожденной контрактурной арахнодактилией (синдромом Билса), наследственной артроофтальмопатией (синдромом Стиклера), MASS-синдромом, синдромами Элерса-Данлоса, Лойса-Дитца, Шпринцена–Голдберга, семейной эктопией хрусталика и др.
Лечение синдрома Марфана
Лечение и дальнейшее наблюдение пациентов с синдромом Марфана должно осуществляться группой специалистов: офтальмологом, кардиологом, кардиохирургом, ортопедом, генетиком, терапевтом.
Лечение больных с синдромом Марфана направлено на профилактику прогрессирования заболевания и развития осложнений, в первую очередь в сердечно-сосудистой системе. При диаметре аорты до 4 см назначаются β-адреноблокаторы, антагонисты кальция или ингибиторы АПФ. Хирургическое лечение проводится при недостаточности клапанов сердца, пролапсе митрального клапана, значительном расширении (>5 см) восходящей части и расслоении аорты. Реконструктивные операции на аорте при синдроме Марфана, имеют высокий процент послеоперационной 5-ти и 10-ти летней выживаемости. При необходимости выполняют протезирование митрального клапана. У беременных с синдромом Марфана и выраженной сердечно-сосудистой патологией проводят досрочное оперативное родоразрешение путем кесарева сечения. С целью профилактика инфекционного эндокардита и тромбозов после операционных вмешательств назначаются антибиотики и антикоагулянты.
При синдроме Марфана проводится коррекция зрения с помощью подбора очков и контактных линз, при необходимости – лазерное или хирургическое лечение катаракты, глаукомы, удаление смещенного хрусталика с имплантацией искусственного. При выраженных скелетных нарушениях может потребоваться хирургическая стабилизация позвоночника, торакопластика, эндопротезирование тазобедренных суставов. Применяются также патогенетическая коллагеннормализующая терапия, метаболическая и витаминотерапия.
Прогноз жизни больных с синдромом Марфана определяется, в первую очередь, степенью сердечно-сосудистых изменений, а также поражений скелета и глаз. Имеется высокий риск осложненного течения, снижения продолжительности жизни (90-95% не доживают до 40-50 лет) и внезапной смерти. Своевременная кардиохирургическая коррекция при синдроме Марфана позволяет значительно увеличить продолжительность (до 60-70 лет) и улучшить качество жизни больных.
Больные синдромом Марфана должны находиться под постоянным врачебным наблюдением и регулярно проходить диагностическое обследование. При синдроме Марфана показан низкий или средний уровень физической активности, исключающий занятия контактными видами спорта, спортивные соревнования, изометрические нагрузки, подводное плавание. Женщинам детородного возраста с синдромом Марфана необходимо пройти медико-генетическое консультирование.
Синдром Клиппеля–Треноне ( Ангиоостеогипертрофический синдром , Гипертрофическая гемангиэктазия , Синдром Клиппеля-Треноне-Вебера )
Синдром Клиппеля-Треноне – это врожденная дисплазия магистральных вен, которая вызвана спорадическими генными мутациями. К возможными причинам патологии относят тератогенное действие лекарственных средств, инфекционных возбудителей, физических и химических факторов. Заболевание проявляется триадой симптомов: капиллярной гемангиомой, гипертрофическим разрастанием мягких тканей и костей, пороками развития вен. Для диагностики синдрома применяют УЗДГ вен, флебографию, МРТ с контрастированием. Лечение зависит от степени тяжести болезни и включает физиотерапию, фармакотерапию, хирургические операции.
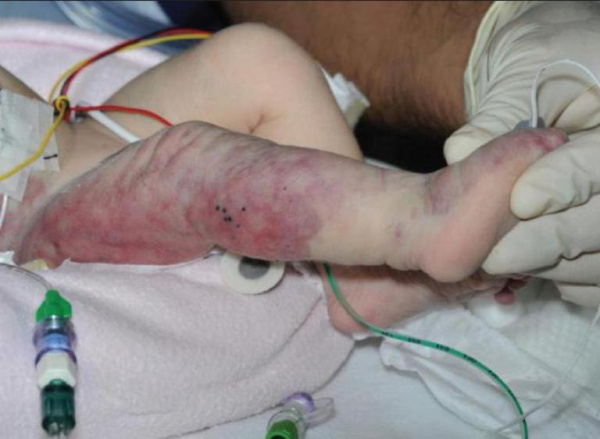
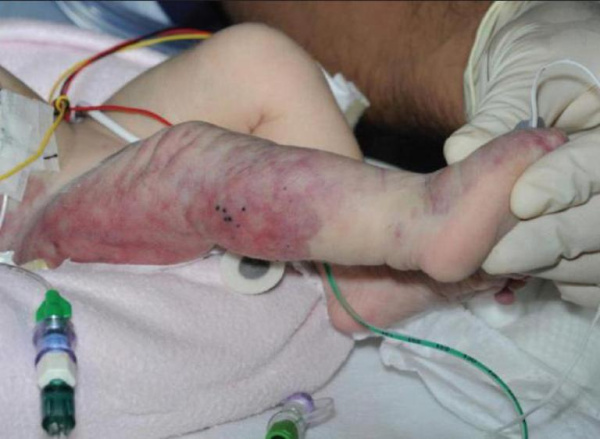
Синдром получил название в честь французских врачей Мориса Клиппеля и Поля Треноне, которые описали характерную клиническую картину еще в 1900 году. Спустя 7 лет английский дерматолог Паркс Вебер независимо от французских коллег описал подобную симптоматику, поэтому иногда заболевание носит тройную фамилию: синдром Клиппеля-Треноне-Вебера. Патология имеет синонимичные названия: гипертрофическая гемангиэктазия, ангиоостеогипертрофический синдром. Заболевание встречается с частотой 1 случай на 100 тыс. населения, существенных расовых или половых различий не выявлено.
До сих пор этиологическая структура заболевания не установлена. Ученые выдвигают несколько предположений, наиболее значимыми из которых являются теории внутриутробного повреждения симпатических ганглиев, аномалии развития глубоких вен, смешанной экто- и мезодермальной дисплазии. Установлена связь синдрома Клиппеля-Треноне (КТС) со спорадической мутацией гена PIK3CA, который участвует в регуляции жизнедеятельности клеток.
Значимая роль в формировании венозной патологии отводится тератогенным факторам, которые влияют на эмбрион и плод на разных сроках беременности. Вероятность синдрома повышается при воздействии ионизирующего излучения, химических канцерогенов, некоторых медикаментов. Имеют значение заболевания, перенесенные беременной женщиной, особенно инфекционные патологии в первом и третьем триместрах.
Патогенез
Диспластические процессы в мягких тканях, костях и сосудистых стенках связывают с нарушением функционирования белка р110, который входит в состав энзима фосфатидилинозитол-3-киназы. Сигнальная молекула участвует в процессах клеточного деления и миграции, поэтому ее патологии имеют множественные клинические проявления. Активация пролиферативных процессов обуславливает гипертрофию тканей конечностей.
Специфическое васкулярное поражение при синдроме Клиппеля-Треноне связывают с гипоплазией артерий, утолщением внутренней выстилки сосудов, разрушением эластических элементов сосудистой стенки. В магистральных венах наблюдаются процессы тромбоза и облитерации, периваскулярного фиброза. Непосредственной причиной нарушения оттока крови от глубоких вен называют эмбриональные тяжи.
Классификация
В международной флебологии и хирургии используется Гамбургская ISSVA-классификация сосудистых аномалий. Согласно ей, синдром Клиппеля-Треноне относится к группе сосудистых мальформаций, связанных с другими аномалиями развития. В отечественной медицине широко применяется клиническая систематизация магистральной венозной дисплазии, которая учитывает следующие признаки:
- Тип поражения. В зависимости от времени развития сосудистой аномалии выделяют эмбриональный, фетальный и промежуточный фетальный варианты патологии.
- Степень тяжести. По характеру и интенсивности клинической симптоматики бывает легкое, среднее, тяжелое и крайне тяжелое течение КТС.
- Локализация патологии. По числу пораженных областей тела выделяют изолированную, сочетанную и распространенную формы заболевания.
- Характер поражения. По анатомическим особенностям венозных аномалий выделяют аплазию, частичную и полную реканализацию, гипоплазию и эктазию сосудов.

Клинические проявления синдром Клиппеля-Треноне заметны у ребенка сразу после рождения. Наиболее ярким признаком являются сосудистые пятна красного или «винного» цвета, которые похожи на географическую карту. Они представляют собой капиллярную гемангиому и располагаются на передненаружной области конечностей. При легкой и среднетяжелой формах КТС пятна имеют гладкую поверхность, тяжелые варианты синдрома дополняются бугристостью и папилломатозными разрастаниями.
Вторым характерным симптомом является деформация пораженной конечности. У новорожденных с тяжелым течением синдрома Клиппеля-Треноне наблюдается симметричное утолщение ноги на 1-5 см, по сравнению со здоровой конечностью. Одновременно с этим происходит удлинение пораженной конечности в пределах 1-3 см, что вызвано диффузной костной и мягкотканной гипертрофией. Изредка встречается «уродующий» гигантизм стопы и макродактилия.
У пациентов с тяжелой и крайне тяжелой разновидностью течения КТС уже в первые 6 месяцев жизни определяются эмбриональные вены. Они располагаются по передненаружной поверхности ноги. Рельеф патологических сосудов легко прощупывается при поверхностной пальпации, видимость вен усиливается в вертикальном положении пациента. По мере роста ребенка обнаруживается хромота и ограничение сгибания в суставах.
Осложнения
Заболевание имеет прогрессирующее течение и вызывает ряд негативных последствий. При тяжелой форме патологии пациенты страдают от заметного дефекта конечности и обширных синюшных пятен, что становится причиной социальной дезадаптации, сложностей в личной и профессиональной сфере. Выраженная гипертрофия одной ноги сопровождается нарушениями походки и сколиозом. Дети с синдромом Клиппеля-Треноне склонны к раннему развитию артрозов и контрактур суставов.
Обследование пациентов с синдромом Клиппеля-Треноне проводится детским хирургом, узкопрофильным флебологом. На первичной консультации необходимо установить врожденный характер проблемы, уточнить историю беременности и родов, узнать семейный анамнез. При внешнем осмотре выявляют гемангиомы, диспропорциональность конечностей, видимые подкожные сосуды. В план комплексной диагностики заболевания входят следующие методы:
- УЗДГ сосудов. Методика используется для оценки кровотока в магистральных сосудах, определения участков патологического кровообращения. Исследование дополняют классическим УЗИ для изучения структуры мягких тканей в области гипертрофии.
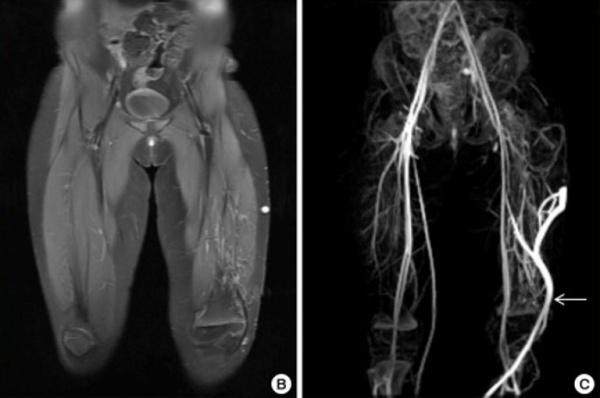
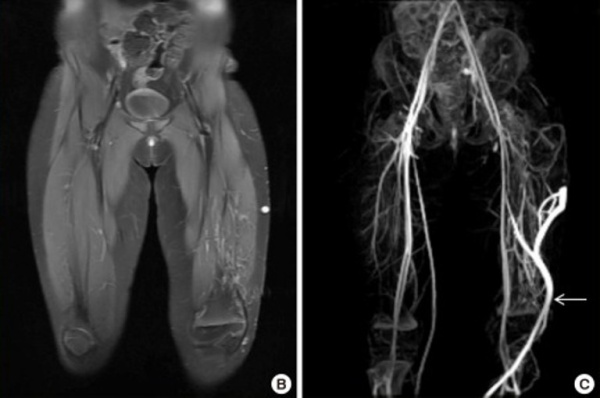
- МРТ. Магнитно-резонансная томография с динамическим контрастным усилением является «золотым стандартом» для диагностики пораженных мягких тканей, обнаружения сосудистой патологии, оценки характера мальформации. По показаниям методику дополняют компьютерной томографией.
- Флебография. Исследование имеет решающее значение для диагностики венозной дисплазии, определения ее характера, протяженности и степени тяжести. Для сочетанной диагностики артериального русла применяют селективную и чрескожную пункционную артериографию.
Дифференциальная диагностика
При постановке окончательного диагноза исключают артериовенозные мальформации, в частности синдром Паркса-Вебера. Дифференциальная диагностика проводится с дисплазией поверхностных вен (синдром Боккенхеймера), гемангиоэндотелиомой, врожденной лимфатической обструкцией. При выраженной костной деформации и гипертрофии необходимо исключить синдром Протея.

МРТ нижней конечности. Расширенная поверхностная венозная сеть и гипертрофия мягких тканей. Белая стрелка - эмбриональная боковая краевая вена.
Лечение синдрома Клиппеля-Треноне
Консервативная терапия
Программа лечения КТС подбирается с учетом его степени тяжести и возраста пациента. В консервативной флебологии практикуется сочетание медикаментозной терапии с физиолечением и применением ортопедических устройств. Показано эластическое бинтование и ношение компрессионных чулков для профилактики отеков и уменьшения венозного застоя. Большинство пациентов получают венотоническую терапию для предупреждения развития венозной недостаточности.
Хирургическое лечение
При синдроме Клиппеля-Треноне применяются малоинвазивные методики: внутривенная и транскожная лазерная коагуляция вен. Они уменьшают выраженность сосудистых мальформаций, препятствуют прогрессированию болезни. С этой же целью используется пенная склеротерапия сосудов. Малоинвазивное лечение – метод выбора в педиатрии, поскольку оно дает хороший клинический результат при минимальной травматизации и коротком реабилитационном периоде.
Также применяются оперативные методы лечения. При тяжелой степени синдрома Клиппеля-Треноне их выполняют в первые 2 года жизни, среднетяжелые и легкие формы требуют планового лечения в возрасте 3-6 лет. Тактика хирургического вмешательства подбирается индивидуально и может включать удаление эмбриональных вен, перевязку перфорантных вен, венозную пластику. По показаниям выполняют ортопедические операции и ампутации.
Прогноз и профилактика
Болезнь Клиппеля-Треноне отрицательно влияет на качество жизни пациентов, что связано с косметическими дефектами и множественными симптомами сосудистой аномалии. Однако при своевременной терапии она не угрожает жизни и имеет относительно благоприятное течение, за исключением крайне тяжелых вариантов. Поскольку КТС не имеет наследственной природы и точных причинных факторов, эффективные меры профилактики не разработаны.
1. Синдром Клиппеля-Треноне. Этиология, патогенез, диагностика и лечение/ М.В. Азаров, Д.Д. Купатадзе, В.В. Набоков// Педиатр. – 2018. – №2.
2. Абдоминальный вариант синдрома Клиппеля-Треноне/ А.М. Чеканов, М.Н. Чеканов, М.Ф. Осипенко, С.Г. Штофин и др.// ЭиКГ. – 2018. – №7.
3. Синдром Клиппеля-Треноне в практике врача скорой медицинской помощи/ А.С. Багдасарьян// Кубанский научный медицинский вестник. – 2018. – №2.
4. Варикозная болезнь вен у детей с синдромом Клиппеля-Треноне/ Ю.О. Синяченко// Здоровье ребенка. – 2017. – №1.
Читайте также:
- Группы плевральных сращений. Морфология плевральных сращений
- Лекарства и электрокардиостимулятор. Взаимодействие антиаритмических препаратов и ЭКС
- Лучевая диагностика болезни Хираямы
- МРТ фораминальной экструзии межпозвонкового диска
- Лучевые изменения печени при наследственной геморрагической телеангиэктазии
