Синтез глюкокортикостероидов и уропепсиногена при раке желудка
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Примеры синтеза кортикостероидов (ГКС) надпочечниками при раке желудка
Для иллюстрации полученных данных приведем выписки из историй болезни.
1. Больной Б-в, 32 лет, поступил в клинику по поводу рака желудка. Жалобы: боли в животе, черный стул, слабость, недомогание, потеря аппетита, похудание, быстрая утомляемость. Болен около месяца. Объективно: питание пониженное, кожа бледная с землистым оттенком; пульс 80 удароп в 1 минуту; АД 140/70, тоны сердца глухие; легкие в пределах нормы; живот мягкий, безболезненный при пальпации; печень слегка выступает из подреберья. Рентгенологически: рак кардиального отдела желудка с переходом на пищевод. Анализ крови: Нb 47%, эр. 2860 тыс., л. 8300, э. — 6, п.—2, с. — 48, лимф.—28, м. — 16.
Сахарная кривая: 101—185—203—89—128. Анализ желудочного сока: натощак — общая плотность 10, свободная НСl — 0; после гистамина — общая кислотность 44—56, свободная НСl — 20— 22 титр. ед.
Кортикостероидогенез: спонтанная экскреция 17-ГОКС и 17-КС ниже нормы, реакция на АКТГ отрицательная (надпочечниковый гипокортицизм).
После радикальной операции (операционный диагноз: рак желудка с метастазами в лимфоузлы большого сальника, малигнизированный полип) состояние улучшилось. Выписан под наблюдение онколога.

2. Больной О-в, 47 лет, поступил в клинику по поводу рака желудка. Жалобы: эпигастральные боли, слабость, недомогание, плохой аппетит, похудание, снижение работоспособности. С 1948 г. отмечает тошноту, иногда эпигастральные боли, в 1960 г. боли усилились, в июле 1962 г. аппендэктомия, с октября 1962 г. боли приняли постоянный характер, самочувствие ухудшилось — при обследовании выявлен рак желудка.
Объективно: питание понижено, кожа бледная; пульс 70 ударов в 1 минуту; АД 120/65; сердце и легкие в пределах нормы; живот мягкий, при пальпации безболезненный; печень не увеличена. Рентгенологически: рак желудка. Анализ кропи: Нb 82%, эр. 5070 тыс., л. 6500, п. — 9, с. — 69, лимф.— 20, м. — 2. Анализ желудочного сока: натощак — общая кислотность 6, свободная НС1 — 0, пепсин 140 мг%, после гистамина — общая кислотность 12, свободная НСl — 0, пепсин 382 мг%.
Кортикостероидогенез: спонтанная экскреция 17-ГОКС и 17-КС п пределах нормы, реакция на АКТГ положительная. Однако колебания спонтанной экскреции в отдельные дни (от субнормальных до нормальных цифр), а также отсутствие подъема экскреции 17-КС после введения АКТГ позволяют говорить об умеренных нарушениях функционального состояния ГНС.
После паллиативной операции (неоперабельный рак с прорастанием поджелудочной железы и метастазами) самочувствие удовлетворительное. Послеоперационное течение гладкое. Выписан под наблюдение онколога.
Таким образом, в зависимости от стадии заболевания характер нарушений со стороны гипофизарно-надпочечниковой системы может быть различным. Так, при операбельных формах рака угнетение гипофизарно-адреналовых функций выражено в иной степени, нежели у больных с неоперабельным раком желудка. Все это указывает на то, что, по-видимому, имеется определенная связь между стадией заболевания и характером нарушения функциональной активности ГНС.
Можно предположить, что при операбельном раке желудка надпочечники функционируют с меньшей нагрузкой, выделяя меньшее количество кортикостероидов; гем не менее, они еще способны ответить на введение АКТГ увеличением экскреции 17-ГОКС. При неоперабельном же раке желудка, очевидно, кора надпочечников функционирует с большим напряжением, будучи не в состоянии ответить на стимуляцию АКТГ повышением своей функциональной активности.
Синтез глюкокортикостероидов и уропепсиногена при раке желудка
Работами ряда авторов показано, что эстрогены, гормоны коры надпочечников и гипофиза оказывают влияние на возникновение и развитие опухолей как в эксперименте, так и в клинике. Известно, что природные и синтетические эстрогены способны вызывать у животных восприимчивых линий появление доброкачественных и злокачественных опухолей (Гринштейн, П. Дезев). Auchincloss, Haagensen наблюдали возникновение рака молочных желез у женщины, получившей в течение 2 лет по поводу различных расстройств в половой сфере около 75 г эстрадиола.
Согласно данным Lipschutz с сотр., ацетат гидрокортизона оказывает профилактическое действие при индукции опухолей матки и брюшины у морских свинок. Baserga, Shubik нашли, что кортизон подавляет рост первичной карциномы молочных желез у мышей, но благоприятствует метастазированию.
Гринштейн сообщает о том, что надпочечники животных — носителей опухоли — содержат меньшее, чем в норме, количество жировых веществ. Согласно данным Э. Юсфиной и Н. Цериковской, при опухолевом росте реакция эндокринных органов протекает иначе, чем при действии на организм других вредных агентов, что свидетельствует о недостаточности механизмов защиты.
Таким образом, молено считать доказанным, что между гормонами и злокачественными опухолями существуют определенные взаимоотношения.
Исследование состояния эндокринной системы при злокачественных новообразованиях предполагает выяснение взаимоотношений, существующих между опухолью и ее носителем, и включает в себя два аспекта: изучение влияния опухоли на эндокринные органы и воздействия эндокринного аппарата на течение новообразовательного процесса. Как в отечественной, так и в зарубежной литературе встречается относительно небольшое количество работ, посвященных данному вопросу.
Так, Pearlman при обследовании 20 больных раком желудка наблюдал снижение уровня 17-КС в моче. Bottiglioni, Sturani, Nanni сообщают о 10 случаях рака с низким содержанием 17-КС. Другие авторы (Neukomm, Piegari), напротив, не находят при раке желудка существенных отклонений от нормы в экскреции 17-КС.
Противоречивость полученных данных, по-видимому, связана как с малым числом наблюдений, так и с неоднородностью материала (не учитывалась стадия заболевания).
Нарушения функционального состояния гипофиза и надпочечников у больных раком желудка
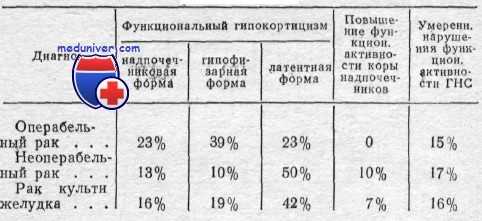
Е. М. Самунджан на сравнительно большом материале удалось показать различный характер нарушений со стороны адренокортикальной системы в зависимости от стадии заболевания (рака желудка и т. п.). Автор использовал для оценки функциональной активности адренокортикальной системы такие тесты, как уровень экскреции 17-КС и эозинофильная проба Торна.
Под нашим наблюдением находились 65 больных раком желудка в возрасте от 32 до 60 лет (из них 35 мужчин, 30 женщин). У части больных первичный рак желудка не был осложнен метастазированием (операбельный рак; II—III стадия по общепринятой классификации). Такие больные подвергались радикальному оперативному вмешательству, после чего выписывались из клиники под наблюдение онкологов. У другой части больных в процессе обследования или на операции отмечалось наличие метастазов (неоперабельный рак — IV стадия). Наконец, у ряда больных наблюдался рецидив рака желудка (рак культи желудка).
Обследование, проведенное в нашей лаборатории, показало, что у значительного числа больных раком желудка спонтанная экскреция 17-ГОКС была ниже нормы (в 25%), в остальных случаях колебалась в пределах нормы и лишь у отдельных больных превышала нормальный уровень (рис. 17). Средний уровень спонтанной экскреции 17-ГОКС составлял при неоперабельном раке 6,81 ± 1,04 мг, а при операбельном 3,58 ± 0,46 мг, при раке культи желудка 10,19 ±2,78. Коэффициент вариации колебался от 38 до 81%, будучи наибольшим при неоперабельных формах рака.
Спонтанная экскреция 17-КС у подавляющего большинства больных раком желудка была ниже нормы (в 44% случаев) или на ее нижней границе (у 40% больных). Средний уровень экскреции 17-КС составлял при неоперабельном раке 5,55 ± 0,86 мг, при операбельном — 6,07 ±1,14 мг, при раке культи желудка 6,87 ± 0,58 мг в сутки. Коэффициент вариации колебался от 12 до 80% и был наибольшим при неоперабельных формах рака.
Наконец, спонтанная экскреция уропепсиногена у большинства больных также оказалась ниже нормы (в 65% случаев). Только у 7% больных она превышала нормальный уровень, в остальных же случаях колебалась в пределах нормы. Средний уровень спонтанной экскреции уропепсиногена составлял при неоперабельном раке желудка 77 ± 2,0 мг, при операбельном — 40 ± 6,6 мг, при раке культи желудка — 46 ± 8,0 мг/24 часа. Коэффициент вариации колебался от 13 до 61% и был наибольшим при операбельных формах.
Таким образом, при операбельном раке желудка наблюдалось отчетливое снижение среднего уровня экскреции 17-ГОКС, 17-КС и уропепсиногена по сравнению с таковым у практических здоровых лиц. При неоперабельном же раке желудка наряду с низкими величинами спонтанной экскреции 17-ГОКС, 17-КС и уропепсиногена, встречавшимися у некоторых больных, преобладали нормальные цифры, а в отдельных случаях уровень спонтанной экскреции значительно превышал норму.
Что касается результатов нагрузочной пробы с АКТГ, то при операбельных формах рака в большинстве случаев (61%) сохранялась положительная реакция, напротив, при неоперабельном раке у большинства больных (в 78% случаев) ответная реакция коры надпочечников оказалась отрицательной.
Анализ нарушений кортикостероидогенеза показал, что у подавляющего большинства больных раком желудка (в 77%) наблюдаются явления функционального гипокортицизма. Так, у ряда больных снижение спонтанной экскреции 17-ГОКС и 17-КС сочеталось с отрицательной реакцией на введение 40 ЕД АКТГ (надпочечииковая форма), в других случаях субнормальная экскреция 17-ГОКС и 17-КС до нагрузки сопровождалась положительной ответной реакцией на АКТГ (гипофизарная гипоадрения); наконец, у части больных наряду с нормальной экскрецией 17-ГОКС и 17-КС до нагрузки (в некоторых случаях имело место изолированное снижение экскреции 17-КС) отмечалась отрицательная реакция на АКТГ (латентная форма).
У отдельных больных наблюдались признаки повышения функциональной активности коры надпочечников (спонтанная экскреция 17-ГОКС и 17-КС значительно превышала нормальный уровень); в остальных случаях показатели функционального состояния ГНС приближались к нормальным. Тем не менее, средний уровень экскреции 17-КС у этих больных был ниже такового в контрольной группе, отсутствовало также увеличение экскреции 17-КС в ответ на введение АКТГ.
Гипофизарно-адреналовая система при предраковых заболеваниях желудка
В последние годы большое внимание уделяется изучению эндокринных влияний на состояние внутренних органов как в норме, так и при различных заболеваниях. В частности, ряду авторов (Gray, Zubiran, Villareal и др.) удалось показать наличие тесной взаимосвязи между функциональной активностью гипофизарно-надпочечниковой системы (ГНС) и функциональным состоянием желудка в эксперименте на животных и у практически здоровых лиц. Получены данные об изменении функции ГНС у больных язвенной болезнью (см. работу В. Н. Туголукова). Имеются сведения об изменении функции надпочечников при злокачественных опухолях внутренних органов (Piegari, Schubert, Е. М. Самунджан и др.), а также о роли гормонов в возникновении и развитии новообразований у животных и человека (Гринштейн, Дезев и др.).
Однако вопрос об участии эндокринной системы в патогенезе хронического гастрита и рака желудка относится к числу малоизученных.
Встречающиеся в литературе указания скудны и разноречивы и не дают четкого представления о характере нарушений со стороны гипофизарно-адреналовой системы при этих заболеваниях.
Между тем некоторые экспериментальные работы свидетельствуют о развитии атрофии эпителиальных элементов слизистой оболочки желудка после гипофизэктомии и сюрреналэктомии (Peremans, Baker). По своему характеру эти изменения напоминают морфологические поражения слизистой желудка при хроническом гастрите и сопровождаются соответствующими расстройствами секреторной функции желудка.
Аналогичные морфологические и функциональные изменения имеют место у больных с болезнью Аддисон—Бирмера и у людей с удаленными надпочечниками (Grawitz, Grey, и др.). Все это свидетельствует о том, что нарушения эндокринной регуляции, очевидно, имеют определенное значение в развитии хронического гастрита и рака желудка.
Согласно современным представлениям, хронический гастрит как клинико-анатомическое понятие характеризуется определенными морфологическими изменениями слизистой желудка. Последние сочетаются с нарушениями секреторной, а также моторной функции желудка. В какой-то степени страдает и инкреторная функция. При хроническом гастрите в патологический процесс часто вовлекаются и другие органы пищеварения (кишечник, печень, желчные пути, поджелудочная железа), а также возникают различные нарушения со стороны нервной и эндокринной системы (С. М. Рысс).
Известно также, что отдельные формы хронического гастрита, такие, как прогрессирующий атрофический гастрит с наличием дисрегенераторных процессов в слизистой оболочке желудка (гастрит «перестройки») или атрофический гастрит с атрофией желез и гиперплазией поверхностного эпителия, относятся к предраковым заболеваниям желудка (Ц. Г. Масевич). То обстоятельство, что рак желудка практически никогда не развивается на совершенно здоровой слизистой (А. В. Мельников, К. А. Скулме и др.), свидетельствует о несомненной связи между хроническим гастритом и раком желудка.
На протяжении ряда лет нами проводились исследования по изучению функционального состояния гипофизарно-надпочечниковой системы при хроническом гастрите и раке желудка. Основной задачей исследований являлось получение качественной и количественной характеристики нарушений функций ГНС, установление зависимости между формой (степенью тяжести, стадией) заболевания и характером этих нарушений, а также их связи с клиническими особенностями течения последнего.
Как известно, изучение функционального состояния ГНС в клинике базируется на трех основных типах исследований: определении спонтанной экскреции кортикостероидов, воспроизводстве тех же анализов после стимуляции или ингибиции коры надпочечников с помощью фармакодинамических средств, изучении скорости обновления кортикостероидов, меченых радиоактивными изотопами. Наибольшее распространение в клинической практике получили два первых метода (Heusghem).
Что касается изучения уровня гормонов коры надпочечников в крови, то последнее, обладая некоторыми преимуществами перед их определением в моче, в то же время имеет существенный недостаток, так как дает представление только о «мгновенном» (характерном для данного момента) содержании гормонов даже у здоровых людей в состоянии покоя. Напротив, определение гормонов в суточной моче позволяет получить более общее представление об активности надпочечников, так как большинство кортикостероидов быстро выводится с мочой (Heusghem, Юллес и Холло, Уилкинс, Н. А. Юдаев). Идеальным является сочетание обоих методов.
Однако необходимо иметь в виду, что однократному определению не следует придавать большого значения, наблюдение должно быть более или менее длительным.
Функция надпочечников, обмен уропепсиногена после операции на язве желудка и ее осложнениях
Анализируя литературные материалы о состоянии ГГНС при язвенной болезни в хирургическом аспекте, можно констатировать следующее: А. Т. Пулатов, В. Е. Волков, В. С. Гафаров склоняются к выводу, что непосредственно после резекции желудка имеет место повышение адренокортикальной функции. По наблюдениям Н. П. Цизиной, у больных после этой операции функциональная активность ГГНС оказалась сниженной.
Gerchards, Cesnik, Memco и Sorge утверждают, что количество выделяемых глюкокортикоидов и уропепсиногена у оперированных больных прямо пропорционально тяжести оперативного вмешательства.
Ю. M. Полоус у большинства обследованных больных наблюдал неадекватную реакцию на стимулирующее действие АКТГ и расценивал этот факт как функциональное истощение коркового вещества надпочечников или парадоксальную реакцию возбужденного органа в ответ на раздражитель. Автор отметил, что у больных, имевших до операции признаки адренокортикальной недостаточности, послеоперационный период протекал с различными осложнениями.
После ушивания прободной язвы желудка и двенадцатиперстной, кишки В. Г. Мыкуляк констатировал снижение адренокортикальной функции, а Ю. Н. Кленус — повышение ее, с удовлетворительной резервной способностью коркового вещества.
По наблюдениям О. Г. Сизова и С. З. Клецкина, при анастомозитах имеет место подъем уровня уропепсиногена; увеличение экскреции этого протеолитического фермента было обнаружено у больных при пенетрации язвы в соседние органы (О. Г. Сизов), в то время как В. Г. Мыкуляк отмечал у такого рода больных понижение показателей экскреции 17-кетостероидов и отрицательную пробу Торна.
По данным же О. Ф. Гоцуляк, у больных с пенетрирующими и перфоративными язвами показатели уропепсиногена в большинстве случаев оказались повышенными, при перидуодените и перигастрите содержание протеолитического фермента понижалось и наиболее низким оно было при стенозе привратника.
По мнению Ю. М. Полоус, при язвенной болезни, осложненной рубцовой деформацией (особенно при локализации язвы в желудке), функциональная активность коры надпочечников повышалась, в то время как В. Г. Мыкуляк выявил понижение экскреции 17-кетостероидов при данном осложнении.
М. Д. Смехова и А. Ф. Бунатян наблюдали у больных с пептическими язвами анастомоза адренокортикальную недостаточность (даже в период клинического благополучия). Авторы отмечают, что у больных, перенесших реконструктивную резекцию желудка, ранний послеоперационный период, а иногда и сама операция протекали с различными осложнениями и объясняют их возникновение неполноценной функциональной резервной способностью коры надпочечников.
Сравнивая показатели содержания уропепсиногена после резекции желудка по поводу язвенной болезни и рака желудка, Н. П. Смирнов считает, что после резекции желудка по поводу рака угнетение пепсинообразующей функции культи желудка более выражено, чем после операции по поводу осложненной язвенной болезни. Balabnnski и соавт., Vassilev и соавт., Ginev и Zanzov выявили гипокортицизм у длительно болеющих язвенной болезнью, особенно при тяжелых массивных кровопотерях и после резекции желудка.
В то же время Savulescu и др. как при осложненных хронических язвах, так и при гастродуоденальных кровотечениях установили гиперкортицизм, который в 70—80% случаев сопровождался положительной реакцией на стимуляцию АКТГ и в 100% случаев — эозинопенией в ответ на введение инсулина (проба Милку). В течение первых дней кровотечения имела место абсолютная эозинопения, зависящая от гиперсекреции глюкокортикоидов, а в ближайшие дни после геморрагии — эозинофилия, вызванная снижением секреции стероидных гормонов.
Таким образом, по вопросу о состоянии адренокортикальной функции при осложненной язвенной болезни как до, так и после резекции желудка или ушивания прободной язвы имеется еще много разногласий, что указывает на необходимость дальнейшего изучения этой проблемы.
Владимирова Любовь Юрьевна
Заведующая отделом лекарственного лечения опухолей, заведующая отделением противоопухолевой лекарственной терапии ФГБУ «НМИЦ онкологии» Минздрава России, член правления RUSSCO, доктор медицинских наук, профессор, Ростов-на-Дону
Несмотря на определенный прогресс в лечении рака желудка, прогноз больных остается неблагоприятным. За последние несколько лет был получен определенный успех при иммунотерапии меланомы, в лечении которой ее применили впервые, а также при раке молочной железы, раке почки, раке предстательной железы и при немелкоклеточном раке легкого. Поэтому журнал Science в 2013 году назвал иммунотерапию «прорывом года» [1]. Интерес к иммунотерапевтическим подходам в лечении рака желудка все больше возрастает.
Роль иммунной системы
Известно, что иммунная система позволяет отличать «свое» от «чужого». В гипотезе иммуновыживаемости раковых клеток была представлена концепция, согласно которой иммунная система способна находить и уничтожать появившиеся злокачественные клетки 3. Первоначально эта теория была отвергнута, но постепенно в эксперименте были получены весомые доказательства, и теперь они являются частью теории «иммуноредактирования» рака [5].
Этот процесс имеет 3 основные фазы: устранения («elimination»), равновесия («equilibrium») и избегания («escape»). Во время фазы элиминации рост и размер клеток опухоли могут вызывать изменения в микроокружении и локальное повреждение. Клетки иммунной системы, такие как натуральные киллеры и Т-клетки натуральные киллеры, секретируют гамма-интерферон и цитокины, а также осуществляют ингибирование ангиогенеза и пролиферацию клеток опухоли. Затем антигенпрезентирующие дендритные клетки поглощают опухолевые антигены и активируют Т-лимфоциты для развития иммунного ответа. Самой продолжительной из всех трех фаз является фаза равновесия. В этом процессе CD8+Т-клетки, дендридные клетки и опухолевые клетки находятся в фазе динамического баланса и опухолевые клетки находятся в покое. К сожалению, во время этого долгого процесса генетически нестабильные опухолевые клетки могут выживать, приобрести резистентность, и это приводит к фазе избегания.
Другим важным этапом было выделение первого антигена опухолей человека, распознаваемого Т-клетками [6]. Это стало возможно в результате клонирования гена MAGE (melanoma antigen-encoding gene), который кодирует антигены, распознанные цитотоксическими Т-клетками. Это открытие было не только новым доказательством способности нашей иммунной системы находить и разрушать опухолевые клетки, но также впервые была определена молекулярная природа этих антигенов.
Иммунотерапия: вакцины против рака
Вакцина против рака создана с целью усиления способности иммунной системы человека распознавать и разрушать опухолевые клетки путем стимулирования опухолеспецифичных Т-лимфоцитов. В частности, опухолевые антигены должны быть распознаны Т-клетками с помощью специальных антиген-презентирующих клеток (например, дендритных клеток). Обычно эти антигены представляют собой малые внутриклеточные пептиды, которые на поверхности опухолевых клеток имеют молекулы главного комплекса гистосовместимости и распознаются Т-клетками. Молекулы комплекса гистосовместимости I класса отвечают за презентацию антигена СD3+ CD8+, а II класса – СD3+СD4+.
В настоящее время были обнаружены и изучены тысячи опухолевых антигенов. Ген MAGE, впервые найденный у больных меланомой, представлен по-разному в различных солидных опухолях, но он также присутствует на нормальных клетках, не проявляя себя. Другие найденные потенциальные антигены являются пептидами, связанными с мутациями (например, KRAS и связанные с ним мутации), антигены дифференцировки, антигены избыточной экспрессии (например, HER2/neu и раково-эмбриональный антиген) и вирусные антигены (например, HPV).
Рак желудка экспрессирует MAGE в 38% случаев. В доклинических исследованиях показано, каким образом Helicobacter pilori может индуцировать экспрессию МАGE-3 [7,8]. Нановакцина, нагруженная пептидом МАGE-3 с целью усилить иммунный ответ, была изучена на мышиной модели рака желудка. В результате была получена регрессия опухоли [9]. Японскими учеными проведена I/II фаза исследования на 22 больных с распространенным раком желудка с использованием пептидов от VEGF-R1 и VEGF-R2 совместно с применением S-1 и цисплатина. В результате была получена частичная регрессия у 55% больных и увеличение продолжительности общей выживаемости [10]. Кроме того, опухолевые антигены, связанные с HER2/neu, обычно избыточно экспрессируемые при раке желудка, могут играть важную роль в развитии новых подходов к иммунотерапии и вакцинации.
Адоптивная иммунотерапия (или иммунотерапия «адоптивными клетками») является еще одним видом иммунотерапии. Опухолево-специфичные Т-клетки забирают у больного и культивируют in vitro. Затем эти клетки реинфузируются больному в больших количествах. В настоящее время генетическая модификация этих клеток in vitro до их возвращения имеет особое значение. Можно использовать различные типы клеток в качестве активированных киллеров. Некоторые из них были изучены при раке желудка, в том числе лимфоциты, инфильтрирующие опухоль [11].
В одном из последних исследовании у 44 больных с распространенным раком желудка были использованы тумор-ассоциированные лимфоциты в комбинации с или без химиотерапии [12]. Результаты показали, что общая выживаемость была лучше в группе комбинации химиотерапии с тумор-ассоциированными лимфоцитами. Более того, при раке желудка были исследованы цитокин-индуцированные киллеры [13,14]. Клинические исследования подтвердили что больные, которых лечили химиотерапией в комбинации с цитокин-индуцированными киллерами, обработанными in vitro интерлейкином-2 совместно с антителами анти-СD-3, имели лучшую выживаемость по сравнению с больными, которым была проведена только химиотерапия. Однако высокая специфичность обработанных киллеров этого типа является крайне важной, позволяя уменьшить риск жизнеугрожающих побочных эффектов, связанных с выраженным иммунным ответом.
Ингибиторы иммунных контрольных точек
Чтобы избежать избыточной пролиферации и повреждения ткани, необходимо тщательно регулировать активность . В этот процесс включено несколько иммунных контрольных точек. Т-клетки экспрессируют ингибирующие рецепторы CTLA-4 и РD-1. Эти молекулы обычно появляются на поверхности Т-клеток после их активации и передают негативный сигнал. Блокада этих рецепторов с помощью антител вызывает повышенную активность Т-клеток, которая достаточно высока при многих видах опухоли.
Не так давно в геномном атласе рака были проанализированы молекулярные характеристики аденокарциномы желудка [15]. Были выделены 4 опухолевых подтипа: опухоли, позитивные по вирусу Эпштейна-Барр, микросателлитные нестабильные опухоли, геномно-стабильные опухоли и опухоли с хромосомной нестабильностью. В подгруппе с вирусом Эпштейн-Барр, составляющей 15% от всех, выявлена повышенная экспрессия РD-L1, что говорит о выраженном присутствии иммунных клеток при раке желудка и позволяет использовать ингибиторы иммунных контрольных точек.
Было проведено исследование II фазы с использованием тремелимумаба – полностью гуманизированного моноклонального антигена анти CTLA-4 – в качестве 2-й линии терапии 18 больных раком желудка [16]. Хотя объективный ответ отмечен у 5% больных, медиана выживаемости составила 4,8 мес. и соответствовала таковой при лечении рака желудка с использованием химиотерапии.
Кроме того, можно предположить, что комбинация ингибиторов из 2 блокаторов иммунного ответа может быть более эффективна у больных с распространенным раком желудка. Новый препарат MEDI 4736 является моноклональным антигеном человека IgG1, который связывается с РD-L1 и предотвращает его связывание с РD-1 и СD-80. Полученные в I фазе предварительные данные показали многообещающий клинический эффект препарата при многих видах опухоли [17]. Сегодня продолжается несколько исследований MEDI 4736 как монотерапии, так и в комбинации с иммуномодуляторами, например, тремелимумабом.
Ниволумаб – антитело, которое блокирует взаимодействие между РD-1 и соответствующим лигандом РD-L1. Ниволумаб показал впечатляющую эффективность при многих видах опухолей. В декабре 2014 FDA одобрило ниволумаб для лечения нерезектабельной или метастатической меланомы после прогрессирования на ипилимумабе (и BRAF ингибиторе при наличии BRAF V600 мутации). Позже ниволумаб получил одобрение в качестве 2-й линии лечения при плоскоклеточном немелкоклеточном раке легкого. Основой тому послужило улучшение общей выживаемости в сравнении с доцетакселом (9,2 мес. vs 6,0 мес., HR 0,59, р=0,00025).
В настоящее время при раке желудка проводится I фаза исследований этого анти-PD-1 иммуностимулирующего антитела самостоятельно или в комбинации. Доклинические исследования показали, что двойная блокада РD-1 и СТLА-4 приводила к повышению выброса цитокинов и увеличивала пролиферацию СD8+ и СD4+ Т-клеток по сравнению с блокадой одного из рецепторов [18,19]. Продолжаются исследования Ib/II фазы по изучению активности ниволумаба в монотерапии или в комбинации с ипилимумабом у больных метастатическим раком желудка, раком поджелудочной железы, трижды-негативным раком молочной железы и мелкоклеточным раком легкого [20].
Пембролизумаб является высокоспецифичным гуманизированным моноклональным IgG4 антителом, которое блокирует взаимодействие PD-1 c его лигандами PD-L1 и PD-L2. Это антитело показало обещающие результаты у 135 больных метастатической меланомой в большом исследовании I фазы (KEYNOTE-001) [21,22]. Использование пембролизумаба привело к общему ответу у 26% больных и имело управляемый профиль токсичности. На этом основании FDA одобрило его для лечения меланомы. Недавно было проведено исследование по безопасности и активности пембролизумаба у больных раком желудка в I фазе, было скринировано 165 больных распространенным раком желудка и гастроэзофагального соединения [23]. 65 больных (40%) были PD-L1 позитивными (критерием служило окрашивание PD-L1 в строме или ≥1% опухолевых клеток), 39 из них получали пембролизумаб (10 мг/кг) каждые 2 недели. У 41% больных отмечено уменьшение опухоли. Общий ответ в азиатской популяции больных составил 32%, в неазиатской – 30%. Отмечено, что лечение больные перенесли хорошо, даже несмотря на то, что они предварительно получали серьезное лечение. Далее, были получены предварительные доказательства взаимосвязи между выживаемостью без прогрессии, ответом опухоли на лечение и экспрессией PD-L1.
Иммунотерапия в настоящее время выходит на передовую позицию. Получены неожиданные результаты, особенно при лечении меланомы, при которой этот терапевтический подход позволил улучшить выживаемость. При раке желудка, несмотря на некоторые результаты, требуется дальнейшее изучение этого вопроса. Кроме того, открытие эффективных биомаркеров позволило бы сделать важный шаг в определении групп больных, где иммунотерапия была бы оптимальной. Это могло бы не только увеличить количество больных, у которых возможен эффект от лечения, но также выделить больных, у которых возможно развитие выраженной токсичности. Такой подход поможет определить экономическую выгоду от лечения. Следовательно, дальнейшие клинические исследования могли бы быть посвящены изучению потенциальных биомаркеров, таких как экспрессия PD-L1, инфильтрации иммунными клетками (например, СD8/регуляторные Т-клетки и хемокины) и использования частоты мутаций в опухоли.
Читайте также:
