Сперматогенез при криодеструкции простаты. Андрогенная активность при деструкции простаты
Добавил пользователь Дмитрий К. Обновлено: 07.01.2026
Рак предстательной железы лечение 1, 2, 3 стадии. Симптомы, признаки, метастазы, прогноз.
Содержание:
Что такое предстательная железа?
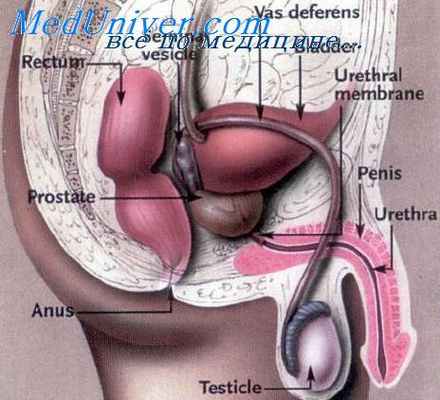
Предстательная железа это орган, являющийся частью мужской репродуктивной системы, расположенный в малом тазу у передней части прямой кишки, под мочевым пузырем.
Размер предстательной железы в норме примерно соответствует размеру грецкого ореха. Так как предстательная железа окружает начальный отдел мочеиспускательного канала (уретры), то при увеличении она может сдавливать уретру и препятствовать нормальному току мочи из мочевого пузыря.
Предстательная железа состоит из двух типов ткани – железистой и мышечной. Первая состоит из желез, вырабатывающих жидкость, которая входит в состав семенной жидкости. Мышечная ткань обеспечивает опорожнение желез при семяизвержении. Функция предстательной железы зависит от наличия в организме мужских половых гормонов (андрогенов), которые стимулируют рост ткани предстательной железы.
Какие бывают опухоли предстательной железы?
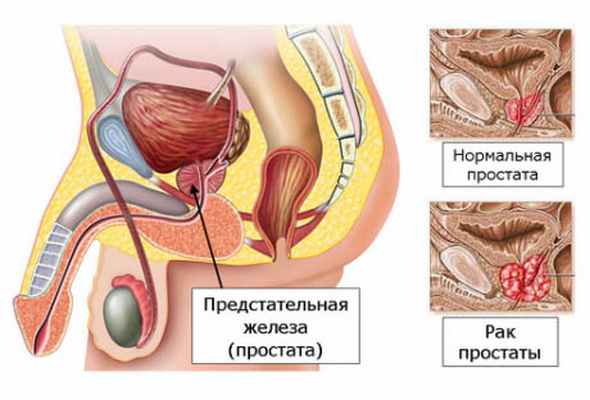
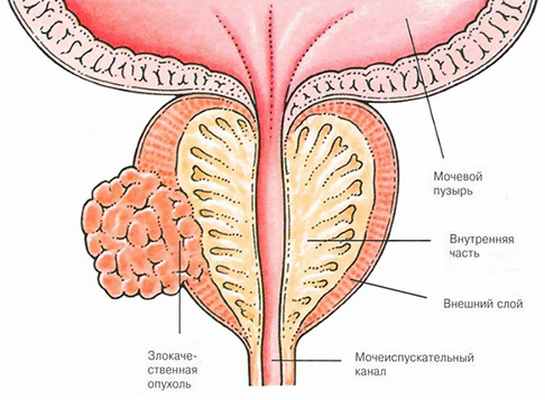
Наиболее распространенными заболеваниями предстательной железы являются простатит (воспаление предстательной железы) и доброкачественная гиперплазия предстательной железы (ДГПЖ), ранее ошибочно называемая "аденомой простаты".
ДГПЖ не является опухолью, а представляет собой избыточное образование нормальных клеток предстательной железы, когда железа увеличивается, сдавливает мочеиспускательный канал и создает препятствие нормальному току мочи.
Следует знать, что гиперплазия предстательной железы не может переродиться в злокачественную опухоль и развивается из других клеток, чем рак предстательной железы.
Однако наличие простатита или ДГПЖ, не исключает возможности наличия у мужчины рака предстательной железы.
ДГПЖ является распространенным заболеванием, частота которого увеличивается с возрастом.
Симптомы гиперплазии предстательной железы
Симптомы ДГПЖ встречаются у большинства мужчин старше 50 лет, а в возрасте старше 80 лет ДГПЖ выявляется более чем в 90 % случаев.
Наличие ДГПЖ само по себе не является показанием к лечению, но у некоторых мужчин имеются выраженные симптомы или осложнения ДГПЖ, которые нуждаются в лечении.
Из злокачественных новообразований наиболее часто встречается аденокарцинома, которая развивается из эпителиальных клеток желез предстательной железы и составляет 95 % всех случаев.
Довольно редко встречается переходно-клеточный рак и плоскоклеточный рак.
Еще более редко встречаются злокачественные неэпителиальные опухоли предстательной железы, информация о которых в данном материале не оговаривается.
Под термином "рак предстательной железы" обычно понимают именно аденокарциному, поэтому в дальнейшем речь будет идти только об аденокарциноме предстательной железы.
У кого чаще развивается рак простаты?
Далеко не всегда удается ответить на вопрос – почему один человек заболевает раком предстательной железы, а другой нет, тем не менее, известно, что у людей с определенными факторами риска РПЖ встречается чаще.
Исследования выявили следующие факторы риска для рака предстательной железы:
- возраст старше 65 лет. Возраст является основным фактором риска для рака предстательной железы. Большинство больных РПЖ старше 65 лет. Это заболевание редко встречается у мужчин моложе 45 лет;
- наследственность. Если кто-либо из ближайших родственников (отец, брат) болен раком предстательной железы, то риск заболевания возрастает в два раза. Если РПЖ выявлен у двух родственников, то риск возрастает более, чем в 5 раз;
- этническая принадлежность. Доказано, что рак предстательной железы чаще встречается среди представителей негроидной расы;
- некоторые морфологические изменения предстательной железы. Эти изменения на клеточном уровне выявляются только при биопсии предстательной железы): у мужчин с простатической интраэпителиальной неоплазией (ПИН) может быть повышен риск развития рака;
- генетическая предрасположенность. Выявлены определенные участки ДНК с генами, нарушения в которых повышают риск развития рака предстательной железы. Если у человека имеются генетические изменения в одном или более из этих участков, то вероятность развития РПЖ возрастает. Кроме того, другие исследования показали повышенный риск развития рака у мужчин с изменениями в конкретных генах, таких как BRCA1 и BRCA2.
Как часто встречается рак предстательной железы?
Рак простаты – очень распространенное заболевание. В мире РПЖ занимает 2-е место среди причин смертности от онкологических заболеваний у мужчин.
В Республике Беларусь уровень заболеваемости раком предстательной железы находится на 3 месте после рака кожи и легкого, и составляет 46,3 случая на 100 тыс. мужчин.
Как проявляется рак предстательной железы?
Рак предстательной железы может длительное время никак себя не проявлять. Обычно симптомы (признаки болезни) начинают проявляться с ростом и увеличением размеров опухоли.
Наиболее общие симптомы рака предстательной железы включают:
- нарушение мочеиспускания;
- затруднения при мочеиспускании (в первое время трудно начать мочиться или остановить поток мочи, в дальнейшем весь акт мочеиспускания протекает с большим усилием);
- боль или жжение при мочеиспускании;
- частые позывы к мочеиспусканию, особенно в ночное время;
- слабый поток мочи;
- нарушение эрекции;
- примесь крови в моче или сперме;
- частые боли в нижней части спины, в области таза или бедра.
Эти симптомы далеко не всегда связаны с наличием рака. ДГПЖ, инфекции мочевых путей и другие заболевания могут вызывать подобные симптомы. При наличии, каких либо из перечисленных выше проблем следует обратиться к врачу для прохождения обследования.
Диагностика рака предстательной железы
Рак предстательной железы может быть заподозрен при наличии вышеуказанных симптомов у пациента с факторами риска после проведения пальцевого исследования предстательной железы через прямую кишку (пальцевое ректальное исследование). Исследование позволяет определить размеры и плотность предстательной железы, а также наличие в ней опухолевых образований. Однако отсутствие каких-либо изменений по данным ректального исследования не исключает возможности наличия рака предстательной железы. В дальнейшем уточнить вероятность наличия рака, может помочь определение уровня в крови простат-специфического антигена (ПСА).
Простат-специфический антигена (ПСА)
ПСА – специфический белок, который образуется в клетках эпителия предстательной железы и секретируется в просвет желез предстательной железы. Некоторая часть ПСА попадает в кровоток, и может определяться в сыворотке крови. При наличии РПЖ уровень ПСА в крови может значительно повышаться.
Ранее считалось, что нормальное содержание ПСА в крови составляет 4 нг/мл и менее. В 2004 году были опубликованы данные исследования, которое показало, что при уровне ПСА
Поэтому в настоящий момент нет общепринятого значения "нормального" уровня ПСА в крови.
Увеличение уровня ПСА не всегда связано с опухолевым процессом и может наблюдаться в следующих случаях:
- наличие ДГПЖ;
- воспалительные заболевания предстательной железы (простатит);
- после езды на велосипеде;
- после полового акта;
- после урологических манипуляций (пальцевое ректальное исследование, цистоскопия, трансректальное УЗИ, биопсия предстательной железы).
Для получения наиболее "правильного" уровня ПСА, необходимо исключить возможные воздействия на предстательную железу и половые контакты за неделю до исследования. Если имеются явления простатита, следует предварительно пройти курс противовоспалительного лечения.
Учитывая сложность интерпретации данных уровня ПСА, оценивать анализ должен специалист, имеющий опыт диагностики и лечения рака предстательной железы.
Лечение рака простаты (предстатательной железы)
Хирургическое лечение рака простаты
1. Радикальная простатэктомия
Радикальная простатэктомия – операция, при которой полностью удаляется предстательная железа вместе с регионарными лимфатическими узлами. В основном эта операция выполняется при I-II стадии, но в ряде случаев, ее выполняют у пациентов с III стадией заболевания.
В ходе операции часто повреждаются нервы, проходящие рядом с предстательной железой и ответственные за эрекцию, в связи с чем после операции развивается эректильная дисфункция (частичное или полное отсутствие эрекции).
В некоторых случаях при малых размерах злокачественной опухоли возможно сохранение этих нервов, что может обеспечить сохранение эрекции. Но даже при сохранении эрекции после операции у мужчин отсутствует эякуляция (семяизвержение) и соответственно возможность зачать ребенка.
Если пациент планирует в дальнейшем завести детей, то перед проведением операции по лечению рака простаты необходимо обратиться в центр вспомогательной репродукции для консервации спермы и возможности в дальнейшем выполнить экстракорпоральное оплодотворение;
2. Трансуретральная резекция предстательной железы
трансуретральная резекция предстательной железы – операция, выполняемая для облегчения симптомов РПЖ при возникновении задержки мочи (невозможность самостоятельного мочеиспускания) в результате сдавления злокачественной опухолью мочеиспускательного канала.
При ТУРП невозможно удалить рак полностью, но возможно удалить часть опухоли, которая блокирует поток мочи. При этой операции на теле не делается разрезов. Операцию осуществляют с помощью специального инструмента – резектоскопа, который вводят через мочеиспускательный канал.
Онкологическую опухоль удаляют с помощью проволочной петли на конце резектоскопа, через которую проходит электрический ток большой мощности. Данное вмешательство позволяет пациенту восстановить самостоятельное мочеиспускание.
Лучевая терапия
При лучевой терапии используются высокие дозы рентгеновского или других видов облучения для уничтожения клеток рака и уменьшения опухоли. Этот метод лечения может быть использован при любой стадии рака.
Лечение рака простаты в Беларуси в нашем центре может быть двумя способами лучевой терапии
1. Дистанционная лучевая терапия
Дистанционная лучевая терапия это метод лечения, когда источник излучения находится на расстоянии от поверхности тела человека. Сеанс облучения длится несколько минут, более длительное время занимает процесс настройки и подготовки к лучевой терапии.
Обычно лечение проводят амбулаторно, 5 раз в неделю на протяжении 6 недель
2. Брахитерапия
Брахитерапия – вид лучевой терапии, когда при этом источник излучения помещают внутрь опухоли.
Лечение проводят в условиях стационара. В предстательную железу под наркозом вводятся полые иглы, через которые вводят радиоактивные зерна, которые остаются внутри предстательной железы. Источники такого излучения сохраняют свою активность в течение нескольких месяцев.
Основным недостатком лучевой терапии является то, что наряду с опухолевыми клетками, в процессе облучения повреждаются и близлежащие здоровые ткани. Поэтому после облучения могут наблюдаться кожные реакции в зоне полей облучения, частое и болезненное мочеиспускание, понос, боли и кровотечение из прямой кишки. Большинство этих явлений прекращаются вместе с прекращением лучевого лечения.
В современном виде метод брахитерапии рака предстательной железы, заключающийся в локальном облучении пораженного опухолью органа, начал применяться в США и Европе в 80–х годах прошлого столетия. В России этот метод радикального лечения рака предстательной железы используется с 2000 года (с использованием низкой мощности дозы, I125), а с 2008 года стали использоваться широко источники иридия (Ir 192) высокой мощности дозы.
Брахитерапия рака предстательной железы с использованием высокой мощности дозы используется в нашем Центре с 2008 года и зарекомендовала себя как надежный и эффективный метод лечения рака предстательной железы. Наши специалисты с большой ответственностью подходят к выбору диагностики и лечения данного заболевания. При обсуждении различных методов лечения, их преимуществ и недостатков, врачи всегда прислушиваются к мнению самого пациента и его родных.
По эффективности брахитерапия сравнима с радикальной простатэктомией, но имеет ряд преимуществ.
Преимущества высокодозной брахитерапии
- сохранение органа, ее структуры и половой функции;
- точность и равномерность распределения дозы излучения в предстательной железе;
- отсутствие источников излучения в организме после проведения брахитерапии;
- отсутствие радиационного воздействия на других людей;
- короткий курс лечения.
Брахитерапия хорошо переносится даже пожилыми людьми с тяжелыми сопутствующими заболеваниями. Уже на следующий день пациент может выписаться из клиники и вернуться к нормальной жизни. HDR–брахитерапия эффективна при лечении пациентов с низким, средним и высоким риском.
Доказано, что в группах онкологических пациентов с высоким риском сочетание наружной лучевой терапии с HDR–брахитерапией более эффективно, чем обычная лучевая терапия. Мы имеем большой опыт выполнения брахитерапии рака предстательной железы. Нами успешно пролечено более 500 человек.
Побочные действия:
В ближайший после процедурный период возможны учащенное мочеиспускание, примесь крови в моче, сперме, болезненные ощущения во время эякуляции. Иногда - задержка мочеиспускания, что требует установки катетера в мочевой пузырь.
В отделении брахитерапии имеются 2 самых современных брахитерапевтических комплекса с приставкой Swift и Oncentra prostate для лечения рака предстательной железы под контролем УЗИ в реальном времени и аппаратами "МикроСелектрон– HDR" и "Флекситрон".
Гормональная терапия
Цель гормонотерапии – снижение продукции мужского полового гормона (тестостерона), так как он усиливает рост клеток рака предстательной железы. Основным источником андрогенов в организме являются яички, кроме этого небольшое количество мужских половых гормонов вырабатывается надпочечниками.
Существует несколько способов снижения продукции организмом тестостерона:
1. Хирургическое удаление яичек (хирургическая кастрация).
Медицинское название этой операции – орхиэктомия. Орхиэктомия может быть выполнена как амбулаторная манипуляция, но, как правило, требует госпитализации и общего обезболивания.
Удаление яичек эффективно снижает продукцию тестостерона и облегчает боль, расстройства мочеиспускания и другие симптомы, связанные с РПЖ. Побочные эффекты этого вида лечения включают импотенцию и приливы жара (мужской климакс);
2. Медикаментозный способ (медикаментозная кастрация).
Для этого вида лечения используют препараты, представляющие собой аналоги природного лютеинизирующего гормона рилизинг-гориона (ЛГРГ). При применении аналогов ЛГРГ происходит прекращение выработки тестостерона яичками. Поэтому облегчается боль, расстройства мочеиспускания и другие симптомы, связанные с РПЖ.
Как правило, препарат вводится один раз в месяц в амбулаторных условиях, возможно самостоятельное введение препарата. На сегодняшний день существуют 3- и 6-месячные формы аналогов ЛГРГ. Кроме аналогов ЛГРГ для гормонотерапии используются другой класс препаратов – антиандрогены, которые блокируют связывание тестостерона с его рецепторами, и соответственно блокируют действие тестостерона.
Применение этих препаратов оправдано у молодых мужчин, желающих сохранить половую функцию;
Химиотерапия при лечении рака простаты
Химиотерапией называется использование лекарств, убивающих раковые клетки. Химиотерапия при раке предстательной железы используется в случае распространенного рака и при неэффективности гормонотерапии. Химиотерапия обычно проводится циклами.
Каждый цикл имеет период лечения и период отдыха. Побочные эффекты зависят от химиопрепарата и индивидуальной его переносимости. Для уменьшения повреждения здоровых тканей ведется контроль дозы и частоты введения химиопрепаратов.
Какой метод лечения более эффективен
Эффективность хирургического и медикаментозного метода одинакова, однако преимуществом медикаментозной гормонотерапии является возможность проведения прерывистого лечения и его отмены, что невозможно после удаления яичек.
Гормонотерапия РПЖ может использоваться отдельно или сочетаться с другими методами лечения, а также применяться для лечения рецидива заболевания.
Следует знать, что гормонотерапия не излечивает РПЖ, но может замедлить его рост, уменьшить размеры опухоли и облегчить симптомы, вызванные опухолью!
Какое наблюдение требуется после проведенного лечения
К сожалению, даже после проведения радикального лечения может наблюдаться повторное возникновение опухоли (рецидив). Поэтому врачи нашего онкологического центра в Белоруссии рекомендуют пациентам, прошедшим лечение по поводу рака предстательной железы, все же периодически проходить обследование.
Одним из важных компонентов обследования является анализ ПСА. Также обследование включает общий осмотр, анализы крови и мочи, может быть назначено УЗИ или компьютерная томография.
Сперматогенез при криодеструкции простаты. Андрогенная активность при деструкции простаты
Изменения простаты при криодеструкции. Результаты криодеструкции простаты
У животных контрольной группы, у которых вскрывали брюшную полость и разрезали стенку мочевого пузыря, не отмечалось структурных изменений ни в яичках, ни в предстательной железе. Хирургическое вмешательство сопровождалось кратковременным сдвигом экскреции андрогенов в ближайшие после операции сроки.
У собак, забитых в течение 1-й недели эксперимента, предстательная железа, как правило, была увеличена, имела мягкую консистенцию, была темно-багрового или багрово-красного цвета с диффузными кровоизлияниями под капсулой. На разрезе в центре долей железы наблюдалась начинающаяся секвестрация тканей. Мочевой пузырь был без видимых изменений.
Иногда в области рубца отмечались следы гиперемии кровеносных сосудов. Окружающие предстательную железу ткани не подвергались патологическим изменениям.
Ход и форма подходящих нервов и сосудов соответствовали норме, что свидетельствует об отсутствии изменений со стороны внешней иннервации и кровоснабжения органа.
На ангиорентгенограммах отмечены хорошо инъецированные подходящие к органу сосуды — правая и левая мочеполовые артерии с их восходящими и нисходящими ветвями. Собственное же артериальное сплетение предстательной железы не выражено, что свидетельствует о нарушении лишь внутриорганного кровоснабжения.
Нервные волокна внутриорганного нервного сплетения предстательной железы крупного и среднего калибра. Отдельные ацинарные полости окружены нервными сплетениями без заметных патологических изменений. Лишь в отдельных случаях можно было отметить нервные образования, окружающие ацинусы, с признаками гиперимпрегнации.
Следовательно, при криодеструкции сосудистые внутриорганные образования предстательной железы подвергаются патологическим изменениям в значительно большей мере, чем нервные.
При микроскопическом изучении предстательной железы у собак в ранние сроки после ее замораживания наблюдались явления острого альтеративного воспаления. Эпителиальные клетки претерпевали значительные дистрофические изменения с наличием кар йопикнотических или даже кар политических нарушений. В дитоплазме таких клеток отсутствовали интрацеллюлярные глыбки или гранулы секрета. Она имела однородную крупногранулярную структуру.
Миоэпителиальные элементы, также подвергались значительным дистрофическим и атрофическим изменениям.
В течение 3—5 мес после криовоздействия предстательная железа полностью атрофировалась. Границы клеток не определялись, их ядра почти не встречались. А там, где они сохранялись, претерпевали явления кариопикноза и даже криорексиса. Миоэпителиальные элементы полностью были защищены фиброзной, грубоволокнистой соединительной тканью, что следует рассматривать как переход хронического воспалительного процесса в склероз или цирроз органа.
Через год после криовоздействия паренхима предстательной железы состояла из огромных неправильной формы ацинарных полостей без содержимого, выстланных резко атрофичным эпителием. Вокруг ацинарных полостей, а также миоэпителиальных элементов развивалась плотная грубоволокнистая соединительная ткань. Подобные изменения свидетельствуют об атрофии железы и полной утрате функции.
Спустя 1,5 года интерстициальный эндокриноцит почти не попадал в поле зрения, а через 2—2,5 года— подностью отсутствовал. Фолликулярные поддерживающие клетки местами также были подвергнуты дистрофическим изменениям, однако в значительно меньшей степени, чем интерстициальный эндокриноцит.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Что такое криодеструкция, и как она поможет при раке простаты?
Рак предстательной железы - одно из онкологических заболеваний, первое по распространенности среди мужской части населения. Каждый год в мире обнаруживается до четырехсот тысяч больных с этим диагнозом, так что перспектива его развития пугает любого мужчину, не зависимо от его возраста и общего состояния здоровья. На сегодняшний день существует множество способов лечения рака предстательной железы, один из которых - криодеструкция при раке простаты.
Что представляет собой и как проводится криодеструкция?

Криодеструкция представляет собой наименее инвазивный метод воздействия на опухоль, то есть такой, который оказывает наименьшее негативное воздействие на организм в целом, и наименее опасен для пациента. Это воздействие на новообразование сверхнизких температур, в результате которого раковые клетки разрушаются, и без каких-либо затруднений выводятся из организма естественным путем. Здоровые ткани при таком подходе не страдают, а восстановление занимает самый короткий срок, какой только может занимать реабилитация ракового больного.
Проводится данная операция следующим образом:
- Больному в состоянии общей или местной анестезии вставляют зонды (полые внутри иглы) между анальным отверстием и мошонкой так, чтобы их острия выходили как раз к центру поражения предстательной железы.
- В мочевой пузырь вставляют катетер, через который внутрь подается теплая соленая вода. Нужно это для того, чтобы не произошло переохлаждение мочевого пузыря.
- В анальное отверстие вставляется трансректальный ультразвуковой датчик, которым определяется состояние новообразования во время операции. Кроме того, специальные приборы позволяют постоянно держать под контролем температуру внутренних органов, располагающихся в непосредственной близости.
- После того, как все подготовительные процедуры пройдены, начинается непосредственно операция: по зондам внутрь простаты подается строго дозированный криоагент (это может быть жидкий азот или аргон). Доза рассчитана строго на то, чтобы заморозить опухоль, не повредив здоровые участки. Как только пораженная область затвердевает, поступление криоагента прекращается. После оттаивания процедура повторяется снова. Обычно требуется несколько подходов, и операция занимает примерно пару часов.
- Как только последний подход закончен, зонды извлекаются из организма, а вот катетер остается в мочевом пузыре еще какое-то время спустя.
В каких случаях показана криодеструкция рака предстательной железы?
Надо сказать, что криохирургия - достаточно недавнее изобретение, и повсеместно она стала вводиться только в последние годы. Именно поэтому нет никаких точных данных о том, насколько эффективна операция такого типа в долговременной перспективе. Именно из-за этого, а также из-за особенностей ее воздействия на организм есть ряд особых показаний к ее применению.
- Стадия опухоли. Применяется процедура криодеструкции исключительно на начальной стадии, когда опухоль еще сравнительно не велика.
- Невозможность использования методов радикальной простатэктомии или лучевой терапии. Обычно связана с какими-либо специфическими патологиями у больного.
- Возраст пациента. Применяют криодеструкцию обычно в тех случаях, когда пациент уже преклонного возраста.
- Отсутствие эффекта от радиотерапии.
задать вопрос специалисту
Побочные эффекты и осложнения криодеструкции
В целом, как малоинвазивное воздействие, криодеструкция имеет малое количество осложнений, однако стоит все же иметь их ввиду. Кроме того, если криохирургия была назначена после неудачных попыток лечения радиотерапией, то негативный эффект от обеих методик может взаимно усиливаться. Вот основные проблемы, с которыми сталкивается пациент после криодеструкции рака предстательной железы:
Метаболические изменения у пациентов с раком предстательной железы при андроген-депривационной терапии
Рак предстательной железы является наиболее распространенным видом рака среди мужчин, а андрогенная депривационная терапия (АДТ) – наиболее эффективное лечение этого заболевания. Краеугольным камнем лечения рака предстательной железы является ингибирование выработки тестостерона, которое прерывает вызванный тестостероном рост опухоли предстательной железы. Резкое снижение уровня тестостерона, однако, имеет несколько нежелательных эффектов на метаболический профиль и метаболизм кости, а также может привести к усталости, потере либидо, гинекомастии и анемии, провоцировать вазомоторную гиперемию и в целом влиять на качество жизни. Из-за хорошей (длительной) выживаемости пациентов с раком предстательной железы побочные эффекты, связанные с лечением, имеют большое значение, и поэтому в каждой клинической ситуации преимущества АДТ необходимо сопоставлять с побочными эффектами, связанными с лечением. В настоящей статье основное внимание уделяется описанным метаболическим осложнениям АДТ, включая ожирение, диабет, изменения липидов, метаболический синдром и сердечно-сосудистые заболевания. Также содержатся практические рекомендации по управлению побочными эффектами и осложнениями, основанные на доступных руководствах, выпущенных профессиональными медицинскими сообществами.
Ключевые слова
Для цитирования:
For citation:
Рак предстательной железы является наиболее распространенной опухолью среди мужчин, средний возраст пациентов составляет ~68 лет. Эффективное систематическое лечение рака предстательной железы значительно улучшило ожидаемую продолжительность жизни этих пациентов, и, за исключением пациентов с метастатическим заболеванием, 5-летняя канцерспецифическая выживаемость составляет сегодня 98,8% [1]. Андроген-депривационная терапия (АДТ) является фундаментальным элементом лечения нелокализованного рака предстательной железы у пациентов с высоким риском заболевания, которым не предполагается радикальное лечение [2–4]. По оценкам различных авторов, 50% мужчин с раком предстательной железы проводится АДТ на разных этапах лечения [5]. АДТ улучшает общую выживаемость на 26% за 10 лет наблюдения у пациентов с локализованным и местно-распространенным заболеванием при сочетанном применении с лучевой терапией и использованием внешнего источника излучения [6, 7], хотя у мужчин с метастатическим поражением данная терапия способствует уменьшению боли [8–10]. У пациентов с раком предстательной железы применяют следующие методы АДТ.
Виды андроген-депривационной терапии
-терапия агонистами рилизинг-гормона лютеинизирующего гормона (ГнРГ);
-терапия антагонистами ГнРГ;
-максимальная (комбинированная) андрогенная блокада;
Существуют убедительные доказательства увеличения распространенности метаболических изменений (рис. 1) при проведении фармакологической АДТ у пациентов с раком предстательной железы [11].
Рис. 1. Метаболические изменения при андроген-депривационной терапии.
Метаболический синдром – это совокупность метаболических факторов риска развития сердечно-сосудистых заболеваний и сахарного диабета 2 типа (СД 2). Данные изменения стали более распространенными вместе с ростом ожирения во всем мире [12]. В 1988 г. Reaven описал резистентность к стимулированному инсулином поглощению глюкозы, гиперинсулинемию, увеличение липопротеинов очень низкой плотности, триглицеридемию, снижение липопротеинов высокой плотности (ЛПВП), гипертензию и в совокупности назвал их синдромом X. Reaven предположил, что основной причиной сердечно-сосудистых заболеваний является резистентность к инсулину, которая впоследствии приводит к гипертензии, гиперлипидемии и СД [13, 14]. Термин «метаболический синдром» применяется при наличии трех из следующих пяти факторов: уровень глюкозы в плазме натощак ≥6,1 и 1,7 ммоль/л; уровень ЛПВП в сыворотке крови 94 см, артериальное давление ≥140/90 мм рт.ст. [15]. Активное медицинское вмешательство, которое предполагает терапию отдельных компонентов этого синдрома, рекомендовано пациентам с наличием данных факторов риска [3, 16].
АДТ вызывает метаболические эффекты, которые приводят к изменению структуры тела и липидного профиля, повышают риск развития инсулинорезистентности, диабета и метаболического синдрома [17–19]. В некоторых исследованиях сообщается, что АДТ связана с развитием сердечно-сосудистой заболеваемости и смертности [20–23]. Существует принципиальная схема отличий побочных эффектов и метаболических осложнений АДТ (рис. 2). В данной статье основное внимание уделяется негативным воздействиям АДТ, особенно метаболическим изменениям.
Рис. 2. Побочные эффекты и метаболические осложнения андроген-депривационной терапии.
АДТ И МЕТАБОЛИЧЕСКИЙ СИНДРОМ
В 1941 г. Huggins, Hodges описали преимущества АДТ для пациентов с метастатическим раком простаты. Эта новаторская работа установила четкую связь между уровнем мужских половых гормонов в крови, раком предстательной железы и гормональной терапией как фундаментальной основой лечения [24]. Для пациентов с раком предстательной железы АДТ является методом лечения с доказанным механизмом эффективности [25].
АДТ вызывает высокую степень изменения метаболических параметров, что увеличивает риск развития метаболического синдрома. Действительно, некоторые исследования показали, что примерно у 36–55% мужчин, получающих АДТ в течение 12 месяцев и более, развивается метаболический синдром, независимо от возраста, расы и стадии рака предстательной железы [26–28].
Метаанализ, выполненный Alberti и соавт., включающий 9 обсервационных исследований [28] и одно когортное исследование [29], выявил большую распространенность метаболического синдрома – 60–75% в исследуемой популяции.
Braga-Basaria и соавт. сообщили результаты перекрестного исследования у пациентов с раком предстательной железы, которым проводилась длительная (более 12 месяцев) АДТ; отмечено, что был повышен риск развития резистентности к инсулину и гипергликемии [30]. В данном исследовании проанализированы три группы: пациенты с раком предстательной железы (n=18), которые находились на АДТ рецидивирующего или метастатического заболевания в течение ≥12 месяцев до включения в исследование; сопоставимые по возрасту мужчины с неметастатическим раком предстательной железы (n=17) после радикальной простатэктомии и/или лучевой терапии, но без АДТ; пациенты (n=18) с нормальным уровнем простат-специфического антигена (ПСА) [30]. Мужчины в группе АДТ получали терапию в течение 1–9 лет и имели более высокие уровни глюкозы и инсулина натощак, чем мужчины в двух других группах (р=0,002 и р=0,002 соответственно) [30]. Индекс массы тела (ИМТ) также был значительно выше в группе АДТ, чем в двух других группах (р=0,005). Эти данные позволяют предположить, что у пациентов, которые получают длительную АДТ, могут развиться побочные метаболические эффекты.
АДТ агонистами и антагонистами гонадотропин-рилизинг-гормона (ГнРГ) применяются для проведения терапии неметастатического или рецидивирующего рака после радикального лечения [25, 31] вместе с лучевой терапией для лечения первичной опухоли высокой степени прогрессирования. Тестостерон, основной андроген у мужчин, синтезируется в яичках и высвобождается в кровоток, где он связывается с глобулином, связывающим половые гормоны (ГСПГ) [32]. Андроген способствует росту мышечной массы и подавляет отложение жира [32]. Низкий уровень тестостерона и ГСПГ приводит к инсулинорезистентности, увеличивает количество абдоминального жира и частоту центрального ожирения [33]. Исследование пациентов без опухоли подтверждает, что низкий уровень тестостерона может независимо стимулировать инсулинорезистентность и метаболический синдром [34].
Метаболический синдром, возникающий на фоне проведения АДТ, имеет некоторые отличия от классического определения метаболического синдрома. При классическом метаболическом синдроме уровень ЛПВП снижается примерно на 5%, в то время как на фоне АДТ отмечается его увеличение [35, 36]. Метаболический синдром связан с низким уровнем адипонектина [37] и повышенным уровнем С-реактивного белка [38], в то время как у пациентов при АДТ уровни адипонектина повышаются, а уровень С-реактивного белка остается неизменным [39, 40]. Клиническое значение этих различий еще предстоит определить.
Следует отметить, что проведение АДТ приводит к более выраженным изменениям компонентов существующего метаболического синдрома у этих пациентов. Таким образом, скрининг метаболических нарушений до старта АДТ, тщательный мониторинг и корректировка лечения в зависимости от наличия и серьезности метаболических изменений имеют важное значение.
Различные исследования сообщают, что АДТ увеличивает содержание жира и триглицеридов и снижает чувствительность к инсулину [26, 36]. Однако метаболические изменения, вызванные АДТ, имеют характеристики, отличные от характеристик классического метаболического синдрома, так как АДТ увеличивает ЛПВП и подкожный жир, а не висцеральный абдоминальный жир [35, 36]. Хотя классический метаболический синдром связан с уменьшением адипонектина [37] и увеличением С-реактивного белка [41], АДТ повышает уровень адипонектина и не меняет уровень С-реактивного белка [42, 36]. Нами проведено сравнение метаболических эффектов, наблюдаемых при классическом метаболическом синдроме и применении АДТ (табл. 1).
Таблица 1. Сравнение метаболического синдрома и метаболических эффектов при андрогенной депривационной терапии.
Рациональная терапия рака предстательной железы

Рак предстательной железы (РПЖ) – одна из самых актуальных медицинских проблем во всем мире. Это связано, в первую очередь, с высокой заболеваемостью. Около 15% среди всех новообразований, регистрируемых в развитых странах, приходится на долю РПЖ (Heidenreich A., 2007).
В 2006 г. в Европе заболеваемость РПЖ составила 24% среди всех новообразований у мужчин, заняла 1 место в структуре заболеваемости, и явилась причиной смерти у 11% мужчин (Farley J., 2007). В России заболеваемость раком простаты составляет 18 на 100 000 мужского населения, прирост заболеваемости с 1994 по 2004 гг. составил 131,39% (1 место), среднегодовой прирост - 8,75%. Также отмечается высокая смертность от РПЖ (9,5 на 100 000 мужского населения) и наблюдается прирост смертности (с 1994 по 2004 гг. на 62,99%).
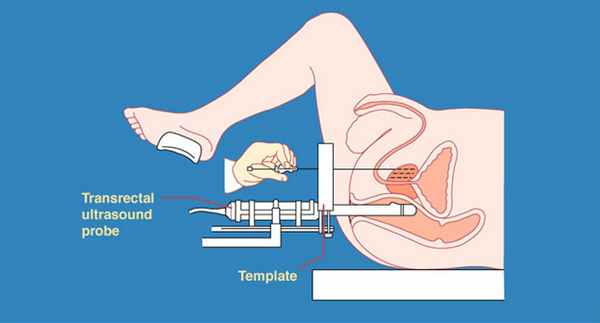
Учитывая то, что наилучшие результаты лечения РПЖ достигаются при наличии локализованной формы рака, огромное значение приобретает возможность раннего выявления опухоли, еще не имеющей клинических проявлений – так называемый скрининг рака простаты. При скрининге применяются три метода обследования пациента – контроль уровня простатоспецифического антигена (ПСА), пальцевое ректальное исследование (ПРИ) и трансректальное ультразвуковое исследование простаты (ТРУЗИ).
ПСА – это гликопротеин, вырабатываемый секреторным эпителием простаты. Было установлено, что при злокачественной опухоли количество ПСА в сыворотке крови может значительно повышаться, однако увеличение уровня ПСА в ряде случаев может быть связано и с другими заболеваниями простаты – простатитом и аденомой предстательной железы. На сегодняшний день пороговый уровень ПСА, который может свидетельствовать о наличии РПЖ, остается неясным, однако наиболее часто пороговым для мужчин в возрасте до 60 лет считают уровень 2,5—3 нг/мл (Guidelines EUA 2008).
При определении тактики лечения учитываются стадия опухоли и степень дифференцировки, возраст больного, наличие клинических проявлений заболевания, вероятность длительного безрецидивного периода, риск осложнений, а также пожелания пациента.
У больных с наличием тяжелых интеркуррентных заболеваний, со скромной ожидаемой продолжительностью жизни (менее 10 лет), при отсутствии клинических проявлений локализованных форм рака простаты 1-2 стадии с высокой и умеренной дифференцировкой опухоли возможно бдительное наблюдение (Watchful Waiting). Активное наблюдение таких пациентов с регулярным контролем ПСА, ПРИ, ТРУЗИ с целью раннего выявления возможного прогрессирования рака и перехода к агрессивной тактике лечения, показывает лучшие результаты выживаемости пациентов по сравнению с немедленным назначением гормональных препаратов. Поэтому проведение гормональной терапии у больных раком простаты 1-2 стадии Европейской ассоциацией урологов не рекомендуется.
Радикальная простатэктомия рекомендована к выполнению у пациентов, не имеющих выраженной сопутствующей патологии и с ожидаемой длительной продолжительностью жизни (более 10 лет). При правильном отборе больных радикальная простатэктомия позволяет добиться прекрасных результатов 10- и 15-летней выживаемости – 90 и 82% соответственно. Важнейшими прогностическими факторами, влияющими на исход операции, являются степень дифференцировки опухоли (сумма баллов по шкале Глисона), стадия заболевания и предоперационный уровень ПСА. Наилучший прогноз имеют больные с суммой баллов по шкале Глисона менее 7 и стадией Т1. Высокий предоперационный уровень ПСА является неблагоприятным прогностическим признаком в отношении рецидива болезни.
Лучевая терапия показана пациентам с локальными формами РПЖ (Т1-Т2), желающим избежать хирургического лечения или имеющим высокий операционно-анестезиологический риск, а также больным со стадией Т3N0M0. Кандидаты для лучевой терапии должны иметь достаточно долгую ожидаемую продолжительность жизни. У пациентов с высоким риском поражения лимфоузлов (ПСА>10 нг/мл, сумма баллов по шкале Глисона >7) желательно предварительное выполнение лапароскопической тазовой лимфаденэктомии. Одним из эффективных методов лучевого воздействия на предстательную железу при лечении стадии Т1-Т2 является применение брахитерапии или интерстициальной лучевой терапии. Сущность брахитерапии заключается во введении под контролем УЗИ в предстательную железу гранул радиоактивного I125. При этом, в отличие от дистанционной лучевой терапии, окружающие ткани практически не поражаются. Процедура введения капсул занимает около часа и проводится в амбулаторных условиях, что выгодно отличает ее от других видов лучевого лечения.
В настоящее время внедряются новые методы лечения локализованного РПЖ, такие как криотерапия, лазеротерапия, сфокусированный высокоинтенсивный ультразвук.
Гормональная терапия (андрогенная депривация) является основным методом лечение местно-распространённого и диссеминированного РПЖ, она эффективна более чем в 85% случаев. У больных РПЖ стадии Т3 с отсутствием клинических симптомов заболевания, наличием высоко- или умеренно дифференцированных опухолей, ожидаемой продолжительностью жизни менее 10 лет возможно применение бдительного наблюдения (отсроченное лечение).
В настоящее время андрогенная депривация достигается кастрацией (химической или хирургической), применением антиандрогенов, комбинацией первых двух методов (максимальная андрогенная блокада) и редко, как терапия второй линии, использованием женских половых гормонов (эстрогенов).
Наиболее дешевым и быстрым методом достижения кастрационного уровня тестостерона является билатеральная орхидэктомия. Преимуществами хирургической кастрации являются дешевизна, независимость от степени финансирования лечения, надежность. Учитывая отрицательный психологический эффект хирургической кастрации, широкое распространение получили методы медикаментозной кастрации аналогами лютеинизирующего гонадотропин-рилизинг гормона (а-ЛГРГ). Через три недели после начала лечения наступает снижение сывороточного тестостерона до посткастрационных значений. Недостатком медикаментозной кастрации является дороговизна препаратов я и прямая зависимость от финансирования лечения.
С появлением новых современных фармакологических препаратов стало возможным назначение антиандрогенов в качестве монотерапии. Ряд исследований показал эффективность и безопасность монотерапии нестероидным антиандрогеном бикалутамид (Касодекс) в дозе 150 мг/сутки при лечении пациентов, желающих сохранить либидо и потенцию, хотя результаты исследований последних лет показали лучшие результаты кастрации по сравнению с антиандрогенами. Для получения эффекта кастрации дозу бикалутамида рекомендуют повысить до 300-600 мг (Tyrrell CJ. BJU international 2006). Повышение дозы антиандрогенов сопровождается увеличением количества побочных эффектов (диарея, гепатотоксичность, кардиотоксичность, инфаркт миокарда, стенокардия, тромбоэмболия, ожирение, дислипидэмия, сахарный диабет, остеопороз), которые резко снижают качество жизни пациентов.
Для устранения андрогенов яичкового и надпочечникового происхождения применяется максимальная андрогенная блокада (МАБ). МАБ подразумевает применение антиандрогена в комбинации с ЛГРГ или орхидэктомией. Преимущества МАБ над монотерапией аналогами ЛГРГ в отношении улучшения общей выживаемости остаются спорными. Лучшие результаты выживаемости больных с местно-распространенным РПЖ достигаются при отсроченном назначении антиандрогенов по сравнению с немедленным их применением. При метастатической болезни рекомендуется немедленное назначение антиандрогенов (Isbarn H. et al., 2009).
Диагноз «гормонорезистентный рак предстательной железы» (ГРРПЖ) устанавливается при наличии роста уровня ПСА и/или каких-либо других признаков прогрессирования заболевания при адекватной андрогенной блокаде с подтвержденным кастрационным уровнем тестостерона. Изначально большинство раковых опухолей простаты представлены тремя популяциями клеток: андрогензависимые клетки, для развития которых требуется андрогенная стимуляция; андрогенчувствительные клетки – они не погибают при отсутствии андрогенов, но их рост при этом замедляется; андрогеннезависимые клетки – для их роста не требуются андрогены. Прогрессирование заболевания на фоне проводимой гормонотерапии связано с гибелью андрогенозависимых клеток и ростом клона андрогннезависимых. В то же время возможна первичная гормонорезистентность рака простаты, на долю которой приходится 15-20% случаев.
Одним из методов, направленных на предотвращение развития гормональной резистентности РПЖ, является интермитирующая андрогенная блокада (ИАБ). Концепция ИАБ состоит во временной андрогенной блокаде, при которой частично сохраняются стволовые опухолевые клетки. При достижении определенного ответа терапию антиандрогенами прекращают, чтобы дать возможность роста новым клонам андрогенчувствительных клеток. Терапия возобновляется в случае прогрессирования симптомов заболевания и роста ПСА. Данный метод позволяет отложить развитие гормонально-резистентного состояния клеток рака. ИАБ имеет положительные моменты, связанные с низкой токсичностью и снижением стоимости лечения.
В 1993 г. H. Scher и W. Kelly сообщили, что отмена флутамида у пациентов с максимальной андрогенной блокодой приводит к снижению ПСА, симптоматическому ответу и объективному улучшению. Многочисленные исследования подтвердили этот эффект и у других антиандрогенов, включая бикалутамид, нилутамид, ципротерон и даже прогестерон. Это явление было названо «Эффект Удаления Антиандрогенов». Отмена антиандрогенов в настоящее время является первым стандартным действием при выявлении прогрессирования заболевания на фоне гормональной терапии у больных РП в США. Европейской ассоциацией урологов рекомендуется отменить антиандрогены, если они были назначены, с момента установления прогрессирования заболевания. Эффект отмены антиандрогенов может наблюдаться в течение 4 - 6 нед после прекращения терапии флутамидом или бикалутамидом.
В последние годы разрабатываются эффективные схемы полихимиотерапии гормонорезистентного рака предстательной железы (ГРРПЖ). Доцетаксел в дозе 75 мг/м2 каждые 3 нед показал существенные преимущества в увеличении выживаемости по сравнению с другими схемами химиотерапии у больных метастатическим ГРРПЖ. У больных метастатическим ГРРПЖ с наличием симптомов поражения костной ткани как доцетаксел, так и митоксантрон с преднизолоном или гидрокортизоном являются эффективными схемами химиотерапии. Ведется поиск новых эффективных лекарств терапии ГРРПЖ: блокаторы эндотелин А-рецептора, играющего ключевую роль в прогрессии ГРРПЖ – ZD4054; таргетные препараты - бевасизумаб, афлиберсепт и противоопухолевые вакцины - G-VAX, Provenge.
Таким образом, широкое внедрение скрининговых программ позволят диагностировать ранние формы рака простаты, при которых радикальные методы лечения показывают хорошие результаты выживаемости больных. Рекомендуется бдительное наблюдение (отстроченное лечение) асимптомных пациентов пожилого и старческого возраста с наличием тяжелой сопутствующей патологии не только при ранних локализованных стадиях рака простаты, но и при местно-распространенных. Немедленное гормональное лечение показано только пациентам с метастатической формой болезни. Самым эффективным способом андрогенной депривации является кастрация (медикаментозная или хирургическая). Использование антиандрогенов должно быть ограничено только случаями прогрессии болезни на фоне кастрации. При стабилизации процесса рекомендуется делать перерыв гормонального лечения под контролем уровня ПСА и анализа симптомов. Возобновить лечение следует при первых же признаках прогрессии болезни. Такая тактика ведения больного позволяет отсрочить время наступления гормонорезистентности, улучшить качество жизни, снизить стоимость лечения без ущерба выживаемости. Рекомендуется отменить антиандрогены, если они были назначены, с момента установления прогрессирования заболевания. Использование полихимиотерапии с включением таксанов позволяет улучшить результаты лечения гормонорезистентного рака простаты. Важным методом лечения больных раком предстательной железы с метастазами в кости явилось использование бисфосфонатов.
Читайте также:
