Связывание лекарств с белками плазмы. Распределение лекарства при передозировке
Добавил пользователь Алексей Ф. Обновлено: 24.01.2026
СВЯЗЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ С БЕЛКАМИ ПЛАЗМЫ : ТОЧКА ЗРЕНИЯ АНЕСТЕЗИОЛОГА
Margaret Wood, Vanderbilt Univercity , Nashville, Tennessee
Именно свободная, или несвязанная фракция препарата свободно проникает через мембраны, таким образом, что равновесная концентрация в межклеточной жидкости будет определяться именно несвязанной формой препарата. В общем, чем больше уровень связывания препарата с белками плазмы крови, тем меньше лекарства может выйти за пределы сосудов, и тем меньше будет объем его распределения. Например, исследование отношения между объемом распределения такого препарата, как пропроанолол, и концентрацией свободной фракции показывает, что объем распределения повышается с увеличением свободной фракции. Итак, частичный объем распределения является показателем как распределения, так и связывания препарата.
Обычно при расчетах этой величины пользуются общей концентрацией препарата в плазме. Поскольку только свободная фракция в плазме и проникает во все остальные ткани, то использование величины общей концентрации может дать ошибочные результаты, поскольку связанная форма в распределении не участвует. Для препаратов, которые хорошо связываются с белками, очень важно рассчитать объем распределения препарата. Эффект влияния связывания с белками на объем распределения может быть проиллюстрирован при использовании тиопентала, как прототипа. Свободная фракция тиопентала в плазме повышается с 15.7% у здоровых до 28% у больных с почечной недостаточностью, что указывает на снижение связывания тиопентала при патологии почек. В результате биодоступность препарата увеличивается и увеличение объема распределения (высчитанное с использованием общей концентрации препарата) у больных с почечной недостаточностью будет равным 3.0 л/кг. Если связывание с тканями не изменено, то объем распределения не будет зависеть от связывания препарата с белками, и в случае тиопентала, объем распределения свободной фракции у здоровых и больных будет практически одинаковым ( 12.0 л/кг и 11.5 л/кг соответственно).
Измерение и интерпретация связывания препарата с тканями является одной из самых интересных проблем современной фармакологии, поскольку разработаны новые методы оценки данного процесса. Современные данные в литературе базируются в основном на результатах эксперимента на животных или анализе посмертных тканей. К сожалению, метод оценки этого процесса у живого человека является инвазивным, однако исследования в этой области могут дать много новой важной информации о фармакокинетике многих препаратов и конкуренции при их распределении.
Предположим, что свободные концентрации препарата в плазме и в ткани равны:
Но объем распределения в ткани равен:
Исходя из уравнения 3, он равен
где Ср = общая концентрация в плазме, Ст= общая концентрация в ткани, Vd ss = изначальный объем распределения, V p = объем плазмы, V t = объем ткани, Fр= свободная фракция препарата в плазме и F t = свободная фракция препарата в тканях.
Итак, из уравнения 4, объем распределения зависит от связывания препарата как с белками крови, так и с белками плазмы. Для хорошо растворимых в липидах препаратов, которые в равной степени связываются как с плазмой, так и с тканями, и поэтому легко проникают через мембраны клеток, объем распределения свободной фракции будет равен количеству воды всего тела. Итак, если взять простейший пример препарата, который в равной мере связывается как плазмой, так и тканями, то мы получим следующее: fp = ft , отсюда fp/ft =1, Vdss = Vp + Vt = вода всего тела ( из уравнения 4).
Для препаратов, которые не очень хорошо растворимы в липидах и поэтому с трудом проходят через мембраны, объем распределения будет равен объему всей межклеточной жидкости. Наименьший такой объем равен объему плазмы. Объем распределения, равный объему плазмы возможен только тогда, когда препарат так сильно связывается плазмой, что свободная фракция его в плазме близится к нулю, и тогда, когда его связывание в тканях равно нулю и, следовательно, свободная фракция в тканях приближается к 100 %. Итак, из уравнения 4, если fp --> 0, то Vd ss = Vp . Лекарства, которые хорошо связываются с белками плазмы, но не очень хорошо- с белками тканей ( fp/ft <1), имеют объем распределения больше объема плазмы, но меньше количества воды всего тела. Напротив, препараты, которые более интенсивно соединяются с белками тканей ( fp/ft >1), имеют объемы распределения, большие количества воды всего тела. Для препаратов, которые очень сильно связываются с белками тканей, свободная фракция их в ткани будет очень низкой, скажем, 1%, а свободная фракция их в плазме будет приближаться к 100%. Итак, если fp/ft>1,
то Vdss = Vp + Vt [100/1] ( из уравнения 4). Однако, Vp + Vt примерно равны объему воды всего тела, и поэтому Vdss примерно в 100 раз превысит объем воды всего тела, что демонстрирует, что для препаратов, хорошо связывающихся с белками тканей, Vd больше объема воды всего тела.
Антипирин, который минимально связывается как с белками плазмы, так и с белками тканей, и для которого и fp, и ft достигают 100%, имеет объем распределения, примерно равный объему воды всего тела ( fp/ft =1, Vdss = Vp +Vt ).
Уровень связывания препарата с белками плазмы является важным фактором при распределении препарата между матерью и плодом, поскольку только несвязанная, то есть свободная фракция препарата может проходить через плаценту. Связывание с плазмой бупивакаина выше в плазме матери, чем в плазме у новорожденного (в связи с тем, что у новорожденного концентрация АГК ниже) и во время родов, после эпидуральной анестезии бупивакаином, общая концентрация бупивакаина в крови из пупочной вены будет ниже, чем в венозной крови матери. Бупивакаин хорошо связывается белками плазмы крови матери и поэтому только очень маленькая свободная фракция участвует в распределении и проходит через плаценту. Однако, свободная фракция бупивакаина в венозной крови матери и в крови из пупочной вены плода сразу после родов одинаковы. Поскольку только свободная форма может занять рецептор и оказать фармакологический эффект, эти эффекты будут одинаковы, несмотря на разницу общих концентраций бупивакаина в крови матери и плода. Это - хороший источник всяких конфузов, поскольку некоторые препараты считаются наиболее безопасными для использования в акушерской практике именно вследствие их более низкой общей концентрации в крови новорожденного, чем в крови матери, причем в этом случае никто не принимал во внимание различную связывающую способность плазмы крови матери и плода, что может очень серьезно повлиять на эффективную концентрацию препарата в крови новорожденного или плода.
Время полуэлиминации препарата ( t 1/2 ) зависит как от объема его распределения (Vd), так и от клиренса препарата (Cl).
Изменения связывания препарата с белками могут влиять как на объем распределения, так и на клиренс препарата, иногда в совершенно противоположных направлениях, поэтому очень трудно предсказать общий эффект изменений связываемости на время полужизни.
Снижение связывания тиопентала с белками плазмы у больных с хронической почечной недостаточностью в результате вышеописанных причин не привело к изменению времени его полужизни, поскольку изменились как объем распределения, так и клиренс препарата.
Все лекарственные препараты могут быть разделены на две группы в соответствии с той скоростью, с которой они удаляются, проходя через печень человека. Такие препараты, как пропранолол, морфин и лидокаин, которые быстро удаляются из крови при их прохождении через печень относятся к препаратам с высоким уровнем экстракции, тогда как препараты, плохо удаляемые печенью, к ним относятся варфарин и толбутамид, считаются препаратами низкого уровня экстракци. Их фармакокинетика всегда считалась зависящей от активности ферментов печени, тогда как кинетика препаратов высокого уровня экстракции зависит только от печеночного кровотока. Это может быть выражено следующим уравнением, которое пригодно для использования относительно любого органа:
Клиренс (Cl)= Q * E,
где Q = органный кровоток и Е= показатель экстракции.
Влияние связывания препарата с белками на печеночный клиренс зависит от показателя экстракции препарата. Для препаратов с высоким уровнем экстракции, для которых Е=1, клиренс должен равняться кровотоку. Таким образом, для них клиренс зависит практически только от кровотока, поскольку весь препарат, который проходит через орган, будет удален из крови, вне зависимости от того, связан он с белком, или нет. Например, показатель экстракции для пропранолола составляет около 80% и пропранолол хорошо связывается с белками: его свободная фракция составляет 5-10 %. Изменения в связи препарата с белками мало влияют на печеночный клиренс пропранолола, поскольку показатель экстракции в несколько раз больше величины свободной фракции и поэтому препарат как бы "отрывается" от белков плазмы при прохождении его через печень. Большая часть препарата, проходящего через печень, удаляется вне зависимости от того, связан он с белками или нет. Поэтому для препаратов с высокими показателями экстракции печеночный клиренс зависит только от кровотока и не зависит от уровня их связывания с белками.
С другой стороны, для препаратов с низким индексом экскреции, например, для варфарина, уровень из связывания с белками в значительной степени ограничивает их печеночный клиренс. Если у препарата низкий показатель печеночной экстракции и он хорошо связывается с белками плазмы крови, печеночный клиренс ограничен и очень чувствителен к изменениям связываемости препарата с белками. Изменения связывания изменяют величину свободной фракции, которая доступна для печеночных клеток, поскольку показатель экскреции меньше, чем свободная фракция (в данной ситуации). Если препарат имеет низкий показатель экстракции и плохо связывается с белками (то есть величина его свободной фракции велика ), то его печеночный клиренс ограничен и практически нечувствителен к изменениям связывания препарата с белком.
Таким образом, выше были описаны два типа элиминации препаратов: один из них ограничен величиной свободной концентрации препарата, то есть это будет называться ограниченной элиминацией, а другой является неограниченной, то есть из плазмы будет удаляться как связанная, так и не связанная форма препарата. Ограниченная элиминация наблюдается, когда показатель экстракции меньше, чем величина свободной фракции препарата, а неограниченная элиминация наблюдается тогда, когда показатель экстракции выше, чем величина свободной фракции. Примерами препаратов с ограниченной элиминацией являются хорошо связывающиеся с белками фенитоин, вальпроат натрия и диазепам, примерами препаратов, элиминация которых не ограничена являются пропранолол и лидокаин. Для препарата, который полностью элиминируется печенью, верно следующее уравнение:
где f b = свободная фракция препарата в крови, Q= печеночный кровоток, Cl fint = клиренс свободной фракции и Cl H = печеночный клиренс.
Для препаратов с высоким клиренсом тогда, когда значение Clint большое по сравнению со скоростью доставки препарата в печень, то клиренс будет практически равен кровотоку в печени (Clint>> Q и ClH = Q ) и значение свободной фракции практически не будет влиять на клиренс, до те пор, пока fb не станет очень маленькой, примерно 0.25%.
Из общего для всех органов уравнения (Cl = Q*E), можно сделать вывод, что уровень экскреции или почечный клиренс тех препаратов, которые хорошо выводятся почками, практически равен почечному кровотоку и целиком зависит от него и относительно нечувствительен к изменениям связываемости препарата с белком. Напротив, клиренс тех препаратов, которые плохо выводятся почками, очень чувствителен к изменению их связи с белками.
Препараты могут подвергаться клубочковой фильтрации, активной секреции и / или реабсорбции. Те препараты, которые только фильтруются, дают ультрафильтрат и для них,
где f u = свободная фракция препарата в плазме и GFR= cкорость клубочковой фильтрации.
Поскольку альбумин не проходит в норме через мембрану клубочка, та часть препарата, которая связана с альбумином, не может быть профильтрована, и только свободная фракция проходит через почечный фильтр. Поэтому скорость клубочковой фильтрации препарата обратно пропорциональна уровню его связанности с белком. Препараты, которые выводятся преимущественно путем клубочковой фильтрации и к тому же хорошо связываются с белком, имеют очень длительное время полужизни.
Только свободная фракция лекарственных препарата активно секретируются почечными канальцами. Для того, чтобы поддержать равновесие между свободной и связанной фракциями, снижение концентрации свободной фракции должно сопровождаться распадом комплекса белок-препарат. Аналогично описанному выше процессу элиминации в печени, этот процесс может быть достаточно быстрым - тогда показатель экскреции будет превышать величину свободной фракции, что указывает на то, что во время прохождения препарата через почки он "отрывается от белка". Примером такой ситуации может служить пеннициллин, который хорошо связывается с белками и очень быстро выводится почками в связи с очень высокой канальцевой секрецией и минимальной реабсорбцией. Поскольку его почечный клиренс нечувствителен к изменению связанности препарата с белками, то такой клиренс будет называться неограниченным.
Почечный клиренс уменьшается, если к остальным процессам прибавляется процесс канальцевой реабсорбции. Интенсивная реабсорбция может так уменьшить коэффициент экстракции, что препарат попадет в группу длительно удаляемых. Если реабсорбируется какая- то постоянная часть препарата (F R ) и секреции нет, то справедливо следующее уравнение:
Это уравнение показывает, что и в этом случае почечный клиренс прямо пропорционален величине свободной фракции.
Дигитоксин хорошо связывается с альбумином, но имеет низкий почечный клиренс вследствие его интенсивной канальцевой реабсорбции. Однако, почечный клиренс дигитоксина прямо пропорционален свободной фракции дигитоксина.
Известно, что лекарственные препараты могут взаимодействовать друг с другом, при этом могут наблюдаться нежелательные эффекты или снижение терапевтической активности препаратов. Назначаемые вместе препараты или эндогенные вещества могут конкурировать за рецептор для присоединения к белку, что выражается в конкурентных взаимодействиях. Снижение связывания препарата с белком или его вытеснение с места связывания могут усилить действие препарата, однако, поскольку обычно несколько таких процессов проходят параллельно, то результат может быть непредсказуемым. Одновременное назначение второго препарата может вызвать вытеснение первого с рецептора на белке, но концентрация этого второго препарата должна обязательно достигать молярной концентрации мест для связывания, а иначе конкуренция будет невозможной. Любое энодогенное или экзогенное вещество, связывание которого зависит от концентрации (увеличение свободной фракции с увеличением общей концентрации) в терапевтических концентрациях может вызвать такие процессы . Примерами таких препаратов являются фенилбутазон и сульфаниламиды.
Фармакологический эффект при смещении одного из препаратов зависит от того, по какому пути идет элиминация препарата - неограниченному или ограниченному. Для препаратов, элиминация которых зависит от уровня их связывания белками, повышение свободной фракции в результате вытеснения, результат будет следующим: большое количество препарата выйдет из плазмы в ткани. Это приведет к увеличению объема распределения, поскольку пространство для распределения препарата увеличится. При продолжающемся введении препарата общая концентрация постепенно вернется к исходной, однако клиренс препарата увеличится, поскольку увеличится свободная фракция препарата , а именно от нее зависит уровень клиренса (см. раздел о влиянии связывания препарата на его рапределение). Это увеличение клиренса и возвращает общую концентрацию к исходному уровню, однако общая концентрация препарата при этом уменьшается. Таким образом, после возвращения в исходное состояние величина свободной фракции увеличивается, а общая концентрация препарата уменьшается, что, в принципе, мало отражается на эффекте препарата и его токсичности. Однако, для тех препаратов, клиренс которых не зависит от их связывания с белками при повышении величины свободной фракции в результате конкурентных взаимодействий увеличивается и объем распределения, при продолжении их введения общая концентрация возвращается к своей исходной величине, поскольку клиренс изменяться не будет. Увеличение свободной фракции вызывает последующее увеличение общей концентрации, поэтому возможность развития побочных и токсических эффектов увеличивается.
Это практическое значение конкурентных взаимодействий определяется уровнем связывания препарата с белками, уровнем экстракции препарата в печени и терапевтическим действием препарата.
Многие конкурентные взаимодействия описаны для препарата, который плохо экстрагируется и его элиминация ограничена - варфарина. Варфарин очень хорошо связывается с альбумином и описаны его конкурентные взаимодействия с хлоралгидратом, клофибратом и фенилбутазоном. Конкурентные взаимодействия между сульфафеназолом и препаратом с низкой экстракцией толбутамидом могут играть определенную роль в развитии тяжелых гипогликемических реакций. Было сделано предположение, что назначение сульфафеназола может усиливать действие тиопентала натрия в связи с тем, что он вытесняет тиопентал с рецепторов на белках. Однако, не для всех конкурентных взаимодействий верен именно этот механизм, поскольку в данном случае наблюдается и изменение метаболизма препарата и изменения его токсических свойств.
Местный анестетик бупивакаин хорошо связывается с белками плазмы крови и имеет малую терапевтическую широту, что указывает на то, что при конкурентных взаимодействиях можно ожидать появления токсических побочных эффектов. Дифенилгидантион, хинидин, промедол и дезипирамин in vitro вытесняют бупивакаин с рецепторов, тогда как диазепам не оказывает такого действия, однако нельзя сказать, что эти экспериментальные данные можно переносить на человека. Бупивакаин вытесняет с рецепторов мепивакаин in vitro, что указывает на то, что конкурентные взаимодействия могут происходить и между анестетиками амидной группы.
Все врачи понимают, что практически для всех препаратов существует тесная взаимосвязь между их общей концентрацией в плазме и эффектом. Однако, для тех препаратов, которые хорошо связываются с белками плазмы крови, эффект (будь он терапевтическим или токсическим) может принципиально зависеть от величины свободной фракции препарата в плазме крови , таким образом, понимание факторов, влияющих на связывание препарата с белками плазмы крайне важно для грамотной интерпретации взаимоотношения эффекта и концентрации препарата.
Связывание многих препаратов с белками плазмы может уменьшаться или увеличиваться в зависимости от большого количества патофизиологических факторов, что приводит к важным изменениям фармакокинетики и фармакодинамики. Измерение в плазме или цельной крови общей концентрации препарата может привести к неоправданному увеличению терапевтической дозы препарата, что таит в себе большую опасность, или же врач может удариться в другую крайность - назначить слишком малую дозу препарата. Итак, насколько это возможно, следует вводить в практику измерение свободной концентрации препарата как метод мониторинга его концентрации во время лечения.
Связывание лекарств с белками плазмы. Распределение лекарства при передозировке
Альбумин является наиболее важным белком плазмы, связывающим кислые лекарства. Конкуренция за участки связывания, присутствующие на альбумине, приобретает клиническую значимость для лекарств, связывающихся более чем на 80%, особенно если связывание превышает 90%. При столь высокой степени связывания любое небольшое изменение величины связанной фракции приведет к значительным изменениям величины свободной фракции, т.е. фракции, от которой зависят фармакологические эффекты.
Многие основные лекарства связываются с глобулиновой фракцией (например, с альфа-кислым гликопротеином). Интерпретация клинического значения этого взаимодействия осложняется тем, что данный белок представляет собой реагент острой фазы и его концентрация относительно быстро меняется и неодинакова у различных индивидов. Концентрация а-кислого гликопротеина повышается с возрастом, при воспалительных заболеваниях и остром патологическом стрессе.
При передозировке выбор наиболее подходящей среды для определения концентрации лекарства зависит от его химических свойств. Кислые лекарства концентрируются в плазме, поэтому кровь является наиболее подходящей средой для определения их концентрации. Основные лекарства, независимо от пути их введения, целесообразно определять в просвете желудка. Диффузия основных лекарств в желудке приводит к почти полной их ионизации в этой среде. Если градиент концентрации остается постоянным, основные лекарства концентрируются в желудке до тех пор, пока не возникнет равновесие распределения неионизированной фракции. Прием бикарбоната для подщелачивания мочи может увеличить длительность действия амфетамина. В результате такого подщелачивания возрастающая фракция амфетамина в моче присутствует в неионизированной форме и быстро реабсорбируется через люминальную поверхность почечных канальцев.
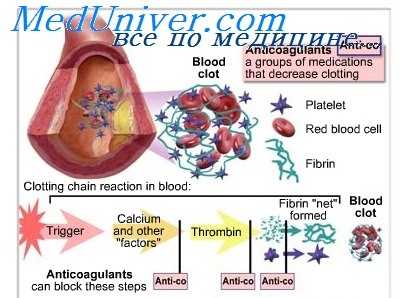
Анатомические и физиологические факторы, способствующие дифференциальному распределению лекарств. Анатомическая и биохимическая природа гематоэн-цефалического барьера влияет на способность лекарственных веществ проникать в головной мозг. Диффузия из капилляров мозга жестко ограничена клеточными зонулами; они усиливают барьерный эффект на пути диффузии лекарств в мозг. Однако существуют 4 области мозга, где этот барьер отсутствует: гипофиз, эпифиз, дно 4-го желудочка мозга и капилляры хориоидеи.
Хориоидея содержит также транспортеры, удаляющие заряженные молекулы из спинномозговой жидкости (СМЖ). В норме СМЖ не содержит белков, поэтому концентрация лекарства в СМЖ сходна с концентрацией свободного лекарства в крови.
Все лекарства проходят через плаценту и поступают в материнское молоко (если не доказано обратное). Лекарства диффундируют через плаценту, однако равновесие между матерью и плодом устанавливается медленнее вследствие ограниченного плацентарного кровотока. Если не доказано обратное, следует полагать, что все лекарства проходят через плаценту и поступают в материнское молоко. Клиническое значение присутствия лекарств в плаценте и молоке следует оценивать индивидуально для каждого препарата.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Связывание лекарств с белками плазмы
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Молекулы лекарственного вещества могут присоединяться к многочисленным белкам крови. При этом образуются комплексы лекарства с белком.
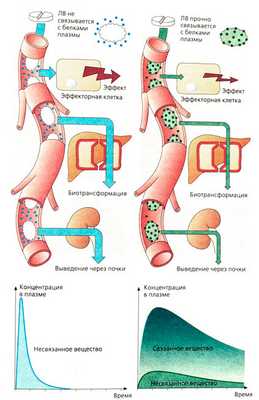
Из белков плазмы в комплексообразовании участвуют чаще всего альбумины, реже — бета-глобулины и кислые гликопротеины. Другие белки плазмы (например, транскортин, трансферрин, тироксинсвязывающий белок) связывают в комплексы другие специфические вещества. Прочность связывания зависит от концентрации реагирующих веществ и сродства лекарственных веществ к белкам. Концентрация альбуминов в плазме составляет 4,6 г/100 мл (0,6 мМ), и поэтому они имеют очень высокий потенциал связывания лекарства. Сродство лекарств к белкам плазмы (КЬ ~ 10_3-10-5 М) обычно значительно ниже, чем к рецепторам. Поэтому для большинства лекарств связывание с белками плазмы практически пропорционально концентрации (исключения: салициловая кислота и некоторые сульфаниламиды). Другими словами, для большинства лекарств при терапевтических концентрациях полного насыщения альбуминов не происходит.
Молекула альбумина имеет центры связывания анионов и катионов. Комплексообразование может происходить за счет ионных и отчасти вандерваальсовых сил. Количество связанного вещества коррелирует с его гидрофобностью.
Связывание с белками плазмы происходит очень быстро и обратимо, поэтому любое изменение концентрации несвязанного вещества приводит к соответствующим изменениям концентрации связанного вещества. Связывание с белками плазмы имеет большое значение, так как непосредственно влияет на концентрацию несвязанного лекарства, которая определяет: 1) эффективность лекарства и 2) скорость его выведения.
При одинаковой общей концентрации лекарственного вещества (например, 100 нг/мл) его активная концентрация при 10% связывании с белками плазмы составляет 90 нг/мл, при 99% связывании — лишь 1 нг/мл. Снижение концентрации свободного вещества вследствие связывания с белками сказывается также на биотрансформации (например, в печени) или выведении через почки, так как лишь свободная часть лекарственных веществ из плазмы может проникнуть в гепатоцит или быть профильтрована почками.
При снижении концентрации свободного вещества вследствие биотрансформации или выведения почками происходит его высвобождение из комплекса с белками. Связанное с белками лекарство представляет собой депо, которое, с одной стороны, снижает активность вещества, но, с другой, увеличивает длительность его действия из-за замедления выведения.
Если два вещества имеют сродство к альбумину, то возникает конкуренция за связывание с ним. Вещество может вытеснить из комплекса с белком другое лекарство, и тогда действующая концентрация этого второго вещества возрастает (это один из видов взаимодействия лекарственных веществ). При повышении концентрации лекарственного вещества возрастает его эффективность и усиливается выделение.
При понижении концентрации альбуминов в плазме (заболевания печени, нефротический синдром, плохое общее самочувствие) изменяется фармакокинетическое поведение лекарств, образующих комплексы с альбуминами.
После попадания в кровь лекарственные средства могут связываться с молекулами белка, которые присутствует в большом количестве, что приводит к образованию комплексов лекарственное средство-белок.
К связывающим белкам относятся в основном альбумин и в меньшей степени β-глобулины и кислые гликопротеиды. Другие белки плазмы (транскортин, трансферрин, тироксинсвязывающий глобулин) выполняют специализированные функции по связыванию определенных веществ.
Степень связывания зависит от концентрации реагентов и аффинитета лекарственного вещества к конкретному белку. Концентрация альбумина в плазме составляет 4,6г/100 мл (или 0,6 ммоль/л) и поэтомуобусловливаеточень высокую связывающую способность (два места на молекулу). Как правило, лекарственные средства обладают гораздо меньшим аффинитетом (KD - 10 -5 -10 -3 М) к белкам плазмы, чем к специфическим связывающим местам (рецепторам).
В диапазоне терапевтически значимых концентраций связывание белков с большинством лекарственных средств повышается линейно с концентрацией (исключения: салицилат и определенные сульфаниламиды).
В молекуле альбумина имеются разные места связывания анионных и катионных лигандов, а также действуют силы Ван-дер-Ваальса. Степень связывания коррелирует с гидрофобностью лекарственного вещества (лекарственное средство вытесняется из воды).
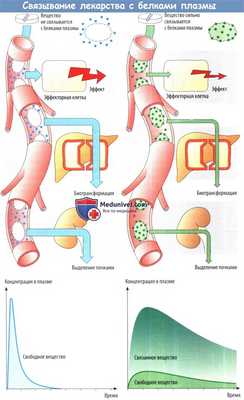
Связывание с белками плазмы — это быстрый и обратимый процесс, т. е. за любым изменением концентрации несвязанного лекарственного вещества немедленно следует соответствующее изменение связанной концентрации. Связывание белками имеет большое значение, т. к. именно концентрация свободного лекарственного вещества определяет интенсивность действия.
При данной общей концентрации в плазме (предположим, 100 нг/мл) эффективная концентрация составит 90 нг/мл для лекарственного вещества, связанного с белком на 10%, но 1 нг/мл для лекарственного вещества, связанного с белком на 99%. Снижение концентрации свободного лекарственного вещества в результате связывания с белками влияет не только на интенсивность действия, но и на биотрансформацию (в печени) и выделение почками, и, лишь свободное лекарственное средство поступая в печень, осуществляющую метаболизм, или подвергается клубочковой фильтрации.
При падении концентрации свободного лекарственного вещества недостаток восполняется за счет связанного с белком количества. Связывание белком плазмы аналогично депонированию для увеличения времени действия за счет задержки выделения, но при этом снижается интенсивность эффекта. Если два вещества обладают аффинитетом к одному и тому же участку связывания в молекуле альбумина, они начинают конкурировал за это место.
Одно лекарственное средство может вытеснить другое с места связывания и тем самым повысить уровень свободной (действующей) концентрации замещенного лекарственного вещества (вид лекарственного взаимодействия). Увеличение свободной концентрации замещенного лекарственного вещества означает повышение эффективности и ускорение выведения.
Снижение концентрации альбумина (при заболевании печени, нефротическом синдроме, плохом общем состоянии) приводит к изменению фармакокинетики лекарственных средств, которые в значительной степени связываются с альбумином.
Лекарственные средства, связанные с белками плазмы, которые являются субстратами переносчиков, выводятся из крови с высокой скоростью. Например, парааминогиппурат выводится почечными канальцами, а сульфобромофталеин — печенью. Скорость клиренса этих веществ можно использовать для определения почечного или печеночного кровотока.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
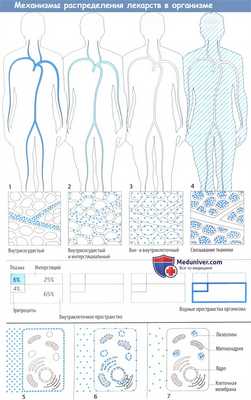
Механизмы распределения лекарств в организме
Лекарственное средство после захвата организмом распределяется в кровь и через нее в различные ткани организма. Распределение может ограничиваться внеклеточным пространством (плазма + интерстициальное пространство) или может включать и внутриклеточное пространство.
Некоторые лекарственные средства активно связываются тканевыми структурами, поэтому их концентрации в плазме значительно падают еще до начала выделения.
После распределения в кровь макромолекулы остаются в основном в сосудистом пространстве, т. к. они не могут проникнуть через гистогематический барьер или даже фенестрированный эндотел ий капилляров. Это свойство используется при потере крови, когда необходимо восполнить объем циркулирующей крови, например, путем инфузии растворов с декстраном.
Более того, в сосудистом пространстве преимущественно находятся вещества, обладающие высоким аффинитетом к белкам плазмы (определение объема плазмы с помощью связанных с белком красителей). Несвязанное (свободное) лекарственное средство покидает кровоток, но с различной скоростью, т. к. гистогематический барьер имеет неодинаковое строение в сосудах различных органов. Эти локальные отличия не показаны на приведенных рисунках.
Распределение в организме определяется свойством проникать сквозь мембранные барьеры. Гидрофильные вещества (инулин) не захватываются клетками и не связываются структурами клеточной поверхности, поэтому могут использоваться для определения внеклеточного объема жидкости. Липофильные вещества диффундируют сквозь клеточную мембрану; в результате достигается равномерное распределение в жидкостях организма.
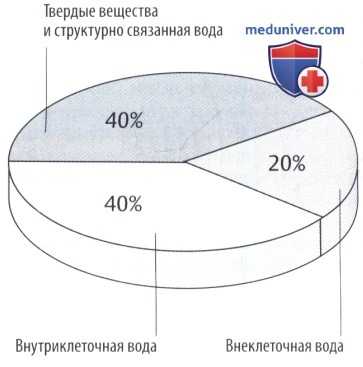
Масса тела может снизиться, как показано на секторной диаграмме. Другие подразделы указаны на рисунке ниже.
Отношение объема интерстициальной/внеклеточной жидкости варьирует в зависимости от возраста и массы тела. В процентном отношении объем интерстициальной жидкости высокий у недоношенных детей или у здоровых новорожденных (до 50% массы тела) и снижается при ожирении и старении.
Концентрация (с) раствора соответствует количеству (D) вещества, растворенного в объеме (V); из этого следует, что с = D/V. Если известна доза лекарственного препарата (D) и его концентрация в плазме (с), то можно вычислить объем распределения (V) по формуле: V=D/c. Тем не менее это кажущийся (теоретический) объем распределения (Vapp), т. к. при расчете предполагается равномерное распределение в организме.
Равномерное распределение нехарактерно при связывании лекарственных средств клеточными мембранами или мембранами внутриклеточных органелл либо при накоплении внутри органелл. В таких случаях концентрация в плазме уменьшается и Vapp может превысить фактическую величину имеющегося объема жидкости. Наоборот, если значительная часть молекул лекарственного вещества связана с белками плазмы, то с увеличивается, а вычисляемый Vapp может быть меньше, чем биологическое значение.
Читайте также:
- Классификация переломов акромиального конца ключицы
- Причины синдрома Марфана. Пролапс митрального клапана
- Диагностика и лечение пневмонии, признаки и симптомы
- Клеточная терапия печеночной недостаточности. Клетки печени, стволовые клетки
- Температура при декомпрессии. Влияние температуры на декомпрессию
