Угнетение кроветворения полонием. Перераспределение полония в организме
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
В ходе развития лучевой болезни (ЛБ) возникает нарушение механизмов регуляции процессов кроветворения и кровераспределения, усиливается и извращается кроверазрушение с недостаточной утилизацией продуктов распада крови.
6.2.1.1.1.Изменения костного мозга
В период начальных реакций лучевой болезни происходит энергичное поступление нейтрофильных лейкоцитов из костного мозга в кровь, т.е. в периферической крови наблюдается нейтрофильный лейкоцитоз, появляется большое количество сегментоядерных, палочкоядерных и юных форм. В соотношении клеток белого и красного ряда происходит относительное увеличение клеток красной крови, т.е. в самом начале ЛБ в периферической крови увеличивается количество эритроцитов и нейтрофилов.
Общее количество клеток красного костного мозга уменьшается вследствие их ускоренного выхода на периферию и прекращения образования новых молодых клеток крови.
В дальнейшем в зависимости от дозы облучения с разной интенсивностью прогрессирует опустошение костного мозга за счёт как белой, так и красной крови.
Вначале в костном мозге возникает полнокровие, очаги кровоизлияния, плазматического пропитывания, а затем и очаги, где кроветворение отсутствует и идёт замещение жировой тканью. Число и размеры этих очагов быстро увеличиваются и они сливаются. При острой лучевой болезни (ОЛБ) на 7-10 день костный мозг полностью
замещается жировой тканью. В результате развивается лейкопения, а при тяжёлых и смертельных формах ЛБ – алейкемия.
Таким образом, при лучевой болезни, с одной стороны, подавляется дифференцировка клеток ретикулярного синцития костного мозга, вырабатывающих клетки крови, а, с другой стороны, сам процесс кроветворения так нарушается, что часть клеток погибает, а часть ускоренно заканчивает своё развитие и поступает в ток крови, часть же переходит в плазматические формы.
В случаях выздоровления его начало характеризуется и началом восстановления кроветворения. Костный мозг быстро заполняется кроветворной тканью и процесс регенерации протекает в высоком темпе. Полная же регенерация растягивается на значительный интервал времени.
При хронической лучевой болезни (ХЛБ) динамика изменений костного мозга и кроветворения иная.
В случаях внешнего облучения малыми дозами на протяжении длительного времени костный мозг не претерпевает существенных изменений, иногда наблюдается умеренная гиперплазия. При внутреннем облучении последняя более выражена.
Начальный период ХЛБ характеризуется колебаниями показателей крови как в сторону лейкопении, так и в сторону лейкоцитоза. Затем постепенно развивается угнетение кроветворения с уменьшением количества лейкоцитов, тромбоцитов и ретикулоцитов на 30-50% от исходного уровня, сменяющееся стабилизацией полученного состояния. В последующем у разных животных в разные сроки начинают нарастать признаки нарушения кроветворения, иногда по типу злокачественного малокровия с прогрессированием анемии, т.е. развивающейся декомпенсации кроветворения.
При ХЛБ развитие аплазии кроветворной ткани костного мозга протекает менее бурно, чем при ОЛБ. Обнаруживаются сохранившиеся участки кроветворения, хотя последнее и находится в подавленном и извращённом состоянии. Мегакариоциты почти отсутствуют, а встречающиеся более мелкие имеют уродливые формы. Наблюдается распад клеток белой и красной крови с явлениями их фагоцитоза.
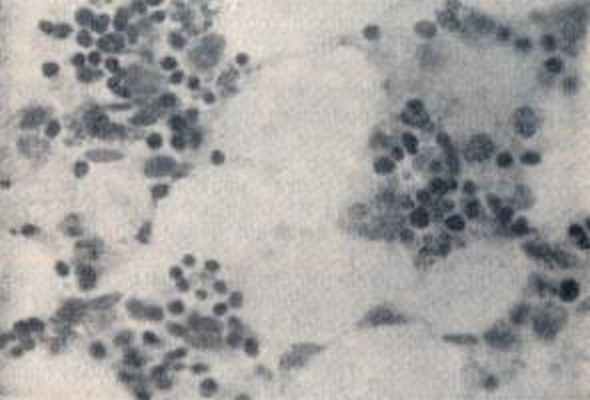 | Костный мозг собаки через 24 часа после облучения (5 Гр). Начальные явления гибели части клеточных элементов и неравномерное их распределение. |
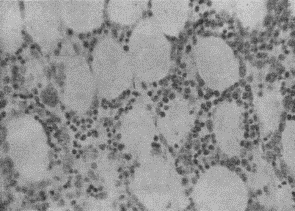 | Костный мозг собаки через 3 суток после облучения (5 Гр). Уменьшение дифференциации клеток красного и белого ряда при сохранности ретикулярных клеток и отдельных мегакариоцитов. |
| | Костный мозг собаки через 3 суток после облучения (5 Гр). Участки сохранившейся миелоидной ткани. |
| | Костный мозг собаки через 9 суток после облучения (6 Гр). Опустошение клеточных элементов. |
| | Костный мозг собаки на высоте заболевания через 10 суток после облучения (6 Гр). Единичные ретикулярные клетки, остатки кроветворной ткани. |
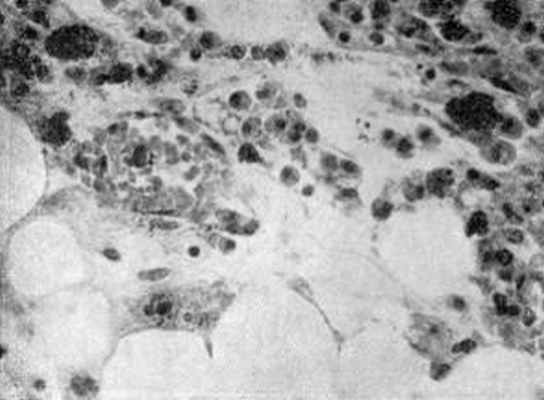 | Костный мозг собаки через 13 дней после подкожного введения полония (0,1 мкКи/кг массы животного). Значительная убыль клеток кроветворной ткани, набухание ретикулярных клеток, образование клеток плазматического типа. |
Рис. 6.1. Микрофотограммы костного мозга собаки после
острого облучения. (Н.А. Краевский, 1957).
6.2.1.1.2.Изменения лимфатических узлов
Установлена особо высокая чувствительность лимфоузлов и всей лимфопоэтической системы к действию ионизирующих излучений. Поэтому с самого начала заболевания ОЛБ развивается нарастающая лимфопения на фоне нейтрофилёза.
Вначале в лимфоузлах, в основном в центре фолликулов, наблюдается распад малых лимфоцитов и лимфобластов, распространяющийся на весь лимфоузел. Общее число лимфоцитов в нём резко сокращается. В ретикулярных клетках отмечаются набухание и фагоцитоз, а они сами становятся основной клеточной формой лимфоузла.
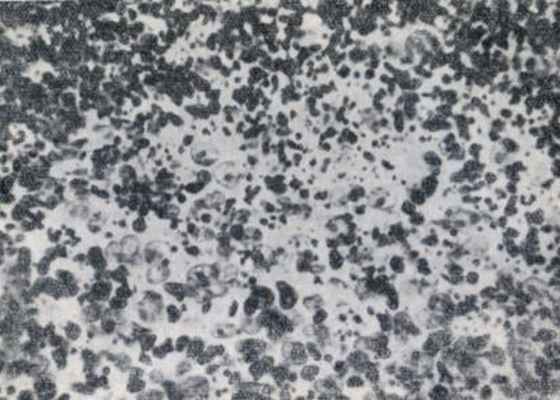 | Через 1 час после облучения. Доза облучения 6,5 Гр. Начало распада лимфоцитов в центре фолликула. |
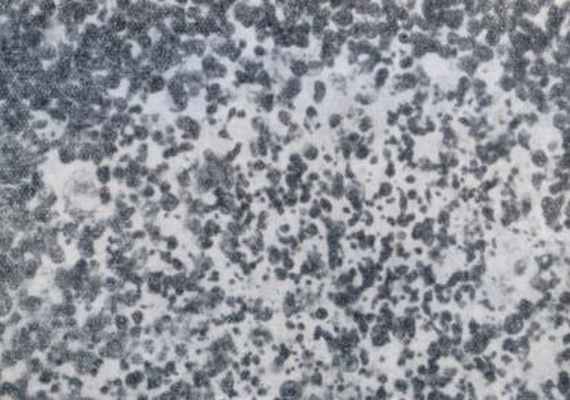 | Через 2 часа после облучения. Доза облучения 6,5 Гр. Продолжающийся распад лимфоцитов. |
 | Через 6 часов после облучения. Доза облучения 6,5 Гр. распад лимфоцитов распространяется на весь фолликул. |
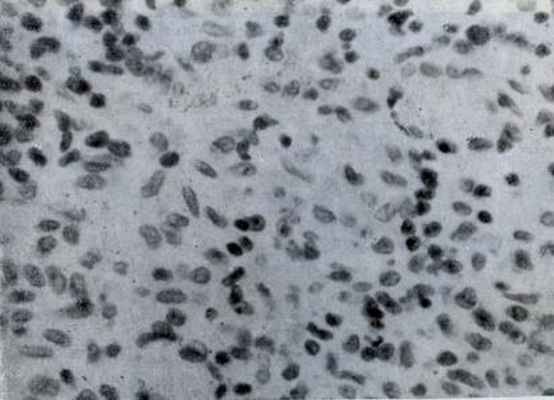 | Через 5 суток после облучения. Доза облучения 6,5 Гр. Опустошение фолликула, сохранились в основном ретикулярные клетки |
Рис. 6.2. Микрофотограммы лимфатических узлов крыс после облучения. (Н.А. Краевский, 1957).
На высоте заболевания лимфоузлы значительно увеличиваются в размерах, в них развиваются отёк и кровоизлияния, а затем атрофия. В просветах расширенных синусов накапливаются эритроциты и наблюдаются эритрофагия и гемосидероз.
К моменту выраженных клинических проявлений ЛБ лимфопоэз в лимфоузлах прекращается, но в период регенерации он частично восстанавливается.
При ХЛБ, особенно если она вызвана внутренним облучением, степень изменений определяется разновидностью изотопа и характером его распределения в организме. Тропные к лимфатической системе, как, например, полоний, оказывают на неё значительно более выраженный эффект.
Установлено, что при ХЛБ по мере подавления костно-мозгового кроветворения в лимфоузлах формируется экстрамедуллярное кроветворение, но только в период до развития апластической анемии с атрофией костного мозга.
Аналогичны изменения и в солитарных фолликулах пищеварительного тракта и в миндалинах.
6.2.1.1.3.Изменения селезёнки
С учётом некоторых различий в гемопоэзе в селезёнке у различных видов животных сущность и последовательность изменений при ЛБ аналогичны тем, что наблюдаются в других органах системы кроветворения.
Вследствие облучения после весьма короткого по времени усиления кроветворения наступает резкое подавление лимфопоэза с ичезновением лимфоцитов. Вначале происходит распад лимфатических элементов с явлениями карио- и плазморексиса (распад на глыбки) и прогрессирующим уменьшением размеров фолликулов. Затем последние становятся неразличимыми. Пульпа селезёнки приобретает однородный вид и становится бедной клеточными элементами. Преобладают ретикулярные и плазматические клетки, располагающиеся в небольшом количестве вокруг центральных артерий и в синусах около трабекул.
При подостром течении ОЛБ и ХЛБ наблюдается выраженная эритрофагия, накапливается гемосидерин.
Селезёнка уменьшается в размерах и по массе, резко ослабевает её депонирующая функция.
 | Поглощённая доза 5 Гр. Обеднение пульпы лимфоидными элементами с почти полным исчезновением фолликула. |
Рис. 6.3. Микрофотограмма селезёнки собаки через 10 суток
после облучения. (Н.А. Краевский, 1957).
В период выздоровления восстановление протекает медленно.
Таким образом, при лучевом поражении и лучевой болезни наблюдаются глубокие изменения в органах кроветворения со снижением и извращением кроветворной функции. Форменные элементы крови повреждаются в разной мере, что приводит к их усиленной гибели со снижением утилизации продуктов распада и проявляющейся в виде нарастающего гемосидероза.
Помимо подавления процесса кроветворения возникают и качественные его изменения, ведущие к нарастанию числа плазматических костных форм.
Отмечается определённая последовательность в развитии изменений органов кроветворения.
Вначале возникают кратковременная активация процесса кроветворения, а затем нарастающий распад клеточных форм и снижение их образования.
В латентный период, несмотря на прогрессирующее угнетение кроветворения, на периферии ещё сохраняется некоторый уровень состава белой и красной крови, как результат мобилизации резервных возможностей системы.
На высоте заболевания наблюдаются опустошение органов кроветворения и значительный дефицит клеток в периферической крови, особенно белой, - состояние декомпенсации.
Период выздоровления характеризуется восстановлением кроветворения за счёт уцелевших клеток ретикулярного синцития.
Выше указанная периодичность характерна для ОЛБ. При ХЛБ периодичность носит стёртый характер, смена периодов растянута во времени, на протяжении всего заболевания отмечаются признаки регенерации.
Следует отметить, что при ХЛБ могут развиться три основные группы так называемых заболеваний крови: 1) типа апластической анемии; 2) типа злокачественного малокровия; 3) истинный лейкоз.
Угнетение кроветворения полонием. Перераспределение полония в организме
Угнетение кроветворения полонием. Перераспределение полония в организме
В равной мере демонстративными бывают признаки угнетения кроветворения в селезенке, лимфатических узлах и костном мозге. С первого же дня в селезенке и лимфатических узлах происходит распад лимфоцитов в центральной части и на периферии фолликулов.
Поэтому в разгар заболевания остается только узкая зона из немногочисленных зрелых лимфоцитов, а на всей площади лимфатического фолликула преобладают ретикулярные и плазматические клетки, богатые рибонуклеиновой кислотой [Куршакова Н. Н., 1958, 1961].
В расширенных синусах появляется большое количество макрофагов с признаками эритрофагии, фагоцитоза клеточного детрита, кровяного пигмента и а-частиц.
Гистоавторадиографические исследования показывают, что а-частицы включаются в ретикулярные клетки красной пульпы, эндотелий кровеносных сосудов и в клетки лимфатических фолликулов, хотя в последних радиоактивных частиц, как правило, содержится меньше, чем в красной пульпе.
Однако это, по-видимому, является особенностью распределения в селезенке не только 210Ро, но и других u-излучателей, образующих в организме коллоидные комплексы. В частности, такая же особенность отмечена Э. Р. Любчанским и А. П. Ни-фатовым (1972) и в отношении 241Am.

Можно выделить фазы перераспределения 210Ро в селезенке: максимального накопления излучателя (1—5-е сутки), уменьшения концентрации на 13—15% (5—10-е сутки), кратковременного увеличения концентрации (10—15-е сутки) и постепенного уменьшения [Парфенов 10. Д., Соловьев А. И., 1972].
Через 2 нед полнокровие красной пульпы становится меньше, а в лимфатических фолликулах имеются некоторый полиморфизм и увеличение числа клеток за счет незрелых лимфоидных форм и плазматических клеток. Однако даже к концу месяца, несмотря на значительное уменьшение содержания альфа-излучателя, полного восстановления клеточного состава селезенки не наступает.
Судя по подсчетам альфа-треков на стандартных площадях гисторадиоавтографов, изменение концентрации 210Ро и скорости выведения его из белой и красной пульпы существенно отличаются. В частности, на 10-е сутки после введения излучателя непосредственно в кровь концентрация альфа-частиц в белой пульпе уменьшается почти на 50%. а в красной — всего лишь па 15% по отношению к максимальному содержанию их в течение первых 5 сут.
Аналогичная морфологическая картина наблюдается и в лимфатических узлах. Вместе с тем в костном мозге независимо от пути поступления 210Ро в организм на гисторадиоавтографах определяется равномерно диффузное распределение а-частиц по всем клеточным элементам кроветворной ткани.
Наибольший уровень активности отмечается в конце l-й педели, когда заметно уменьшается количество кроветворных клеток. К концу 2-й недели опустошение костного мозга выражено еще значительнее за счет гибели и резкого снижения воспроизводства клеток крови, причем исчезновение клеток красного ростка крови наступает позже, чем белого [Красвский 11. Л., 1957; Петрович II. К, 1961]. Тем не менее некоторое количество зрелых форм мнелопдного и эритроцитарного ряда сохраняется даже в разгар заболевания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Токсикология радиоактивных веществ - Плутоний
Существенно влияет на всасывание Pu в ЖКТ состав пищевого рациона, различные добавки могут увеличивать накопление радионуклида в организме или способствовать его более быстрому выделению. Салливан и другие представили результаты шести экспериментов по изучению влияния пищевых рационов на абсорбцию азотнокислого 238 Pu у крыс после внутрижелудочного введения. Крыс содержали на рационах, состоявших из цельного молока, сухого молока, различных молочных добавок промышленного производства, апельсинового сока или содержавших недостаток Са либо витамина Д. Любые изученные изменения в рационе увеличивали абсорбцию 235 Pu и накопление в организме в 2—20 раз по сравнению с обычным питанием. У крыс, кормившихся молоком матерей, которые содержались на рационе с недостатком Са, также наблюдали увеличение абсорбции 238 Pu. Крысам внутривенно вводили 11,1·10 4 Бк цитрата 239 Pu. Одной группе через 2.5 ч после инъекции плутония вводили через рот цитрат железа 13,3 мг на животное. Введение железа повторяли в течение 83 сут. с периодичностью 1 раз в неделю. Положительный эффект железа проявляется преимущественно в первые. 20 сут. При трехразовом введении железа из организма подопытных животных выводится с калом в 2 раза больше плутония, чем в контроле. Суммарное количество (кал+моча) составляет 60,3% (55,9+ +4,4), а в контроле 36,8% (33,7+3,1). В результате действия железа тип распределения плутония в организме меняется от скелетного к печеночному. Наиболее эффективным является профилактическое применение препарата железа; в этих условиях содержание 239 Pu в скелете можно снизить в 3 раза по сравнению с контролем (С. И. Рушоник и др ).
Г, А. Заликин, П. Г. Нисимов в опытах на крысах изучали всасывание из ЖКТ 238 Pu и 241 Am, содержащихся в мясопродуктах. Всасывание простой соли 238 Pu составляет 0,03%. При введении 238 Pu с мясом всасывается 0,74%, т е. в 24,7 раза больше. При этом около 90% введенного 238 Pu обнаружено в скелете. Таким образом, в мясопродуктах радионуклиды присутствуют в виде комплексных соединений с белками или отдельными аминокислотами и поэтому всасывание их из желудочно-кишечного тракта происходит в значительно больших количествах. На всасывание 239 Pu через кожу существенно влияет целостность кожного покрова. В производственных условиях могут повреждаться кожные покровы рук вследствие царапин и ссадин, а также воздействия растворителей и кислот. А. Г. Бажин указывает, что уровни резорбции растворимых и нерастворимых соединений 239 Pu через ссадины кожи крыс за 2 сут. воздействия составляют от 0,046 до 17% нанесенного количества. Крысам однократно наносили на кожу 239 Pu в 0,1—10 и. HNO или в 5—100% ТБФ в 0,1 мл в количествах 1110 и 370 кБк на крысу.
Таблица 11.2. Содержание 23 SPu в органах и тканях крыс после внутрибрюшинного введения (% введенного)
Установлено, что основным путем внутрикожного поступления 239 Pu является трансфолликулярный. Роль трансэпидермального пути возрастает с увеличением деструктивного действия изученных растворов. Основное количество депонированного нуклида откладывается в скелете (64—80%). Всасывание 239 Pu в растворе 0,1 н. HNO3 за 3 сут. составило 0,02% нанесенного количества. Увеличение концентрации кислоты до 0,5—10 н. сопровождается возрастанием резорбции в 2,5—5 раз. Аппликация нуклида в органических растворителях характеризуется 4-5-кратным увеличением уровней его накопления в организме по сравнению с контролем. Комбинированное воздействие кислоты и органических растворителей на кожный покров обусловливает наиболее высокие скорости и 25-кратное возрастание всасывания нуклида [46].
Э. Р. Любчанский приводит данные о распределении лимоннокислого 239 Pu при внутрибрюшинном введении (табл. 11.2).
Как видно, через 5 сут. в бедре крыс содержалось 3,72, в печени 13,8, в мышцах 2.11%. Через 20 сут. содержание 239 Pu в бедре составляло 3,3, в печени 6,75, в мышцах 1,81%. Уменьшение активности в органах и тканях происходит с различной скоростью. Так, из печени 85% Pu выводится с биологическим периодом полувыведения, равным 7 сут, 15% с периодом полувыведения, равным 125 сут. Биологический период полувыведения 239 Pu из бедренной кости составляет 840 сут, из лопатки 707 сут, из мышц— 108 сут. Возраст крыс влияет на отложение и экскрецию 239 Pu. У старых крыс (18 мес) 239 Pu в костях задерживается на 20—25% меньше, чем у молодых (3 мес). Экскреция 239Ρ у старых крыс увеличена в 2 раза.
Путь введения Pu в организм не безразличен для распределения радионуклида, но ведущим в этом процессе является форма вводимого соединения. Устойчивые комплексные соединения Pu. не склонные к гидролизу, к образованию коллоидов и гидроксидов, при поступлении в организм задерживаются преимущественно в скелете. Соединения Pu, склонные к образованию коллоидов и гидроксидов, задерживаются главным образом в печени и других органах, богатых ретикулоэндотелиальной тканью [97].
Сейдель и другие самкам тупайя — примитивным полуобезьянам—в возрасте 8 — 18 мес внутримышечно вводили мономерный 239 Pu в количестве 1,85-10 4 Бк/кг. После забоя животных изучали распределение 239 Pu в органах и тканях до 790 сут. Показано, что 239 Pu быстро резорбировался из места введения, а основными органами депонирования являются скелет и печень, в которых содержалось соответственно 50 и 20% введенного количества. Период полувыведения 2:”Pu из скелета составил около 500 - 600 сут, а из печени около 150 сут. Поражение печени обнаружено у пяти животных, а у одного животного к моменту гибели на 790 сут. обнаружено развитие остеосаркомы.
Грин и другие вводили мышам-самкам линии СВА внутривенно 239 Pu в дозе 18,5-10 2 Бк/кг. Через 24 ч. 10 сут, 1 и 3 мес после введения изотопа животных забивали и исследовали содержание и распределение 239 Pu в подвздошных костях с помощью авторадиографических методов. Установлено, что в начальные сроки исследования 239 Pu локализуется на поверхности костей, но к 3 мес после введения проникает через кость в костный мозг.
Наблюдаются некоторые различия в накоплении и распределении радионуклида при однократном и длительном введении его в организм. При длительном поступлении Pu в организм крыс и собак содержание его постепенно увеличивается почти во всех внутренних органах в течение 300—600 сут.
При хроническом ингаляционном поступлении с первичным отложением в легких (0,017—3,7) -10 4 Бк/г значительные количества Pu откладываются в бронхиальных лимфатических узлах. К концу эксперимента (238 сут) содержание Pu в легких собак составляло 45,5%, в бифуркационных лимфатических узлах 51,5, в печени 2,16%. Через 2 г в бронхиальных лимфатических узлах содержание Pu было в 30 раз выше, чем в легких [158, 97].
Мюллер и другие исследовали поглощение и транспорт кол лоидных частиц 241 Am и 241 Pu в легких крыс. Скопление β-тре- ков было широко представлено в клетках с включением большой электронной прочности, вероятно, в альвеолярных макрофагах. Треки всегда обнаруживались вокруг этих включений, которые, вероятно, представлены лизосомами. Биохимические исследования позволяют предполагать, что коллоидные частицы растворялись и транспортировались в кровяное русло. Нерастворимые частицы радионуклидов диаметром 0,9 мкм также захватывались in vitro крысиными альвеолярными макрофагами. Доза, поглощенная клеточными структурами в непосредственной близости от частиц в течение нескольких дней, является достаточной для поражения лизосомальных мембран, что может стать причиной развития фиброза легких.
Важное практическое значение имеет микрораспределение Pu для выяснения механизма действия и патогенеза вызванного нм поражения. Многие авторы считают, что основными местами депонирования Pu в скелете являются костное вещество под эпифизарной пластинкой, эндост и периост [97, 159, 164]. В печени плутоний распределяется неравномерно, значительно большая концентрация его наблюдается в макрофагах, а также по периферии печеночных долек.
В поздние сроки после внутрибрюшинного введения большая часть плутония располагается в макрофагах перипортальной соединительной ткани, в клетках Купфера, преимущественно периферических отделов печеночной дольки [97, 148]. Перераспределение 239 Pu из костных поверхностей в глубину кости наблюдается в эндосте и трабекулах ребра.
Микрораспределение Pu в костном мозге кроликов и крыс равномерное [97]. В селезенке мышей, крыс и кроликов плутоний распределяется в красной пульпе. В надпочечниках наибольшие количества его накапливаются в клубочковом и сетчатом слоях коркового вещества. В легких локализация плутония характеризуется очаговым скоплением радионуклида в стенке альвеол и крупных альвеолярных макрофагах [97, 149]. В ранние сроки после ингаляции плутония он располагается в виде отдельных скоплений во всех долях легких. Через 32 сут. помимо одиночных треков наблюдаются звезды, расположенные в межальвеолярных перегородках. Каких-либо отличий в микрораспределении растворимых и нерастворимых соединений плутония при ингаляции не установлено [97, 156].
Т. И. Левдик и другие у собак через 1,5—5 мес после ингаляции 239 PuO2 в количестве 92.5—296 кБк/кг исследовали среды глаза. Установлено, что Pu всасывается из легких в кровь и накапливается в пигментном слое сетчатки, меньше — в сосудистой оболочке, в области экватора и поверхностных слоях коры хрусталика. Длительная фиксация плутония в участках расположения меланобластов (сетчатка и сосудистый тракт) создает депо плутония, которое хорошо определяется при радиометрии. Заслуживает внимания накопление Pu в хрусталике, а именно, в зоне роста эпителия и в области дифференцировки клеток эпителия в хрусталиковые волокна. С учетом высокой биологической эффективности α-излучения Pu можно предполагать, что развитие катаракты и других нарушений органа зрения в определенной степени обусловлено прямым действием α-излучения.
Имеются сведения о накоплении и распределении 239 Pu в различных органах человека, имевших непосредственный контакт с этим радионуклидом.
Введение большой дозы Pu (74Χ10 4 Бк/кг) внезапно ухудшает общее состояние, животные становятся вялыми. В этой стадии поражения преобладают тяжелые расстройства кровообращения, изменения кроветворных и паренхиматозных органов. У животных развивается выраженный геморрагический синдром. Кровоизлияния отмечаются в слизистой ЖКТ, легких, сердце, лимфатических узлах, подкожной клетчатке [97]. В острой стадии поражения плутонием происходит угнетение кроветворения; лейкопения, тромбоцитопения, ретикулопения и анемия. Гибель животных наступает в первые 2 —3 нед от апластической анемии и кровоизлияний. Подострая форма поражения данным радионуклидом характеризуется отчетливыми регенеративными реакциями кроветворения, атрофическими и дегенеративными процессами во внутренних органах. В этой стадии поражения у животных отмечается эктопическое селезеночное кроветворение, прекращается спермато- и овогенез [97, 159]. При подостром поражении 239 Pu в дозе (11,1—74) ·10 4 Бк/кг происходит изменения в костной системе. Интенсивно рассасывается костное вещество снонги- озного и компактного слоев костей, затормаживаются процессы энхондрального окостенения, проявляются глубокие нарушения процессов остеогенеза. Гибель животных в этой стадии поражения наступает от цирроза печени, сопровождающегося желтухой, асцитом и истощением [97].
Хроническая форма поражения плутонием развивается при воздействии малой дозы 239 Pu (для крыс Механизм поглощения Pu печенью в литературе описывается с двух противоположных точек зрения. Одни считают, что и печень поступает плутоний, не связанный в крови с трансферрином. По мнению других, основным поставщиком плутония для печени является плутонийтрансферриновое соединение сыворотки крови. Перенос плутония из крови к костным поверхностям осуществляет плутонийтрансферриновое соединение сыворотки.
Г. А. Демина и другие вводили крысам внутримышечно цитрат 23*Pu и 239 Pu в дозе 3330 и 111 кБк соответственно, изучали роль различных ингредиентов сыворотки крови в переносе плутония из мышц в печень и скелет. Показано, что быстрее всех уходит из крови альбумин—трансферриновая форма плутония. Медленнее убывает форма плутония, связанная с γ-глобулином. За отложение плутония п печени ответственны макроглобулиновая и небелковая фракции сыворотки крови. За отложение плутония в скелете ответственна, в основном, альбуминтрансферриновая фракция сыворотки крови. К 32-м сут. накопление всех форм плутония в скелете достигает 89—98%.
В отдаленные сроки после поражения 239 Pu у животных часто возникают опухоли костей. Для плутония характерно более частое развитие остеосарком в позвоночнике. При ингаляционном поступлении плутония возможны пневмосклерозы и рак легких. Крысам интратрахеально вводили нитрат плутония в дозе 92,5 кБк/кг. Органами депонирования являются скелет, печень и почки, в которых накапливается соответственно 53.4; 8.3 и 1% введенного количества. В отдаленные сроки у крыс возникают опухоли (рак легких, печени, остеосаркомы, лейкозы) в 36,4% случаев в опытной группе при 3,4% в контроле (Е. С. Жорова и др.).
Сравнение биологической эффективности 239 Pu с другими β- и γ-излучателями показало, что плутоний примерно в 2—45 раз токсичнее 226 Ra, в 45—200 раз токсичнее 90 Sr. По гематологическим показателям 239 Pu токсичнее 226 Ra и 90 Sr в 10 и 40 раз соответственно.
Дзуик и другие приводят данные по ускорению выведения 239 Pu из организма человека. Нерастворимое соединение 239 Pu попало в организм двух научных сотрудников (27 и 29 лет) во время работы с негерметизированным источником. Запачканы также были руки, лицо, волосы. Для выведения радионуклида из организма применяли слабительные и ДТПА. Суточная экскреция 239 Pu с мочой увеличивалась от 0,06 до 0,25 Бк/л у одного пациента и от 0,08 до 0,17 Бк/л у другого. В течение нескольких месяцев наблюдения не было выявлено каких-либо отклонений от нормы.
Неотложная помощь при остром поражении 239 Pu.
Промывание носа и ротовой полости 2%-ным раствором пентацина, дезактивации кожи 5%-ным раствором пентацина. препаратом «Защита-7», пастой 11,6, раствором деконтамина. В случае попадания на кожу или в рану в больших количествах и невозможности дезактивации — иссечение пораженных участков под радиометрическим контролем. При ингаляционном воздействии — немедленное многократное вдыхание аэрозоля 5—10%- ного пентацина. Применение отхаркивающих (термопсис с содой) и рвотных средств (1%-ный апоморфин — 0.5 мл) или промывание желудка. Очистительные клизмы. Внутривенно —5%- ный пентацин — 5—10 мл (вводить медленно!). Последующий курс лечения в течение месяца (10—20 инъекций через 1—2 сут). Мочегонные: гипотиазид — 0,2 г, фонурит — 0,25 г [79].
ПДП 239 Pu в организм персонала через органы дыхания составляет 17,39-10 2 Бк/год. ДК п воздухе рабочих помещений 33,3-10 Бк/л. в атмосферном воздухе 11,1-10 7 Бк/л, в воде — 81,4 Бк/л.
В последнее время получены данные о кинетике обмена, микрораспределении и биологическом действии 239 Pu при естественных путях поступления в организм животных. Материалы этих исследований указывают на необходимость снижения ДК 239 Pu. Авторы считают, что предельно допустимая нагрузка 239Рп в скелете человека (0, 148·10 4 Бк) должна быть уменьшена в 4 раза, в легких (0,074· 10 4 Бк) в 10 раз.
Раздел 3. Биологическое действие ионизирующих излучений
У многих радионуклидов существенная в биологическом отношении активность содержится в очень малом количестве вещества. Так, масса 50 мкКи полония-210 (доза, при поступлении которой в организм человека можно ожидать развития глубоких нарушений функций печени и почек) составляет всего 12´10 -9 г, а 1 мКи стронция-90 (ЛД 50/30 для крыс) содержится в 8 мкг этого изотопа. Даже труднорастворимые соединения радионуклидов в столь малых количествах часто оказываются в растворе в виде ионов, что значительно облегчает их проникновение через биологические барьеры, всасывание и распространение по организму.
3.6.2.1. Пути поступления радиоактивных веществ в организм
Во внутреннюю среду РВ могут попасть ингаляционно, через стенки желудочно-кишечного тракта, через травматические и ожоговые повреждения, через неповрежденную кожу. Всосавшиеся РВ через лимфу и кровь могут попасть в ткани и органы, фиксироваться в них, проникнуть внутрь клеток и связаться с внутриклеточными структурами.
Знание пути поступления радионуклида в организм весьма важно в практическом отношении. У ряда РВ характер всасывания, распределение по органам и тканям, выведение и биологическое действие существенно зависят от пути поступления.
Ингаляционное поступление радиоактивных веществ. Общая поверхность альвеол составляет около 100 м 2 , что приблизительно в 50 раз превышает поверхность кожи, и при контакте, особенно профессиональном, с аэрозолями РВ, радиоактивными газами и парами ингаляционный путь заражения является основным.
Радионуклиды, попавшие в органы дыхания, в различной степени могут задерживаться в легких и верхних дыхательных путях. На количество РВ, остающееся в органах дыхания после выдоха, влияют прежде всего аэродинамические свойства аэрозоля, зависящие от размера, плотности, формы частиц, от их влажности, гигроскопичности, растворимости и химической природы. В легких откладываются преимущественно частицы диаметром от 0,01 до 1 мкм. Имеют значение и анатомо-физиологические особенности дыхательной системы, в частности, соотношение размеров альвеолярных и бронхиальных поверхностей, минутный объем легких, частота дыхания, скорость движения воздуха по дыхательным путям.
Метаболизм радионуклидов, оставшихся после выдоха в органах дыхания, определяется следующими основными процессами:
– ретроградным выносом частиц со слизью в результате деятельности мерцательного эпителия в глотку с последующим их заглатыванием (отчасти, отхаркиванием);
– резорбцией РВ в кровь через альвеолярные мембраны с последующим отложением в органах или выведением. Резорбции подвергаются преимущественно растворимые частицы. В зависимости от их растворимости время резорбции может составлять от нескольких десятков минут до нескольких дней и даже более. Степень резорбции одного и того же радионуклида сильно зависит от химической формулы соединения, в состав которого он входит;
– фагоцитозом макрофагами нерастворимых частиц и коллоидных форм радионуклидов. Часть захвативших радионуклиды фагоцитов ретроградно удаляется в глотку и заглатывается или отхаркивается. Другая часть транспортируется лимфой и откладывается в бронхо-легочных узлах. Наибольшее практическое значение этот вид отложения имеет при ингаляционном поступлении нерастворимых или слабо растворимых соединений плутония, тория, цезия.
Около 10% радионуклидов, захваченных фагоцитами, перемещаются через альвеолярную мембрану с периодом полувыведения около нескольких дней. Небольшая часть РВ задерживается в паренхиме легких, эпителиальных клетках: период полувыведения из них составляет около 600 суток. Еще прочнее фиксация РВ в бронхо-легочных лимфатических узлах, куда они попадают с фагоцитами.
При оценке опасности ингаляционного поступления РВ учитывают лучевую нагрузку на легкие, эпителий бронхов, регионарные лимфатические узлы, на стенку желудочно-кишечного тракта, последствия резорбции, а в случае ингаляции гамма излучающих радионуклидов определенное значение может иметь и облучение других органов грудной полости.
При поступлении радионуклидов через органы дыхания их химические соединения подразделяются на три ингаляционных класса в зависимости от длительности эффективного периода полувыведения (Тэфф.) из легких. К классу «М» (медленный) отнесены соединения с Тэфф. более 100 сут., к классу «П» (промежуточный) – с Тэфф. от 10 до 100 сут. и к классу «Б» (быстрый) – с Тэфф. менее 10 суток.
Поступление радиоактивных веществ через желудочно-кишечный тракт. Желудочно-кишечный тракт – второй основной путь поступления РВ в организм. Оно может произойти как непосредственно после их попадания во внешнюю среду, так и после прохождения по биологическим цепочкам. Поражающее действие при алиментарном поступлении радиоактивных веществ связано как с лучевой нагрузкой на стенку пищеварительного тракта, так и с всасыванием РВ в кровь и лимфу.
Продвижение радионуклидов по желудочно-кишечному тракту не имеет каких-то особенностей по сравнению с нерадиоактивными веществами, содержащимися в пище. Резорбция РВ зависит от химических свойств вещества (главным образом, растворимости), физиологического состояния желудочно-кишечного тракта (рН среды, моторная функция), состава пищевого рациона. Молоко, например, способствует усилению всасывания радиоактивного стронция. Резорбция радионуклидов снижается при увеличении содержания в пище стабильных изотопов этих же элементов и наоборот.
Преимущественно через ЖКТ поступают и всасываются щелочные элементы – K, Ca, Na, Rb, Cs, I, и в меньшей степени – щелочно-земельные элементы – Sr (40-60%), Co (30%), Mg (10%), Zn (10%), Ba (5%). Трансурановые элементы и редкоземельные металлы в желудочно-кишечном тракте образую труднорастворимые соединения и поэтому степень их всасывания очень низкая – Po – 6%, Ru – 3%, U –
3-6%, Pu – 0,01%, Zr – 0,01%.
Всасывание хорошо растворимых радионуклидов происходит в основном в тонкой кишке. Значительно меньше РВ всасывается в желудке. Всасывание в толстой кишке практического значения не имеет. Наиболее интенсивно и полно резорбируются растворимые радионуклиды, находящиеся в ионной форме. Радионуклиды щелочных металлов и галоидов после попадания в желудочно-кишечный тракт практически полностью всасываются в кровь. Изотопы редкоземельных элементов, плутония, трансурановых элементов вследствие склонности их солей к гидролизу и образованию труднорастворимых и нерастворимых соединений всасываются в кишке в пределах нескольких сотых-деся-титысячных долей процента от поступившего количества. Всосавшиеся радионуклиды могут повторно и неоднократно (с желчью, кишечными соками) поступать в желудочно-кишечный тракт и дополнительно
облучать его слизистую оболочку.
Все сказанное относится и к радиоактивным продуктам, вторично попавшим в желудочно-кишечный тракт после ингаляционного
поступления.
Нерастворимые и мало растворимые гамма-излучатели облучают кишечник и другие органы брюшной полости, а бета-излучатели – только слизистую оболочку кишки, в основном до выведения радионуклидов с калом, в течение примерно 30 часов. Однако в криптах кишечника РВ могут задерживаться в течение длительного времени, формируя
высокие локальные дозы.
При нормировании поступления радионуклидов в организм с водой и пищей, так же как и при нормировании ингаляционного поступления, исходят из той предпосылки, чтобы при достижении предела годового поступления (ПГП) величина дозы, накопленной за год, равнялась величине соответствующего годового предела дозы.
Поступление радиоактивных веществ через неповрежденные кожные покровы, раневые и ожоговые поверхности. Большинство радиоактивных веществ практически не проникают через неповрежденную кожу. Исключение составляют окись трития, йод, нитрат и фторид уранила, а также полоний. Коэффициенты резорбции в этих случаях
составляют сотые и тысячные доли единицы.
Проникновение РВ через кожу зависит от площади загрязненного участка, от физико-химических свойств соединения, в состав которого они входят, растворимости в воде и липидах, рН среды, от физиологического состояния кожи. Всасывание радионуклидов повышается при повышении температуры среды вследствие расширения кровеносных и лимфатических сосудов, раскрытия сальных и потовых желез.
Требует особого внимания радиоактивное загрязнение ран в производственных и лабораторных условиях. Основную опасность в случае производственного заражения представляет резорбция высокотоксичных радионуклидов (например, полоний), которая у растворимых РВ может достигать десятков процентов от общего количества, поступившего в рану. Большие количества РВ могут поступить не только через колотые или резаные раны, но и через небольшие царапины и ссадины. Всасывание через них щелочных, щелочноземельных элементов и галоидов в 100-200 раз превышает резорбцию через неповрежденную кожу; это всасывание с поверхности раны трудно растворимых РВ (чаще всего относится и к продуктам ядерного взрыва) происходит медленнее и в значительно меньшем количестве, но все же в сотни раз интенсивнее, чем через интактную кожу. С поверхности ожогов I-II степеней продукты ядерного взрыва всасываются всего в 2-10 раз быстрее.
Проявление общего действия резорбированных продуктов ядерного взрыва с раневых и ожоговых поверхностей мало вероятно. Лишь в редких случаях возможно поступление через раны значительных количеств редкоземельных элементов.
Резорбция плохо растворимых соединений РВ в основном происходит по лимфатическим путям, в результате чего радионуклиды накапливаются в лимфатических узлах. Оттуда некоторая часть радионуклидов с фагоцитами поступает в органы ретикулоэндотелиальной системы. Последствия резорбции чаше всего связаны с избирательной тропностью тех или иных изотопов к отдельным органам (новообразования, лейкозы, другие системные заболевания крови).
В месте нахождения радионуклида в плохо растворимой форме могут возникнуть опухоли (чаще остеогенные саркомы). Имеет значение и воздействие ионизирующего излучения на течение раневого процесса. При поступлении в рану большого количества плохо резорбирующихся радионуклидов под влиянием облучения в клетках тканей раневой поверхности развиваются дегенеративные и некротические процессы, снижается способность клеток к размножению. В ранах часто развиваются гнойные, иногда анаэробные процессы. Медленно отторгаются некротизированные ткани, замедляется регенерация.
3.6.2.2. Метаболизм радиоактивных веществ, всосавшихся в кровь
В крови радионуклиды могут находиться в свободном состоянии или в составе различного рода химических соединений и комплексов. Значительная часть радионуклидов связывается протеинами. Часть радионуклидов, попавших в кровь, выводится из организма, другая часть проникает в органы и депонируется в них. Знание характера распределения, особенностей обмена и депонирования РВ, возможного их перераспределения со временем необходимо для предсказания преимущественного поражения того или другого органа, дозы облучения этого критического органа, клинических проявлений и исхода поражения.
Понятия концентрация и содержание радионуклида в органе не являются синонимами. Под концентрацией понимают удельную активность радионуклида, выражаемую в Бк/г, а содержание – это абсолютное значение активности в целом органе. Концентрация РВ в органе после однократного поступления постепенно снижается, что зависит от радиоактивного распада изотопа и его биологического выведения.
Суммарная константа уменьшения концентрации изотопа в органе (Тэфф.) представляет собой сумму констант радиоактивного распада и биологического выведения. При расчетах чаще пользуются понятием эффективного периода полувыведения – Тэфф. Он связан с периодом полураспада и периодом биологического полувыведения:
При длительном поступлении РВ в организме или в отдельном органе ежедневно накапливается определенная доля поступившего за эти сутки количества. Показателем этого накопления служит величина, называемая «кратностью накопления». Эта величина показывает, во сколько раз содержание радионуклида превышает величину его ежедневного поступления. Так, если к концу поступления РВ в организме содержится 150% от величины суточного поступления, кратность накопления составит 1,5.
Бывает, что после одноразового сравнительно массивного радиоактивного заражения поступление РВ в организм не прекращается полностью, а продолжается длительное время, но в меньших количествах. В этих случаях могут преобладать (в зависимости от уровня поступления) либо процессы депонирования в органе, либо процессы выведения из него.
3.6.2.3. Выведение радиоактивных веществ из организма
Попавшие в организм РВ могут выводиться через почки, желудочно-кишечный тракт (в том числе с желчью), легкие, а также со слюной, молоком, потом. В большинстве случаев основные количества РВ экскретируются с калом и мочой. С калом преимущественно выводятся РВ, поступившие алиментарным путем, а также и при ингаляционном заражении и вторичном заглатывании частиц, вынесенных ретроградно в глотку. Некоторые растворимые радионуклиды могут выделяться с желчью и другими пищеварительными соками и также выводиться с калом. В желудочно-кишечном тракте процессы экскреции РВ постоянно сопровождаются процессами их реабсорбции.
При выведении радионуклидов преимущественно с мочой высокая доза облучения может быть получена почками.
Выведение с выдыхаемым воздухом имеет существенное значение для трития, паров окиси трития, радона и торона, образующихся при распаде поступивших в организм радия и тория.
Динамика выведения РВ из организма описывается теми же формулами, которые приводились в предыдущем разделе при характеристике скорости уменьшения концентрации радионуклидов в отдельных органах. По содержанию РВ в выделениях можно судить о количестве их в организме как на момент определения, так и на момент поступления.
Таким образом, в обмене поступивших в организм радионуклидов можно выделить четыре основные стадии:
– образование на месте поступления первичного депо (кожа, раны, слизистые оболочки желудочно-кишечного тракта, верхних дыхательных путей);
– всасывание с мест поступления в кровь или лимфу;
– депонирование в критическом органе (образование вторичных
депо);
– выведение различными путями, в том числе и с явлениями
рециркуляции.
Продолжительность названных стадий существенно различается для различных радионуклидов и их соединений, а также для разных путей поступления РВ в организм.
Указанные положения должны учитываться при оценке клинической картины поражения и планировании лечебно-профилактических мероприятий. Особенности пространственного и временного распределения дозы определяют характер течения поражения отдельными радионуклидами, различающийся как по особенностям проявления, так и по срокам формирования эффектов. В зависимости от этого меняются и конкретные диагностические, и лечебные мероприятия в различные сроки с момента заражения, и прогностическая оценка данных радиометрических определений.
3.6.2.4. Биологическое действие радиоактивных веществ
При внутреннем радиоактивном заражении (инкорпорации радионуклидов) количество поступивших в организм радионуклидов чаще всего не может создать в течение короткого времени дозы, достаточно высокой для развития острого лучевого поражения. В этих случаях более характерно развитие хронической лучевой болезни.
При внутреннем радиоактивном заражении концепция критического органа представляется сложнее, чем при общем внешнем облучении. В этом случае прежде всего имеют значение особенности распределения радионуклидов по органам и тканям (тропность радионуклидов). Важным фактором являются значения пороговых повреждающих доз для разных тканей. По способности преимущественно накапливаться в тех или иных органах выделяют следующие основные группы радиоактивных элементов (табл. 42).
Таблица 42 – Типы распределения радиоактивных элементов в организме
Элементы 1 группы периодической системы:
Н, Li, Na, К, Rb, Cs, Ru, Cl, Br и др.
3. Наиболее опасные радиоизотопы
В связи с широким распространением в природе радиоактивных изотопов естественного и искусственного происхождения, в связи с постоянно увеличивающимся применением их в отраслях экономики и науки необходимо иметь возможно более полное представление о свойствах хотя бы некоторых наиболее опасных при попадании внутрь организма радиоактивных элементов.
Все изотопы при соблюдении мер безопасности не могут оказать неблагоприятного влияния ни на человека, ни на окружающую среду. При грубом нарушении норм радиационной безопасности возможно внешнее или внутренне облучение в повышенной дозе. Как было отмечено выше, клиническое течение лучевой болезни, обусловленной внешним и внутренним радиоактивным заражением, определяется дозой облучения, растворимостью и всасываемостью поступивших внутрь радионуклидов, характером их распределения в органах, тканях, путями поступления в организм и скоростью распада и выведения из организма. Как всасывание, так и распределение и выведение радионуклидов зависят от их физико-химической природы.
Выделены 4 группы опасных радионуклидов − А, Б, В и Г.
Группа А − радионуклиды особо высокой токсичности (свинец-210, торий-230);
Группа Б − радионуклиды с высокой токсичностью (йод-131, стронций- 90, уран-235);
Группа В − радионуклиды со средней токсичностью (цезий-137, натрий-22, кальций-45);
Группа Г − радионуклиды с наименьшей токсичностью (углерод-14, железо-55, хром-51).
Токсичность зависит от вида и энергии излучения, периода полураспада, физико-химических свойств вещества. Рассмотрим некоторые радионуклиды (изотопы) более подробно.
Йод (I). Природный йод состоит из одного стабильного изотопа с массовым числом 127. Из искусственных радиоактивных изотопов йода важнейшими являются йод-131 (Т1/2 − 8 суток) и йод-133 (Т1/2 − 22 часа). При ядерных взрывах и авариях на АЭС радиоактивные изотопы йода составляют значительную часть активности «молодых» продуктов деления, и они являются одним из основных компонентов заражения внешней среды. Йод в основном представлен органическими соединениями. В форме элементарного йода находится лишь 5%. Примерно 90% активности представляют короткоживущие изотопы. Поступая во внешнюю среду, йод-131 становится источником внешнего и внутреннего облучения, так как он бета-активен.
Поступление в организм человека радиоактивных изотопов йода происходит через органы пищеварения, дыхания, кожу, раневые и ожоговые поверхности. Практическое значение имеет пищевой и ингаляционный путь. Основными цепочками являются: растения − человек, растения − животное − человек и т.д. Особое значение, как источники поступления йода в организм человека, могут иметь продукты питания растительного и животного происхождения, особенно молоко, свежие молочные продукты и листовые овощи. Так, у коров с молоком йод-131 выводится в количестве до 1% в литре и при длительном поступлении − 0,5−1,1%.
Поступивший в организм радиоактивный йод быстро всасывается в кровь и лимфу. В течение первого часа всасывается 80−90%. Органы и ткани по концентрации йода образуют убывающий ряд: щитовидная железа, почки, мышцы, кости. Накопление йода-131 в щитовидной железе протекает быстро: через 2−6 ч после поступления содержание его составляет 5−10 и 15−20% соответственно, через сутки − 25−30% введенного количества. При поступлении малых количеств йода-131 уже отмечаются нарушение функции щитовидной железы, а также незначительные изменения крови и некоторых показателей обмена и иммунитета. Облучение щитовидной железы в дозах порядка десятков Грей (Гр) вызывает снижение ее функциональной активности. При дозе несколько Грей выявлено повышение активности железы, которое может смениться состоянием гипофункции. Статистически значимое учащение возникновения опухолей железы отмечено при дозе облучения 0,5 Гр.
Общий характер действия йода на организм: при действии паров появляется кашель, насморк, слезотечение, конъюнктивит, опухание околоушных желез, головные боли. В тяжелых случаях − рвота, понос, белок и эритроциты в моче, задержка мочи, одышка. При хроническом отравлении − катар слизистых носа (типичный насморк), зева, исхудание, наблюдается желтоватая окраска зубов.
Основным путем выведения йода-131 из организма являются почки, также он выводится с калом, потом, прочими жидкостями и через органы дыхания, однако доля этого выведения не установлена.
Неотложная помощь при работе в зоне, зараженной радиоизотопами йода: с целью профилактики прием ежедневно иодида калия по 0,25 г (одна таблетка в день); дезактивация кожных покровов водой с мылом, промывание носоглотки и полости рта; при поступлении радионуклидов в организм внутрь − иодид калия − 0,2 г, иодид натрия − 0,2 г, сайодин – 0,5 г, рвотные средства (апоморфин 1% − 0,5 мл) или промывание желудка, обильное питье, мочегонные средства.
Фосфор (Р). Природный фосфор состоит из одного стабильного изотопа − фосфора-31. Известны шесть искусственных радионуклидов с массовыми числами: 28−30, 32−34.
Одним из основных источников поступления радиоактивного фосфора-32 в окружающую среду являются атомные предприятия по производству плутония. Фосфор-32 − доминирующий радионуклид в большинстве форм водных организмов и водоплавающих птиц. Основной путь поступления радионуклидов из водных сбросов в организм человека − использование питьевой воды, а также потребление рыбы и других пищевых продуктов из водоемов. Наиболее интенсивное накопление фосфора-32 (Т1/2 = 14,22 суток) происходит в растущих тканях с повышенным обменом. Так, при раковых поражениях желудка, кишечника, матки накопление фосфора-32 по отношению к нормальным тканям происходит быстрее и увеличивается в 2−6 раз в зависимости от опухоли. Выводится из организма через почки и желудочно-кишечный тракт (ЖКТ). Специфичность действия связана с избирательным накоплением в костной ткани, большую опасность представляет поступление нерастворимых соединений радиоактивного фосфора в органы дыхания. При поражении такими соединениями наблюдается лучевой ожог кишечника, сопровождающийся кровавым поносом, резким исхуданием, лейкоцитозом, наблюдается сгущение крови, т.е. происходит угнетение функции костного мозга и других органов кроветворения.
Стронций-90 (Sr). Это бета-излучающий изотоп. Среди искусственных изотопов стронция это долгоживущий радионуклид. Стронций-90 (Т1/2 =29,1 лет) − один из важнейших компонентов радиоактивного заражения биосферы. Попадая в окружающую среду, стронций-90 характеризуется способностью включаться в процессы обмена веществ у растений, животных и человека. Поэтому при оценке заражения биосферы стронцием-90 принято рассчитывать отношение стронция-90 к кальцию в стронциевых единицах (с.е. - 1 мккюри стронция на 1 г кальция). В растения стронций-90 может поступать непосредственно при прямом заражении листьев и из почвы через корни. Относительно больше накапливают его бобовые растения, корнеплоды, меньше − злаки, в том числе зерно, лен. У животных и человека стронций-90 накапливается главным образом в костях.
Величина отложения его в организме животных и человека зависит от возраста особи и количества поступающего радионуклида, интенсивности роста новой костной ткани и др. Большую опасность стронций-90 представляет для детей, в организм которых он поступает с молоком и накапливается в быстрорастущей костной ткани.
Биологическое действие стронция-90 связано с характером его распределения в организме и зависит от дозы бета-излучения, создаваемого им и его дочерним изотопом иттрием-90. При длительном поступлении стронция-90 в организм даже в относительно небольших количествах в результате непрерывного облучения бета-излучением костной ткани могут развиваться лейкемия и рак костей. Существенные изменения в костной ткани наблюдаются при содержании стронция-90 в рационе около 1 мккюри на 1 г кальция, т.е. 1 с.е., а вес мккюри стронция-90 равен 3,7* 10 −13 г, предельно допустимая концентрация (ПДК) для вод открытых водоемов (в кюри/л) для стронция-90 равна 3,7* 10 −13 .
Цезий-137 (Cs) − бета-гамма-излучающий изотоп цезия, один из главных компонентов радиоактивного заражения биосферы. Т1/2 = 30,2 года. Это один из 15 долго живущих изотопов, остальные искусственные радиоизотопы цезия короткоживущие, если не считать цезий-134, период полураспада которого равен 2 годам. Указанные два радионуклида содержатся в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы АЭС. Цезий-137 интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления цезия-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных цезий-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент его накопления отмечен у северных оленей и североамериканских водоплавающих птиц. В организме человека он распределен относительно равномерно и не оказывает значительного вредного действия при поступлении в небольших количествах. Однако критическими органами являются печень, легкие и особенно селезенка, для селезенки предельно-допустимое поступление (ПДП) составляет 0,34 мккюри, а для всего организма ПДП=33 мккюри. Цезий-137 используют в медицине (радиотерапия).
Территория с плотностью радиоактивного загрязнения почвы цезием-137, превышающей 1 Ки/км 2 , является зоной радиоактивного загрязнения.
Уран (U). Ядра урана-238 делятся при захвате только быстрых нейтронов с энергией не менее 1 Мэв. Уран и его соединения радиационно и химически токсичны. Предельно допустимая доза облучения профессиональных работников − 5 бэр в год, а населения − 0,5 бэр в год, металлический уран или его соединения используются в основном в качестве ядерного горючего в ядерных ректорах. Уран-235 является источником ядерной энергии в ядерном оружии. Уран-238 служит источником вторичного ядерного горючего − плутония-239.
При попадании в организм уран действует на все органы и ткани, являясь общеклеточным ядом. Преимущественно поражает почки, печень и желудочно-кишечный тракт.
Радий (Ra). Радий-226 – α-активен (Т1/2 = 1590 лет). Радий и его соединения широко распространены в природе и являются одним из основных источников естественного фона. В организм человека может попадать с пишей, питьевой водой, вдыхаемым воздухом и через неповреждённую кожу. Около 90% радия поступает в организм с пищей и около 10% с водой. Установлено, что продолжительное облучение значительными уровнями радия в питьевой воде влечет за собой «высокий риск» рака костей для облученных. По оценкам Агентства по защите окружающей среды США (ЕPA), долговременное потребление воды, содержащей 5 пКи (пикокюри) на литр (0,185 Бк/л), влечет за собой 44 случая дополнительных смертей от рака на каждый миллион облученных. Риск удваивается до 88 случаев (10 пКи/л) и утраивается до 132 случаев (15 пКи/л) и т.д. Токсичность радия обусловлена его радиоактивностью. Накапливается в основном в костной ткани. Одним из признаков радиевой интоксикации является лучевое поражение костей − их деструкция, развитие радиационного остеита, который приводит к повышенной хрупкости и патологическим переломам костей. Радиационный остеит челюстных костей, как правило, осложняется инфекцией и протекает как хронический остеомиелит.
Радон (Rn). Радон-222 − α-активен (Т1/2 = 3,8 дня). Газ, который образуется в радиоактивных минералах, постоянно поступает в атмосферу и гидросферу. Он бесцветный, не имеет ни запаха, ни вкуса, в 7,5 раз тяжелее воздуха. Наибольшее содержание радона наблюдается в приземных слоях атмосферы. С увеличением высоты оно уменьшается. В атмосферу и гидросферу радон поступает из почвы, а в воздух помещений − через неплотные строительные конструкции и из самих строительных конструкций, а также из водопроводной воды и природного газа. Радон на 50−70% формирует дозу, получаемую человеком от естественных источников радиации. В организм человека он попадает в основном с вдыхаемым воздухом и в значительно меньшей степени, с питьевой водой.
Токсическое действие радона связано с его радиоактивностью. Скапливаясь в альвеолах легких, он поражает легочную ткань, вызывая ее злокачественное перерождение. До 20% смертей от рака легких напрямую связано с радоном.
Калий (К). Калий-40. Вторым после радона по значимости дозообразования является природный калий, который содержит 0,012% калия-40. Т1/2 = 2,5*10 −10 лет. Этот изотоп повсеместно встречается в минералах и живых организмах и своим β-излучением создает естественное (фоновое) облучение. Других естественных радиоактивных изотопов калия не обнаружено. Калий-40 как токсический элемент не рассматривается, он ответственен только за внешнее облучение, годовая доза от него составляет 16−20% от общей.
Плутоний (Рu). Плутоний - 239 (Т1/2 = 24065 лет) − один из наиболее токсичных радионуклидов, характеризующийся высокой удельной α –активностью. В состав оружейного плутония кроме Рu-239, входят и другие его радиоактивные изотопы (236, 237, 238, 241, 247 Рu).
При неядерном взрыве (нарушении герметичности боеприпаса, пожаре) плутоний может поступить во внешнюю среду в форме мелкодисперсных аэрозолей и интенсивно окисляется до двуокиси (РuО2), а при температуре свыше 1500 °С до окиси (РuО), которые характеризуются низкой растворимостью и всасываемостью.
Основную опасность плутоний представляет как внутренний альфа-облучатель. В организм человека нуклид может поступать ингаляционно, перорально и через раневые и ожоговые поверхности. В лёгких нуклид оседает неравномерно, что приводит к неравномерному облучению. Всосавшийся в кровь нуклид депонируется в основном в скелете и печени и в небольших количествах в других органах. Из организма плутонии выводится медленно.
Время уменьшения вдвое воздействия радионуклида на организм (за счёт физического снижения активности радионуклида и биологического выведения его из организма (Тэфф) из печени и скелета) оценивается в 40 и 100 лет. Дозы, таким образом, формируются в течение всей жизни человека. Пожизненные эффективные дозы при поступлении нуклида с рационом и через органы дыхания в зависимости от возраста человека (20−30−50−70) равны соответственно 4,2−2,5*10 −7 и 4,1−1,6*10 −5 Зв/Бк.
Ингаляционное воздействие плутония на человека наиболее опасно и может привести, даже при поступлении небольшого количества, к развитию острой пневмонии и пневмосклерозу. Распространённость процесса в лёгких и тяжесть поражения возрастают с увеличением поглощённой дозы. Развитие пневмосклероза является главной неопухолевой формой отдалённой патологии. Минимальная пневмосклеротическая доза находится в пределах 0,8−1,2 Зв. Лёгочная патология сопровождается соответствующим нарушением функции сердечнососудистой системы. Развитие дистрофических и склеротических процессов в печени приводит к нарушению её функции. Накопление плутония в гонадах проявляется в снижении их функциональной активности.
Медицинские последствия поступления плутония в организм взрослого человека
Читайте также:
