Везикоуретальный рефлюкс и рефлюкс-нефропатия
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Пузырно-мочеточниковый (син. везикоуретеральный) рефлюкс - патогенетический термин, отражающий процесс ретроградного заброса мочи из мочевого пузыря в верхние мочевые пути (мочеточник, лоханку, чашечки).
Эпидемиология
Распространенность пузырно-мочеточникового рефлюкса на фоне инфекции мочевыводящих путей составляет 8% у женщин и 2% у мужчин [2], у детей ~ в 25-40% случаев.
Патология
В больщинстве случаев везикоуретральный рефлюкс является результатом нарушения состоятельности клапанного механизма пузырного сегмента мочеточника, позволяя моче ретроградно поступать в мочеточник из мочевого пузыря.
Клиническая картина
Характерной клинической картины нет. Пиелонефрит является осложнением рефлюкса. Пузырно-мочеточниковый рефлюкс может быть изолированной патологией или ассоциироваться с другими врожденными аномалиями:
- клапан задней уретры
- удвоенная чашечно-лоханочная система
Классификация
Диагностика
Методом выбора является микронная цистоуретрография.
Другие методы исследования:
- радионуклидные методы исследования
- УЗИ
- МР-цистография
Микционная цистоуретрограмма
Микционная цистоуретрограмма выполняется только после того, как подтверждена инфекция мочевыводящих путей в особенности у детей до 6 лет [3]. Данная методика позволяет определить:
- наличие и степень пузырно-мочеточникового рефлюкса
- дифференцировать активный и пассивный рефлюкс
- наличие анатомических аномалий
Ультразвуковое исследование
Ультразвуковое исследование в рутинной практике дополняет микционную цистоуретрограмму и позволяет оценить почечную паренхиму на наличие рубцов и аномалий. При помощи ультразвукового исследования с контрастированием мочевого пузыря (контраст, содержащий микропузырьки) возможно оценить дистальные отделы мочеточников [4].
Радионуклидное исследование
При помощи радионуклидного исследования рефлюкс оценивается менее точно. Более того, не существует общепринятой классификации степеней рефлюкса для прямой радионуклидной цистографии большинство радиологов используют 3 термина: умеренная, средняя, высокая [2].
Преимуществом данной методики является более низкая доза лучевой нагрузки, что делает ее отличным инструментом для скрининга женщин детородного возраста и для повторных исследований.
Недостатками являются сложности выявления сопутствующих заболеваний (например, дивертикула мочевого пузыря), а также трудности визуализации уретры у мужчит за счет низкого пространственного разрешения.
Магнитно-резонансная томография
МР цистоуретрография находятся в стадии разработки, главное преимущество методики - это отсутствие ионизирующего излучения, наряду с одновременной визуализацией почечной паренхимы [3].
Лечение и прогноз
Значимый везикулоуретеральный рефлюкс, если его не начать лечить во время, может привести к рецидивирующим инфекциям мочевыводящих путей, рубцеванию почек и, в конечном итоге, почечной недостаточности (рефлюкс-нефропатия).
В лечении рефлюкса на начальных стадиях обычно прибегают к антибактериальной терапии.
Хирургическая реимплантация в качестве лечения рефлюкса выраженной степени направлена на снижение частоты рефлюксной нефропатии.
Эндоскопическое лечение заключается в малоинвазивной трансуретральной подслизистой инъекции биоимплантов под устье мочеточника [5].
ЛЕЧЕНИЕ ПУЗЫРНО-МОЧЕТОЧНИКОВОГО РЕФЛЮКСА У ДЕТЕЙ В ДОКБ
ЛЕЧЕНИЕ ПУЗЫРНО-МОЧЕТОЧНИКОВОГО РЕФЛЮКСА У ДЕТЕЙ В ДОКБ
Пузырно-мочеточниковый рефлюкс (ПМР) является одной из наиболее частых форм нарушения уродинамики в детском возрасте.
У здорового человека моча движется из почки через мочеточник в мочевой пузырь. Если мочевой пузырь полный, давление в нем растет, и клапан пузырного отдела мочеточника смыкается. Поэтому обратное движение мочи исключено. Но при пузырно-мочеточниковом рефлюксе (ПМР) клапан поврежден или ослаблен, и моча движется назад к почке.
Чаще всего такую патологию диагностируют у детей до 2 лет.
Во многих случаях причиной развития рефлюкса у ребенка становится воспаление. В результате него теряется эластичность тканей устья мочеточника, и клапан перестает смыкаться.
Часто ПМР возникает ввиду врожденных аномалий пузырного отдела мочеточника.
Это расстройство уродинамики играет ведущую роль в развитии хронического пиелонефрита, следствием которого является нефрогенная гипертония, а при двустороннем поражении - хроническая почечная недостаточность.
Частота рефлюкса составляет от 0,4 до 1,8 % среди всей популяции, а у детей с инфекцией мочевых путей пузырно-мочеточниковый рефлюкс выявляется у 31,1 %
В связи с этим своевременное лечение ПМР является одной из актуальных проблем.
В норме, мочеточники соединяются с мочевым пузырём таким образом, что образуется клапанный механизм, препятствующий обратному току мочи. В случае различных врождённых патологий, и заболеваний мочевого пузыря, мочеточников, уретры, нервной системы клапанный механизм не формируется или перестаёт действовать. Моча поднимается по мочеточника обратно в лоханку и чашечки почки и даже проникает в ткань почки - паренхиму, что вызывает хроническое воспаление - пиелонефрит и склерозирование паренхимы почки - рефлюкснефропатию.
У кого же из детей можно заподозрить наличие пузырно-мочеточникового рефлюкса. В первую очередь, это дети у которых выявляются изменения в анализах мочи, подъёмы температуры, имеются так называемые дизурические расстройства, т.е. нарушения акта мочеиспускания. Очень часто таким детям первоначально выставляется диагноз: инфекция мочевыводящих путей. Нередко ПМР осложнённый пиелонефритом с начальными проявлениями рефлюкснефропатии маскируется под диагноз: дисметаболическая нефропатия. Это связано с тем, что лабораторный признаки дисметаболической нефропатии, а именно анализ мочи на АКСМ (антикристаллообразующую способность мочи) изменяется в результате поражения клеточных мембран ткани почки на фоне рефлюкснефропатии (что было доказано многочисленными научными исследованиями, в том числе и нашей клиники). Поэтому, все дети с повторяющимися "плохими анализами мочи", нарушением мочеиспускания, требуют тщательного обследования.
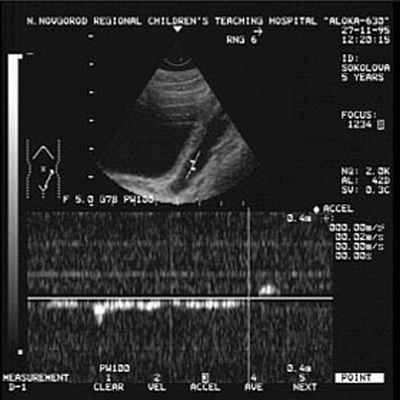
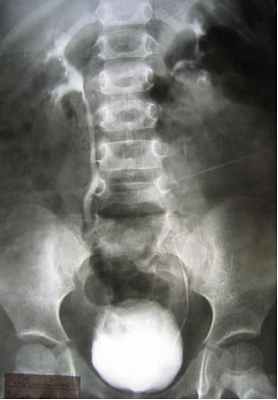
Заподозрить наличие ПМР можно данным УЗС, причём достоверность данных возрастает при использовании допплерографии (рис. 1), но наибольшей информативностью обладает рентгенологический метод - микционная цистография (рис.2). При цистографии контрастное вещество по тонкому катетеру, безболезненно вводится в мочевой пузырь и на рентгеновских снимках, выполненных в покое и при мочеиспускании отчётливо определяется проникновение контрастного вещества в мочеточники и в полостную систему почки (чашечно-лоханочную систему). Дальнейший план обследования зависит от выявленной патологии и может включать: лабораторное обследование, экскреторную урография, статическую и динамическую сцинтиграфию почек, уректро-цистоскопию, уродинамическое обследование, консультация невролога.
Для лечения ПМР применяется, как консервативное лечение, направленное на улучшение функции мочевого пузыря и лечение осложнения ПМР - пиелонефрита, так и оперативное лечение для восстановления клапанного механизма в месте впадения мочеточников в мочевой пузырь. Естественно, что план лечения выбирается врачом индивидуально и зависит от выявленных при обследовании пациента причин, вызывающих ПМР и степени ПМР.
Различные методики антирефлюксных операций направлены на удлинение подслизистого туннеля, т.е. увеличение внутрипузырной части мочеточника и изменение угла вхождения мочеточника в мочевой пузырь.
Необходимо отметить, что длительное время основными оперативными методиками лечения ПМР были "открытые" операции по методу Коэна, Политано – Лидбеттера, при которых мочеточник пересаживается в мочевом рузыре на новое место с формированием, так называемого подслизистого туннеля, обеспечивающего клапанный механизм, или применялась операция Грегуара, при которой мочеточник укладывается в разрез стенки мочевого пузыря, без вскрытия его полости. В настоящее время данные операции не потеряли своей актуальности, но основным методом лечения ПМР стала малоинвазивная эндоскопическая коррекция.
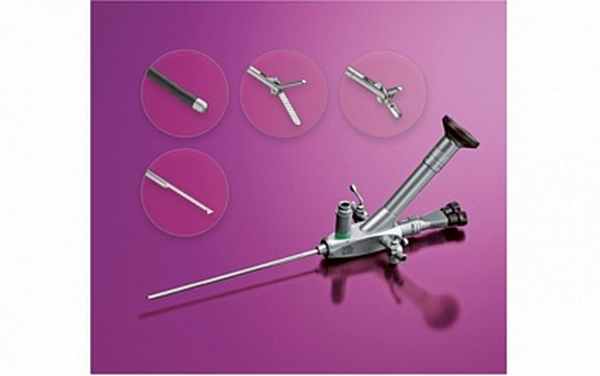
Эндоскопический метод заключается в имплантации специальных препаратов в определённые области устья мочеточника, изменяя форму устья и угол вхождения мочеточника в мочевой пузырь (рис. 3). В зависимости от возраста пациента, степени рефлюкса и других индивидуальных особенностей выявляемых при обследовании ребёнка определяются точки имплантации препарата и его состав. Применяются, как рассасывающиеся, так и сохраняющие свой объём вещества. Операция выполняется под кратковременным наркозом, через мочеиспускательный канал с использованием специального, очень тонкого эндоскопа, позволяющего выполнять операцию практически в любом возрасте. При тяжёлом ПМР эндоскопическое вмешательство может потребовать повторения, в редких случаях применения открытой операции.
Урологическое отделение ДОКБ оснащено всей необходимой эндоскопической аппаратурой фирмы KARL STORZ (Германия) (рис. 4), врачи отделения имеют большой опыт в проведении эндоскопических операций по коррекции пузырно - мочеточникового рефлюкса.
При эндоскопической коррекции ПМР отсутствует длительный и тяжелый для ребенка послеоперационный период с необходимость массивной антибактериальной терапии. Дети легко переносят операцию без разрезов и быстро выписываются из стационара.
Главное вовремя заподозрить заболевание и выполнить необходимое полноценное обследование. В дальнейшем дети перенесшие коррекцию ПМР наблюдаются урологом, проходят курсы лечения в целях профилактики осложнений перенесённого ПМР, предотвращения склеротических изменений в почечной паренхиме.
Врач уролог - андролог
урологического отделения
ДОКБ к.м.н. А.Л. Аврасин

Торжественное завершение в Тверском регионе федерального проекта «Даже у стен есть душа»
10 августа 2021 года в городе Тверь на территории пяти больниц стартовал социальный проект от платформы SWOYS «Даже у стен есть Душа» под патронажем «Золотой скрипкой России», культурно- общественного деятеля Санкт-Петербурга Анастасии Агличевой и при поддержке Общественной палаты Российской Федерации.
Поздравляем с юбилеем Нусинова Евгения Владимировича!
Сегодня, 21 июля, отмечает юбилей главный внештатный детский специалист аллерголог-иммунолог Министерства здравоохранения Тверской области, кандидат медицинских наук, врач аллерголог-иммунолог Нусинов Евгений Владимирович. Евгению Владимировичу исполнилось 50 лет.
6 июля - Всемирный день кардиолога
6 июля в нашей стране отмечают Всемирный день кардиолога. Это ежегодный праздник, посвященный врачам, лечащим заболевания сердечно-сосудистой системы.
Везикоуретальный рефлюкс и рефлюкс-нефропатия
Рефлюкс-нефропатия – это сморщивание почек, вызванное везикоуретральным рефлюксом инфецированной мочи в паренхиму почки. Диагноз следует подозревать у детей с инфекцией мочевых путей или при наличии рефлюкс-нефропатии в семейном анамнезе, или если на пренатальном скрининге при ультразвуковом исследовании обнаружен гидронефроз. Диагностика с помощью экскреторной цистоуретрографии или радионуклидной цистографии. Детей с умеренным или тяжелым рефлюксом лечат профилактическим назначением антибиотиков или хирургически.
Рефлюксная нефропатия связана с типом хронического тубулоинтерстициального нефрита, а также с опосредованным гломерулярным поражением. Традиционно считалось, что к сморщиванию почки приводит хронический пиелонефрит Хронический пиелонефрит Хронический пиелонефрит – это продолжающаяся гнойная инфекция почек, которая встречается исключительно у больных с тяжелыми анатомическими дефектами. Симптомы могут отсутствовать или могут включатьт. Прочитайте дополнительные сведения . Однако, рефлюкс – это, возможно, единственный важнейший фактор, но также могут играть роль другие факторы, не связанные с рефлюксом или пиелонефритом (например, наследственность).
Везикоуретеральным рефлюксом (ВУР) страдает около 1% новорожденных и от 30 до 45% детей младшего возраста с лихорадочными инфекциями мочевыводящих путей Инфекции мочевыводящих путей (ИМП) у детей Инфекции мочеполовых путей (ИМП) диагностируют при выявлении ≥ 5 × 10 4 колоний/мл в образцах мочи, полученных через катетер, или в повторных образцах мочи, содержащих ≥ 10 5 . Прочитайте дополнительные сведения ; он часто встречается у детей с почечными рубцами и, по неизвестным причинам, менее распространен среди темнокожих детей, чем среди белых детей. Часто наблюдается семейная предрасположенность. У детей с массивным рефлюксом (до почечной лоханки плюс дилатация мочеточника) самый высокий риск рубцевания и последующей хронической болезни почек Хроническая болезнь почек Хроническая болезнь почек (ХБП) представляет собой длительное прогрессивное снижение почечной функции. Симптомы развиваются медленно и на продвинутых стадиях включают в себя анорексию, тошноту. Прочитайте дополнительные сведения .
Рефлюкс развивается вследствие несостоятельности уретровезикальных клапанов или механической обструкции мочевого тракта. Наиболее подвержены этому маленькие дети с более короткими внутрипузырными частями мочеточников; нормальное развитие обычно приводит к спонтанному исчезновению внутрипочечного и везикоуретрального рефлюкса к 5 годам. Новые участки сморщивания почки у детей > 5 лет нехарактерны, но могут формироваться после острого пиелонефрита.
Симптомы и признаки ПМР и рефлюкс-нефропатии
У маленьких детей почти не бывает никаких клинических симптомов, помимо случаев периодической инфекции мочевыводящих путей, и диагноз часто не могут установить до подросткового возраста, когда у пациентов начинают проявляться один или несколько из следующих признаков:
Симптомы и признаки почечной недостаточности
Диагностика ПМР и рефлюкс-нефропатии
Первичный скрининг с ультразвуковым исследованием
Экскреторная цистоуретрография и радионуклидная цистография
Рефлюкс-нефропатию можно заподозрить в предродовой период и после рождения ребенка. Первоначальный скрининг проводят с помощью ультрасонографии.
Диагноз и стадия рефлюкс-нефропатии (пренатально или постнатально заподозренной) в конечном итоге определяются с помощью микционной цистоуретрографии Цистоуретрография Визуализационные методики часто используются для обследования пациентов с нефрологической и урологической патологией. Рентгенография брюшной полости без использования рентгеноконтрастных препаратов. Прочитайте дополнительные сведенияПренатальная диагностика
Диагноз можно заподозрить пренатально, если УЗИ, сделанное из-за отягощенного семейного анамнеза или по несвязанным причинам, показывает наличие гидронефроза; у 10–40% таких пациентов диагностируют везикоуретральный рефлюкс (ВУР) после рождения.
Постнатальная диагностика
Везикоуретеральный рефлюкс можно заподозрить после рождения при наличии любого из нижеперечисленных признаков:
ИМП в возрасте ≤ 3 лет
Фебрильная инфекция мочевыводящих путей в возрасте ≤ 5 лет
Рецидивирующая инфекция мочевыводящих путей у детей
Отягощенный семейный анамнез, такой как сибсы с ВУП (противоречиво)
Взрослые (или дети > 5 лет) с рецидивирующей инфекцией мочевыводящих путей, у которых при УЗИ почек определяется сморщивание почек или аномалии строения мочеполового тракта
Возможные отклонения лабораторных показателей: протеинурия, потеря натрия, гиперкалиемия, метаболический ацидоз, почечная недостаточность или их сочетание.
Необходимое тестирование для этих пациентов включает радионуклидную цистографию или микционную цистоуретрографию. Поскольку эти тесты включают катетеризацию (и риск инфекции мочевыводящих путей), а также радиационное облучение, пороговая величина их получения может быть спорной. Некоторые эксперты рекомендуют ЦУГ или РНЦ только при наличии семейного анамнеза заболевания или если на УЗИ после рождения сохраняются значительные постоянные аномалии; однако остается неясным, является ли УЗИ почек достаточно чувствительным методом для определения ВУР. ДМСК-сканирование может быть выполнено новорожденным детям с инфекциями мочевыводящих путей, как указано выше.
Для детей старшего возраста, у которых рефлюкс больше не проявляется, ЦУГ может не выявлять рефлюкс, хотя ДМСК-сканирование показывает рубцевание почек; при цистоскопии могут быть обнаружены признаки имевшегося ранее рефлюкса в устьях мочеточника. Таким образом, ДМСК-сканирование и цистоскопию можно выполнять, если есть прежнее неподтвержденное подозрение на рефлюкс.
Биопсия почек на этой поздней стадии выявляет хронический тубулоинтерстициальный нефрит и фокальный гломерулосклероз, которые могут вызвать протеинурию – от умеренной (1–1,5 г/день) до показателей в нефротическом диапазоне (3,5 г/день).
Лечение ПМР и рефлюкс-нефропатии
Обычно профилактическая антибиотикотерапия
Хирургическое лечение, если имеет место везикоуретральный рефлюкс (ВУР) средней или тяжелой степени
Лечение рефлюкс-нефропатии основано на недоказанном предположении, что уменьшение рефлюкса и инфекции мочевыводящих путей предотвращает сморщивание почки. Детям с очень небольшим ВУР лечение не требуется, но необходимо тщательно следить за симптомами инфекции мочевыводящих путей у них.
Детям со средней выраженностью рефлюкса часто дают антибиотики. Однако лекарственная терапия способствует новым эпизодам острого пиелонефрита, и пока не ясно, является ли профилактическое лечение антибиотиками более эффективным, чем просто динамическое наблюдение.
У пациентов с выраженным рефлюксом более высокий риск почечной недостаточности, поэтому они обычно получают профилактическую антибиотикотерапию или подвергаются хирургическому лечению, включая уретральную реимплантацию или эндоскопическое введение материалов позади мочеточника для предотвращения рефлюкса (сокращение мочевого пузыря во время мочеиспускания сокращает мочеточник между мочевым пузырем и материалом). Частота появления новых участков сморщивания почки одинакова у пациентов, леченых как хирургически, так и медикаментозно.
Рефлюкс спонтанно проходит у около 80% маленьких детей младше 5 лет.
Ключевые моменты
Необходимо рассматривать вероятность рефлюкс-нефропатии у детей
Если есть подозрение на рефлюксную нефропатию, проводите ультразвуковое исследование; если проявится патология, рассматрите возможность проведения цистоуретрографии или радионуклидной цистографии, чтобы свести к минимуму лучевую нагрузку.
Необходимо рассмотреть целесообразность профилактического назначения антибиотиков и – в случае тяжелой формы рефлюкса – хирургического лечения.
По причине отсутствия единого мнения, конкретных рекомендаций относительно времени и метода проведения диагностической визуализации у пациентов и назначения профилактического лечения антибиотиками, не выработано.
Рефлюкс спонтанно проходит у около 80% маленьких детей младше 5 лет.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Везикоуретальный рефлюкс и рефлюкс-нефропатия
Сотрудники «Научно-исследовательский институт педиатрии им. академика Ю.Е. Вельтищева» представили обзор литературы, посвященный генетически обусловленным пузырно-мочеточниковому рефлюксу (ПМР) и рефлюкс-нефропатии, которые сопровождают определенные фенотипы системных или локальных форм наследственной дисплазии соединительной ткани (синдромы Элерса–Данло, Марфана, Вильямса, вялой кожи).
Рефлюкс везикоуретрального соустья, ПМР – нередкая педиатрическая проблема, частота которой составляет 1% в общей популяции и 30% – у детей с инфекцией мочевых путей. Это врожденный или генетически обусловленный дефект мочевых путей с аномальным строением везикоуретрального соустья, выявляемого с помощью цистографии. Причиной ПМР чаще всего является первичный или вторичный дефект устья мочеточника и/или мочевого пузыря. Основной причиной служит первичный дефект везикоуретрального соустья, при котором не происходит его закрытие во время мочеиспускания. Вторичный ПМР обусловлен повышением давления в везикоуретральном соустье и мочеточнике при анатомической обструкции заднего уретрального клапана, а также при функциональной патологии мочевого пузыря (нейрогенный мочевой пузырь). Оба варианта встречаются как изолировано, так и как часть синдрома САKUТ (congenital anomalies of the kidney and urinary tract). Наследственный ПМР, как установлено в настоящее время, обусловлен мутацией одного или нескольких генов, кодирующих внеклеточные белковые компоненты вези- коуретрального соустья и других частей мочевыводящих путей. Генетически обусловленный ПМР характерен для лиц с наследственной дисплазией соединительной ткани.
Cтруктурные компоненты, участвующие в биомеханических функциях везикоуретрального соустья. Везикоуретральное соустье – важнейшая структура в мочевых путях, защищающая верхние мочевые пути с низким давлением от высокого давления в мочевом пузыре, возникающем при мочеиспускании. Везикоуретральное соустье предупреждает ретроградный ток мочи к почке, что обеспечивается закрытием его просвета. Такая функция везикоуретрального соустья обусловлена различными факторами: 1) адекватной длиной дистального (внутрипузырного) отдела мочеточника, в норме составляющего 0,5 см у новорожденных и 1,5–2,5 см у старших детей и у взрослых; 2) участием в «закрытии» не только мышц мочеточника, но и детрузора (сочетанное сдавливающее воздействие); 3) участием внеклеточного микроокружения, действующего синергично с мышечными структурами и участвующего в сокращении устья мочеточника в норме. Аномалии в любом из этих элементов создают высокий риск ПМР. Однако многочисленные исследования показали, что у 50–65% детей ПМР без клинических проявлений претерпевает обратное развитие с возрастом.
В тяжелых случаях рефлюкса и рецидивирующего пиелонефрита возникают паренхиматозное перерождение и фиброзное рубцевание почек – рефлюкс-нефропатия. Картина рефлюкс-нефропатии описана F. Tokhmafshan и соавт. как при врожденных, так и при генетически обусловленных формах ПМР и нередко наблюдается и без пиелонефрита. Рефлюкс-нефропатия – частая причина хронической почечной недостаточности, наблюдающаяся в 10–15% случаев у детей с необходимостью длительного проведения гемодиализа или трансплантации почек.
Гистологически рефлюкс-нефропатия характеризуется интерстициальной инфильтрацией и хроническим воспалением, утолщением тубулярных и канальцевых мембран, атрофией и дилатацией канальцевого эпителия, утолщением интимы и мезангиума вокруг артерий и артериол, фиброзом вокруг гломерул и канальцев. Фиброз связывают с активацией миофибробластов, количество которых увеличивается в связи с переходом в миофибробласты предшественников других клеток в ответ на действие провоспалительных цитокинов (TGFb1), что служит основой патогенеза ренального и мочеточникового фиброза и стимуляции избыточной продукции компонентов внеклеточного матрикса. В норме соотношение мышечных клеток и внеклеточного матрикса составляет 1:0,3, а при ПМР – 1:3 с заменой дегенеративных мышечных волокон на коллагеновые волокна не только в области везикоуретрального соустья, но и в соседнем с ним детрузоре.
Биомеханические свойства компонентов внеклеточного матрикса везикоуретрального соустья. Если мышечные клетки обеспечивают продвижение мочи по мочевыводящим путям, то их участие в функции везикоуретрального соустья во многом дополняется компонентами внеклеточного матрикса. От его специфического состава зависят сократительные способности везикоуретрального соустья в ответ на внутренние и внешние воздействия. Выделяют 3 основные свойства внеклеточного матрикса: 1) сила натяжения, обеспечивающая устойчивость ткани к деформации, перерастяжению и разрыву (это свойство зависит от количества, организации и типа коллагена); 2) податливость (комплаентность) ткани к расширению; 3) способность ткани возвращать оригинальные размеры и форму (сокращение) после воздействия внешних или внутренних сил, что обеспечивается количеством и качеством эластических волокон.
Из коллагенов всех типов в функции внеклеточного матрикса везикоуретрального соустья и мочевыводящих путей принимают участие в основном коллагены 4 типов: I, II, III и V, кодируемые генами COL1A1, COL1A2, COL2A1, COL3A1, COL5A1, COL5A2, COL5A3. Коллаген I типа входит в состав внеклеточного матрикса органов мочевой системы, а также печени, сухожилий, кожи, артерий, дентина, клапанов сердца, роговицы глаза. Мутация генов коллагена I и II типов обусловливает гипермобильность суставов, гиперрастяжимость кожи, деформации скелета, зубов, клапанов сердца, патологию глаз, сколиоз. Нарушается расщепление проколлагена в коллаген после секреции предшественника коллагена во внеклеточный матрикс; коллаген II типа содержится во внеклеточном матриксе вместе с коллагеном I типа. Оба коллагена определяют резистентность везикоуретрального соустья к растяжению (сила натяжения). Коллаген III типа определяет форму и толщину коллагеновых фибрилл, входит в состав внеклеточного матрикса не только везикоуретрального соустья, но и артерий, кожи, паренхиматозных органов. Коллаген III типа образует более тонкие и более растяжимые фибриллы, чем коллаген I типа, и встречается в большем количестве в сосудистых стенках. Толстые фибриллы коллагенов I и II типов определяют силу натяжения, а тонкие фибриллы коллагена III типа, имеющие между собой более тесную внутреннюю перекрестную связь, определяют резистентность к гиперрастяжению. Коллаген V типа – тонковолокнистый компонент основного вещества сосудистой стенки, регулирует размер и диаметр коллагеновых фибрилл. В составе внеклеточного матрикса везикоуретрального соустья этот коллаген представлен в меньшем количестве, чем I и II типы. Известно, что мутация генов коллагенов I–V типа приводит к дефициту гидроксилизина в их молекулах. Кроме того, недостаток гидроксилизина может быть обусловлен мутацией гена лизилгидроксилазы (PLOD1), обеспечивающей гидроксилирование лизина в молекулах коллагена. Это приводит к снижению стабильности коллагеновых волокон, дегенеративным изменениям соединительной ткани из-за нарушения синтеза коллагена и снижения прочности перекрестных связей между фибриллами.
Кроме того, значительную роль в функции клеточных элементов органов мочевой системы играет нефибриллярный коллаген IV типа (ген COL4A1), образующий сетчатые «строительные леса» в базальных клеточных мембранах, в том числе базальных гломерулярных мембранах, является уникальным компонентом внеклеточного матрикса большинства клеточных образований (эпителий, эндотелий, миоциты, шванновские клетки, адипоциты) и содержит значительно больше оксипролина, чем другие коллагены. Коллаген IV типа обеспечивает связь молекул внеклеточного матрикса с клетками, а также между компонентами самого матрикса, включая факторы роста, ламинины, протеогликаны, обеспечивает адгезию, миграцию, созревание и регенерацию клеток, заживление ран, иммобилизацию ферментов. Большинство мутаций генов коллагена IV типа обусловливают полисистемные болезни и часто приводят к эмбриональной летальности, синдрому Альпорта, глухоте, почечной недостаточности.
Помимо коллагенов к главным фибриллярным компонентам внеклеточного матрикса везикоуретрального соустья относятся эластические волокна, образующиеся путем переплетения эластина, составляющего ядро, с микрофибриллами фибулина и фибриллина, входящими в семейство гликопротеинов внеклеточного матрикса. Образующиеся эластические волокна обеспечивают сохранность оригинальной формы и размеры (сокращение) ткани везикоуретрального соустья после повторных циклов «раздувания». Это свойство теряется с возрастом. Кроме того, эластические волокна участвуют в адгезии, пролиферации клеток внеклеточного матрикса. Фибриллин играет ключевую роль в регуляции сигнальной системы трансформирующего фактора роста β, а также образует основу для депозиции эластина. Образованию и перекрестному связыванию эластина в микрофибриллы фибриллина способствуют члены семейства фибулинов – фибулин-4 и фибулин-5. Белок тропоэластин, кодируемый геном эластина (ELN), является фундаментальным компонентом эластина. Вновь трансплантируемые мономеры тропоэластина секретируются во внеклеточный матрикс, где они, перекрестно связываясь, образуют эластин. Экспрессия гена эластина начинается еще с 17 нед гестации, что способствует своевременному развитию и созреванию тканей, необходимых для эластического «сжатия», экспрессия эластина с возрастом снижается, наблюдается потеря сократительной способности тканей.
Процесс накопления коллагена во внеклеточного матриксе регулируется различными факторами, главные из которых – факторы роста, в частности TGFβ1 (ген TGFB) – мощный профиброзирующий цитокин, усиливающий избыточную продукцию коллагена, снижающий деградацию внеклеточного матрикса и генерирующий приток фибробластов при прогрессировании фиброза. Основными молекулярными компонентами фиброзной ткани служат коллагены I и III типов, продуцируемые фибробластами. TGFβ1 – член суперсемейства факторов роста β, белок, синтезируемый многими клетками и обладающий многими функциями, включая контроль роста, пролиферацию, дифференцировку клеток и апоптоз. Этот цитокин в норме подавляет воспалительную реакцию и синтез провоспалительных цитокинов, участвует в контроле тонуса сосудов, повышая синтез эндотелина-1 и ренина. Активный TGFβ1 влияет на функции Т- и В-лимфоцитов и клетки миелоидного ряда. Дисрегуляция активности этого цитокина и его сигнального пути может обусловить усиление апоптоза. Вариант полиморфизма Leu/Pro гена TGFB приводит к замене в его молекуле лейцина на пролин, что увеличивает риск развития артериальной гипертонии, нефропатии, ретинопатии, бронхиальной астмы. Частота этого нуклеотидного варианта составляет 43–55%, тип наследования – аутосомно-доминантный. Однако TGFβ1 может оказывать провоспалительное действие на клетки миелоидного ряда (макрофаги, моноциты), функционируя как хемоатрактант в ответ на некоторые патогены. Действуя на Т-лимфоциты, TGFβ1 может повышать экскрецию провоспалительных цитокинов, особенно в незрелых клетках, а через В-лимфоциты – усиливать апоптоз и снижать пролиферацию, экспрессию образования антител и трансферрина в зрелых и незрелых клетках. Под действием TGFβ1 может повышаться экспрессия моноцитарных цитокинов – ИЛ1α, ИЛ1β и TNF-α и снижаться продукция Т-хелперов в макрофагах и моноцитах.
Показано, что стимуляция эпителиомезенхимального перехода при прогрессировании фиброза происходит в результате связывания C-конца неактивного TGFβ1 с тенасцином, который играет большую роль во внеклеточном матриксе. Тенасцин взаимодействует с коллагенами I, III, V, XII–XIV типов через EGF-подобный, FNIII-подобный и фибриноген-подобный домены. Важность этих контактов подчеркивается при мутации гена TNXB, ведущей к гиперподвижности суставов, гиперрастяжимости кожи. При этом состоянии коллагеновые фибриллы в ткани некомпактно, неплотно упакованы, расположены отдельно друг от друга, что сочетается со снижением количества и качества эластичных фибрилл, их перегибами и фрагментацией. В таких нарушениях задействованы тропоэластин – основной предшественник эластина, а также С-концевой домен, FNIII-домен и фибриногенглобулярный домены тенасцина. Подчеркивается, что 95% мутаций тенасцина затрагивают домены фибронектина III (FNIII). Таким образом, тенасцин влияет на обеспечение биомеханических свойств тканей через регуляцию образования и стабильности как коллагеновых, так и эластических фибрилл. В дополнение к сохранению тканевой архитектуры тенасцин играет регулирующую роль в клеточных контактах, «обороте» матрикса, биоактивности TGFβ1, активируя его латентные формы. Однако тенасцин может проявлять антиадгезивные свойства, оказывать отрицательное действие на активность матричных металлопротеиназ (ген ADAMTS2), модулируя «оборот» внеклеточного матрикса, а через EFG и FNIII-домены способствовать пролиферации эндотелиальных клеток.
Частое выявление ПМР у лиц с наследственной дисплазией соединительной ткани, а также крайняя необходимость участия компонентов стенок мочеточника и мочевого пузыря, включая мускулатуру и внеклеточный матрикс везикоуретрального соустья, в антирефлюксном механизме подтверждают, что дефекты этих структур могут обусловить развитие рефлюкса. Изучение мутаций генов компонентов внеклеточного матрикса при ПМР и рефлюкс-нефропатии позволили определить варианты наследственных дисплазий соединительной ткани с высоким риском развития этих болезней. Как правило, к таким болезням относятся синдромы Элерса–Данло, Марфана, Вильямса, вялой кожи. Не описаны случаи ПМР при несовершенном остеогенезе, возможно, в связи с недостаточным количеством наблюдений, хотя в генезе этого синдрома участвуют мутации генов коллагена I и II типов.
Заключение. Нормальная функция мочевого тракта нуждается в деликатном балансе сил натяжения и сократительной способности тканей, что обеспечивается качественным и количественным составом коллагеновых и эластических волокон. При генетической или врожденной патологии с нарушением этого баланса возрастает частота дефектов структуры и функции мочевыводящих путей. Так, активация сигнального пути трансформирующего фактора роста β2 потенцирует фиброз внеклеточного матрикса с преобладанием сил натяжения (накопление коллагена I типа), в результате чего повышается давление внутри мочеточников, препятствующее току мочи, с нарушением закрытия пузырно-мочеточникового соустья и развитием рефлюкса. С повреждением структуры и дисфункцией мышц мочевого пузыря (гиперрефлекторный мочевой пузырь) повышается риск нарушения градиента давления между мочевым пузырем и везикоуретральным соустьем во время мочеиспускания, что способствует появлению ПМР. Характерная для классических вариантов синдрома Элерса–Данло гипермобильность суставов может свидетельствовать о снижении сил натяжения и сократительной способности тканей и наличии ПМР. Мутация гена тенасцина – крупного многофункционального гликопротеина внеклеточного матрикса, обусловливает уменьшение как сил натяжения, так и сократительной способности тканей при гипермобильности суставов с развитием ПМР. По мнению ряда авторов, сочетание ПМР и дивертикулов мочевого пузыря является результатом наследственной дисплазии соединительной ткани, в связи с чем целесообразны дальнейшие генетические исследования у больных с ПМР и рефлюкс-нефропатией.
Рефлюкс-нефропатия
Оценена эффективность профилактики формирования хронической болезни почек у детей с пузырно-мочеточниковым рефлюксом. Проведено сопоставление комплекса клинических и параклинических данных 40 детей в возрасте от 1 года до 17 лет с пузырно-мочеточниковым р
Установлена нозологическая структура хронической болезни почек (ХБП) у детей Оренбургской области. В результате проведенного исследования установлено преобладание тубулоинтерстициальных болезней (91,3%) в нозологической структуре ХБП. Проведенное исследов
Установлено стадийное снижение частоты бактериального воспаления тубулоинтерстициальной ткани почек у детей с тубулоинтерстициальным поражением почек (ТИПП), значение ренальной инфекции среди предикторов формирования (38,05%) и прогрессирования (27,3%) ТИ
Проведено исследование с целью установить предикторы прогрессирования рефлюкс-нефропатии у детей. Обследованы 148 детей в возрасте от 1 года до 17 лет с рефлюкс-нефропатией (РН) на разных стадиях тубулоинтерстициального поражения почек (ТИПП) и детей конт
Оценена эффективность профилактики прогрессирования хронической болезни почек (ХБП) у подростков с ренальной инфекцией. Проведено сопоставление комплекса клинических и параклинических данных 118 детей в возрасте от 1 года до 17 лет с рефлюкс-нефропатией н
Оценены структурные и функциональные изменения почек у детей с рефлюкс-нефропатией (РН) на разных стадиях тубулоинтерстициального поражения почек (ТИПП). Определены и сопоставлены структурные и функциональные изменения почек у 188 детей в возрасте от 1 го
Оценена эффективность медикаментозной реабилитации подростков, перенесших рецидив ренальной инфекции у детей с тубулоинтерстициальным поражением почек (ТИПП). Проведенная оценка эффективности медикаментозной реабилитации пациентов, перенесших обострение р
Проведено сопоставление комплекса клинических и параклинических данных 118 детей с рефлюкс-нефропатией на разных стадиях тубулоинтерстициального поражения почек (ТИПП), 40 детей с пузырно-мочеточниковым рефлюксом (ПМР) без признаков нефросклероза. Параме
Анализ суточной экскреции с мочой цитокинов и факторов роста свидетельствует о преобладании продукции и экскреции провоспалительных, просклеротических цитокинов и факторов роста над противовоспалительными, что подтверждает превалирование процесса фиброген
Оценена эффективность профилактики рецидивов ренальной инфекции у детей с тубулоинтерстициальными болезнями почек. Проведено сопоставление комплекса клинических и параклинических данных 45 детей с рефлюкс-нефропатией на разных стадиях тубулоинтерстициал
Эффективность терапии ингибитором ангиотензинконвертирующего фермента обосновывает использование данной группы лекарственных препаратов для профилактики прогрессирования хронической болезни почек у пациентов с рефлюкс-нефропатией, доказывая возможность об
Ранняя диагностика тубулоинтерстициального поражения почек у детей с пузырно-мочеточниковым рефлюксом основана на оценке комплекса иммунологических, гемодинамических факторов, позволяет с вероятностью 94% прогнозировать формирование рефлюкс-нефропатии у п
Рассмотрено лечение пузырно-мочеточникового рефлюкса методом эндоскопической коррекции. Метод характеризуется рядом важных преимуществ – малой травматичностью, короткой продолжительностью оперативного вмешательства, возможностью применения в амбулаторных
Актуальные проблемы
Специализации
- Premium
- Аллергология
- Бронхопульмонология
- Вакцинопрофилактика
- Гастроэнтерология
- Гепатология
- Гинекология
- Дерматовенерология
- Иммунология
- Инфекции
- Кардиология
- ЛОР-патология
- Медтехника
- Неотложная помощь
- Нутрициология
- Онкология
- Педиатрия
- Психоневрология
- Ревматология
- Сезонная аллергия
- Терапия
- Уронефрология
- Фармакология
- Эндокринология
- ИТ в здравоохранении
Календарь событий:
Четвертый Байкало-Енисейский онкологический форум дата окончания: 09 Сентября 2022 Место проведения: Красноярск, ул. 1-я Смоленская 16к2, конференц-зал Онкодиспансера
Международный форум «Росмедобр-2022. Инновационные обучающие технологии в медицине» состоится в Москве дата окончания: 17 Сентября 2022 Место проведения: Москва, Рэдиссон Славянская Отель и Бизнес-центр
XIII международный форум «Росмедобр-2022. Инновационные обучающие технологии в медицине» дата окончания: 17 Сентября 2022 Место проведения: Москва, Рэдиссон Славянская Отель и Бизнес-центр
Читайте также:
