Влияние секретина на синтез инсулина, на желудок и кровоток
Добавил пользователь Skiper Обновлено: 30.01.2026
Введение. В настоящее время сахарный диабет (СД), без преувеличения, занимает одну из драматических страниц мировой медицины. Эта патология является одной из наиболее важных проблем здравоохранения, она бросает вызов в равной степени, как эндокринологам, так и врачам других специальностей. В России по данным ВОЗ прогнозируется рост числа больных СД с 4,6 млн в 2000 г. до 5,3 млн. к 2030 г. [1].
Гастроэнтерологические аспекты СД исследованы значительно хуже, чем изменения сердца, сосудов, почек. Это касается, в первую очередь, патологии верхних отделов пищеварительного тракта, в частности заболеваний пищевода. При этом известно, что наиболее часто больные СД обращаются к врачу в связи с появлением у них различных диспепсических жалоб [2].
Клинические исследования, посвященные изучению состояния пищевода при сочетании гастроэзофагеальной рефлюксной болезни (ГЭРБ) и СД немногочисленны, а результаты их требуют обобщения и дополнения [3]. В частности, нет точных данных по частоте встречаемости, особенностям течения ГЭРБ при разных типах СД, в зависимости от длительности СД, характера сахароснижающей терапии. Многие патогенетические механизмы формирования ГЭРБ при СД освещены недостаточно.
В последние годы, все чаще, больным СД 2 типа (СД 2) назначается инсулинотерапия, в том числе по интенсивной схеме с сочетанием коротких и пролонгированных форм препарата. Это позволяет добиваться компенсации СД 2, снижать риск развития осложнений со стороны сердца, сосудов, почек. В то же время, в литературе имеются данные о неблагоприятном влиянии инсулина на течение ряда патофизиологических процессов в желудочно-кишечном тракте у больных СД. В частности, введение инсулина повышает желудочную секрецию соляной кислоты, уменьшает регенераторный потенциал слизистой желудка [2]. Нами, ранее, было показано неблагоприятное влияние инсулинотерапии на течение гастродуоденальных язв у больных СД 2, на эффективность их лечения и динамику заживления [4]. Вопрос о том, как влияет инсулинотерапия на развитие и течение ГЭРБ при СД 2, оставался без ответа.
Цель нашего исследования состояла в определении особенностей клиники и течения ГЭРБ при СД 2 в зависимости от вида сахароснижающей терапии, в первую очередь, лечения инсулином.
Материал и методы. Под нашим наблюдением находилось 159 больных СД 2 (123 женщины и 67 мужчин), средний возраст - 57,4 ± 7,6 года. Диагноз СД был установлен пациентам согласно классификации и критериям ВОЗ (2005 г.). Инсулинотерапию получали 68 больных СД 2, 91 пациент принимал сахароснижающие таблетированные препараты (СТП) разных групп. Мы не включали в исследование пациентов СД 2, находящихся только на диабетической диете, так как у них была только легкая форма СД. По уровню гликемии больные были в стадии компенсации или субкомпенсации. Всем пациентам с СД проводилось общеклиническое обследование, а также суточная рН-метрия пищевода и желудка на аппарате «Гастроскан 24» («Исток-Система», г. Фрязино) по стандартной методике [5]. На основании жалоб и данных рН-метрии, согласно рекомендациям Монреальского соглашения (2005), устанавливался диагноз ГЭРБ [6]. В дальнейшем пациентам с СД 2 и ГЭРБ проводилось эндоскопическое исследование, биопсия не менее, чем с 3-х участков слизистой оболочки пищевода и желудка. Использовали эндоскопическую классификацию ГЭРБ по Ю.В. Васильеву (2004) [7]. Также проводили изучение степени контаминации H. рylori (НР) слизистой пищевода и желудка гистологическим и уреазным методами. Из обследования исключались больные СД 2 с другими заболеваниями пищевода, клинически значимыми болезнями ЖКТ, с тяжелой сердечной и почечной недостаточностью, кетозом.
В качестве контрольной группы было обследовано по вышеприведенной схеме 74 человека, не страдающих СД, для выявления у них ГЭРБ.
Все пациенты давали письменное согласие на проведение обследования по предложенному алгоритму. Структура соглашения соответствовала официально принятой.
Статистический анализ проводился с использованием программ Excel 2007, Statistic 6.0., с расчетом двухвыборочного и парного критерия Стьюдента, непараметрическим анализом в выборках с малым количеством наблюдений. Для подсчета уровня значимости двухмерных таблиц качественных показателей 2x2 использован метод χ2 (хи-квадрат) Пирсона. Применялся расчет относительного риска события (ОР) с представлением доверительного интервала (ДИ) 95%. Все статистические гипотезы рассматривались как двусторонние с уровнем значимости 0,05.
Результаты исследования. Ведущее значение в диагностике ГЭРБ у больных СД 2 имело суточное рН мониторирование пищевода, при котором определяли патологический гастроэзофагеальный рефлюкс (ГЭР). Этого было достаточно, согласно Монреальским рекомендациям по ГЭРБ (2005), для постановки диагноза. Мы учитывали и пищеводные жалобы больных на изжогу, регургитацию кислым, одинофагию и др., которые должны быть у пациента не менее 1-го раза в неделю на протяжении года. Но только ориентироваться по пищеводным жалобам, как это бывает при скрининговых исследованиях по выявлению ГЭРБ среди населения, мы не могли, так как часть пациентов, при наличии патологического ГЭР, жалоб не предъявляла. Данные рН-метрии пищевода представлены в таблице 1.
Таблица 1. Показатели рН-метрии пищевода у больных СД 2
| Показатель | Норма | СД 2, n=190 | Контроль n=74 | |
| ИЗСД 2 n=68 | ИНЗСД 2, n=91 | |||
| рН | 25,3±2,1* | 13,1±1,5* | 6,2±1,4 | |
| Число ГЭР за 24 часа | 94,3±6,7* | 64,8±3,9* | 50,2±2,9 | |
| Больные с патологическим ГЭР | - | 26 (40,6%)* | 29 (32,1%)* | 18 (24,3%) |
| Показатель De Meester | 36,2±2,2* | 27,3±2,1* | 17,9±2,1 | |
* - достоверность различий с контролем, р
- достоверность различий между ИЗСД 2 и ИНЗСД 2, р
В дальнейшем, были сформированы две группы пациентов с СД 2 и ГЭРБ: в 1-ю вошли лица, которые получали инсулин, как в виде монотерапии, так и в сочетании с СТП - 26 человек, во 2-ю группу были включены больные, получавшие только СТП — 39 человек. Сравнительная характеристика данных групп представлена в таблице 2.
Таблица 2. Сравнительная характеристика 1-й и 2-й групп обследованных
| Параметр | 1-я группа, n=26 | 2-я группа, n=29 | P |
| Средний возраст, лет | 58,9±8,1 | 54,6±6,8 | |
| Мужчин, n (%) Женщин, n (%) | 16 (61,5%) 10 (38,5%) | 16 (55,2) 13 (44,8) | >0,05 >0,05 |
| Стаж СД 2, лет | 13,6±5,4 | 10,1±4,6 | >0,05 |
| Среднетяжелый СД, n (%) Тяжелый СД, n (%) | 11 (42,3) 15 (57,7) | 16 (55,2) 13 (44,8) | >0,05 >0,05 |
| Средняя гликемия, ммоль/л | 8,4+2,2 | 10,4±3,1 | >0,05 |
| НbА 1с* | 7,8±1,4 | 8,1±1,8 | >0,05 |
| Осложнения СД, n (%): Полинейропатия Ретинопатия Нефропатия | 18 (69,2) 25 (96,2) 19 (73,1) | 19 (66,5) 22 (84,6) 21 (72,4) | >0,05 >0,05 |
| Ассоциированные заболевания, n (%): ИБС ЦВЗ | 20 (76,9) 17 (65,4) | 22 (75,9) 18 (62) | >0,05 >0,05 |
*- НbА 1с - гликированный гемоглобин.
Группы 1 и 2 были сравнимы между собой, за исключением более частой ретинопатии у пациентов 1-й группы. Основное различие между пациентами 1-й и 2-й групп состояло в виде сахароснижающей терапии.
Был проведен сравнительный анализ пищеводных жалоб пациентов 1-й и 2-й групп обследованных (таблица 3).
Таблица 3. Частота пищеводных жалоб у больных СД 2 и ГЭРБ
| Характер жалоб | Группы больных | |||
| 1-я группа, n=26 | 2-я группа, n=29 | |||
| Абс. | % | Абс. | % | |
| Отсутствие жалоб | 5 | 19,2* | 12 | 41,4 |
| Изжога | 20 | 76,9* | 13 | 44,8 |
| Регургитация кислым | 15 | 57,7* | 10 | 34,5 |
| Боль за грудиной | 8 | 30,8* | 6 | 20,7 |
| Дисфагия | 6 | 23,1 | 5 | 17,2 |
| Одинофагия | 6 | 23,1 | 5 | 17,2 |
| Тошнота | 14 | 53,8* | 9 | 31 |
| Слюнотечение | 3 | 11,5 | 4 | 13,8 |
* - достоверность различий между группами, р
В 1-й группе пациентов СД 2, получающих инсулин, достоверно чаще наблюдались такие жалобы, как изжога, регургитация кислым, боль за грудиной, связанная с приемом пищи, тошнота, по сравнению со 2-й группой больных СД 2, которые принимали СТП. Среди лиц 1-й группы оказалось достоверно меньше больных ГЭРБ, у которых отсутствовали пищеводные жалобы, в отличие от 2-й группы (19,2% и 41,4% соответственно, p<0,05).
Во время проведения больным СД 2 и ГЭРБ рН-метрического обследования, наряду с изучением внутрипищеводной рН, было обращено внимание на показатели внутрижелудочной кислотности. У пациентов 1-й группы средние значения рН тела желудка составили 1,36±0,08, что соответствовало умеренной гиперацидности. Во 2-й группе больных рН тела желудка была достоверно выше (1,89±0,11, p<0,05), и это соответствовало его нормацидному состоянию. В антральном отделе желудка, у обеих групп, имела место компенсация ощелачивания (рН — 4,48 ± 0,21 и 4,56 ± 0,42, соответственно, p>0,05).
Была поставлена задача оценить эндоскопическую картину изменений пищевода в обследованных группах больных (таблица 4).
Таблица 4. Результаты эндоскопического исследования пациентов с СД 2 и ГЭРБ
| Стадия ГЭРБ | 1-я группа, n=26 | 2-я группа, n=29 | ||
| Абс. | % | Абс. | % | |
| I стадия, эндоскопически негативная | 2 | 7,7* | 8 | 27,6 |
| II стадия, рефлюкс-эзофагит | 6 | 23,1* | 9 | 31 |
| III стадия, эрозивный эзофагит | 13 | 50* | 10 | 34,5 |
| IV стадия, язва пищевода | 5 | 19,2* | 2 | 6,9 |
Отмечено, что в 1-й группе достоверно чаще выявляли эрозивный эзофагит и язвы пищевода, чем в группе 2. При этом эрозивный эзофагит наблюдался в 50% случаев в 1-й группе. Эндоскопически негативная ГЭРБ и простой рефлюкс - эзофагит встречался чаще у лиц 2-й группы, получающих СТП. Различия между группами были достоверны. Следует отметить, что у всех пациентов с эндоскопически негативной ГЭРБ, при гистологическом исследовании биоптатов слизистой пищевода, были обнаружены воспалительные изменения. Гистологическая картина, в целом, представляла собой пролиферацию или дистрофию покровного эпителия, расширение межклеточных пространств в базальном слое эпителия, очаговую или диффузную лимфоплазмоцитарную инфильтрацию слизистой, эрозии, паракератоз в эпителиоцитах, склероз подслизистого слоя.
До настоящего времени нет однозначного мнения о связи инфекции HP с развитием проявлений ГЭРБ. Одни исследования свидетельствуют об отсутствии влияния HP-статуса больных на риск развития ГЭРБ [8]. Другие авторы сообщают о более легком течении ГЭРБ у НР-позитивных больных [6, 9]. Но в представленных, а так же других исследованиях, речь шла о больных только ГЭРБ.
Мы провели изучение инфицированности НР пациентов с сочетанием СД 2 и ГЭРБ. Отметим, что в биоптатах слизистой пищевода ни у одного пациента НР не был обнаружен. При исследовании желудочных биоптатов, НР определялся с различной частотой в группе 1 и 2 (таблица 5).
Таблица 5. Инфицированность НР больных СД 2 и ГЭРБ в зависимости от вида сахароснижающей терапии
| Показатель | 1-я группа, n=16 | 2-я группа, n=18 | ||
| Абс. | % | Абс. | % | |
| HP (-) | 4 | 25* | 7 | 38,9 |
| HP (+) | 12 | 75* | 11 | 61,1 |
* - достоверность различий в группах, р
Как видно из таблицы 5, в 1-й группе пациентов достоверно чаще выявляли НР инфекцию, чем у лиц из 2-й группы (75% и 61,1% соответственно, p<0,05).
В первую очередь мы убедились, что у больных СД 2, которые получали инсулин, ГЭРБ наблюдалась достоверно чаще, чем в группе с СД 2, леченных СТП. Для того, чтобы определить является ли инсулинотерапия фактором риска развития ГЭРБ при СД 2, был рассчитан показатель ОР события. Его значение составило 1,72 (ДИ 95%: 1,33–2,26, р=0,024), и это свидетельствует о достоверном влиянии назначения инсулина на формирование ГЭРБ при СД 2.
У больных СД 2, получавших инсулин, более тяжело протекала клиника ГЭРБ, с большей выраженностью пищеводных жалоб, чем в группе лиц с инсулиннезависимым СД 2. Оказалось, что отсутствие в назначениях больных СД 2 инсулина, достоверно способствует бессимптомному течению ГЭРБ (ОР = 2,03, ДИ 95%: 1,54–3,22, p = 0,031).
Назначение инсулина больным СД 2 способствовало и более тяжелым эндоскопическим проявлениям ГЭРБ. У данных пациентов преобладали эрозивно-язвенные поражения слизистой пищевода. Получение инсулина оказалось фактором риска эрозивного эзофагита (ОР = 1,86, ДИ 95%: 1,42–2,97, р= 0,019).
У пациентов с СД 2 и ГЭРБ отмечалось довольно высокая степень инфицированно-сти НР слизистой желудка. Данный показатель тоже имел зависимость от вида сахароснижающей терапии. Получавшие инсулин больные СД 2 и ГЭРБ, имели достоверно больший процент лиц НР(+), риск инфицированности НР у этих больных был высоким (ОР = 1,58, ДИ 95%: 1,22–2, 75, р = 0,044).
На вопрос о том, почему назначаемый больным СД инсулин так неблагоприятно влияет на течение ГЭРБ у этих пациентов, можно получить лишь далеко неполный ответ.
Причины такого действия инсулина, в определенной степени, объясняются результатами настоящего исследования. У больных СД 2 с ГЭРБ, получавших инсулин, рН-метрическое исследование пищевода обнаружило более выраженные изменения, которые заключались в большей частоте патологического ГЭР, что свидетельствует о моторных нарушениях нижнего пищеводного сфинктера, большего времени суточного закисления в просвете пищевода. В свою очередь, это связано с повышенной интрагастральной кислотностью у лиц, получающих инсулин, что также было выявлено посредством рН-метрии желудка. То, что инсулин способен через свои связи с эндогенными гормонами пищеварительного тракта (гастрином, гастроинтестинальным пептидом и др.) повышать кислотность желудка, показано в немногочисленных исследованиях [4]. Вероятно, есть и другие причины неблагоприятного влияния инсулина на течение ГЭРБ при СД. Они требуют дальнейшего выяснения.
В настоящее же время, основываясь на результатах данной работы, можно рекомендовать врачам учитывать особенности течения ГЭРБ у больных СД 2 в зависимости от вида сахароснижающей терапии.
Влияние секретина на синтез инсулина, на желудок и кровоток
Гастрин, секретин, холецистокинин-панкреозимин: синтез, функции
Отдельными экспериментальными работами показана возможность выделения гастрина нервными окончаниями, но подавляющим большинством исследователей гастрин отнесен к регуляторным пептидам с доминирующим эндокринным генезом. Внутриполостное выделение гастрина (в составе желудочного сока) доказано у человека со всей определенностью, по физиологическая значимость этого феномена мало изучена и по состоянию наших знаний на современном этапе несопоставима с известной по тысячам экспериментальных и клинических работ ролью поступающего в кровь, действующего гормональным путем гастрпна.
Рецепторы гастрина в фундальной слизистой оболочке желудка доказаны радиоизотопными исследованиями вполне достоверно. О такой возможности говорят результаты опытов на животных с введением гастрина и пентагастрина в гипоталамическую зону головного мозга.
Секретин впервые открыт более 80 лет назад, положил начало эндокринологии системы пищеварения, но связь биосинтеза его с определенными (S) инкреторными клетками кишечной слизистой оболочки была доказана надежными иммуноцитохимическими исследованиями лишь в 70-х годах. Фрагменты молекулы секретина биологически неактивны, усиливает панкреатическую секрецию бикарбонатов (наиболее демонстративный эффект секретина) только целая молекула гормона. Глюкоза, жиры и белки (в том числе — олигопептиды) инкрецию секретина не стимулируют.
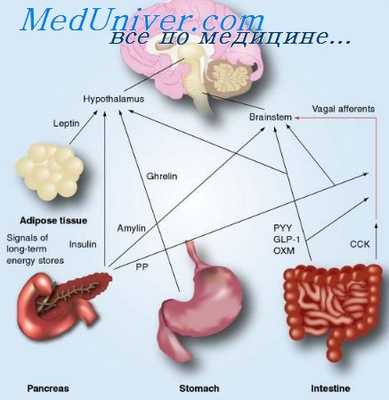
У человека концентрация секретина в дуоденальной слизистой оболочке намного больше, чем в еюнальной. Для секретина строго доказан только гормональный тип действия, наиболее специфичные рецепторы его в клетках мелких протоков экзокрннной ткани поджелудочной железы. Вопреки ранним представлениям, сейчас известно, что печень практически не играет роли в катаболизме секретина.
Холецистокинин-панкреозимин. Каждый гормон с двумя основными свойствами был назван холецистокинином-панкреозимином, его многогранный спектр физиологических эффектов и взаимосвязи с другими гастронитестинальными гормонами ныне изучены в деталях и позволяют считать холецистокинин-панкреозимин одним из ключевых (но справедливому определению П. К. Климова) гормональных пептидов, регулирующих функции системы пищеварения.
Он обнаружен в инкреторных I — клетках дуоденальной, еюнальной и, значительно в меньшей мере, идеальной слизистой оболочки, закономерно выявляется и в головном мозгу. Концентрации холецистокинина-панкреозимина (ХКП) в дуоденальной слизистой оболочке колеблются от 150 до 250 имоль/г ткани, в слизистой оболочке тощей кишки — 120—170 пмоль/г, подвздошной — не более 40 пмоль/г. Еще исходными работами по очистке ХКП был выделен гормон со структурой из 33 аминокислотных остатков.
Последующим воздействием трипсина на эту молекулу был получен СООН-терминальный октапептид ХКП, обладавший активным действием па мышцу желчного пузыря и панкреатичеческую секрецию ферментов. В последние годы препарат ХКП-8 находит все большее применение в физиологических и клинических исследованиях, чему способствовал его синтез. Во всяком случае па нынешнем этапе наших знаний основная роль придается образованному в эндокринных клетках проксимального отдела кишечника и поступающему в кровь ХКП.
В то же время перспективы анализа физиологической и клинической значимости локализованного в нервных тканях ХКП представляются очевидными (достаточно назвать вероятную роль его в регуляции аппетита.
СЕКРЕТИН
СЕКРЕТИН — один из пептидных гастроинтестинальных гормонов. Открыт Бейлиссом (W. М. Bayliss) и Э. Старлингом в 1902 г. Термин «гормон» был впервые применен именно по отношению к С.
С. синтезируется в основном в S-клетках слизистой оболочки двенадцатиперстной кишки (см.) и, в меньшей степени, в проксимальной части тощей кишки (см. Кишечник). В чистом виде гормон выделили в 1962 г. Мутт и Йорпес (V. Mutt, J. Е. Jorpes), а в 1966 г. Боданский (М. Bodanszky) с сотр. синтезировали его.
Молекула С. состоит из 27 аминокислотных остатков, расположенных в последовательности: Гис-Сер-Асп-Гли-Тре-Фен-Тре-Сер-Глу-Лей-Сер-Арг-Лей-Арг-Асп-Сер-Ала Арг-Лей-Гли-Арг-Лей-Лей-Гли-Глу-Лей-Вал-NH2. Мол. вес (масса) С. равен 3035.
Бейлисс и Э. Старлинг предположили, что С. образуется из депонированного в клетке предшественника — просекретина. Более детальное изучение путей синтеза С. позволило сделать заключение, что секретин в S-клетках сохраняется как сильное основание в электростатически связанном состоянии с ионизированными карбоксильными группами клеточных белков; при поступлении в двенадцатиперстную кишку соляной к-ты в составе эвакуируемого из желудка содержимого этот заряд снижается, С. высвобождается и транспортируется из клеток в кровоток. Высвобождение гормона начинается в двенадцатиперстной кишке при pH ок. 4,5 и находится в прямой зависимости от подкисляемой площади кишки концентрации ионов водорода. У человека повышение содержания С. в плазме крови отмечено при pH в пределах 2—3 в интрадуоденальной среде. Высвобождение С. при нервных влияниях и действии других хим. агентов не доказано.
С. резко увеличивает объем секреции и выделение бикарбонатов поджелудочной железой, стимулируя центроацинозные и другие клетки ее экзокринной части. Этот основной эффект действия секретина усиливается другими нейрогуморальными факторами, начинающими действовать после приема пищи. Кроме того, С. вызывает усиление секреции электролитов печенью (повышает секрецию и уменьшает реабсорбцию натрия и бикарбонатов) и двенадцатиперстной кишкой; усиливает холерез (см. Желчеобразование); потенцирует стимулирующее действие холецистокинин-панкреозимина (см. Холецистокинин) на моторику желчного, пузыря и ферментовыделительную деятельность поджелудочной железы, оказывая на нее трофическое влияние; тормозит секрецию соляной к-ты с одновременным усилением секреции пепсина железами желудка (см. Пепсин); повышает инкрецию инсулина (см.), тормозит инкрецию глюкагона (см.) и гастрина (см.); снижает перистальтическую активность желудка (см.), двенадцатиперстной кишки и тонус нижнего пищеводного сфинктера, а также скорость пролиферации кишечных эпителиоцитов; повышает кровоток в поджелудочной железе, инвертазную и мальтазную активность тонкой кишки; увеличивает сердечный выброс крови и кровоток в органах брюшной полости; усиливает ренальное выделение воды, натрия, калия и бикарбонатов; стимулирует липолиз (см. Пищеварение).
Полупериод существования С. в кровотоке составляет 2,5—3 мин. Точно место, где происходит разрушение гормона, не установлено, но к числу органов, в к-рых осуществляется этот процесс, относят почки и печень. Кроме того, гидролиз С. осуществляется ферментными системами крови и эндотелия кровеносных сосудов; небольшое количество гормона удаляется из кровотока с мочой и желчью.
Эффекты С. реализуются в процессе его взаимодействия с мембранными рецепторами клеток-мишеней путем стимуляции аденилатцик-лазы и изменения содержания циклического аденозинмонофосфата.
Высвобождение С. угнетается при уменьшении интрадуоденальной ацидификации (секреторная недостаточность желудка), синдроме Золлингера — Эллисона (см. Золлингера — Эллисона синдром), резекции двенадцатиперстной кишки, дуодените, язвенной болезни двенадцатиперстной кишки.
С. в сыворотке крови определяется радиоиммунологическим методом (см.). В норме его содержание в плазме крови может достигать 150 пг/мл.
Очищенные биологические и синтетические препараты С. применяют с диагностической целью для стимуляции панкреатической секреции при исследовании поджелудочной железы. С лечебной целью препараты С. используют в качестве ингибитора секреции соляной к-ты железами желудка при язвенной болезни двенадцатиперстной кишки.
Библиография: Желудочно-кишечные гормоны и патология пищеварительной системы, под ред. М. Гроссмана и др., пер. с англ., с. 138 и др., М., 1981; Уголев А. М. Энтериновая (кишечная гормональная) система, JI., 1978, библиогр.; Физиология эндокринной системы, под ред. В. Г. Баранова, с. 414, JI., 1979, библиогр.; В 1 о-o'm S. R. а. Р о 1 a k J. М. The new peptide hormones of the gut and their clinical significance, Acta gastroenterol. belg., v. 41, p. 371, 1978; Dock- r a у G. J. Molecular evolution of gut hormones, application of comparative studies on the regulation of digestion, Gastroenterology, v. 72, p. 344, 1977, bibliogr.; Gardner J. D. Receptors for gastrointestinal hormones, ibid., v. 76, p. 202, 1979, bibliogr.; Heitz P. U. The neuroendocrine system of the gastrointestinal tract, Path. Res. Pract., v. 165, p. 333, 1979, bibliogr.
Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов
Для цитирования: Аметов А.С. Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов. РМЖ. 2006;26:1867.
Сахарный диабет 2 типа является гетерогенным заболеванием, развивающимся в результате комбинации врожденных и приобретенных факторов. Согласно мнению профессора Ральфа Де Фронзо, патофизиология сахарного диабета 2 типа представляет собой кульминацию двух одновременно протекающих процессов: с одной стороны – инсулинорезистентность, с другой – недостаточность функции b–клеток для того, чтобы преодолеть инсулинорезистентность путем повышения уровня инсулина. В этой связи изучение функции b–клеток в норме и при патологии находятся под пристальным вниманием исследователей.
В норме b–клетки быстро адаптируются к снижению чувствительности к инсулину на уровне печени или периферических тканей, повышая секрецию инсулина и предотвращая развитие гипергликемии натощак. При сахарном диабете 2 типа гипергликемия натощак развивается в случаях недостаточной функции b–клеток в плане производства и секреции инсулина, необходимого для преодоления инсулинорезистентности. Вне всякого сомнения, эти факторы тесно связаны друг с другом, хотя кажется абсолютно ясным, что без нарушенной секреции инсулина не может развиваться гипергликемия и таким образом именно b–клетки и их функция являются «сердцем» данной проблемы.
Более 25 лет тому назад было убедительно показано, что у пациентов с нарушенной толерантностью к глюкозе или с сахарным диабетом 2 типа имеют место нарушения кинетики выделения инсулина и снижение инсулинового ответа на пищевую нагрузку.
Рассматривая вопросы секреции инсулина в норме и при сахарном диабете 2 типа, необходимо отметить, что у здоровых лиц существует постоянная базальная секреция инсулина, которая имеет место даже тогда, когда отсутствуют любые экзогенные стимулы для выделения инсулина. И даже в тех случаях, когда уровень глюкозы плазмы после ночного голодания низкий (4,4–5,5 ммоль/л), все равно в организме человека поддерживается постоянная базальная секреция инсулина.
Известно, что в постпрандиальном периоде глюкоза попадает в циркуляцию крови непосредственно из абсорбированных с пищей углеводов, а затем распределяется – в основном в скелетные мышцы через многократное увеличение инсулинопосредованного захвата глюкозы (ИОЗГ). А в связи с тем, что пациенты с сахарным диабетом 2 типа имеют ограниченные возможности к быстрому увеличению ИОЗГ, постпрандиальная гликемия у них будет значительно повышенной.
Необходимо особо подчеркнуть, что постпрандиальная гипергликемия может развиваться и существовать в течение нескольких лет до развития и появления гипергликемии натощак и до клинической манифестации сахарного диабета.
Организация запасов глюкозы в первую очередь именно мышечной тканью частично объясняется тем, что эта ткань способна абсорбировать глюкозу достаточно быстро и в больших количествах, препятствуя развитию постпрандиальной гипергликемии в физиологических условиях. Причем колебания постпрандиального уровня глюкозы являются важной составляющей общей суточной гипергликемии.
В настоящее время убедительно показано, что b–клетки несут серьезную ответственность за поддержание в организме человека уровней глюкозы в достаточно узком диапазоне. По мнению P.D. Home (2000), уровень глюкозы в норме у лиц молодого и среднего возраста абсолютно стабилен в течение ночи и составляет непосредственно перед завтраком 4,3 ммоль/л. После завтрака концентрация глюкозы повышается, достигая 7,0 ммоль/л в течение 30 минут, затем снижается, достигая показателя 5,5 ммоль/л в течение почти такого же времени.
Необходимо отметить, что у больных сахарным диабетом 2 типа повышение секреции инсулина в ответ на прием пищи замедлено и ослаблено. У некоторых пациентов инсулиновый ответ на прием пищи вообще отсутствует.
Особое место в исследованиях занимает информация, касающаяся двухфазности секреции инсулина в норме и патологии.
В настоящее время известно, что выделение инсулина происходит двухфазным образом, характеризующимся наличием острых пиков, продолжающихся в среднем в течение 10 минут (первая фаза), с последующим постепенным повышением выделения инсулина (вторая фаза).
Существует точка зрения, что эти две фазы фактически представляют два различных внутриостровковых пула инсулина. Первый пул, или пул немедленного реагирования, представляет собой в количественном отношении около 5–10% внутриостровкового содержания инсулина. Речь идет о гранулах инсулина, находящихся максимально близко к мембране b–клетки, и считается, что именно этот быстровыделяемый пул обеспечивает первую, раннюю фазу в секреции инсулина.
Второй пул, или готовый к использованию пул инсулина, или резервный пул, для выделения которого необходима аденозинтрифосфат–зависимая мобилизация инсулинсодержащих гранул, перемещающихся постепенно в первый пул, с последующим экзоцитозом, фактически представляет 90–95% запасов инсулина, содержащихся в b–клетках в данную единицу времени.
Несомненно, что обе фазы в секреции инсулина являются важными в поддержании нормального гомеостаза глюкозы. Однако в настоящее время значительно большее внимание уделяется именно первой фазе инсулиновой секреции. Предполагается, что это и есть главная детерминанта в «раннем» выделении инсулина в течение первых 30 минут после приема пищи или глюкозы.
Интересно отметить, что инсулиновый секреторный ответ панкреатических b–клеток на стимуляцию глюкозой заключается в развитии первой фазы, которая появляется сразу же после внутривенного введения глюкозы. Далее следует снижение секреции инсулина до самых низких значений и затем развитие пролонгированной второй фазы ответа. Первая фаза секреции инсулина развивается за счет активации КАТФ–зависимых (триггерных) каналов, которые повышают концентрацию кальция и, как предполагается, высвобождают гранулы из «готового к высвобождению» пула. Из этого следует, что вторая фаза влечет за собой приготовление гранул для опорожнения, возможно, включающее транслокацию и способность к наполнению перед экзоцитозом. Механизмы, ответственные за развитие второй фазы инсулиновой секреции, включают путь КАТФ–зависимых каналов по причине необходимости увеличения концентрации кальция и дополнительные сигналы независимо от КАТФ–зависимых каналов. Механизмы, лежащие в основе таких дополнительных сигналов, пока остаются неизвестными. Современные гипотезы предполагают повышение цитозольного длинноцепочечного ацетил–КоА, малат–пируватный цикл, «экспорт» глутамата из митохондрий, а также увеличение соотношения АТФ/АДФ.
У человека каждая b–клетка содержит около 10000 гранул инсулина, из которых только 100 представляют собой «готовый к высвобождению» пул.
Очевидно, что стимуляция высвобождения при помощи даже одного стимулятора секреции, такого как глюкоза, происходит согласно строго координированному взаимодействию многих факторов по отношению к передвижению гранул: прикрепление к плазматической мембране, приготовление к высвобождению (наполнение) и экзоцитоз. Общее количество инсулинсодержащих гранул в b–клетках значительно превышает количество, требуемое для контроля гликемии, связанной с однократным приемом пищи. Характерно, что лишь очень малый процент гранул и, соответственно, общего содержания инсулина в гранулах, секретируется в ответ на стимуляцию глюкозой [Proks P. еt al., 1996].
Хорошо известно, что существуют и неглюкозные стимулы секреции инсулина, такие как аминокислоты, свободные жирные кислоты и гормоны. Важную роль в стимуляции секреции инсулина играет и невральная регуляция.
Следует отметить также, что многие гормоны влияют на b–клетки, либо стимулируя, либо подавляя, либо модулируя инсулиновый ответ на глюкозу.
В последние годы большой научно–практический интерес вызывает изучение роли гормонов желудочно–кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека.
В этой связи следует подчеркнуть, что в литературе имеются данные, свидетельствующие о важной роли таких гормонов желудочно–кишечного тракта, как глюкагоноподобный пептид 1 (ГПП–1) и глюкозо–зависимый–инсулинотропный полипептид или желудочный ингибирующий пептид (ГИП). Эти гормоны получили название инкретины, а их действие, приводящее к усилению глюкозозависимой секреции инсулина b–клетками поджелудочной железы, было названо «инкретиновый эффект». Кстати, «инкретиновый эффект» был впервые описан в 1960 году, и приписывается пептидным гормонам, которые секретируются К– и L–клетками кишечника в ответ на прием пищи.
Наиболее популярным и наиболее изученным в настоящее время является ГПП–1.
ГПП–1 является посттрансляционным продуктом гена проглюкагона, членом суперсемейства глюкагона, в которое входят такие пептидные гормоны, как глюкагон, глюкагоноподобный пептид 1, глюкагоноподобный пептид 2, желудочный ингибирующий пептид и экзендин–4. В нашей статье основное внимание будет уделено именно ГПП–1.
ГПП–1 продуцируется энтеро–эндокринными L–клетками тонкого кишечника, и регуляция его секреции из эндокринных клеток ЖКТ осуществляется с помощью нескольких внутриклеточных сигналов, включая протеин киназу А, протеин киназу С и кальций. Многочисленные экспериментальные работы продемонстрировали, что секреция ГПП–1 контролируется нутриентами, а также невральными и эндокринными факторами. Следует отметить, что плазменные базальные уровни ГПП–1 у человека находятся в пределах от 5 до 10 пМ, и повышаются после приема пищи до 50 пМоль.
В исследованиях Kieffer T.Y. (1999), Drucker D.J. (1998), Massimo S.P. (1998) было показано, что ГПП–1 секретируется в ответ на прием смешанной пищи и таких отдельных нутриентов, как глюкоза, жирные кислоты и пищевые волокна. Так, пероральный прием глюкозы у человека приводил к двухфазному увеличению ГПП–1 в плазме, тогда как внутривенные инфузии глюкозы имели минимальный эффект [Hermann C., 1995]. В связи с тем, что большинство L–клеток, продуцирующих ГПП–1, расположены в дистальных отделах тонкого кишечника, быстрое повышение уровня ГПП–1 в плазме, наблюдаемое после приема пищи, может быть обусловлено непрямыми стимулирующими эффектами. В связи с чем Roberge J.N. (1993) было сделано предположение о наличии проксимально–дистальной петли, которая передает нутриент–стимулирующие сигналы из проксимальных отделов кишечника через невральные и эндокринные эффекты к дистальным L–клеткам.
При анализе экспериментальных работ было высказано предположение, что кандидатом на роль такого трансмиттера могут претендовать ГИП и ацетилхолин. Однако у человека ГИП не стимулирует секрецию ГПП–1, что было убедительного показано в исследованиях Nauck M.A. (1993). В литературе также обсуждается роль гастрин–продуцирующего пептида [Hermann–Rinke C., 2000] и n. vagus, который играет важную роль, обеспечивая быстрое высвобождение ГПП–1 из дистальных L–клеток в ответ на прием нутриентов [Rocca A.S., 1999].
Таким образом, двухфазная секреция ГПП–1, может происходить за счет интеграции гормональных и невральных факторов, которые стимулируют раннее выделение ГПП–1 (10–15 минут), а прямой нутриентный контакт с L–клетками стимулирует вторую фазу (30–60 минут) секреции ГПП–1 [Kieffer T.Y., 1999].
Хотя этот вопрос и менее изучен, необходимо также отметить, что подавляют секрецию ГПП–1 инсулин и соматостатин–28 [Hansen L., 2000], а также нейропептид галанин [Hermann–Rinke C., 2000].
Период полужизни циркулирующего, биологически активного ГПП–1 меньше, чем 2 минуты. Такой короткий период полужизни ГПП–1 в плазме обусловлен протеазной активностью фермента дипептидил пептидаза IV (ДПП–IV). ДПП–IV широко экспрессируется во многих тканях и органах, включая поджелудочную железу, ЦНС, сосудистую сеть эндотелия тонкого кишечника, находящегося в непосредственной близости к месту секреции ГПП–1.
Необходимо отметить, что первичный путь клиренса ГПП–1 осуществляется через почки с помощью механизмов, включающих гломерулярную фильтрацию и канальциевый метаболизм [Dearcor C.F., 1996]. В этой связи интерес представляют данные, что у пациентов после двусторонней нефрэктомии или у пациентов с уремией уровень иммунореактивного ГПП–1 в плазме был повышенным.
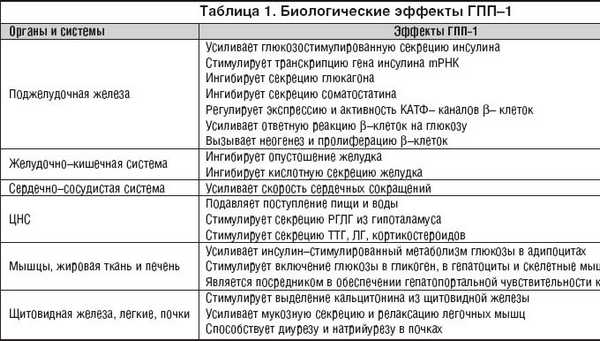
Множественные биологические эффекты ГПП–1 проявляются на самых различных уровнях (табл. 1).
Было установлено, что действие ГПП–1 не ограничивается только усилением экзоцитоза секреторных гранул, содержащих инсулин из b–клеток, а как следует из данных, представленных в таблице 1, ГПП–1 влияет также и на a–клетки поджелудочной железы, подавляя секрецию глюкагона, что, в свою очередь, ограничивает постпрандиальное повышение глюкозы.
ГПП–1 усиливает регенерацию островковых клеток путем воздействия на факторы транскрипции, такие как PDX–1. Этот ростовый эффект ГПП–1 может играть роль в адаптации островков к возрастающим требованиям к b–клеткам, например, в условиях инсулинорезистентности, на фоне ожирения. ГПП–1 имеет внепанкреатический эффект, включая инсулиннезависимое распределение глюкозы и улучшение чувствительности к инсулину [M.A. Nauck et al., 1997].
Определенный интерес представляют данные о том, что эффект действия ГПП–1 проявляется путем мощного усиления, подобно взрыву (вспышке) секреции инсулина. Однако введение ГПП–1 не влияет на частоту и амплитуду пульсовой секреции инсулина [Porksen W., 1998].
Кроме того, имеются доказательства того, что ГПП–1 действует как вещество, повышающее чувствительность b–клеток к глюкозе. Так, ГПП–1 может способствовать образованию АТФ в митохондриях. Во всяком случае, важное клиническое значение имеет тот факт, что препараты сульфонилмочевины, которые связываются с АТФ–чувствительными калиевыми каналами и закрывают их, вызывая тем самым деполяризацию мембраны и поступление ионов кальция внутрь клетки, могут выключать зависимость ГПП–1 от глюкозы. Так, введение ГПП–1 в изолированную поджелудочную железу крыс, находящуюся в перфузионном растворе с низкой концентрацией глюкозы, которая обычно не влияет на секрецию инсулина, приводило к значительной стимуляции секреции инсулина в случаях, когда в железу предварительно вводились препараты сульфонилмочевины. Показано, что цАМФ, образующийся в результате активации рецепторов ГПП–1, также может непосредственно влиять на процесс экзоцитоза, и, по оценкам исследователей, этот процесс составляет до 70% от всего секреторного инсулинового ответа. Клинически важным следствием зависимости эффектов ГПП–1 от концентрации глюкозы в крови, соответствующие нормальной или выше нормы гликемии натощак, конечно, является то, что ГПП–1 не может вызвать развитие выраженной гипогликемии (кроме, возможно, случаев одновременного применения с препаратами сульфонилмочевины).
Недавно было показано, что ГПП–1 способен ингибировать апоптоз b–клеток. В связи с тем, что нормальное количество b–клеток поддерживается равновесием процессов апоптоза и пролиферации, эти данные представляют огромный интерес и открывают возможность того, что ГПП–1 может оказаться эффективным при патологических состояниях, связанных с усиленным апоптозом b–клеток. Все это позволяет предположить, что ГПП–1 может быть способным стимулировать образование новых b–клеток (неогенез) у пациентов с сахарным диабетом 2 типа и недостаточным количеством функционирующих клеток (хотя еще не выяснено, насколько этот процесс выражен у человека).
Особый интерес представляют данные, касающиеся изучения секреции ГИП и ГПП–1 при сахарном диабете 2 типа.
Так, в исследовании Toft–Nielsen обнаружили, что уровни ГИП натощак у больных сахарным диабетом 2 типа близки к нормальным значениям. В то же время эти авторы, изучая секрецию ГПП–1 у больных сахарным диабетом 2 типа, выявили существенные нарушения этого этерогормона при данном заболевании.
При сравнении секреции инсулина в ответ на оральную и внутривенную нагрузку глюкозой при условии одинаковой концентрации глюкозы оказалось, что превышение секреции инсулина на пероральное введение у здоровых лиц достоверно выше, чем при сахарном диабете 2 типа [Nauck, 1986].
Говоря о нарушении инкретинового эффекта при сахарном диабете 2 типа, важно подчеркнуть, что при этом заболевании секреция ГПП–1 снижена на 20–30% при сохранении в целом его инсулиностимулирующего действия. В то же время следует подчеркнуть, что секреция ГИП при сахарном диабете не меняется, однако установлено снижение его стимулирующего влияния на b–клетки поджелудочной железы.
Причины этих нарушений окончательно не установлены, хотя большинство исследователей приходят к заключению, что нарушение секреции ГПП–1, очевидно, является следствием сахарного диабета 2 типа.
В заключение следует сказать, что в последнее десятилетие благодаря фундаментальным и клиническим исследованиям развилось новое и перспективное направление в лечении сахарного диабета 2 типа, основанное на использовании инкретинового эффекта. Так, изучены свойства и лечебный потенциал ГПП–1, и сегодня нет сомнений в его терапевтической эффективности. Принципиально важным моментом в этом плане являются глюкозозависимая стимуляция секреции инсулина и ингибирование секреции глюкагона. В то же время возможное торможение апоптоза b–клеток поджелудочной железы и усиление их регенерации дают определенную надежду на то, что при сахарном диабете 2 типа удастся остановить прогрессирующее снижение массы функционирующих b–клеток при развитии дефицита секреции инсулина.
Результатом многолетних клинических исследований, проводимых совместно компаниями «Эли Лилли» и «Амилин Фармасьютикалс», явилась разработка препарата Эксенатид, являющегося экзогенным функциональным аналогом ГПП-1 и первым представителем лекарственного класса инкретиновых миметиков. Эксенатид показан при сахарном диабете типа 2 в качестве дополнительной терапии к метформину, производным сульфонилмочевины или комбинации метформина и производных сульфонилмочевины для улучшения гликемического контроля. Неоспоримым преимуществом Эксенатида, делающим возможным его клиническое применение (в отличие от ГПП-1), явился длительный период полувыведения, составляющий 2,4 часа (1-2 минуты для ГПП-1). Аминокислотная последовательность Эксенатида частично соответствует последовательности человеческого ГПП-1, в результате чего он связывается и активирует рецепторы ГПП-1 у человека, приводя к усилению глюкозозависимого синтеза и секреции инсулина из b-клеток поджелудочной железы с участием циклического АМФ и/или других внутриклеточных сигнальных путей. При этом Эксенатид стимулирует высвобождение инсулина из b-клеток в присутствии повышенных концентраций глюкозы, минимально влияя на выброс инсулина при нормогликемии, что ведет к низкому риску гипогликемий. Нормализация углеводного обмена при назначении экзенатида достигается не только за счет глюкозозависимой стимуляции синтеза инсулина, но и за счет реализации таких важных эффектов, как подавление неадекватно повышенного уровня глюкагона, снижение аппетита, торможение эвакуации желудочного содержимого и увеличение массы b-клеток, обусловленное стимуляцией пролиферации и неогенеза, с одной стороны, и торможением апоптоза – с другой. Все вышеперечисленное вселяет уверенность, что инкретин миметики найдут свое достойное место в ряду препаратов, применяемых для лечения сахарного диабета.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Эффекты гастрина, пентагастрина и их влияние на органы пищеварения
В одной из серий специальных электронномикроскопических исследований биоптатов фундальной слизистой оболочки у 15 здоровых добровольцев выявлено увеличение каналикулярных мембранных поверхностей обкладочных клеток уже с 5-й мин с начала внутривенной инфузии пентагастрина. Параллельно увеличению протяженности и ширины просвета внутриклеточных канальцев уменьшалось количество тубовезикул в клетках. Ряд исследователей считают цАМФ конечным клеточным медиатором стимулирующего действия гастрина и пентагастрина на обкладочные клетки, в других клинических наблюдениях опосредующая роль цАМФ в аффекте гастрина и его синтетического аналога оспаривается.
Радиоизотопными исследованиями доказано связывание гастрина и пентагастрина специфическими рецепторами клеток фундальной слизистой оболочки. Интересно отметить, что ни кровоток, ни скорость обновления эпителия по критерию включения меченного тритием тимидина в антральной слизистой оболочке, в отличие от фундальной, под влиянием гастрина или пентагастрина не изменялись. Иными словами, изменения кровоснабжения и трофики относились к месту приложения эффекта, но не к зоне биосинтеза гастрина. Показано усиление поступления простагландина E1 в желудочный сок как у животных, так и у человека после введения гастрпна или пентагастрина.
Этот факт полезен с позиций известных цитопротекторных свойств простагландинов по отношению к гастродуоденальной слизистой оболочке и дополняет сведения о трофическом действии гастрина на эту оболочку.
Многими экспериментальными работами на животных было показано трофическое влияние гастрпна не только на гастродуодеональную слизистую оболочку, но и на экзокринную ткань поджелудочной железы. Удаление антральной слизистой оболочки снижало у собак с панкреатической фистулой секрецию панкреатического ферментного белка на 40% и более. При введении собакам гастрпна параллельно радионммунологически определяемому увеличению гастринемии повышались концентрации и дебит панкреатических бикарбонатов и ферментов. На модели изолированной перфузируемой поджелудочной железы добавление гастрпна или иентагастрина к перфузату значительно (втрое и более) усиливало выделение железой ферментного белка.
Valenzuela et al. в 1970 г. впервые показали в наблюдениях у человека закономерность панкреотропного стимулирующего действия гастрина. В этих исследованиях трем здоровым людям и трем больным язвенной болезнью двенадцатиперстной кишки вводили внутривенно синтетический гастрпн, собирая синхронно дуоденальное и желудочное содержимое. Было отмечено значительное повышение гастрином секреции панкреатических ферментов и бикарбонатов. Опубликованные спустя 2 года, в 1978 г, наши исследования были первыми в мировой литературе, в которых панкреотропный стимулирующий эффект был доказан применительно к пентагастрину.
Особенностью наших исследовании было изучение не только действия самого пептагаетрина на панкреатическое ферментовыделение и бикарбонатовыделение, по и влияние его па панкреотропный эффект эндогенного и вводимого извне панкреозимина, а также на панкреотропный эффект секретина. В тот период отечественный пентагастрин для клинических наблюдений еще не выпускался, и наши исследования были проведены с пентагастрином ICl (Англия), известным под фирменным названием пептавлона. Через 4 года, наши данные с пептавлоном были подтверждены Owyang et al., а еще за год до того, были опубликованы материалы наших исследований с отечественным пентагастрнном, полученным Институтом органического синтеза АН и ныне серийно выпускаемым с санкции Фармакологического комитета МЗ (мы использовали опытные партии пентагастрпна, выпущенные тем же каунасским заводом «Санитас», который сейчас выпускает промышленные партии препарата).
Сведения об умеренном панкреотропном стимулирующем действии пентагастрпна содержатся и в публикации М. М. Богера 1983 г. [10J, основанной на использовании пептагастрина, синтезированного в Ленинградском университете и в силу технических причин не получившего выход в сколько-нибудь широкую клинико-диагностическую практику. В том же 1983 г. опубликована еще одна серия наших исследований с пентагастрином.
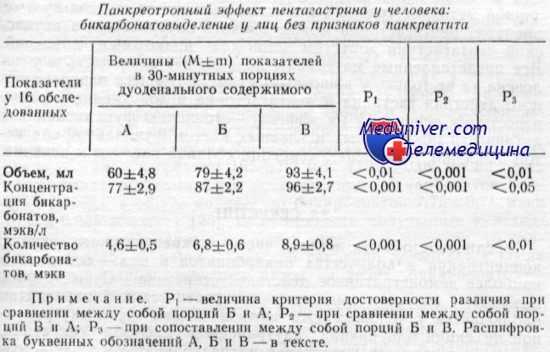
При изучении влияния пентагастрина (использовали пептавлон) па стимулируемую секретином панкреатическую секрецию бикарбонатов секретин вводили внутривенной инфузией со скоростью 1,2 ед/кг/ч в нервом исследовании, а спустя 3—4 дня во втором исследовании у каждого человека проводили инфузию секретина с прежней скоростью, но дополнительно внутривенно вводили и пептавлон со скоростью 2 мкг/кг/ч. При этом в период второго исследования первые 30 мин отсасывали желудочное содержимое из желудочного капала двойного гастродуоденального зонда, а вторые 30 мин аспирации желудочного сока не производили, допуская свободное поступление соляной кислоты в двенадцатиперстную кишку и под влиянием кислоты освобождение там эндогенного секретина.
Обозначенные в таблице буквами порции дуоденального содержимого расшифровываются так: А — в исследовании с секретином без пентагастрина (пептавлона); Б — первая 30-мннутная порция в исследовании с сочетанным введением секретина и пентагастрина (пептавлона), когда желудочный сок аспирировался и не поступал в двенадцатиперстную кишку; В — вторая 30-минутная порция дуоденального содержимого в исследовании с сочетанным введением секретина и пептавлона, когда аспирации желудочного сока не проводили. Дополнительное введение пентагастрина (пептавлона) закономерно усиливало стимулирующее действие секретина по отношению к панкреатическому би карбонатовыделению. При этом важно, что и в случае аспирации желудочного сока эффект пентагастрина проявился статистически достоверно. Иными словами, нельзя свести механизмы панкреотропного действия пентагастрина лишь к усилению им секреции соляной кислоты, повышенному поступлению ее интрадуоденально и освобождению эндогенного секретина, который и потенцирует эффект вводимого извне секретина.
Надо полагать по материалам наших исследований, что и прямой панкреотропный эффект пентагастрина реален у человека (наряду с изложенным механизмом опосредования усиления секреции соляной кислоты, который из материалов таблицы тоже очевиден при сравнении порций Б и В).
Мы провели серию исследований влияния пептагастрина на бикарбонатовыделепие по указанной методике только с помощью пептавлона, поскольку этот препарат пептагастрина можно вводить внутривенно, а каунасский пентагастрин допустим лишь для подкожных инъекций. Все представленные материалы доказывают реальность и у человека (а не только у животных) стимулирующего панкреотропного действия гастрина и пептагастрина в дополнение к давно известному основному их эффекту — усилению функциональной активности обкладочных и главных клеток фундальной слизистой оболочки, повышению секреции соляной кислоты и пепсина.
Читайте также:
- Классификация изменений селезенки. Диффузные изменения селезенки.
- Культуральные свойства лептоспир. Патогенез лептоспирозов. Клиника лептоспирозов.
- Сублетальное влияние химиотерапии на плод и мать
- Поражение протезного ложа при увеличении межальвеолярной высоты
- Лекарства для лечения грибковых инфекций
