Внутриутробная герпес инфекция. Голопрозенцефалия
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Не секрет, что беременность является серьезным испытанием для женского организма. Часто во время беременности у женщины обостряются хронические заболевания, снижается иммунитет и поэтому будущая мама становится особенно уязвимой для всякого рода инфекционных заболеваний. Среди инфекций есть относительно безобидные для матери и плода (например, ОРЗ) и очень опасные (вплоть до ВИЧ).
Но есть группа инфекций, особенность которых заключается в том, что, будучи относительно безобидными для взрослых, и даже для детей, они становятся чрезвычайно опасными для беременных.
По первым буквам латинских названий входящих в нее инфекций эту группу принято называть TORCH-инфекциями или инфекциями TORCH-комплекса.
Расшифровывается аббревиатура TORCH следующим образом:
- Т — токсоплазмоз (toxoplasmosis)
- О — другие инфекции (others)
- R — краснуха (rubella)
- С — цитомегаловирусн ая инфекция (cytomegalovirus )
- H — герпес (herpes simplex virus)
Загадочная буква О — others (другие) — подразумевает такие влияющие на плод инфекции, как гепатит В и гепатит С, сифилис, хламидиоз, гонококковая инфекция, листериоз. Недавно в этот перечень включили ВИЧ-инфекцию, ветряную оспу, энтеровирусную инфекцию.
Однако, как правило, в группу ТОРЧ-инфекций включают только четыре перечисленных заболевания: токсоплазмоз, краснуха, цитомегаловирус и герпес. При этом варианте буква О аббревиатуры расшифровывается как вторая буква слова toxoplasmosis.
Особенность ТОРЧ-инфекций в том, что при первичном заражении ими во время беременности они могут оказывать пагубное действие на все системы и органы плода, особенно на его центральную нервную систему, повышая риск выкидыша, мертворождения и врожденных уродств ребенка, формирования пороков его развития, вплоть до инвалидности.
Часто поражение беременной женщины инфекциями торч-комплекса является прямым показанием к прерыванию беременности.
Кровь на наличие антител к TORCH-инфекция м правильнее всего сдавать еще до наступления беременности, при ее планировании.
Повторим, что наиболее опасным для плода является первичное заражение торч-инфекциями на фоне беременности, особенно на ранних ее сроках, поэтому если при обследовании на torch-инфекци и до беременности в крови женщины обнаруживаются антитела к этим инфекциями, то женщина может спокойно беременеть — ее ребенку с этой стороны ничто не угрожает. Если же перед беременностью антител к инфекциям ТОРЧ-комплекса не обнаруживается, значит, беременной женщине необходимо будет принимать дополнительные меры для того, чтобы обезопасить то них себя и своего будущего малыша.
Подробнее о каждой изTORCH-инфекций и их влиянии на организм беременной женщины и плода.
Токсоплазмоз - это очень широко распространенное заболевание, которым заражено почти 30% людей в мире. Его возбудитель - микроорганизм, который называется токсоплазма. Первичным хозяином токсоплазмы, в организме которого этот паразит размножается, является домашняя кошка, которая чаще всего и становится источником инфицирования человека. Заражение токсоплазмой может произойти через грязные руки (так обычно заражаются дети в детских садах), через сырое или недоваренное (недожаренное) мясо. Для человека со здоровым иммунитетом токсоплазмоз не представляет опасности — переболеть им можно, даже не заметив этого. Кроме того, к токсоплазмозу организм человека вырабатывает устойчивый иммунитет, так что это «одноразовая» болезнь.
Единственная ситуация, при которой токсоплазмоз представляет собой серьезнейшую опасность — это первичное заражение токсоплазмозом во время беременности.
Важно также то, что опасность представляет только токсоплазмоз, которым женщина заразилась во время текущей беременности. Это значит, что если женщина уже переболела токсоплазмозом до беременности (не менее чем за полгода до нее) ее будущему ребенку токсоплазмоз не угрожает. Более того, в трагической ситуации, когда из-за токсоплазмоза во время беременности женщина теряет ребенка, через полгода она может беременеть, уже не опасаясь токсоплазмоза.
Если же во время беременности заражение токсоплазмозом все же произошло, то многое зависит то того, на каком сроке беременности токсоплазмы попали в организм беременной женщины. Чем более ранним был срок беременности — тем больше риск тяжелых последствий при заражении плода токсоплазмозом, но, в то же время, тем меньше вероятность того, что это заражение произойдет.
И, наоборот, на более поздних сроках беременности процент передачи токсоплазмоза плоду очень высок (около 70%), но риск тяжелых поражений плода снижается.
Краснуха — инфекционное вирусное заболевание, передающееся здоровому человеку от больного чаще всего воздушно-капельн ым путем. Краснуха относится к вполне безобидным «детским» инфекциям, ни к каким тяжелым последствиям она, как правило, не приводит. Проявляется краснуха мелкой розовой сыпью по всему телу, повышением температуры примерно до 38°С. Общее состояние больного при этом удовлетворительн ое.
Коварство краснухи в том, что заражение часто происходит во время инкубационного периода, когда болезнь еще никак себя не проявляет и человек не знает о том, что он болен. Однако после перенесенного заболевания краснухой организм человека вырабатывает устойчивый иммунитет, поэтому вторичного заражения краснухой не происходит.
При заражении краснухой беременной женщины эта безобидная инфекция становится смертельно опасной для плода. В начальной стадии беременности вирус краснухи чаще всего поражает нервную ткань плода, ткани глаза, сердце. В первом триместре краснуха беременной является показанием к прерыванию беременности. Если же заражение краснухой произошло во втором или третьем триместре беременности, то таких непоправимых последствий для плода, как правило, не возникает, но, тем не менее, возможно его отставание в росте и другие нарушения. В таких случаях проводится общеукрепляющая терапия, профилактика недостаточности плаценты.
Наконец, при заражении краснухой на последнем месяце беременности ребенок может родиться с проявлениями краснухи, после чего она протекает у него так же, как у детей, заразившихся после рождения, и тяжелых последствий обычно не вызывает.
Цитомегаловирусн ая инфекция — это обнаруженное только в ХХ веке вирусное инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ).
Цитомегаловирус может передаваться половым путем, через кровь, при грудном вскармливании. Влияние ЦМВ на человека зависит, прежде всего, от состояния иммунной системы: при здоровом иммунитете ЦМВ практически не представляет опасности, если же иммунитет снижен, то цитомегаловирус активизируется и может поражать практически все системы и органы зараженного человека. Большинство инфицированных ЦМВ людей переносят инфекцию, даже не замечая ее. Антитела к ЦМВ устойчивы и сохраняются на всю жизнь, повторных заболеваний почти никогда не возникает.
Однако так же, как в случае с остальными торч-инфекциями, если первичное заражение цитомегаловирусо м происходит при беременности, последствия могут быть катастрофическим и. Проблема усугубляется тем, что риск внутриутробной передачи ЦМВ довольно велик — цитомегаловирусн ая инфекция занимает одно из первых мест по внутриутробно му инфицированию плода. Причем инфицирование плода может произойти разными путями, и не, только от больной матери, но и от отца во время зачатия, так как в мужской сперме тоже содержится ЦМВ.
Однако чаще всего ЦМВ попадает в организм плода либо через плаценту, либо через плодные оболочки, то есть из организма матери. Заражение ребенка может произойти и во время родов, при прохождении через инфицированные родовые пути матери, и при кормлении грудью, но этот вариант гораздо менее опасен и к тяжелым последствиям для ребенка, как правило, не ведет.
При внутриутробном заражении цитомегаловирусн ая инфекция может привести к внутриутробной гибели плода или рождению ребенка с врожденной цитомегаловирусн ой инфекцией.
Врожденная цитомегаловирусн ая инфекция может проявиться сразу после рождения ребенка такими пороками развития как недоразвитый головной мозг, водянка головного мозга, гепатит, желтуха, увеличение печени и селезенки, пневмония, пороки сердца, врожденные уродства.
Родившийся ребенок может страдать задержкой психического развития, глухотой, эпилепсией, церебральным параличом, мышечной слабостью.
Иногда врожденная цитомегаловирусн ая инфекция проявляется только на 2—5-м году жизни инфицированного ребенка слепотой, глухотой, речевым торможением, отставанием в умственном развитии, психомоторными нарушениями.
Все это приводит к тому, что первичная цитомегаловирусн ая инфекция у беременной на ранних сроках беременности является показанием к искусственному прерыванию беременности.
Если же женщина была заражена цитомегаловирусн ой инфекцией ранее, а во время беременности произошло ее обострение, то таких страшных последствий не возникает: женщине назначается лечение антивирусными препаратами и иммуномодулято рами.
Следовательно, как и в случаях всех torch-инфекций, анализ на антитела к цитомегаловиру су необходимо сдать до наступления беременности. Если антитела не будут обнаружены, то женщине будет рекомендовано проводить ежемесячное исследование крови, которое не позволит упустить первичное заражение, наиболее опасное для плода.
Если же антитела к ЦМВ обнаружатся и выяснится, что беременная женщина является пассивным носителем цитомегаловируса , то ей рекомендую т приложить дополнительные усилия к поддержанию нормального иммунитета. Напомним также, что ЦМВ может «подарить» ребенку не только мать, но и отец, поэтому на цитомегаловир усную инфекцию должна обследоваться не только женщина, планирующая беременность, но и будущий отец ее ребенка.
Последней из инфекций ТОРЧ-комплекса является герпес. Строго говоря, герпес - это даже не болезнь, а целая группа вирусных инфекционных заболеваний. Известны две группы вирусов герпеса — герпес I и II типов.
Герпес I типа, в частности, проявляется как известная всем «простуда» на губах, герпес II типа в большинстве случаев поражает половые органы (так называемый урогенитальный герпес).
Герпес передается воздушно-капельн ым и половым путем, а также «вертикально», то есть от беременной матери инфекция через плаценту может переходить к плоду.
В случае запущенного хронического течения болезни герпес обоих типов может проявляться поражениями не только кожи и слизистых, но и центральной нервной системы, глаз, внутренних органов.
Как и при всех ТОРЧ-инфекциях, при заражении герпесом у человека вырабатываются антитела, которые в значительной мере «глушат» дальнейшее прогрессирование вируса, и герпес чаще всего проявляется только при снижении иммунитета (как, например, герпес I типа при простуде). Если женщина заразилась герпесом од беременности, то эти антитела переходят к плоду вместе с вирусом, и чаще всего опасности для плода инфекция не представляет.
При первичном заражении герпесом во время беременности, особенно на начальной ее стадии, когда закладываются все органы и системы будущего ребенка, герпесная инфекция может быть смертельно опасной для плода.
В этом случае втрое повышается риск неразвивающейся беременности и выкидышей, возможно развитие уродств у плода. Если заражение генитальным герпесом происходит во второй половине беременности, то увеличивается вероятность появления врожденных аномалий плода, таких как микроцефалия, патология сетчатки, пороки сердца, врожденная вирусная пневмония. Могут произойти преждевременные роды.
Кроме того, заражение плода ВПГ во внутриутробны й период может стать причиной тяжелых ситуаций, связанных с гибелью ребенка после рождения, детского церебрального паралича, эпилепсии, слепоты, глухоты.
Ребенок может заразиться герпесом не только внутриутробно, но и во время родов, проходя родовыми путями инфицированной матери. Это происходит, если во время беременности у женщины обостряется генитальный герпес, а высыпания локализуются на шейке матки или в половых путях. В случае если за четыре недели до родов у беременной женщины обнаруживается вирус герпеса, то роды, как правило, проводятся путем планового кесарева сечения, для того чтобы свести к минимуму риск инфицирования новорожденного.
Вывод напрашивается сам собой: обследование пары, планирующей беременность, на герпес, также должно проводиться еще до наступления беременности.
Если вирус герпеса будет обнаружен, врач назначит лечение, после которого инфекция не будет беспокоить ни будущую маму, ни будущего малыша. При необходимости лечение герпеса назначается и во время беременности, для этого, как правило, используются противовирусные средства, подавляющие активность вируса герпеса, а также препараты, укрепляющие иммунитет беременной женщины, особенно стимулирующие выработку организмом интерферона.
Инфекция, вызываемая вирусом простого герпеса
Вирус простого герпеса (ВПГ) – ДНК–содержащий вирус Herpes simplex virus семейства Herpesviridae подсемейства Alphaherpesvirinae. Согласно статистическим данным ВОЗ, инфекции, обусловленные ВПГ, занимают второе место по распространенности среди вирусных заболеваний человека. Различают два серотипа ВПГ – ВПГ-1 и ВПГ-2. Оба типа вируса вызывают инфекционные заболевания человека различной степени тяжести от характерных везикулезных или пустулезных высыпаний на коже и слизистых до поражений ЦНС. ВПГ-1 – причина офтальмогерпеса, протекающего в форме кератита или кератоиридоциклита, реже увеита, в единичных случаях — ретинита, блефароконъюнктивита. Заболевание может привести к помутнению роговицы и вторичной глаукоме. ВПГ-1 — основная причина энцефалита у взрослого населения стран умеренного климата, при этом только у 6–10% больных отмечается одновременное поражение кожи.
В ходе проведения эпидемиологических исследований установлено наличие специфических АТ к ВПГ у 90–95% обследуемых лиц среди взрослого населения, при этом первичная инфекция манифестно протекает лишь у 20–30% инфицированных.
ВПГ характеризуется коротким циклом репродукции в клеточных культурах и оказывает сильное цитопатическое действие. Он способен к репродукции в различных типах клеток, чаще персистирует в ЦНС, преимущественно в ганглиях, поддерживая латентную инфекцию с возможностью периодической реактивации. Наиболее часто вызывает кожно-слизистые формы заболевания, а также поражение ЦНС и глаз. Геном ВПГ может интегрироваться с генами других вирусов (включая ВИЧ), вызывая их активацию, также возможен его переход в активное состояние на фоне развития иных вирусных и бактериальных инфекций.
Выделение ВПГ продолжается значительное время при первичном инфицировании (ДНК выявляется в плазме крови в течение 4–6 недель), при рецидивах – не более 10 дней. Формирование противогерпетического иммунитета происходит как при манифестном, так и при бессимптомном течении инфекции. При первом контакте АГ с клетками иммунной системы в течение 14–28 дней формируется первичный иммунный ответ, который у иммунокомпетентных лиц проявляется образованием интерферонов, выработкой специфических АТ (вначале – IgM, впоследствии – IgA и IgG), повышением активности естественных киллеров – NK-клеток и формированием мощного пула высокоспециализированных киллеров. В случае реактивации или реинфекции возникает повторный контакт клеток иммунной системы с АГ, образуются АТ и Т-киллеры. Реактивация сопровождается продукцией АТ IgM (редко даже при наличии типичных высыпаний), АТ IgА (чаще) и IgG.
ВПГ (преимущественно ВПГ-2) вызывает генитальный герпес – хроническое рецидивирующее заболевание. Клинические проявления первичного эпизода инфекции, вызванной разными типами вируса сходны, однако инфекции, вызванной ВПГ-2, в гораздо большей степени свойственен рецидивирующий характер. Передача вируса происходит при половых контактах, очаг инфекции локализуется на слизистой и коже половых органов и перигенитальной зоны. Размножение вируса в клетках эпителия приводит к образованию очага сгруппированных пузырьков (папул, везикул), в которых содержатся вирусные частицы, сопровождается покраснением, зудом. Первичный эпизод протекает острее (обычно с симптомами интоксикации), чем последующие рецидивы. Часто возникают симптомы дизурии, признаки эрозии шейки матки.
На ранних стадиях ВИЧ-инфекции течение заболеваний, вызванных ВПГ-1 или ВПГ-2, короткое и типичное. Частым признаком углубления иммуносупрессии и перехода латентной стадии ВИЧ-инфекции в стадию вторичных заболеваний служит развитие опоясывающего лишая. Наличие стойких глубоких вирусных поражений кожи, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши — одни из клинических критериев стадии вторичных заболеваний ВИЧ-инфекции. У больных с количеством CD4+-клеток менее 50 клеток/мкл отсутствует тенденция к самостоятельному заживлению эрозивно-язвенных дефектов. Частота герпетического энцефалита среди поражений ЦНС при ВИЧ-инфекции — около 1–3%. У больных СПИДом с наличием глубокого иммунодефицита заболевание нередко протекает атипично: болезнь начинается подостро и медленно прогрессирует до тяжелейших проявлений энцефалита.
Герпетическая инфекция даже при бессимптомном течении способна вызвать целый ряд патологий у беременной и новорожденного. Наибольшую угрозу репродуктивной функции представляет генитальный герпес, который в 80% случаев обусловлен ВПГ-2 и в 20% – ВПГ-1. Бессимптомное течение чаще имеет место у женщин и более типично для ВПГ-2, чем для ВПГ-1. Первичное инфицирование или рецидивы во время беременности наиболее опасны для плода, поскольку могут привести к самопроизвольному выкидышу, гибели плода, мертворождению, порокам развития. Заражение плода и новорожденного чаще отмечается при бессимптомном течении генитального герпеса, чем при клинически выраженном типичном течении. Новорожденный может приобрести герпетическую инфекцию внутриутробно, во время родов (в 75–80% случаев), либо постнатально.
ВПГ-2 может проникать в полость матки через цервикальный канал с поражением плода в 20–30% случаев; трансплацентарное инфицирование может происходить в 5–20% случаев, инфицирование во время родов – в 40% случаев. Возможна передача вируса при выполнении медицинских процедур. При типичных клинических проявлениях диагноз герпетической инфекции трудностей не представляет, тогда как при атипичных формах верифицируется на основании результатов лабораторных исследований, при этом приоритетными должны быть исследования, направленные на выявление маркеров текущей (активной) инфекции. Активация инфекционного процесса при герпетической инфекции, даже при наличии клинических проявлений в стадии обострения, редко сопровождается выработкой АТ-ВПГ IgM (чаще – при первичной инфекции либо реинфекции), как правило, при этом отмечают появление АТ-ВПГ IgА.
Целесообразными являются диагностические исследования для обнаружения ВПГ или его маркеров при наличии в анамнезе пациента указаний на рецидивирующую инфекцию либо на дебют герпетической инфекции в период беременности.
Дифференциальная диагностика. При наличии инфекционного синдрома (длительный субфебрилитет, лимфаденопатия, гепато- или гепатоспленомегалия) – токсоплазмоз, цитомегаловирусная инфекция и инфекция, вызванная ВЭБ; контактный дерматит, инфекционные заболевания, сопровождающиеся везикулезными высыпаниями на коже и слизистых оболочках (ветряная оспа, опоясывающий герпес, пиодермия и др.); эрозивно–язвенные поражения гениталий, обусловленные Treponema pallidum, Haemophilus ducreyi; болезнь Крона, синдром Бехчета, фиксированная токсикодермия, менингоэнцефалиты и менингиты неясной этиологии, увеиты и кератоконъюнктивиты неясной этиологии).
Показания к обследованию
- Планирование беременности;
- женщины, имеющие в анамнезе либо на момент обращения типичные герпетические высыпания любой локализации, в т. ч. рецидивирующий генитальный герпес, или наличие пузырьковых и/или эрозивных высыпаний на коже, ягодицах, бедрах, слизисто–гнойные выделения из влагалища;
- наличие полового контакта с партнером, имеющим генитальный герпес;
- атипичная форма заболевания: отсутствие зуда или жжения, отсутствие везикул, веррукозные узелки; обширные кожные поражения (до 10% случаев предполагаемого опоясывающего герпеса обусловлено не ВЗВ, а ВПГ);
- женщины с отягощенным акушерским анамнезом (перинатальные потери, рождение ребенка с врожденными пороками развития);
- беременные женщины (в первую очередь имеющие УЗИ-признаки внутриутробной инфекции, лимфоденопатии, лихорадку, гепатит и гепатоспленомегалию неясного генеза);
- дети с признаками внутриутробной инфекции, врожденными пороками развития или наличием на коже или слизистых оболочках везикул или корочек;
- дети, рожденные от матерей, перенесших генитальный герпес во время беременности;
- Пациенты (в первую очередь новорожденные) с сепсисом, гепатитами, менингоэнцефалитом, пневмонией, поражением глаз (увеит, кератит, ретинит, ретинальный некроз), поражением ЖКТ.
Материал для исследования
- Содержимое пузырьков/везикул со слизистых оболочек и кожи половых органов мужчин и женщин – микроскопические исследования, культуральные исследования, выявление АГ, выявление ДНК;
- мазки (соскобы) со слизистых оболочек цервикального канала, уретры (при отсутствии видимых пузырьковых высыпаний или эрозивно-язвенных поражений) – выявление ДНК;
- сыворотка крови, СМЖ (по показаниям) – выявление АТ.
Этиологическая лабораторная диагностика включает микроскопическое исследование, выделение и идентификация вируса в культуре клеток, выявление АГ или ДНК возбудителя, определение специфических АТ.
Сравнительная характеристика методов лабораторной диагностики (вирус простого герпеса - анализ). Среди методов лабораторной диагностики “золотым стандартом” долгое время считали выделение ВПГ в культуре клеток из крови, СМЖ, содержимого везикулезных или пустулезных высыпаний и других локусов (носоглотки, конъюнктивы, уретры, влагалища, цервикального канала). Данный метод предполагает изоляцию вируса при заражении биологическим материалом чувствительных культур клеток с его последующей идентификацией. К неоспоримым преимуществам метода относятся: возможность определения активности инфекции при наличии клинических проявлений и проведения типирования вируса, а также установления чувствительности к противовирусным препаратам. Однако длительность анализа (1–8 дней), трудоемкость, высокая стоимость и необходимость определенных условий проведения исследований затрудняет применение данного метода для рутинной лабораторной диагностики заболевания. Чувствительность достигает 70–80%, специфичность – 100%.
Материал с поверхности высыпаний может быть использован для микроскопических (окраска препаратов по Романовскому–Гимзе) или цитологических (окраска препаратов по Тцанку и Папаниколау) исследований. Названные процедуры имеют низкую диагностическую специфичность (не позволяют дифференцировать ВПГ от других герпес-вирусов) и чувствительность (не более 60%), поэтому не могут считаться надежными методами диагностики.
Выявление АГ ВПГ в крови, СМЖ, содержимом везикулезных или пустулезных высыпаний и других локусов (носоглотки, конъюнктивы, уретры, влагалища, цервикального канала) проводят методами РИФ и РНИФ с использованием моноклональных или высокоочищенных поликлональных АТ. При использовании метода ИФА чувствительность исследования возрастает до 95% и более, специфичность при манифестном герпесе варьирует от 62 до 100%. Однако большинство наборов реагентов для выявления антигена ВПГ методом ИФА не позволяют провести дифференцирование серотипов вируса.
Обнаружение ДНК ВПГ-1 и/или ВПГ-2 при использовании ПЦР в различном биологическом материале превосходит чувствительность обнаружения ВПГ при использовании вирусологического исследования. Выявление ВПГ в соскобах со слизистых оболочек полости рта, урогенитального тракта, в отделяемом пузырьковых высыпаний (везикул) и эрозивно–язвенных поражений кожи с помощью ПЦР является методом выбора. Несомненную ценность имеет определение количества ДНК ВПГ методом ПЦР в режиме реального времени, результаты исследования можно использовать как с диагностической целью, так и для оценки эффективности лечения.
Для выявления АТ к ВПГ разных классов IgА, IgG, IgM, суммарных к антигенам ВПГ обоих типов или типоспецифичных, применяют методы РНИФ или ИФА, для определения авидности АТ IgG – метод ИФА. Наибольшее диагностическое значение имеет детекция АТ IgM как показателя активности процесса, их выявление может свидетельствовать об остром заболевании, реинфекции, суперинфекции или реактивации. Однако в клинически выраженных случаях, в т. ч. при типичном течении генитального или неонатального герпеса, специфические АТ IgM выявляются редко (в 3–6% случаев). Определение авидности АТ-ВПГ IgG несет низкую информационную нагрузку: реактивация при клинически выраженных случаях сопровождалась наличием высокоавидных АТ. Тест на выявление АТ-ВПГ IgА является методом выбора наряду с определением ДНК либо АГ ВПГ при определении активности инфекционного процесса.
Показания к применению различных лабораторных исследований. Определение АТ целесообразно проводить для подтверждения первичной инфекции, а также установления диагноза у пациентов с бессимптомным и атипичным течением заболевания.
У беременных женщин (скрининг) целесообразно проведение исследований для выявления АТ-ВПГ IgМ, а также выявление АТ-ВПГ IgА. Для беременных высокого инфекционного риска дополнительно рекомендуется определение ДНК и АГ ВПГ в лейкоцитарной взвеси или в материале из предполагаемого очага.
При подозрении на внутриутробную инфекцию рекомендуется выявление ДНК вируса в пуповинной крови, у новорожденных – детекция ДНК вируса в различных биологических пробах (отделяемое пузырьковых высыпаний (везикул) эрозивно– язвенных поражений кожи и слизистых оболочек, ротоглотки, конъюнктивы; периферическая кровь, СМЖ, моча и др.), а также определение АТ-ВПГ IgМ и IgА в крови. Учитывая высокую диагностическую значимость определения ДНК вируса методом ПЦР и наличие зависимости между летальностью у новорожденных и виремией, вызванной ВПГ, некоторые исследователи рекомендуют использовать этот метод для лабораторного скрининга генерализованной герпетической инфекции детей, относящихся к группе высокого риска.
Выявление АГ-ВПГ в различных биологических пробах предлагается применять в качестве экспресс-тестов для дифференцирования типов вируса при скрининге популяций с высоким уровнем заболеваемости, а также при мониторинге заболевания.
У больных ВИЧ-инфекцией с атипичными клиническими проявлениями кожных поражений в диагностике отдается предпочтение выявлению ДНК ВПГ методом ПЦР как самому чувствительному методу лабораторной диагностики.
Особенности интерпретации результатов. Обнаружение вирусоспецифических АТ IgM может свидетельствовать о первичной инфекции, реже – о реактивации или реинфекции, выявление АТ-ВПГ IgА – об активности инфекционного процесса (затяжное течение при дебюте герпетической инфекции, реинфекции или реактивации). О врожденной инфекции (неонатальный герпес) свидетельствует присутствие АТ-ВПГ IgM и(или) IgА. Выявление АТ IgG отражает латентную инфекцию (инфицирование).
Выявление ДНК ВПГ свидетельствует о наличии активной (репликативной) стадии вирусной инфекции с учетом выраженности клинических проявлений. Выявление ДНК ВПГ-1 и/или ВПГ-2 методом ПЦР позволяет при однократном тестировании установить факт внутриутробного инфицирования плода; при проведении обследования в первые 24–48 ч после рождения лабораторно подтвердить врожденную инфекцию, вызванную ВПГ.
Диагностическое значение (специфичность и чувствительность) обнаружения ДНК ВПГ в СМЖ у больных ВИЧ-инфекцией с поражением ЦНС окончательно не установлены. Возможно, для подтверждения герпетической этиологии энцефалита необходимо определение концентрации ДНК ВПГ в СМЖ. Исследование для обнаружения ДНК ВПГ в крови малоинформативно в связи кратковременным нахождением ВПГ в сосудистом русле, следовательно, возможно получение отрицательного результата несмотря на развитие клинически выраженного заболевания.
Герпетические инфекции у детей
Герпесвирусные инфекции - группа инфекционных заболеваний, которые вызываются вирусами из семейства Herpesviridae, могут протекать в виде локализованных, генерализованных, рецидивирующих форм болезни, имеют способность к персистированию (постоянному нахождению вируса) в организме человека.
Герпесвирусные инфекции (ГВИ) относятся к наиболее распространенным вирусным болезням человека. Инфицированность и заболеваемость ими каждый год возрастает. Во всех странах мира 60-90% населения инфицированы тем или иным герпесвирусом.
Этиология
Герпесвирусы в своем составе содержат двунитчатую ДНК, имеют глико-липопротеиновую оболочку. Размеры вирусных частиц от 120 до 220 нм.
На сегодня описано 8 типов герпесвирусов, которые выявлены у человека:
- два типа вируса простого герпеса (HSV-1, HSV-2),
- вирус ветряной оспы и опоясывающего герпеса (VZV или HHV-3),
- вирус Эпштейн-Барр (ЕBV или HHV-4),
- цитомегаловирус (CMV или HHV-5), HHV-6, HHV-7, HHV-8.
На основе биологических свойств вирусов сформированы 3 подсемейства герпесвирусов: (альфа-герпесвирусы, бетта-герпесвирусы и гамма-герпесвирусы). К a-герпесвирусам относятся HSV-1, HSV-2, VZV.
К бета-герпесвирусам относятся CMV, HHV-6, HHV-7. Они, как правило, медленно размножаются в клетках, вызывают увеличение пораженных клеток (цитомегалия), способны к персистенции, преимущественно в слюнных железах и почках, могут вызывать врожденные инфекции. К гамма-герпесвирусам относятся ЕBV и HHV-8.
Вирус простого герпеса 1 и 2 типов
Термин "герпетическая инфекция" (ГИ) обычно употребляется относительно заболеваний, которые вызываются HSV-1 и HSV-2. Источником HSV-инфекции являются больные люди различными формами заболевания, в том числе и латентной, а также вирусоносители.
HSV-1 передается воздушно-капельным и контактным путем. Попавший на кожу во время кашля, чихания вирус, находящийся в капельках слюны, выживает в течение часа. На влажных поверхностях (умывальник, ванна и прочее) он сохраняет жизнеспособность в течение 3-4 часов, что нередко является причиной вспышек заболеваний в детских дошкольных учреждениях. Заражение может осуществляться при поцелуях, а также через предметы обихода, которые инфицированы слюной больного или вирусоносителя. HSV-2 передается половым или вертикальным путем. При последнем инфицирование происходит во время родов (контакт с родовыми путями матери), трансплацентарно или через цервикальный канал в полости матки. В связи с тем, что при генерализации инфекции имеет место вирусемия, возможен также трансфузионный или парентеральный путь передачи HSV-2 инфекции. HSV-2 вызывает, как правило, генитальный и неонатальный герпес.
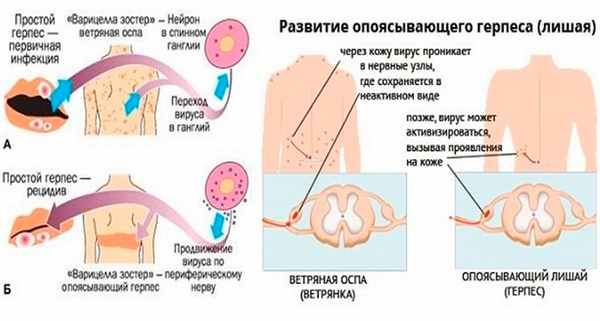
Наибольшая восприимчивость у детей к ГИ в возрасте от 5 месяцев до 3 лет. В зависимости от механизма заражения различают приобретенную и врожденную форму ГИ. Приобретенная ГИ может быть первичной и вторичной (рецидивирующая), локализованной и генерализованной. Также выделяют латентную форму ГИ.
Ни одна инфекция не имеет такого многообразия клинических проявлений, как герпесвирусная. Она может вызывать поражение глаз, нервной системы, внутренних органов, слизистой оболочки желудочно-кишечного тракта, полости рта, гениталий, может являться причиной онкологических заболеваний, имеет определенное значение в неонатальной патологии и возникновении гипертонии. Распространение вируса в организме происходит гематогенным, лимфогенным, нейрогенным путем.
Частота первичной герпесвирусной инфекции возрастает у детей после 6 месяцев жизни, когда полученные от матери антитела исчезают. Пик заболеваемости приходится на возраст 2—3 года. Нередко ГИ встречается и у новорожденных детей, по данным ряда авторов диагностируется у 8% новорожденных с общесоматической патологией и у 11% недоношенных детей.
По данным ВОЗ, заболевания, обусловленные вирусом простого герпеса (HSV), занимают второе место после гриппа среди причин смертности от вирусных инфекций. Решение проблемы диагностики и лечения герпесвирусной инфекции с проявлениями на слизистой оболочке полости рта — одна из важнейших задач практической медицины.
В последнее десятилетие во всем мире значение герпесвирусных заболеваний как проблемы общественного здравоохранения постоянно растет. Представители семейства герпесвирусов человека поражают до 95% населения мира.
К первичным формам ГИ относятся: инфекция новорожденных (генерализованный герпес, энцефалиты, герпес кожи и слизистых), энцефалиты, гингивостоматиты, герпетиформная экзема Капоши, первичный герпес кожи, глаз, герпетический панариций, кератиты. Первичная ГИ возникает вследствие первичного контакта человека с HSV. Как правило, это происходит в раннем детском возрасте (до 5 лет). У взрослых в возрасте 16-25 лет, которые не имеют противовирусного иммунитета, первичная ГИ чаще может быть обусловлена HSV-2. Латентно переносят заболевание 80-90% первично инфицированных детей, и только в 10-20% случаев наблюдаются клинические проявления болезни.
Вторичными, рецидивирующими формами ГИ является герпес кожи и слизистых оболочек, офтальмогерпес, герпес половых органов.
Эпштейн-Барр-вирусная инфекция
Инфекционное заболевание, которое вызывается вирусом Эпштейн-Барр (ЕBV) и характеризуется системным лимфопролиферативным процессом с доброкачественным или злокачественным течением.
ЕBV выделяется из организма больного или вирусоносителя с орофарингеальным секретом. Передача инфекции происходит воздушно-капельным путем через слюну, часто во время поцелуев матерью своего ребенка, поэтому иногда ЕBV-инфекцию называют "болезнью поцелуев". Дети нередко заражаются ЭБВ через игрушки, загрязненные слюной больного ребенка или вирусоносителя, при пользовании общей посудой, бельем. Возможен гемотрансфузионный путь передачи инфекции, а также половой. Описаны случаи вертикальной передачи ЕBV от матери к плоду, предполагают, что вирус может быть причиной внутриутробных аномалий развития. Контагиозность при ЕBV-инфекции умеренная, что, вероятно, связано с низкой концентрацией вируса в слюне. На активацию инфекции влияют факторы, снижающие общий и местный иммунитет. Возбудитель ЕBV-инфекции имеет тропизм к лимфоидно-ретикулярной системе. Вирус проникает в В-лимфоидные ткани ротоглотки, а затем распространяется по всей лимфатической системе организма. Происходит инфицирование циркулирующих В-лимфоцитов. ДНК-вируса проникает в ядра клеток, при этом белки вируса придают инфицированным В-лимфоцитам способность беспрерывно размножаться, вызывая так называемое "бессмертие" В-лимфоцитов. Этот процесс является характерным признаком всех форм ЕBV-инфекции.
ЕBV может вызывать: инфекционный мононуклеоз, лимфому Беркитта, назофарингеальную карциному, хроническую активную ЕBV-инфекцию, лейомиосаркому, лимфоидную интерстициальную пневмонию, "волосатую" лейкоплакию, неходжкинскую лимфому, врожденную ЕBV-инфекцию.
Варицелла-зостер-инфекция
Varicella-zoster вирус вызывает ветряную оспу и опоясывающий герпес. Источником инфекции при ветряной оспе может быть только человек, больной ветряной оспой или опоясывающим герпесом, включая последние 24-48 часов инкубационного периода. Реконвалесценты ветряной оспы остаются заразными на протяжении 3-5 дней после прекращения высыпаний на коже. Через третье лицо заболевание не передается. Возможно внутриутробное заражение ветряной оспой в случае заболевания беременной. Ветряная оспа может встречаться в любом возрасте, но в современных условиях максимальное количество больных приходится на детей в возрасте от 2 до 7 лет. Опоясывающий герпес развивается после первичного инфицирования вирусом Varicella-zoster, после перехода инфекции в латентную форму, при которой вирус локализуется в спинальных, тройничном, сакральном и других нервных ганглиях. Возможна эндогенная реактивация инфекции.
Цитомегаловирусная инфекция
Инфекционное заболевание, которое вызывается цитомегаловирусом (CMV) и характеризуется разнообразными клиническими формами (от бессимптомной до тяжелой генерализованной с поражением многих органов) и течением (острым или хроническим). Факторами передачи CMV могут быть практически все биологические субстраты и выделения человека, в которых содержится вирус: кровь, слюна, моча, ликвор, вагинальный секрет, сперма, амниотическая жидкость, грудное молоко. Потенциальным источником инфекции являются органы и ткани в трансплантологии, а также кровь и ее продукты в трансфузиологии. Пути передачи CMV-инфекции: воздушно-капельный, половой, вертикальный и парентеральный.
Различают врожденную и приобретенную формы CMV-инфекции. Врожденная CMV-инфекция. При антенатальном инфицировании плода заражение происходит преимущественно трансплацентарно. При интранатальном инфицировании CMV поступает в организм при аспирации инфицированных околоплодных вод или секретов родовых путей матери.
У детей более старшего возраста приобретенная CMV-инфекция в 99% случаев протекает в субклинической форме. Наиболее частым проявлением такой формы CMV-инфекции у детей в возрасте старше года является мононуклеозоподобный синдром. Как правило, наблюдается клиника острого респираторного заболевания в виде фарингита, ларингита, бронхита.
Инфекции, вызванные шестым, седьмым и восьмым типами герпесвирусов Герпесвирусы шестого типа (HHV-6) могут явиться причиной эритематозной и розеолезной сыпи (внезапная экзантема), поражений ЦНС и костного мозга у иммуноскомпроментированных детей. Герпесвирусы седьмого типа (HHV-7) вызывают экзантему новорожденных
Для диагностики герпетической инфекции ценным являются цитологический, иммунофлюоресцентный, серологический и ПЦР методы.
Вирусологическое исследование при герпетической инфекции выявляет комплементсвязывающие антитела к ВПГ-1 или -2 в крови матери, пуповинной крови плода и амниотической жидкости.
ПЦР-метод. Материалом для исследования на герпес являются кровь, мазки из глотки, содержимое пузырьков, язв, моча.
Важное значение имеет исследование специфических антител различных подклассов: IgM, IgG1-2, IgG3 и IgG4 к герпес-вирусам. Выявление в сыворотке крови детей специфических иммуноглобулинов М, IgG3, IgG1-2 в титре > 1:20, вирусного антигена и специфических иммунных комплексов с антигеном свидетельствует об остроте инфекционного процесса (активная фаза), а определение только специфических IgG4 расценивается как латентная фаза инфекции или носительство материнских антител.
Лечение
Герпетической инфекции проходит в 3 этапа:
- 1 этап – в активной стадии или при обострении хронического течения заболевания;
- 2 этап – пролонгированное лечение поддерживающими дозами в период ремиссии;
- 3 этап – выявление и санация хронических очагов инфекции, обследование членов семьи для выявления источника инфицирования.
Во всех случаях препараты, их комбинация и длительность подбираются индивидуально с учетом проявлений заболевания, особенности иммунной системы ребенка, возраста, течения заболевания.
Автор материала: врач-педиатр клиники на Родионовской Телицына Е. В.
Внутриутробная герпес инфекция. Голопрозенцефалия
Герпетическая инфекция – инфекция, вызываемая герпесвирусами 1-го и 2-го типа – хроническое рецидивирующее заболевание, входящее в группу ТОRСН – инфекций, для которого характерно поражение кожи, слизистых, глаз, нервной системы.
Инфекция, вызванная герпесвирусами, распространена повсеместно. Инфицированность населения очень высокая. По данным Всемирной организации здравоохранения (ВОЗ) герпесвирусная инфекция занимает второе место среди вирусных заболеваний человека, уступая лишь гриппу.
Восприимчивость к инфекции всеобщая, независимо от пола и возраста.
Подъемы заболевания регистрируются в осенне-зимний период.
Проведенные за последние 10 лет эпидемиологические исследования показали, что к 15-летнему возрасту инфицировано 80% детей, а к 30 годам 90% населения имеют антитела к вирусам того или иного типа.
Возбудитель инфекции – вирус простого герпеса 1 или 2 типа (ВПГ 1 или ВПГ 2). Попадая в клетку – вирус вызывает ее гибель. В отдельных клетках вирус может сохраняться длительное время, но при последующей активации вируса, клетка погибнет.
Считается, что ВПГ – 1 чаще поражает дыхательные пути, а ВПГ-2 - урогенитальную систему, но, несмотря на это, роль ВПГ-1 в развитии генитального герпеса увеличивается.
Вирусы простого герпеса неустойчивы к действию физических и химических факторов, легко разрушаются под действием ультрафиолетовых и рентгеновских лучей, чувствительны к этиловому спирту, эфиру. При низких температурах (-20-70 о С) вирус сохраняется десятилетиями.
Источники инфекции – вирусоносители и больные с различными формами болезни.
Пути передачи инфекции:
- Половой (наиболее значимый);
- Гематогенный;
- Воздушно-капельный;
- Контактно-бытовой (через игрушки, предметы обихода, одежду).
Факторами передачи вируса являются: слюна, кровь, слезная жидкость, сперма, секрет влагалища и цервикального канала, различные органы и ткани, используемые при трансплантации, моча, медицинский инструментарий.
Попадает вирус в организм через поврежденные участки кожи и слизистой, затем, в месте внедрения вируса происходит размножение вирусных частиц. Первичное инфицирование вызывает латентную (скрытую, вялотекущую) инфекцию.
Клиническая картина.
Клинические проявления герпетической инфекции отличаются значительным разнообразием. Они зависят от локализации поражения, распространенности, состояния иммунной системы, типа вируса, а также от механизма заражения.
По механизму заражения герпетическая инфекция бывает первичная и рецидивирующая.
Первичная форма – остро возникающее заболевание при первом контакте с вирусом простого герпеса.
По локализации поражения:
- Кожа – простой герпес, герпетиформная экзема;
- Слизистые оболочки ротоглотки – стоматит, фарингит, тонзиллит;
- Верхние дыхательные пути – острое респираторное заболевание;
- Глаза – кератоконъюнктивит;
- Урогенитальный тракт – уретрит, цистит, вульвовагинит;
- Нервная система – менингит, энцефалит, менингоэнцефалит;
- Внутренние органы – гепатит, гломерулонефрит, пневмония.
Генитальный герпес развивается у молодых людей после начала половой жизни. Первичный генитальный герпес отличается более тяжелым и продолжительным течением. Высыпания обильные и занимают большую площадь поражения. При первичном генитальном герпесе отмечается повышение температуры, общая слабость, раздражительность. В области гениталий появляются везикулезные высыпания, сохраняющиеся до 8 суток.
Влияние вируса простого герпеса на беременность и роды.
Первичное инфицирование и рецидивы во время беременности могут привести к мертворождению, выкидышам, а также к формированию пороков у плода. Наиболее опасно заражение в третьем триместре.
При первичном инфицировании матери во время беременности инфицирование плода происходит в 5% случаев. Чаще всего инфицирование ребенка происходит во время родов (85%) или после родов (10%).
Инфицирование ребенка ВПГ во время родов может стать причиной последующего развития герпетической инфекции новорожденного.
Основную опасность представляет выделение вируса со слизистой половых органов в момент родов. Выделение вируса может сопровождаться высыпаниями в области половых органов, а может и не сопровождаться никакими симптомами.
Последствия герпесвирусной инфекции для ребенка:
- распространение вируса по всему организму с поражением головного мозга, легких, печени, надпочечников, кожи, глаз, ротовой полости;
- поражение ЦНС (снижение аппетита, судороги, повышенная возбудимость);
- поражение кожных покровов, слизистой оболочки глаз, рта.
Профилактика герпесвирусной инфекции:
Важным принципом профилактики этого заболевания является прекращение близких контактов с больным человеком в период обострения.
не пользоваться чужими предметами личной гигиены;
после контакта с пораженным герпесом участком (после нанесения противовирусного крема) необходимо тщательно вымыть руки;
Больной герпесвирусной инфекцией должен иметь отдельную посуду и пользоваться личным полотенцем;
Профилактика ВПГ-1 сводится к соблюдению общих правил предупреждения респираторных заболеваний. Профилактика ВПГ-2 соответствует профилактике инфекций передающихся половым путем ( использование презервативов во время половых контактов), использование антисептических растворов после полового акта.
Неонатальная инфекция вирусом простого герпеса (ВПГ)
Неонатальная инфекция, вызванная ВПГ, обычно передается ребенку во время родов. Типичным признаком является везикулезная сыпь, которая может сопровождаться или прогрессировать до диссеминированной болезни. Диагноз устанавливают путем выделения вирусной культуры, тестирования методом полимеразной цепной реакции, иммунофлуоресценции, или электронной микроскопии. Лечение состоит в назначении парентерально высоких доз ацикловира и поддерживающей терапии.
При неонатальной инфекции, вызванной вирусом простого герпеса (ВПГ), отмечается высокая смертность и значительная заболеваемость. Заболеваемость составляет от 1/3000 до 1/20000 рождений. Частота случаев неонатальной инфекции, вызванной ВПГ 2-го типа, больше, чем вызванной ВПГ типа 1.
Заражение ВПГ происходит во время родов через инфицированные половые пути матери. В некоторых случаях возможна трансплацентарная передача вируса, а также внутрибольничная передача инфекции (контактный путь) от одного новорожденного ребенка другому с участием медицинского персонала, членов семьи. У матерей новорожденных детей, страдающих герпетической инфекцией, как правило, имеются вновь приобретенные половые инфекции, но многие из них не имели симптомов во время родов.
Симптомы и признаки неонатальной ВПГ-инфекции
Симптомы обычно появляются между 1-й и 3-й неделями жизни, но редко могут не появиться и до конца 4-й недели. У новорожденных может быть местная или распространенная форма. Кожные везикулы одинаковы при любом типе инфекции и появляются примерно в 70% случаев. У новорожденных без кожных везикулярных высыпаний обычно развивается поражение центральной нервной системы (ЦНС). У новорожденных с изолированными высыпаниями в области кожи или слизистых оболочек, при отсутствии лечения, заболевание прогрессирует, и в течение 7–10 дней развиваются более тяжелые формы.
На данном снимке крупным планом рта новорожденного показана большая красная язва под верхней губой, вызванная ВПГ-1.
DR P. MARAZZI/SCIENCE PHOTO LIBRARY
У данного новорожденного со СПИДом также выявлен диссеминированный ВПГ-2 с поражениями, покрывающими все тело.
DR M.A. ANSARY/SCIENCE PHOTO LIBRARY
Скопление везикул на эритематозной основе обладают характерными особенностями и могут присутствовать практически на любой части тела.
С разрешения издателя. From Demmler G: Congenital and perinatal infections. In Atlas of Infectious Diseases: Pediatric Infectious Diseases . Edited by CM Wilfert. Philadelphia, Current Medicine, 1998.
Локализованная форма
Новорожденных детей с локализованным герпетическим поражением можно разделить на 2 группы. Для одной группы характерен энцефалит с выраженной неврологической симптоматикой, плеоцитозом спинномозговой жидкости и повышенным содержанием белка. Возможны сопутствующие поражения кожи, глаз и рта. Для другой группы характерно поражение только кожи, глаз, слизистой полости рта, без признаков вовлечения ЦНС или заболеваний внутренних органов.
Диссеминированная форма заболевания
Новорожденные дети с диссеминированной формой болезни и вовлечением внутренних органов имеют гепатит, пневмонию, ДВС-синдром или их комбинацию с или без энцефалита или поражений кожи.
Другие симптомы, которые могут возникать как изолированно, так и в комбинации, включают нестабильность температуры, вялость, гипотонию, дыхательную недостаточность, апноэ и судороги.
Диагностика неонатальной ВПГ-инфекции
Исследование ВПГ с помощью культурального метода или методом полимеразной цепной реакции (ПЦР)
Иногда иммунофлуоресцентное тестирование поражений или электронная микроскопия
Экспресс-диагностика выделения культуры ВПГ или ПЦР имеет важное значение. Наиболее распространенным местом забора образцов являются кожные везикулы. Также необходимо исследовать носоглотку, глаза, прямую кишку, кровь и спинномозговую жидкость. У некоторых новорожденных с энцефалитом вирус присутствует только в ЦНС. Диагноз неонатальный ВПГ также можно поставить с помощью иммунофлуоресцентного окрашивания соскобов с пораженных участков, в частности с использованием моноклональных антител, и электронной микроскопии.
Если вирусологические средства диагностики недоступны, проводят пробу Тцанка пораженных участков, которая может выявить характерные многоядерные гигантские клетки и внутриядерные включения, но этот тест менее чувствителен, чем культуральный, и могут появиться ложноположительные результаты.
Прогноз при неонатальной ВПГ-инфекции
Смертность при нелеченой диссеминированной инфекции простого герпеса составляет 85%; среди новорожденных с нелеченым энцефалитом она составляет около 50%. Без лечения около 65% выживших после диссеминированной формы болезни или энцефалита имеют серьезные неврологические осложнения. Соответствующее лечение, в том числе назначение парентерального ацикловира, уменьшает смертность при заболеваниях ЦНС и диссеминированной форме на 50% и увеличивает часть детей, которые нормально развиваются примерно с 35% до 50–80%.
Летальный исход редко встречается у новорожденных детей с изолированным поражением кожи, слизистых глаз, полости рта. Тем не менее, без лечения, у многих из этих новорожденных заболевание будет прогрессировать до диссеминированной формы или поражения ЦНС, которые могут быть незамеченными.
Лечение неонатальной ВПГ-инфекции
Парентеральное введение ацикловира
В подозрительных случаях, во время ожидания подтверждающих диагностических тестов следует немедленно превентивно начинать лечение ацикловиром. Младенцам с диссеминированной формой и/или болезнью ЦНС следует назначить в дозе 20 мг/кг внутривенно каждые 8 ч в течение 21 дней. После этого режима, младенцам с поражением ЦНС следует назначить ацикловир 300 мг/м 2 внутрь 3 раза в день в течение 6 мес.; этот долгосрочный режим улучшает исходы развития нервной системы в возрасте 1 года, но может вызвать нейтропению.
Необходима активная поддерживающая терапия, включающая внутривенное введение растворов, питание, поддержание дыхания, коррекцию нарушений свертывания крови и контроль судорог.
При локализованных поражениях (кожа, слизистые оболочки полости рта или конъюнктивы) применяют ацикловир из расчета 20 мг/кг внутривенно каждые 8 ч в течение 14 дней. Герпетический кератоконъюнктивит требует сопутствующей местной терапии такими препаратами, как трифлуридин, йододезоксиуридин или видарабин (см. Лечение герпетического кератоконъюнктивита ЛечениеПрофилактика неонатальной герпетической инфекции
Усилия по предупреждению заражения герпетической инфекцией в родах были неэффективны. Универсальный скрининг не рекомендуется и не оказался эффективным, и большинство случаев материнской инфекции с риском передачи протекает бессимптомно. Тем не менее, женщины с генитальными очагами должны пройти в срок тестирование и серологию для диагностики ВПГ и определения риска передачи, также, как и для осуществления лечебного процесса по отношению к подвергшемуся воздействию, но без клинических проявлений новорожденному. Кесарево сечение рекомендовано для женщин с высоким риском передачи герпетической инфекции (например, имеющих активные генитальные высыпания на момент окончания срока вынашивания), даже когда мембраны герпетических везикул разорваны, так как при этом способе родоразрешения снижается риск заражения плода. Кроме того, эмбриональный монитор не должен использоваться во время родов, если у матери подозревают активное течение генитального герпеса. Новорожденные без клинических проявлений, родившихся у женщин с активными очагами на гениталиях на момент родов, должны пройти обследование и проверку на герпетическую инфекцию. Дополнительная информация доступна на портале Aмериканской академии педиатрии ( 1 Справочные материалы по профилактике Неонатальная инфекция, вызванная ВПГ, обычно передается ребенку во время родов. Типичным признаком является везикулезная сыпь, которая может сопровождаться или прогрессировать до диссеминированной. Прочитайте дополнительные сведенияПероральный прием ацикловира или валацикловира в течение последних нескольких недель беременности женщинами с генитальным герпесом в анамнезе, может предотвратить рецидив во время родов и уменьшить необходимость в проведении кесарева сечения.
Справочные материалы по профилактике
1. Kimberlin DW, Baley J, Committee on infectious diseases, Committee on fetus and newborn: Guidance on management of asymptomatic neonates born to women with active genital herpes lesions. Pediatrics 131(2):e635-646, 2013. doi: 10.1542/peds.2012-3216
Основные положения
Неонатальный герпес может быть локализованным на коже, глазах или в полости рта, в центральной нервной системе или может быть распространенным.
Энцефалит и распространенная форма болезни имеют высокую смертность и неврологические последствия, которые распространены среди выживших.
В подозрительных случаях для улучшения исходов важны предположительная терапия и быстрая диагностика с помощью ПЦР ВПГ спинномозговой жидкости, крови или повреждениях.
Следует назначить ацикловир для парентерального введения как при локализованной, так и при распространенной болезни.
У кесарево сечение, если мать имеет активный генитальных поражений герпес, присутствующих на срок.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
- Субтотальная холецистэктомия. Частичная холецистэктомия. Холецистостомия.
- Реактивный артрит
- Семейный периодический паралич
- Сигмовидная ободочная кишка. Топография сигмовидной ободочной кишки. Кровоснабжение сигмовидной ободочной кишки.
- Стеноз легочной артерии. Сердечный цианоз без смешения артериальной и венозной крови.
