Свищи после лучевой на челюсти
Повреждение прямой кишки, вызванное лучевой терапией (ЛТ), наиболее часто встречается после лечения рака шейки матки (РШМ) вследствие высоких доз облучения при внутриректальном применении цезия. Повреждение прямой кишки может проявляться в виде проктита, стриктуры или образования свища.
Полная толстокишечная непроходимость из-за повреждений, вызванных облучением, наблюдается чрезвычайно редко. Симптомы проктита, связанные с облучением, могут появиться после завершения ЛТ через много месяцев или даже лет бессимптомного периода. Чаще всего развивается диарея с или без ректального кровотечения. Схваткообразная боль в животе может быть связана с диареей.
Повреждение наиболее часто локализуется на передней стенке прямой кишки, которая получает максимальную дозу от применения брахитерапии с цезием, и выражается уплотнением слизистой оболочки или даже ее дистрофией либо изъязвлением. Эти осложнения, как правило, излечивают с помощью консервативных методов, включающих бесшлаковую диету, антихолинергические средства, вещества, улучшающие перистальтику кишечника, и клизмы с препаратами кортикостероидов.
Гипербарическая оксигенация также ускоряет заживление ректальных изъязвлений. При обильных кровотечениях из язвочек прямой кишки или при проктите может потребоваться отведение содержимого кишечника (колостомия), чтобы обеспечить заживление повреждений прямой кишки. Очевидно, что при кровотечении необходимо тщательное исследование ректосигмоидного отдела кишечника с помощью гибкого сигмоидоскопа, чтобы исключить рецидив злокачественного новообразования, рака прямой кишки, полипов или дивертикулов и геморроя, вызывающих кровотечение.

Прямокишечно-влагалищный свищ — тяжелое осложнение, которое характерно для осложнений ЛТ и часто предшествует проктиту и изъязвлению прямой кишки. Все больные, имеющие прямокишечно-влагалищные свищи нуждаются в колостомии. Редко эта процедура вызывала самопроизвольное излечение облученной толстой кишки, и впоследствии часто требовалось предпринимать дополнительные методы лечения для закрытия свища.
При показании к хирургической коррекции используют эндоваскулярные лоскуты, чтобы улучшить кровоснабжение облученных тканей прямой кишки и влагалища. Только после того, как свищ полностью закрыт и отсутствует кишечная непроходимость, можно удалить колостому.
Сужение или непроходимость ректосигмоидного отдела ободочной кишки, индуцированные ЛТ, появляются примерно через 24 мес. после завершения ЛТ. Первым этапом лечения служит отводящая колостомия. Для коррекции необходима резекция ректосигмоидного отдела ободочной кишки с формированием низкого колоректального анастомоза. Harris и Wheeltss описали свой метод плотного сшивания низкого колоректального анастомоза конец в конец при повреждении прямой кишки.
Эта операция была выполнена 49 больным, 17 из которых до этого получали ЛТ. Все пять послеоперационных осложнений (2 стриктуры, 2 случая разрушения анастомоза и 1 — недержания кала после закрытия колостомы) наблюдались у больных, подвергавшихся ЛТ до операции.
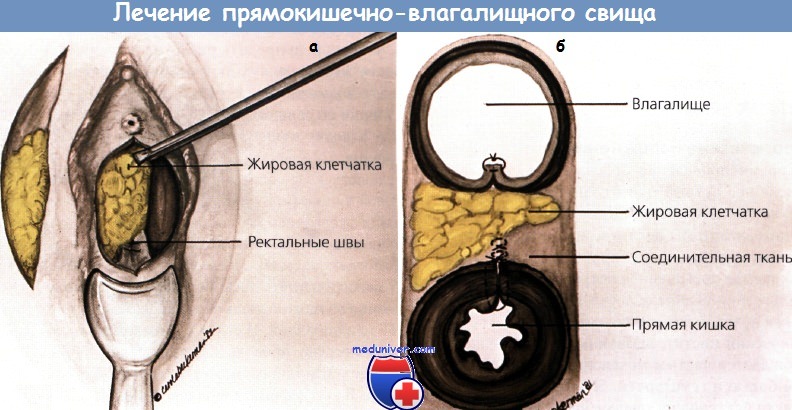
а - закрытие прямокишечно-влагалищного свища ускорено интерпозицией луковицы преддверия влагалища и окружающей ее жировой клетчатки.
б - на поперечном разрезе показано расположение неоваскуляр-ной жировой прослойки
Комплексные свищи могут образоваться между тонкой кишкой, толстой кишкой, влагалищем, мочевым пузырем и кожей. Тщательное исследование вовлеченных в процесс органов обязательно. Это ирригоскопия, проктосигмоскопия, исследование верхних отделов ЖКТ, включая тонкую кишку, внутривенная пиелография, цистография, цистоскопия и фистулография (введение контраста непосредственно в свищ и выявление ретроградного потока контрастного красителя).
Комплексные свищи часто трудно поддаются лечению. Больным следует провести оптимальную подготовку к операции: перевести на ППП, назначить антибиотики, чтобы предупредить развитие инфекции, и провести механическую подготовку кишечника. Если это возможно, то лучше резецировать участок кишки со свищом; однако чаще свищ изолируют и отводят кишечное содержимое от места поражения.
Предшествующее облучение органов таза и подвздошной кишки (или резекция либо двухэтапная операция с созданием стомы) может привести к нарушению всасывания витамина В12 и вызвать мегалобластную анемию. Поскольку печень обычно имеет значительные запасы витамина В12, проявление анемии возможно лишь через несколько лет после ЛТ или операции.
В связи с этим больным советуют ежегодно проводить клинический анализ крови. Тест Шиллинга может отличить дефицит витамина В12 от дефицита фолиевой кислоты. Для лечения дефицита витамина В12 необходимо еженедельное его введение до тех пор, пока уровень гемоглобина не вернется к нормальному (обычно через 4—6 нед.), и затем ежемесячное введение, чтобы предупредить рецидив анемии.
Пузырно-влагалищные свищи чаще всего возникают после интенсивной лучевой терапии (ЛТ), особенно после брахитерапии цезием. При облучении мочевого пузыря необходимо правильно установить прибор, т. к. неправильное его расположение приводит к облучению слишком большой дозой. При таких хирургических вмешательствах, как радикальная гистерэктомия при РШМ стадии №2, которые проводятся после ЛТ, возрастает риск пузырно-влагалищных свищей. Во многих случаях некроз верхнего отдела влагалища, вызванный ЛТ, появляется за месяцы до образования свища.
Лечение некроза может предотвратить образование свища. Оно включает спринцевание раствором перекиси водорода, внутривлагалищное введение эстрогенов и гипербарическую оксигенацию.
Диагностика пузырно-влагалищных свищей включает полное исследование мочевого пузыря и верхних отделов мочевых путей. Нередко при закрытии свища обнаруживают связанные с ним мочеточниково-влагалищный свищ или стриктуру/стеноз мочеточника. Кроме того, учитывая, что верхние отделы влагалища близко расположены к мочевому пузырю и прямой кишке, рекомендуют проводить проктосигмоидоскопию, т. к. ректосигмоидный отдел толстой кишки также может сообщаться со свищом.
Пузырно-влагалищные свищи, индуцированные ЛТ, труднее поддаются лечению, чем необлученные. Первичное осложнение связано с уменьшением кровоснабжения облученных тканей. Поэтому при лечении часто используют необлученную ткань с хорошим кровоснабжением для закрытия свища. Для закрытия пузырно-влагалищного свища при трансабдоминальном, трансвезикальном доступах может быть использован сальник с его хорошим кровоснабжением, причем его часто помещают ближе к мочевому пузырю и влагалищу.
При закрытии пузырно-влагалищного свища через влагалищный доступ возможно комбинированное использование кольпоклейзиса (хирургического закрытия влагалища) и жировой клетчатки половых губ и мышцы, которые мобилизуются и вклиниваются между мочевым пузырем и влагалищем. При повреждении мочеточника после ЛТ может потребоваться реимплантация дистального отдела мочеточника в мочевой пузырь (уретероцистонеостомия) или постоянное отведение мочи.
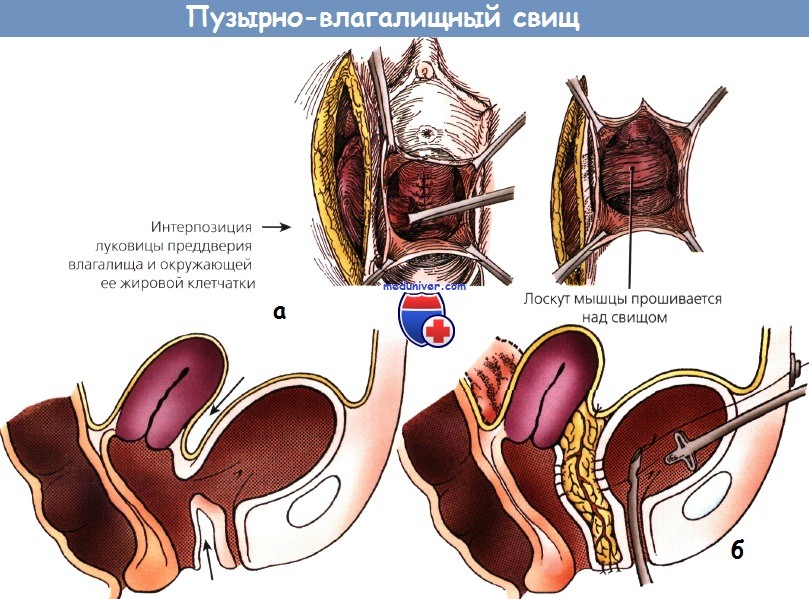
а - пузырно-влагалищный свищ закрывают, используя жировую клетчатку, окружающую луковицу преддверия влагалища.
б - в качестве источника неоваскуляризации используется J-образный лоскут сальника 
На поперечном разрезе закрытие пузырно-влагалищного свища с использованием жировой клетчатки,
окружающей луковицу преддверия влагалища, в качестве источника неоваскуляризации

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
- Код по МКБ-10
- Причины
- Лечение
- К кому обратиться?
Особенно тяжёлое осложнение лучевой терапии злокачественных опухолей таза - постлучевые свищи, составляющие около 8% всех мочеполовых свищей. Свищи после лучевой терапии формируются у 1-5% больных, перенёсших лучевую терапию.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Код по МКБ-10
Причины свищей после лучевой терапии (постлучевых свищей)
Частота образования свищей возрастает при проведении повторных курсов лучевой терапии. В этиологии пострадиационных урологических осложнений играет роль как поражение влагалищного и надчревного сплетения, так и наличие сосудистых заболеваний. Например, у больных с сахарным диабетом и гипертонической болезнью развиваются более тяжёлые пострадиационные осложнения. Несмотря на создание современной аппаратуры для проведения лучевой терапии, количество больных с различными пострадиациоными осложнениями, в том числе и постлучевыми мочеполовыми свищами, остаётся значительным. Оперативное вмешательство также способствует нарушению трофики мочеполовых органов.
Так при комбинированном лечении рака шейки матки риск образования мочеполовых свищей увеличивается в четыре раза. Подобные осложнения обычно возникают в поздние сроки после завершения курса лучевой терапии (в среднем - через два года), поскольку трофические изменения, приводящие к формированию фистулы. прогрессируют медленно.
Однако в литературе есть сообщения о формировании свища через 28 лет после окончания лучевой терапии и даже через 38 лет после завершения облучения. Столь длительный период с момента облучения до формирования свища позволяет дифференцировать лучевые мочеполовые свищи от первичных опухолевых свищей, возникающих непосредственно после разрушения опухоли. Это свидетельствует об участии трофических нарушений в формировании пострадиационных мочеполовых свищей.

[11], [12], [13], [14], [15], [16], [17], [18]
К кому обратиться?
Лечение свищей после лучевой терапии (постлучевых свищей)
Оперативную коррекцию осуществляют после стабилизации общего состояния больных и приобретения тканями в зоне фистулы пластических свойств. При этом исчезает воспаление, отторгаются некротические участки и размягчаются рубцы. Постлучевые свищи оперируют в среднем через 7 мес после окончания лучевой терапии или возникновения рецидива.
Типовыми методами закрыть постлучевые фистулы трудно, хирург должен творчески подойти к разработке хода операции. Нередко больных оперируют многократно. Разумеется, закрыть рецидивный свищ с каждым разом всё труднее, так как после предыдущих операций рубцы в окружающих тканях становятся обширными и более плотными, вследствие чего ухудшается кровоснабжение тканей. Повторные операции приводят не столько к восстановлению произвольного мочеиспускания, сколько к последовательному уменьшению ёмкости мочевого пузыря, которая и без того снижена у половины больных.
С целью улучшения трофики тканей и замещения обширных дефектов при пострадиационных свищах в основу большинства методов положено использование лоскута на ножке, выкроенного из необлучённых тканей. S.R. Kovac и соавт. (2007) считают, что фистулопластика с использованием тканевых прокладок - главный способ оперативного лечения постлучевых мочеполовых свищей. В настоящее время для закрытия пострадиационных мочеполовых фистул многие авторы рекомендуют использовать лоскут Мартиуса.
Кроме того, при оперативном лечении постлучевых свищей в качестве прокладок используют от m. gracilis, m. rectus abdominis, брюшину и сальник.
Для лечения постлучевых пузырно-влагалишных свищей предложено использовать модификацию операции Лацко. Суть предложенной методики состоит в том, что после максимально широкой мобилизации тканей влагалища и мочевого пузыря в зоне свища края последнего не иссекают. На дефект стенки мочевого пузыря накладывают вворачивающиеся швы из синтетических рассасывающихся материалов.
В отдельных наблюдениях, при значительном снижении ёмкости мочевого пузыря и вовлечении в процесс тазовых отделов мочеточников, восстановление произвольного мочеиспускания естественным путем осуществляют с помощью кишечных трансплантатов. Однако, если емкость мочевого пузыря безвозвратно утеряна либо имеются обширные дефекты дна мочевого пузыря и отсутствует мочеиспускательный канал, возникает вопрос о пересадке мочеточников в кишечник на протяжении или суправезикальном отведении мочи с формированием резервуаров Брикера. Mainz-Pouch и их различных модификаций, что обеспечивает нормальную функциональную сохранность почек.
Несмотря на соблюдение всех правил и принципов оперативных вмешательств, совершенствование оперативной техники и создание шовных материалов с улучшенными свойствами, эффективность операций при постлучевых мочеполовых свищах остаётся невысокой. Частота развития рецидивов в различных клиниках составляет от 15 до 70%. Так. в одном из опытов оперативного лечения 182 больных с постлучевыми пуэырно-влагалищными свищами произвольное мочеиспускание удалось восстановить у 146 пациентов (80%). Высокая частота рецидивов побуждает к разработке и усовершенствованию оперативных методов лечения больных с постлучевыми мочеполовыми свищами.
-
Вход Регистрация
- Главная →
- Новости и статьи по стоматологии →
- Хирургия →
- Клинический случай радионекроза челюсти и периимплантита после лучевой терапии
Остеорадинекроз (ОРН) нижней челюсти является серьезным осложнением, которое может возникнуть у пациентов после курса радиотерапии в ходе комплексного лечения новообразований области головы и шеи. Предрасполагающими факторами при этом остаются доза облучения, локализация опухоли, травма зубов в анамнезе и компрометированное состояние стоматологического статуса.
Чаще всего именно у пациентов возрастной категории 50+ регистрируются новообразования головы и шеи и, как правило, у большинства пациентов в этом возрасте имеются дентальные имплантаты, которые играют роль опорных элементов под ортопедические конструкции. Результаты дентальной имплантации, как и состояние периимплантантных тканей, являются некими составляющими элементами в структуре этио-патофизиологического процесса возникновения радионекроза челюстей после проведённой радиотерапии.
Имеющиеся на сегодня исследования по большей мере сконцентрированы на изучении перспектив дентальных имплантатов, установленных до процедуры терапевтического облучения, или же на определении прогноза таких конструкций после такого ятрогенного вмешательства. Но вопрос эффекта радиотерапии на полностью остеоинтегрированный имплантат по-прежнему остается дискуссионным и открытым, поэтому данная статья посвящена описанию изменений периимплантатных структур после терапевтического облучения на примере конкретного клинического случая.
Клинический случай
66-летний пациент был направлен в нашу больницу для дальнейшего лечения ОРН нижней челюсти. 7 лет назад ему проводилась установка титановых инстраосcальных конструкций на месте отсутствующих 35, 36, 45 и 47 зубов. При этом в ходе определенного времени все установленные имплантаты удачно остеоинтегрировались, что было подтверждено в ходе численных повторных контрольных визитов.
Через некоторое время у него диагностировали левостороннюю ротоглоточную карциному, лечение которой проводили посредством лучевой терапии с общей дозой 70 Гр через 2 года после имплантационного вмешательства. В ходе анализа медицинской документации было обнаружено, что левая челюсть была включена в зону терапевтического облучения.
Через 4 года после радиотерапии пациент начал испытывать болевые ощущения в области имплантатов, установленных с левой стороны, в том же участке у него наблюдалось значительное воспаление и отечность десен. После постановки диагноза периимплантита ему было проведено консервативное лечение, состоящее из местной ирригации области поражения и периодического приема антибиотиков на протяжении 6 месяцев. Однако симптомы поражения только усиливались, и он был направлен в нашу больницу для проведения дальнейшего лечения патологии.
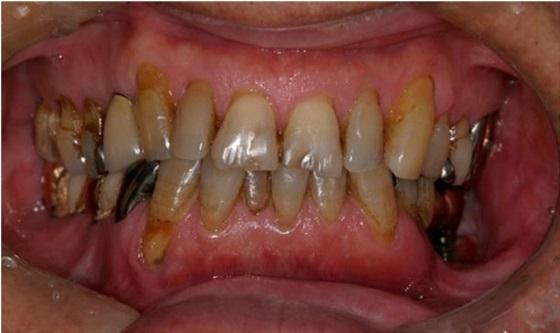
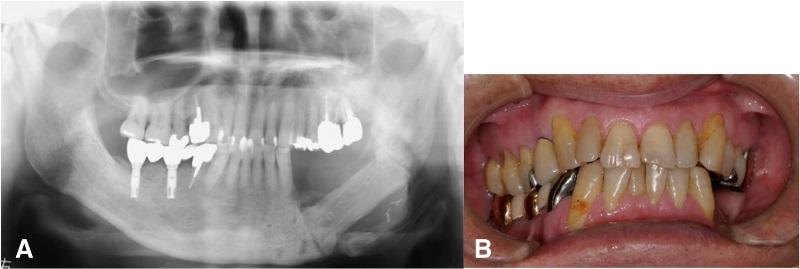
В ходе клинического исследования у пациента был обнаружен болезненный отек левой щеки и гипестезия нижней губы с левой стороны, при этом возможность открытия рта была ограничена до ширины полтора пальца, а вокруг дентальных имплантатов с левой стороны наблюдался некроз альвеолярной кости, воспаление слизистой и периодическое гноеотделение (фото 1).
Фото 1. Клиническая ситуация до лечения.
На ортопантомограмме контурировалась слабо демаркационная зона деструкции костной ткани в области имплантатов на месте 35 и 36 зубов, при этом поражение достигало нижнего края челюсти, что в результате спровоцировало возникновение патологического перелома. Вокруг имплантатов с правой стороны челюсти никаких патологических поражений отмечено не было (фото 2). С помощью КТ-сканирования удалось подтвердить деструкцию нижней челюсти слева и наличие линии перелома через всю толщу костной ткани (фото 3).
Фото 2. Ортопантомограмма пациента до лечения.
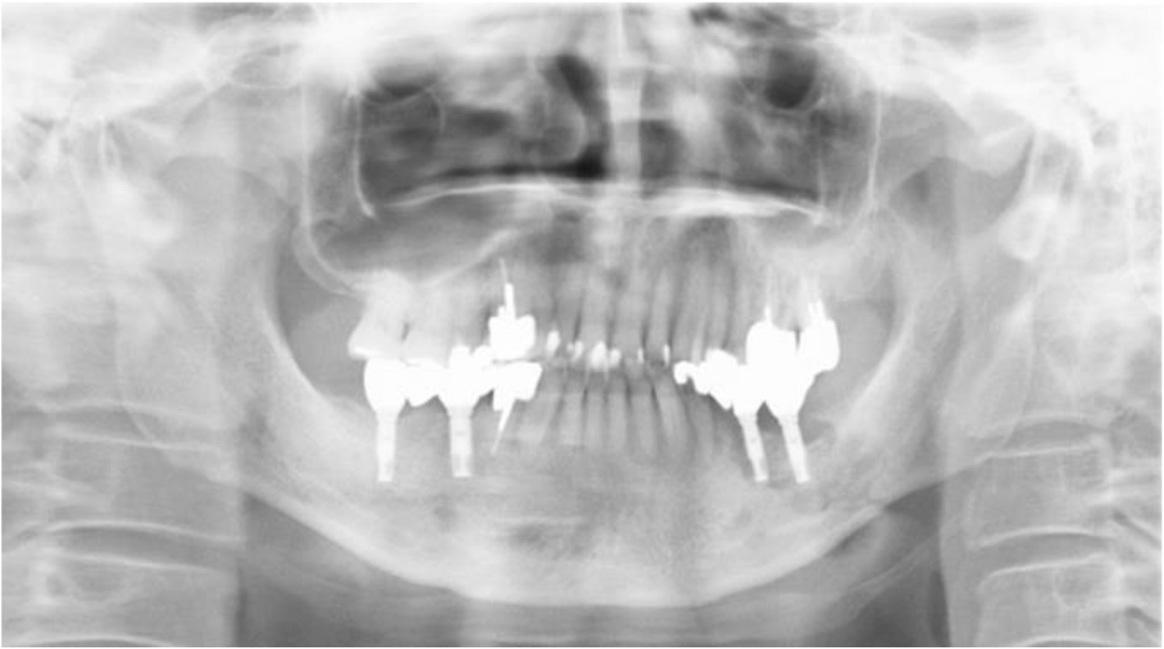
Фото 3. КТ-изображения нижней челюсти с левой стороны: а) аксиальный срез в области левого первого моляра; b) корональный срез в области левого первого моляра.
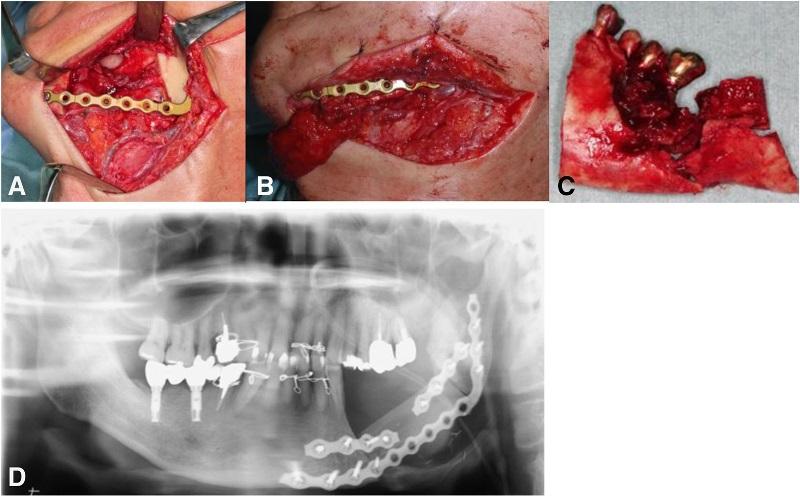
На первом этапе лечения пациент прошел курс 30 сеансов гипербарической кислородной терапии, что позволило лишь незначительно улучшить имеющиеся симптомы поражения. Учитывая, что на рентгенологических снимках не было замечено никакого прогрессирования области деструкции, была проведения частичная резекция области нижней челюсти с последующим восстановлением дефектного участка посредством свободного микроваскулярного лоскута из малоберцовой кости. Фиксация трансплантата проводилась с использованием титановой пластины (фото 4).
Фото 4: а) Сегментированная резекция пораженного участка нижней челюсти; b) локализированный костный трансплантат из области малоберцовой кости; c) резецированная нижняя челюсть; d) ортопантомограмма после операции.
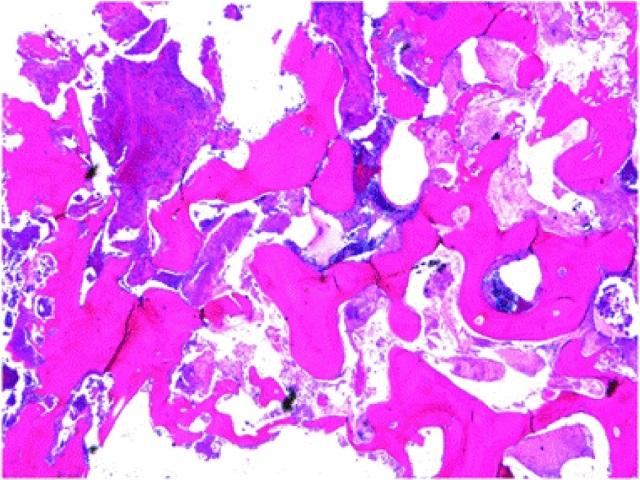
В ходе гистопатологического исследования резецированного участка нижней челюсти было обнаружено потерю остеоцитов и остеобластов в структуре ткани и заполнение костных полостей грибковой массой, а также инфильтрацию области поражения воспалительными клетками с присутствующими признаками фиброза в кости (фото 5).
Фото 5. Гистологический вид резецированного участка нижней челюсти (окраска гематоксилин-эозином).
В качестве окончательного был поставлен диагноз остеорадионекроз. В ходе послеоперационного наблюдения никаких дополнительных поражений в области других имплантатов замечено не было, признаки остеорадионекроза челюсти не рецидивировали, резидуальная часть тканей оставалась интактной (фото 6).
Фото 6. a) Ортопантомограмма через год после хирургического вмешательства; b) вид полости рта через 1 год после хирургического вмешательства.
Обсуждение
В данной статье проанализирован клинический случай возникновения ОРН нижней челюсти вокруг дентальных имплантатов, установленных до начала проведения лучевой терапии у пациента.
По нашим наблюдениям, это уже третий подобный случай, описанный в литературе. Granström и коллеги сообщали о трех случаях развития ОРН вокруг дентальных имплантатов, помещенных до радиотерапии для поддержки транскожного протеза. В свою очередь Slama также сообщил о случае ОРН нижней челюсти в области имплантатов после терапевтического облучения. Исходя их этого, можно предположить, что наличие имплантата играет некую роль в развитии ОРН у пациента после радиотерапии.
В нашем клиническом случае у пациента имплантаты были установлены с обеих сторон нижней челюсти, но ОРН был зарегистрирован лишь с левой стороны, что связано с целевой областью облучения левосторонней карциномы ротоглотки. Наличие дентального имплантата может повлиять на развитие ОРН посредством сразу двух механизмов. Во-первых, наличие имплантата может спровоцировать изменения в распределении дозы облучения вокруг титановой инфраконструкции, поскольку и раннее было известно, что имплантаты сами по себе инициируют разброс лучевой и электромагнитной энергии, чем провоцируют изменения твёрдых и мягких периимплантатных тканей, при чем Friedrich уже раньше сообщал о подобном биологическом эффекте.
Ozen и коллеги, исследуя повышение дозы от рассеянного излучения на границе раздела фаз костной ткани и дентального имплантата, пришли к выводу, что увеличение радиационной дозы, действующей на альвеолярную кость происходит непосредственно вблизи титанового винта, и может достигать повышения на целых 21%. На расстоянии уже 2 мм от титановой поверхности увеличение ионизирующей дозы было минимальным, при этом, очевидно, что увеличение радиационной локальной нагрузки на 15-21% может спровоцировать процесс остеонекроза нижней челюсти в периимплантатной области. При этом Beyzadeoglu сообщили, что изменение длины пучков облучения, как и угла их прохождения, значительно не влияет на суммарную дозу поражения, которая может спровоцировать остеонекроз.
Из вышеописанного можно сделать вывод, что область интерфейса имплантат-кость подвергается повышенному облучению в результате эффекта рассеивания радиационного потока посредством самой титановой конструкции, которая может находится в поле терапевтического действия радиации.
Кроме того, причина ОРН может крыться в действии бактериальной инфекции, ассоциированной с имплантатом. Часто вокруг фиксированных металлокерамических конструкций, как и вокруг конструкций с опорой на имплантаты, наблюдаются области гингивита, что, в свою очередь, провоцирует удушение состояния гигиены полости рта, а это вызывает дальнейшую повышенную бактериальную контаминацию периимплантатного участка.
Лучевая терапия посредством воздействия на сосуды, фибробласты и различные регуляторные факторы роста провоцирует нарушение процесса физиологического заживления ран, а также вызывает развития специфического состояния – иммунодефицита. Все это, в свою очередь, снижает уровень резистентности периимплантатных тканей относительно бактериальных агентов полости рта, тем самым увеличивая риск развития периимплантита. Slama и коллеги сообщали о случаях наличия периимплантита до начала развития ОРН, и в нашей ситуации периимплантит прогрессировал вплоть до ОРН. Хорошо известно, что защитная функция окружающих тканей намного слабее вокруг имплантатов, чем вокруг естественных зубов, поэтому вполне вероятно, что периимплантатный мукозит, вызванный лучевой терапией, может легко прогрессировать, переходя в агрессивный периимплантит, и последующее более тяжелое инфекционное поражение костей челюсти.
Выводы
В последнее время дентальные имплантаты стали популярной опцией лечения пациентов с симптомами частичной или полной адентии. Как следствие, число пациентов, проходящих через курс радиотерапии и имеющих дентальные имплантаты, также прогрессивно увеличивается. Для детального анализа эффекта облучения на прогноз дентального имплантата необходимо проведение более прецизионных и выборочных исследований, которые помогут сделать однозначные выводы по этому поводу.
Авторы: Yuji TeramotoEmail author, Hiroshi Kurita, Takahiro Kamata, Hitoshi Aizawa, Nobuhiko Yoshimura, Humihiro Nishimaki, Kazunobu Takamizawa
Как лечат остеомиелит челюсти – и что нужно знать, чтобы не допустить развития этого заболевания
Своевременное и адекватное лечение не только возвращает здоровье человеку, но и уберегает от последствий, которые могут быть очень тяжелыми. К таким осложнениям относится остеомиелит челюсти – опаснейшая болезнь, характеризующаяся разрушением челюстных костей. В сегодняшнем материале речь пойдет о том, что это такое – остеомиелит челюсти (верхней или нижней), чем он опасен, и как его лечить.
Что такое остеомиелит? Остеомиелит челюсти – это патология, характеризующаяся гнойно-воспалительными и некротическими процессами (отмирания тканей) в костном веществе челюсти. Близость зубов, десен, лицевых мышц, челюстных суставов и других важных органов лица/головы относит остеомиелит 1 в разряд крайне опасных патологий, требующих тщательного лечения. Как выглядит остеомиелит челюсти, можно узнать при рассмотрении нижеприведенного фотоснимка.
Особую опасность представляет как появление гноя (который может распространиться на окружающие области), так и необратимые некротические процессы (иногда кость приходится даже удалять).
Согласно МКБ-10 (Международной классификации болезней, разработанной Ассамблеей ВОЗ 2 ), остеомиелит челюсти имеет коды с М86.0 по М86.9 (в зависимости от типа заболевания).

В основе заболевания всегда лежит инфекция. Чаще всего оно возникает при попадании в кость стрептококков и стафилококков, сальмонеллы, брюшнотифозных палочек. Реже – синегнойной палочки, грибков, возбудителей туберкулеза. Причем, чем слабее иммунитет и снабжение тканей челюстной системы кислородом, полезными веществами, тем выше шанс инфицирования.
Патогенная микрофлора обычно проникает в кость тремя путями – через больной зуб, через кровоток, через травму лица или кости. Кстати, один из способов классификации остеомиелита челюсти основывается именно на причинах – поэтому подробнее рассмотрим их в следующем разделе.
Различают как минимум 9 различных подвидов заболевания, каждый из которых может одновременно относиться к разным группам. Например, диффузный хронический гематогенный остеомиелит челюсти – чтобы понять, что это означает, предлагаем ознакомиться с дальнейшей классификацией.
- очаговый: болезнь затрагивает небольшой участок, протяженностью примерно 1-3 зуба,
- диффузный: воспаление распространяется на большие костные участки, куда вовлечены сегменты зубов (вплоть до целого ряда) или челюстные суставы, лицевые кости.
Одонтогенный означает, что причина в больном зубе – это может быть как периодонтит (воспаление у корней), так и киста или гранулема. Причем, шансы появления остеомиелита челюстных костей возрастают в несколько раз, если у пациента уже неоднократно случались рецидивы периодонтита хронического типа.

Интересный факт! Чаще всего одонтогенный остеомиелит бывает у людей в возрасте 20-40 лет – и у мужчин патологию диагностируют в 2 раза чаще, чем у женщин.
Также одонтогенный остеомиелит челюсти может возникнуть после удаления зуба – особенно после удаления зуба мудрости. Здесь гнойно-некротический процесс начинается при попадании в лунку удаленного зуба микробов – с инструмента стоматолога или при несоблюдении правил гигиены пациентом. Также в лунке может остаться кусочек больного корня – в котором есть кариес, или же вокруг имеется гранулема или киста.
Причиной появления травматического поражения челюстных костей становится какое-либо механическое воздействие:
- падения и удары головой,
- неудобные протезы или завышенные коронки, пломбы: здесь сначала начинается периодонтит, который при отсутствии лечения вызывает воспаление костной ткани,
- огнестрельные ранения в область лица,
- последствия челюстно-лицевых операций,
- последствия неудачной операции по наращиванию кости: обычно такую процедуру проводят перед двухэтапной имплантацией зубов, хотя многие клиники отказались от наращивания из-за его низкой эффективности.

Гематогенный остеомиелит челюсти означает, что инфекция проникла в челюстную кость через кровеносную систему из какого-либо инфекционного очага в организме. Например, во время тяжелой болезни – гриппа, менингита или скарлатины, хронического тонзиллита или урогенитальной инфекции. Болезнь начинается внезапно и развивается быстро.
Чаще всего гематогенный тип диагностируют у детей (в 75% случаев), причем у мальчиков в 3-5 раз чаще, чем у девочек. У новорожденных воспалению челюстных костей предшествует инфицирование пупочной ранки или кожи.

Еще один способ классификации остеомиелита челюсти основывается на стадиях, через которые протекает заболевание в процессе своего развития – это острая, подострая и хроническая. Рассмотрим их подробнее, а также остановимся на симптомах.

Острый остеомиелит челюсти в первые 2-3 дня заболевания имеет смазанную симптоматику, поэтому могут возникнуть сложности с диагностикой. Человек чувствует общую слабость, теряет аппетит, поднимается температура до 39-40 градусов Цельсия, возникает озноб, увеличиваются лимфоузлы. За это же время постепенно появляются, а затем стремительно нарастают болевые ощущения в голове и в области челюстной кости, которые могут отдаваться в висок, в глазницу.
На 2-3 день острой стадии десны становятся отекшими, нарастает боль. А на 3-4 день из-под десны в области концентрации боли появляются гнойные выделения (при надавливании). Еще спустя несколько дней отек распространяется на жевательные мышцы, возникают сложности с открыванием и закрыванием рта. Структурные изменения в костном веществе становятся видны на рентгене только спустя 10-14 дней после начала болезни. Анализы показывают повышенное количество лейкоцитов и СОЭ, снижение гемоглобина.
Важно! При остром диффузном воспалении (в зависимости от его места положения) может неметь подбородок, теряться чувствительность мышц, возникать острый гайморит, абсцессы и флегмоны.
В упрощенном понимании подострая стадия – это продолжение острой, и наступает она примерно через 10-12 дней после начала болезни. Здесь наблюдается угасание сильной боли, состояние больного улучшается, анализы нормализуются. Но появляется заметная шаткость зубов, особенно в непосредственной близи к патологическому очагу, а на деснах образуются свищи. На рентгене определяются нечеткие очаги разрушения костного массива.

Хроническая стадия начинается после подострой (примерно через 2 недели) и может длиться от нескольких недель до нескольких лет. Состояние человека нормальное, нет жалоб на боль. Но это при условии, что патология находится в ремиссии – причем шаткие зубы могут даже немного укрепиться, десны менее отечны, чем при острой и подострой стадии (однако приобретают синюшный оттенок из-за некротических процессов под ними).
На заметку! Именно в хронической стадии начинаются процессы образования секвестров – омертвления челюстной кости, могут выпадать зубы над патологическим очагом.

Если же хронический остеомиелит челюсти находится в стадии обострения, то снова возвращается боль, хотя и не такая сильная как при острой стадии в самом начале болезни. Возникают дополнительные свищевые ходы, через которые из кости эвакуируется гной. Причем, если свищевой ход закрывается, то гнойные массы остаются внутри кости – и это негативный признак. Общее состояние человека ухудшается, опять возрастает температура, анализы свидетельствуют о сильном воспалительном процессе. Визуально меняется лицо из-за отека, абсцесса или флегмоны.
Данная форма еще называется альбуминозной и отличается от остальных отсутствием гноя, вместо которого образуется серозный экссудат (жидкость) или слизь, насыщенные белком. Диагностика редко бывает информативна, обычно диагноз ставится в ходе хирургической операции, когда обнаруживаются протяженные отслоения надкостницы от альвеолярного отростка. В целом, заболевание отличается слабой симптоматикой, обширные воспаления и отеки отсутствуют.

Разновидность гематогенного остеомиелита (чаще встречается у подростков, и локализуется обычно в костях ног, а не лица). Особенностью абсцесса Броди считают ограниченное омертвение губчатой кости с последующим ее расплавлением – в итоге в этом месте образуется костная полость. Патология характеризуется вялой симптоматикой, т.к. боль и отек довольно слабы.
Склерозирующая форма патологии, характеризующаяся уплотнением костного вещества. Провоцирует его появление золотистый стафилококк, проникающий в кость после травм (внезапных или регулярных), сильных переохлаждений. Выявить заболевание помогает рентген-диагностика – на снимке хорошо определяются участки уплотнения костного вещества и патологические полости.

Одна из редчайших форм, встречающаяся чаще всего у детей примерно 10-летнего возраста. Патология имеет неясное происхождение, но эксперты склоняются к тому, что ее вызывают травмы (даже незначительные). Особенность в том, что над пораженными участками кости находятся припухлости и множественные очаги болезненности.
У детей течение остеомиелита челюсти чаще всего происходит стремительно. За очень короткое время (буквально – за часы) появляются следующие симптомы:
- общая вялость и бледность кожи,
- скачок температуры до 39-40 градусов Цельсия,
- жалобы на боль в зубе или голове,
- отказ от пищи,
- сонливость,
- болезненность при жевании.

При распространении токсинов по организму, появляется рвота, спутанность сознания, судороги. Поэтому при первых симптомах нужно как можно скорее обращаться за профессиональной медицинской помощью и не заниматься самолечением.
Asya93, отзыв с форума woman.ru

Также пациента нередко направляют на ультразвуковую диагностику (УЗИ) для оценки состояния лицевых мышц, кровотока, прилежащих лимфатических узлов.
Задумываясь о том, чем лечить патологию, нужно знать, что лечение остеомиелита челюсти всегда комплексное и проводится в условиях стационара. Для снятия воспаления пациенту прописывается курс антибиотиков. Причем иногда даже сразу нескольких – например, цефуроксим детям, взрослым – гентамицин + оксациллин, а после основного курса – офлоксацин.
Такой курс лечения длится 4-6 недель (при острой форме) и более – при хроническом течении болезни. Также назначаются общеукрепляющие и иммуномодулирующие препараты для ускорения реабилитации. При угрозе сепсиса необходимы меры, направленные на очищение крови пациента от токсинов и инфекции – например, переливание плазмы.

Вылечить патологию только лишь медикаментозно нельзя – обязательно требуется хирургическое вмешательство для удаления причинных зубов, вскрытия гнойных очагов (ставится дренажная трубка для оттока жидкости) и/или отсечении отмершей кости (секвестрэктомия). После чего в прооперированную область подсаживается костная крошка – если очаг был небольшим, либо массивный костный блок, накладываются специальные мембраны для регенерации. Здоровые, но подвижные из-за болезни, зубы шинируют стекловолокном или металлической нитью.
На заметку! В целом, при своевременном обращении к стоматологу, прогноз лечения благоприятный. Однако возвращение к привычной жизни может занять несколько месяцев, т.к. кость восстанавливается долго и могут возникнуть трудности с открыванием/закрыванием рта.
В качестве дополнительных мер для ускорения выздоровления пациенту предлагают физиотерапию – УВЧ, УФО, электрофорез, магнитотерапию. Как разрабатывать челюсть после остеомиелита, тоже расскажет лечащий врач. Для этого чаще всего назначается массаж, пережевывание жевательных резинок. В среднем период восстановления занимает до 3-х лет, но тут все индивидуально.

Также пациентам, которым удаляли зубы, нужно решать вопрос о протезировании. На период реабилитации показано ношение съемных протезов, а после полного восстановления можно провести ортодонтическую коррекцию брекетами или поставить импланты. Для сложных случаев показана базальная и скуловая методика имплантации.

Последствия отказа от лечения, равно как и неполноценное лечение патологии или прерывание курса антибиотиков, могут привести к очень опасным последствиям, о которых обязательно следует знать. Список осложнений остеомиелита челюсти выглядит следующим образом:
В целях профилактики важно тщательно проводить гигиену полости рта, вовремя лечить – причем не только зубы (кариес, пульпит), но и любые другие инфекционные патологии организма. А после выздоровления не забывайте про укрепление иммунитета – полноценно питайтесь и больше времени проводите на свежем воздухе.
Также следует избегать травм лица, а при их появлении своевременно обращаться за медицинской помощью. Особое внимание нужно уделить детям во время смены прикуса (в возрасте 5-12 лет) – ведь воспаление кости может повредить формирующийся зачаток постоянного зуба.
- Харьков Л.В., Яковенко Л.Н., Чехова И.Л., Хирургическая стоматология и челюстно-лицевая хирургия детского возраста, 2005 г.
- Всемирная организация здравоохранения.
Здравтсвуйте! У меня сынок несколько дней назад укусил пуговицу на кофте, а теперб плачет постоянно и кушает плохо. Что делать, вдруг это остеомиелит, а то так страшно про него написано? лучше сходить к зубному или к детской врачу?
Здравствуйте, Ирина. Конечно, обратиться к врачу нужно не откладывая, но что касается остеомиелита, то это спорный диагноз. Поскольку данная патология обычно развивается 2-3 недели. Возможно, что вашего сына травма периодонта или пульпит, но может быть и перелом корня зуба. Однако, в любом случае, у детей болезни протекают стремительно, поэтому сейчас важно поставить верный диагноз и принять адекватные меры.
Читайте также:


