Антиретровирусные препараты в целях профилактики вич
Постконтактная профилактика (ПКП) ВИЧ-инфекции подразумевает максимально скорый прием антиретровирусной терапии после ситуации, предполагающей риск инфицирования ВИЧ.
Решение о целесообразности назначения препаратов для постконтактной профилактики, а также какие именно препараты для этого использовать, может принимать только врач.

Фонд развития межсекторного социального партнерства, Москва, 2017.

Выделяют ПКП двух видов:
- Профессиональная: контакт работников здравоохранения с ВИЧ-содержащим материалом, подразумевающий риск инфицирования.
- Не связанная с профессией ПКП: случаи сексуального насилия, незащищенный секс, использование общего шприца при применении инъекционных наркотических средств и т.д.
СанПиН указывает на необходимость начать прием антиретровирусных препаратов должен быть начат в течение первых двух часов после ситуации, связанной с риском, но не позднее 72 часов.
Данный СанПиН рассматривает в качестве стандартной схемы постконтактной профилактики заражения ВИЧ лопинавир/ритонавир (Калетра) + зидовудин/ламивудин (Комбивир и другие комбинированные препараты с таким составом). Несмотря не то, что зидовудин нельзя назвать современным препаратом, в разрезе целей ПКП данный режим вполне можно считать применимым в 2017 году.
Однако, далее текст СанПиНа в п.8.3.3.3.2 допускает следующее:
При отсутствии данных препаратов для начала химиопрофилактики могут использоваться любые другие антиретровирусные препараты; если невозможно сразу назначить полноценную схему ВААРТ, начинается прием одного или двух имеющихся в наличии препаратов. Использование невирапина и абакавира возможно только при отсутствии других препаратов.
Важно понимать, что применение двух, а тем более одного АРВ-препарата для целей ПКП сегодня не может рассматриваться. Нет оснований полагать, что это эффективно, а главное – безопасно. Схема ПКП должна быть полноценной, содержащей три препарата, два из которых относятся к разным классам. Абсолютно неприемлемо использовать абакавир без данных о результатах типирования на аллель HLA-B*5701, которое позволяет прогнозировать потенциально опасной для жизни риски развития реакции гиперчувствительности на данный препарат. Использование невирапина также не стоит рассматривать для целей ПКП из-за относительно высоких рисков нежелательных реакций со стороны печени.
Рекомендации ВОЗ (декабрь 2014) предполагают следующие режимы ПКП у взрослых и подростков:
Упоминаемые ниже рекомендации CDC относятся ко второй группе ПКП – не связанных с профессией рисков.
- До начала постконтактной профилактики следует установить ВИЧ-статус человека, в отношении которого планируется ПКП, предпочтительно для этих целей использовать лабораторные тесты четвертого поколения.
- Не связанная с профессией ПКП рекомендуется, если достоверно известно, что потенциальный источник является ВИЧ-инфицированным.
- Для достижения максимальной эффективности ПКП должна быть начата в течение 72 часов после риска. После истечения 72 часов от потенциального риска ПКП не рекомендуется.
- ПКП предполагает прием трех антиретровирусных средств в течение 28 дней.
- Предпочтительным режимом для взрослых и подростков является следующий режим: [тенофовир (300 мг) + эмтрицитабин (200 мг) один раз в день] + ралтегравир (400 мг дважды в день) или долутегравир (50 мг один раз в день).
- Альтернативным режимом для взрослых и подростков является: [тенофовир (300 мг) + эмтрицитабин (200 мг) один раз в день] + [дарунавир (800 мг) + ритонавир (100 мг) – один раз в день].
Руководство предусматривает режимы для детей, беременных и лиц с нарушениями функции почек (см. Table 6, p. 33).
Следует учитывать, что оптимальная продолжительность ПКП неизвестна. ПКП является безопасной для жизни, однако, ПКП может в ряде случаев вызывать побочные эффекты, в том числе выраженные. ПКП назначается специалистом в области здравоохранения на основании объективных данных о контакте с ВИЧ с учетом эпидемиологических данных о рисках. ПКП не является 100% эффективной и не дает гарантии предупреждения развития ВИЧ-инфекции.
8.3.3.2. Необходимо в возможно короткие сроки после контакта обследовать на ВИЧ и вирусные гепатиты В и С лицо, которое может являться потенциальным источником заражения и контактировавшее с ним лицо. Обследование на ВИЧ потенциального источника ВИЧ-инфекции и контактировавшего лица проводят методом экспресс-тестирования на антитела к ВИЧ после аварийной ситуации с обязательным направлением образца из той же порции крови для стандартного тестирования на ВИЧ в ИФА. Образцы плазмы (или сыворотки) крови человека, являющегося потенциальным источником заражения, и контактного лица, передают для хранения в течение 12 месяцев в центр СПИД субъекта Российской Федерации.
Пострадавшего и лицо, которое может являться потенциальным источником заражения, необходимо опросить о носительстве вирусных гепатитов, ИППП, воспалительных заболеваний мочеполовой сферы, других заболеваний, провести консультирование относительно менее рискованного поведения. Если источник инфицирован ВИЧ, выясняют, получал ли он антиретровирусную терапию. Если пострадавшая – женщина, необходимо провести тест на беременность и выяснить, не кормит ли она грудью ребенка. При отсутствии уточняющих данных постконтактную профилактику начинают немедленно, при появлении дополнительной информации схема корректируется.
8.3.3.3. Проведение постконтактной профилактики заражения ВИЧ антиретровирусными препаратами:
8.3.3.3.1. Прием антиретровирусных препаратов должен быть начат в течение первых двух часов после аварии, но не позднее 72 часов.
8.3.3.3.2. Стандартная схема постконтактной профилактики заражения ВИЧ – лопинавир/ритонавир + зидовудин/ламивудин. При отсутствии данных препаратов для начала химиопрофилактики могут использоваться любые другие антиретровирусные препараты; если невозможно сразу назначить полноценную схему ВААРТ, начинается прием одного или двух имеющихся в наличии препаратов. Использование невирапина и абакавира возможно только при отсутствии других препаратов. Если единственным из имеющихся препаратов является невирапин, должна быть назначена только одна доза препарата – 0,2 г (повторный его прием недопустим), затем при поступлении других препаратов назначается полноценная химиопрофилактика. Если химиопрофилактика начата с использованием абакавира, следует как можно быстрее провести исследование на реакцию гиперчувствительности к нему или провести замену абакавира на другой НИОТ.
8.3.3.3.3. Оформление аварийной ситуации проводится в соответствии с установленными требованиями:
– сотрудники ЛПО должны незамедлительно сообщать о каждом аварийном случае руководителю подразделения, его заместителю или вышестоящему руководителю;
– травмы, полученные медработниками, должны учитываться в каждом ЛПО и актироваться как несчастный случай на производстве с составлением Акта о несчастном случае на производстве;
– следует заполнить Журнал регистрации несчастных случаев на производстве;
– необходимо провести эпидрасследование причины травмы и установить связь причины травмы с исполнением медработником служебных обязанностей;
8.3.3.3.4. Все ЛПО должны быть обеспечены или иметь при необходимости доступ к экспресс-тестам на ВИЧ и антиретровирусным препаратам. Запас антиретровирусных препаратов должен храниться в любом ЛПО по выбору органов управления здравоохранением субъектов Российской Федерации, но с таким расчетом, чтобы обследование и лечение могло быть организовано в течение 2 часов после аварийной ситуации. В уполномоченном ЛПО должен быть определен специалист, ответственный за хранение антиретровирусных препаратов, место их хранения с доступом, в том числе, в ночное время и выходные дни.
8.3.3.3.5. Перечень медикаментов, входящих в состав аварийной аптечки по ВИЧ-инфекции:
– 70 % спирт 2 флакона по 100 мл;
– 5% спиртовой раствор йода;
– стерильная дистиллированная вода (400 мл);
– нашатырный спирт;
– перевязочные средства (вата, бинты и пр.);
Постконтактная профилактика инфицирования ВИЧ при профессиональных контактах.
- Повреждение кожи (укол иглой или порез острым инструментом). При контакте с ВИЧ-инфицированной кровью (при уколе или порезе) риск заражения в среднем составляет около 0,3% .
- Попадание биологических жидкостей на слизистые оболочки или поврежденную кожу. Заболевания кожи и слизистых также повышают риск заражения ВИЧ при попадании на них инфицированного материала. Риск инфицирования при попадании ВИЧ-инфицированной крови на неповрежденные слизистые составляет примерно 0,09%.
Под профессиональным контактом понимают любой прямой контакт слизистых, подкожный или внутривенный контакт с потенциально инфицированными биологическими жидкостями, при исполнении профессиональных обязанностей (т.е. работников сферы здравоохранения и санитарии, лиц, обеспечивающих общественную безопасность и сотрудников лабораторных учреждений).
Постконтактная профилактика (ПКП) – представляет короткий курс антиретровирусных препаратов с целью снижения риска ВИЧ – инфекции после возможного инфицирования (произошедшего при исполнении служебных обязанностей или других обстоятельствах).
- Повреждение кожи острым предметом, загрязненным кровью, жидкостью с видимой примесью крови или другим потенциально инфицированным материалом, или иглой из вены больного.
- Укушенная рана, если укус сделал ВИЧ-инфицированным с заметным источником кровотечения во рту.
- Попадание крови, жидкости с видимой примесью крови или другого потенциально инфицированного материала на слизистые оболочки (рот, нос, глаза).
- Попадание крови, жидкости с видимой примесью крови или другого потенциально инфицированного материала на поврежденную кожу (например, при наличии дерматита, участков обветренной кожи, потертостей или открытой раны).
«…проводится при попадании большого количества крови или биологической жидкости на раневую поверхность или слизистые и состоит в приеме ретровира (зидовудина, азидотимидина – АЗТ) или его аналогов в дозе 200 мг каждые четыре часа в течение 3 дней, затем 200 мг каждые шесть часов в течение 25 дней.
Алгоритм оценки степени риска инфицирования ВИЧ
(CDC Antiretroviral postexposure prophylaxis after sexual, injection drug use, or other nonoccupational exposure to HIV in the United States):
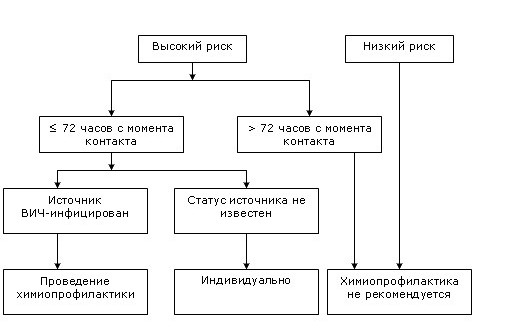
Контакт слизистой влагалища, прямой кишки, глаза, полости рта и других слизистых, повреждённой кожи или подкожный контакт с кровью, спермой, секретом влагалища и прямой кишки, грудным молоком или другими биологическими жидкостями, контаминированными видимыми включениями крови, если известно, что источник ВИЧ-инфицирован.
Контакт слизистой влагалища, прямой кишки, глаза, полости рта и других слизистых, повреждённой кожи или подкожный контакт с мочой, секретом слизистой полости носа, слюной, потом или слезами, не контаминированными видимыми включениями крови, при подозрении или если известно, что источник ВИЧ-инфицирован.
Профилактика передачи ВИЧ от матери ребенку (ПМР).
Частота ПМР составляет 20-40% при естественном течении инфекции. При использовании современных схем профилактики частота ПМР составляет менее 2%. В рамках программы профилактики ВИЧ/СПИДа в Беларуси поставлена задача снижения частоты вертикальной передачи ВИЧ до 2% и менее к 2010 году.
Схемы профилактики ПМР включают в себя компоненты:
| во время беременности |
|
| в родах |
|
| у новорожденного |
|
Медикаментозная профилактика у ВИЧ-позитивных беременных является основным мероприятием ПМР и имеет целью подавление репликации ВИЧ в организме женщины. При оптимальном подавлении репликации ВИЧ вирусная нагрузка у беременной в крови минимальна, что и обусловливает резкое снижение риска передачи ВИЧ ребенку, а также резкое снижение риска передачи ВИЧ при профессиональном контакте во время проведения акушером планового кесарева сечения.
Необходимая длительность медикаментозной профилактики для достижения оптимального подавления репликации ВИЧ – не менее 1-2 месяцев, поэтому рутинно рекомендуемый срок начала медикаментозной профилактики у беременной – с 28 недель гестации.
Необходимая эффективность медикаментозной профилактики достигается только при высокой приверженности беременной к приему препаратов (не более 5% пропущенных приемов от их общего числа). Беременную следует консультировать по приверженности к приему препаратов, как перед назначением медикаментозной профилактики, так и во время ее проведения при каждом визите к врачу.
А. ВИЧ-инфицированные беременные, при обследовании которых определено, что они не нуждаются в АРТ (1-2 клинические категории по классификации ВОЗ 2006 г. и СD4 >350 клеток/мкл)
А.1. При ВН А.2. При ВН >10 000 копий в мл, или если нет возможности определить ВН на фоне беременности, или если женщина ранее получала зидовудин
Схема: зидовудин 300 мг + ламивудин 150 мг + ингибитор протеазы внутрь 2 раза в сутки.
Сроки проведения: с 28 недель беременности (для беременных, впервые обследованных в более позднем гестационном сроке – с момента установления диагноза ВИЧ-инфекции) до родов и в родах, сразу после родов все три препарата одновременно отменяются.
В. ВИЧ-инфицированные беременные, при обследовании которых определено, что они нуждаются или могут нуждаться в АРТ (3-4 клинические категории по классификации ВОЗ 2006 г. или СD4 В.1. При СD4 В.2. При СD4 200-350 клеток/мкл:
Схема: зидовудин 300 мг + ламивудин 150 мг + ингибитор протеазы внутрь 2 раза в сутки. При анемии вместо зидовудина — абакавир 300 мг внутрь 2 раза в сутки.
Сроки проведения: с момента обследования и формулировки показаний к лечению до родов и в родах, после родов решение о продолжении АРТ принимается инфекционистом после повторной оценки клинических и иммунологических (СD4) данных.
С. ВИЧ-инфицированные беременные, которые начали получать АРТ еще до наступления беременности.
Продолжать текущую схему, если она не содержит ифавиренц или комбинацию ставудина и диданозина.
Если схема содержит ифавиренц: заменить ифавиренц на ингибитор протеазы или на абакавир; при СD4 D. Беременные, которые впервые обращаются за помощью к моменту родов: ВИЧ-инфицированные или с неизвестным ВИЧ-статусом (когда нет возможности провести экспресс-тест на ВИЧ).
- зидовудин 300 мг внутрь каждые 3 ч до рождения ребенка + ламивудин 150 мг внутрь в начале родов и затем каждые 12 ч до рождения ребенка + невирапин 200 мг внутрь однократно в начале родов;
- невирапин 200 мг внутрь однократно с началом родовой деятельности или за 4-6 часов до проведения родоразрешения методом кесарева сечения.
После родов: зидовудин 300 мг + ламивудин 150 мг внутрь 2 раза в сутки в течение 7 суток (чтобы предупредить риск развития резистентности к препаратам класса ННИОТ).
Медикаментозная профилактика у новорожденных
А. Новорожденные от матерей, которые во время беременности и родов получали медикаментозную профилактику, не включающую невирапин (зидовудин или зидовудин + ламивудин или зидовудин + ламивудин + ингибитор протеазы).
- зидовудин (сироп) 4 мг/кг внутрь 2 раза в сутки; или
- зидовудин (сироп) 4 мг/кг + ламивудин (раствор) 2 мг/кг внутрь 2 раза в сутки.
Сроки проведения: начать прием препаратов следует в первые 8 часов после рождения, длительность приема – в течение 4-6 недель.
В. Новорожденные от матерей, которые во время родов получали экстренную медикаментозную профилактику невирапином.
Схемы и сроки проведения:
- [зидовудин (сироп) 4 мг/кг + ламивудин (раствор) 2 мг/кг внутрь 2 раза в сутки] в течение 4-6 недель + невирапин (раствор) 2 мг/кг внутрь однократно; начать прием препаратов следует в течение 48-72 часов после рождения; или
- невирапин (раствор) 2 мг/кг внутрь однократно между 48 и 72 часам жизни; или
- невирапин (раствор) 2 мг/кг внутрь двукратно: первую дозу – сразу после рождения, вторую – через 72 часа.
История
Первая эффективная терапия против ВИЧ базировалась на нуклеозидном ингибиторе обратной транскриптазы (НИОТ) зидовудине (AZT). В 1987 году она была одобрена USFDA 3) . Впоследствии были разработаны несколько новых НИОТ, однако даже в случае комбинированного использования препаратов, они не могли подавлять вирус в течение долгого периода времени, и пациенты по-прежнему умирали. Для того чтобы дифференцировать понятия от ранней антиретровирусной терапии (АРТ), был введения термин высокоактивной антиретровирусной терапии (ВААРТ). В 1996 году в ходе последовательных публикаций в The New England Journal of Medicine, авторами которых выступили Хаммер и его коллеги, а также Гулик и другие исследователи, была продемонстрирована существенная польза комбинирования 2 НИОТ с новым классом антиретровирусных препаратов, а именно ингибиторами протеаз, таких как индинавир. Эта концепция терапии из 3 препаратов была быстро включена в клиническую практику, показав впечатлительное влияние на снижение на 60-80% темпов проявления СПИДа, смертности и госпитализации 4) .
Классы препаратов
Ингибиторы протеазы блокируют вирусный фермент протеазы, которые необходим для выработки зрелых вирионов в момент формирования принимающей мембраны. В частности, эти препараты предотвращают расщепление белков-предшественников gag и gag/pol. Вирусные частицы, вырабатываемые в присутствии ингибиторов протеазы, являются дефективными и, в основном, неинфекционными. Примерами ингибиторов протеазы ВИЧ являются Лопинавир, Индинавир, Нелфинавир, Ампренавир и Ритонавир. Дарунавир и атазанавир рекомендуются при терапии первой линии. Ингибиторы созревания имеют подобные эффекты за счёт связывания с gag, однако развитие двух двух экспериментальных препаратов этого класса Бевиримата и Вивекона в 2010 году было прекращено. Устойчивость к некоторым ингибиторам протеазы является высокой. Препараты второго поколения были разработаны, и они являются эффективными против устойчивых вариантов ВИЧ-инфекции.
Комбинированная терапия
Рекомендации по лечению
В развитых странах (то есть в странах с доступом ко всем или почти всем методам лечения и лабораторным тестированиям) существует несколько руководящих указаний для заражённых ВИЧ-1 взрослых людей. В США существуют как руководящие указания Международного общества СПИДА (IAS-USA), так и Министерства здравоохранения и социальных служб США. В Европе существуют руководящие указания европейского Клинического Общества СПИДа. Для ограниченных ресурсах стран, большинство руководящих указаний сходится с указаниями Всемирной Организации Здравоохранения 14) .
Текущие руководящие указания используют новые критерии для начала ВААРТ. Тем не менее, остаются различные мнения по этому вопросу, и решение о начале лечение ложится на пациента и врача. Текущие руководящие указания американского Министерства здравоохранения и медицинских услуг (от 8 апреля 2015 года) заключаются в следующем:
Кроме того, руководящие указания от Всемирной Организации Здравоохранения (от 30 июня 2013 года) гласят:
Исходная резистентность представляет собой наличие резистентных мутаций у пациентов, которые до этого никогда не лечились от ВИЧ. В странах с высоким уровнем исходной резистентности рекомендуется проведение тестирования на резистентность до начала лечения; или, если начало лечения является сложным, необходимо эмпирически выбрать режим лечения, который затем можно модифицировать на базе тестирования на резистентность. В Великобритании, в 11,8% случаях отмечается средний до высокого уровень исходной резистентности к комбинации эфавиренза + зидовудина + ламивудина, и в 6,4% случаях была выявлена средняя до высокой исходная резистентность к ставудину + ламивудину + невирапину. В США, по состоянию на 2005 год, 10,8% одной когорты пациенты никогда не были на АРТ до проявления, по крайней мере, одной резистентной мутации 15) . Различные исследования в различных частях мира показали увеличение стабильных показателей исходной резистентности в эру эффективной терапии ВИЧ. При тестировании исходной резистентности, комбинация эффективных антиретровирусных препаратов может быть подобрана в индивидуальном порядке.
В случае схемы, базирующейся на ингибиторах протеазы, ритонавир используется в низких дозировках для ингибирования ферментов цитохрома р450, ускоряя уровни других ингибиторов протеазы, но не для оказания прямого противовирусного эффекта. Этот усиливающий эффект позволяет принимать препараты реже в течение дня. Кобицистат используется вместе эвитегравиром для достижения аналогичного эффекта, однако сам по себе он не проявляет прямого противовирусного эффекта 16) . ВОЗ предпочла следующую первоначальную схему для подростков и взрослых (от 30 июня 2013 года):
ВИЧ может быть особенно опасным для младенцев и детей; одно исследование, проведённое в Африке, показало, что около 52% детей, родившихся с ВИЧ и не лечившихся от ВИЧ, умерли до 2 лет. В пять лет, риск заболевания и смерти от ВИЧ начинает приближаться до уровня молодых взрослых людей. ВОЗ рекомендует лечить всех детей до 5 лет, а также детей старше 5 лет с 3 или 4 стадией болезни или при CD4 менее 500 клеток на мл. Указания Министерства здравоохранения и социальных служб США являются более сложными, рекомендуя лечение всех детей в возрасте до 12 месяцев и детей любого возраста с проявлением симптомов 17) . В отношении использования антиретровирусных препаратов, этот процесс осложнён фактом, что многие дети, рождённые матерями с ВИЧ, приняли лишь одну дозировку невирапина (ННИОТ) в момент рождения для того, чтобы предотвратить передачу. Если этот процесс обернулся негативным результатов, то может выработаться устойчивость в ННИОТ. Кроме того, в рамках объёмного исследования, проведённого в Африке и Индии, выяснилось, что схемы на базе ИП превалировали над ННИОТ у детей до 3 лет, которые никогда не употребляли ННИОТ ранее. Таким образом, ВОЗ рекомендует схемы на ИП для детей до 3 лет. ВОЗ рекомендует детям до 3 лет следующую схему:
Для детей от 3 до 10 лет и подростков с массой тела, не превышающей 35 килограммов, рекомендуется следующая схема:
Цели лечения беременных женщин включают то же благотворное влияние в отношении матери, что и для остальных взрослых, а также предотвращение передачи инфекции ребёнку. Риск передачи от матери к ребёнку пропорционален плазменной вирусной нагрузке матери. Матери, не подвергающиеся лечению, с вирусной нагрузкой более 100000 копий на мл имеют риск передачи более 50%. При вирусной нагрузке менее 1000 копий на мл риск передачи составляет менее 1%. АРТ в отношении матери до и во время родов, а также в отношении матери и новорождённого после родов рекомендуются для существенного снижения риска передачи. Метод, выбранный для родов, также важен, так как при запланированном кесаревом сечении отмечается более низкий риск, чем при естественных родах или экстренной кесаревом сечении 18) . ВИЧ может обнаруживаться в грудном молоке инфицированной матери, передаваясь в ходе кормления. ВОЗ в отношении грудного вскармливания балансирует между низким риском передачи в ходе грудного вскармливания женщинами на АРТ и благотворным влияние кормления против диареи, пневмонии и недоедании. Также настоятельно рекомендуется, чтобы младенцы на грудном вскармливании получали профилактическую АРТ. В США, Министерство здравоохранения и социальных служб выступает против грудного вскармливания ВИЧ-инфицированными женщинами.
На фоне улучшений при терапии ВИЧ, ряд исследований в настоящее время показал, что пациенты, лечившиеся в странах с высоким уровнем доходов, могут рассчитывать на нормальную продолжительность жизни 19) . Это означает, что высокая доля людей, живущих с ВИЧ, в настоящее время являются пожилыми, и на данный момент продолжаются уникальные исследования на пожилых людях в отношении изучения аспектов ВИЧ-инфекции у людей пожилого возраста. Существуют данные, что пожилые люди с ВИЧ имеют ослабленную реакцию в отношении увеличения количества CD4, однако у них отмечается более высокая склонность к достижению крайне низких уровней вируса. Тем не менее, не все исследования выявили какие-то особенности реакции на терапию. Текущие указания не выделяют отдельные рекомендации для пожилых людей, однако важно учитывать тот факт, что пожилые пациенты также гораздо чаще употребляют другие препараты, не связанные с ВИЧ, и необходимо учитывать их взаимодействие с любыми потенциальными препаратами от ВИЧ. Существует также повышенный уровень связанных с ВИЧ состояний, не являющихся СПИД-индикаторными (HANA), таких как сердечно-сосудистые заболевания, заболевания печени и деменция, которые представляют собой мультифакторные осложнения от ВИЧ, связанное с ними поведение, а также коинфекции, включая гепатит В, гепатит С и вирус папилломы человека в ходе лечения ВИЧ 20) .
Опасения
Существует несколько опасений в отношении антиретровирусной терапии, которые необходимо разрешить до её начала:
Реакция на терапию
Первичной целью АРТ является подавление вирусной нагрузки до неопределяемых уровней (меньше 50 копий на мл). Это должно произойти через 24 недель после начала комбинированной терапии. Мониторинг вирусной нагрузки является наиболее важным предиктором реакции на лечение с помощью АРТ. Уровни, превышающие 200 копий на мл, принято считать вирусологической недостаточностью, и в таком случае необходимо проводить дальнейшие тестирования в отношении потенциальной вирусной устойчивости. Отсутствие подавления вирусной нагрузки при АРТ определяется в качестве вирусологической недостаточности.
Количество клеток CD4 является ещё одним ключевым показателей иммунного состояния и эффективности АРТ. Число CD4 должно расти на 50-100 клеток на мл в первый год терапии. Могут отмечаться существенные колебания числа клеток CD4 вплоть до 25% в зависимости от времени суток или сопутствующих инфекций 22) . В одном долгосрочном исследовании, наибольшее увеличение числа клеток CD4 произошло в первые два года после начала АРТ с последующим небольшим ростом. Это исследование также показало, что пациенты, которые начали АРТ при более низком количестве CD4, и через определённый период имели более низкое число CD4, чем те, кто начал терапию при более высоких уровнях CD4. Когда достигается вирусное подавление при АРТ, но без увеличения числа CD4, это состояние можно определить в качестве иммунологического отсутствия реакции или иммунологической недостаточности. Когда подобный исход предполагается, врачами не было выработано общего мнения в отношении того, как изменить терапию таким образом, чтобы исключить иммунологическую недостаточность, и будет ли такая терапия оказывать благотворное влияние. Указания Министерства здравоохранения и социальных служб США не рекомендует в таких случаях применять подавляющие схемы 23) .
Терапия спасения
У пациентов с обнаруживаемой вирусной нагрузкой при АРТ необходимо проводить тестирования для выявления наличия лекарственной устойчивости. Чаще всего, генотип сравнивается с базами данных других вирусных генотипов ВИЧ и профилями устойчивости для предсказания реакции на терапию. Если отмечается выраженная резистентность, необходимо провести фенотипическое тестирование вируса пациента в отношении диапазона концентраций препаратов, однако оно является дорогим и длится несколько недель, поэтому вариант с тестированием генотипов является предпочтительным. Использование информации о генотипах или фенотипах позволит выработать схему из 3 препаратов, где будут использоваться, по крайней мере, 2 класса препаратов, что позволит в наибольшей степени подавить вирус. Если схема не может быть разработана на базе препаратов первой линии, то такая терапия называется терапией спасения, и когда необходимо использование 6 или более препаратов, то такая терапия будет называться мега-ВААРТ 24) .
Структурированные перерывы в лечении
Побочные эффекты
Каждый класс и, в отдельности, каждый антиретровирусный препарат обладают своими рисками проявления побочных эффектов.
НИОТ могут мешать синтезу митохондриальных ДНК, приводя к высоким уровням лактата и лактоацидоза, стеатозу печени, периферической невропатии, миопатии и липоатрофии. Текущие НИОТ первой линии, такие как ламивудин / эмтриктабин, тенофовир и абакавир реже вызывают митохондриальную дисфункцию 25) .
ННИОТ, как правило, безопасны и хорошо переносятся. Основной причиной прекращения употребления эфавиренца являются нервно-психические отклонения, включая суицидальные мысли. Невирапин может вызвать серьёзную гепатотоксичность, особенно у женщин с большим числом CD4.
Ингибиторы протеазы (ИП) часто употребляются вместе с ритонавиром, сильным ингибитором фермента цитохрома Р450, что приводит к многочисленным лекарственным взаимодействиям. Они также связаны с липодистрофией, повышением уровня триглицеридов и повышенным риском сердечного приступа 26) .
Ингибиторы интегразы (INSTI) являются одними из наиболее хорошо переносимых антиретровирусных препаратов с отличными краткосрочными и среднесрочными результатами. Учитывая их относительно недавнее открытие, пока что существует недостаточно данных о безопасности в долгосрочном периоде. Они могут быть связаны с увеличением уровней креатинина киназы и довольно редко с миопатией.
Постконтактная профилактика ВИЧ
Планирование беременности
ВИЧ-инфицированные женщины, как выяснилось, обладают пониженной фертильностью, что может затрагивать доступные репродуктивные возможности. В случае, когда женщина ВИЧ-отрицательная, а мужчина является ВИЧ-положительным, необходимо применение первичных вспомогательных репродуктивных технологий для предотвращений передачи ВИЧ, которые заключаются в очищении спермы и последующей внутриматочной инсеминации (ВМИ) или экстракорпоральным оплодотворением (ЭКО). Предпочтительно, чтобы до этого мужчина добился неопределяемого уровня вирусной нагрузки в плазме 28) . В прошлом были зарегистрированы случаи передачи ВИЧ в отношении ВИЧ-отрицательного человека через искусственное осеменение, однако большое современное исследование, проведённое на базе 741 пары, где у мужчины отмечалась стабильная вирусная нагрузка и протестированные на ВИЧ-1 образцы спермы, не выявило ни одного случая передачи ВИЧ. В случаях, когда женщина является ВИЧ-положительной и мужчина ВИЧ-отрицательным, обычно применяется искусственная инсеминация. При соответствующем лечении риск передачи инфекции от матери к ребёнку составляет менее 1%.
Касательно излечения
Люди, живущие с ВИЧ, могут рассчитывать на нормальную продолжительность жизни, если у них отмечается подавление вируса в рамках комбинированной антиретровирусной терапии. Тем не менее, для этого требуется пожизненное употребление лекарств, также могут отмечаться более частые проявления сердечно-сосудистых, почечных, печёночных и неврологических заболеваний. Это побудило учёных на дальнейшие исследования в отношении излечения ВИЧ.
Основным препятствием для проведения антиретровирусной терапии ВИЧ-инфекции является то, что ВИЧ способен интегрироваться в ДНК клеток-хозяев, оставаясь в латентном состоянии, в то время как антиретровирусные препараты атакуют только активный ВИЧ. Клетки, в которых ВИЧ находится в состоянии покоя, называются резервуарами вирусов, и одним из их основных источников, как считают, является центральная памяти и переходная память CD4+ Т-клеток 31) . Текущие сообщения об излечении ВИЧ у двух младенцев, предположительно, было осуществлено в связи с тем, что лечение началось спустя несколько часов после заражения, предотвратив установление ВИЧ в резервуарах. В настоящее время существуют данные о том, чтобы были проведены действия по попытке активации резервуарных клеток с целью их репликации для того, что вирус вышел из латентного состояния, после чего он станет уязвимым перед антиретровирусными препаратами и иммунной системой. Мишенью также является гистондезацетилаза (ГДАЦ), которая подавляет транскрипцию, и при ингибировании это может привести к увеличению клеточной активации. Ингибиторы ГДАЦ, а именно вальпроевая кислота и вориностат, использовались в рамках испытаний на людях, однако результаты до сих пор являются предварительными 32) .
Даже при деактивации всех латентных вирусов, считается, что организму нужна сильная иммунная реакция для того, чтобы очистить все оставшиеся инфицированные клетки. Современные стратегии включают использование цитокинов для восстановления числа клеток CD4+, а также терапевтические вакцины первичных иммунных реакций.
Читайте также:


