Цинковые пальцы в лечении вич
1. Какие вы знаете Х-сцепленные первичные иммунодефициты.
● IPEX-СИНДРОМ=Immune dysregulation, polyendocrinopathy, enteropathy, X-linked (FOXP3)

● Х-сцепленная форма гипер-IgM-синдрома
И еще 2 из Википедии
● Синдром Ду́нкана (Х-сцепленный лимфопролиферативный синдром) — иммунодефицит, характеризующийся повышенной чувствительностью к вирусу Эпштейна—Барр.
● Синдром Бру́тона (агаммаглобулинемия бру́тоновского типа) — недостаточность иммуноглобулинов всех классов.
1.2. Приведите как минимум 2 примера генов, инактивирующие мутации в которых проводят к ТКИД (SCID), и кратко опишите фенотипические проявления.

1.3. В передаче сигналов от каких рецепторов участвует gammac?
Рецепторы к интерлейкинам/рецепторы Т-хелперов и NK
1.4. Как можно объяснить, что дефект в Jak3 приводит к иммунодефицитам, а в Jak1-2 – нет?
JAk3 связана с γc, а остальные нет. Плюс, многие мутации связанные с Jak1-2 летальны
1.5. Приведите примеры вторичных иммунодефицитов
Наиболее ярким примером приобретенной формы ВтИД является ВИЧ-инфекция с развитием синдрома приобретенного иммунодефицита (СПИД).
Другие примеры вторичных иммунодефицитов
• Иммуносупрессия в ходе пересадки органов или химиотерапии.
1.6. Какие наиболее распространенные симптомы наблюдаются при иммунодефицитах, затрагивающих систему комплемента.

1.7. Какие терапевтические мишени используются при высокоэффективной анти-ретровирусной терапии при лечении ВИЧ/СПИД?
Комбинация препаратов собирается из трёх или четырёх компонентов. По принципу действия все компоненты делятся на следующие группы: ингибиторы обратной транскриптазы двух видов — нуклеозидные и ненуклеозидные, ингибиторы протеазы, ингибиторы интегразы, ингибиторы слияния (ингибиторы фузии), ингибиторы рецепторов.
Цель — остановить воспроизведение вируса в организме.
1.8. Исторически первой для лечения ВИЧ/СПИД использовали монотерапию, мишенью которой была обратная транскриптаза (ревертаза) вируса. По какой причине от нее были вынуждены отказаться.
Из-за высокой изменчивости вируса (обратная транскриптаза совершает примерно 1 ошибку на 1000, это ОЧЕНЬ много). При монотерапии очень быстро отбирались мутанты, которые уходили от одного определенного ингибитора.
1.9. 1.9 Назовите известные вам свойства ВИЧ-1, которые делают его уникально сложным для борьбы с этим вирусом.
● -Поражает центральное звено адаптивного иммунитета – СD4+ T клетки (хелперы).
● -Высокоизменчив, так как его главный фермент – обратная транскриптаза – делает ошибки при синтезе.
● -Встраивается в геном клетки хозяина.
1.10. Какие открытия последних лет вселяют надежду на то, что распространение ВИЧ удастся остановить.
главные достижения последних лет:
● Высокоэффективная лекарственная терапия
● Получение нейтрализующих антител широкой специфичности (а с ними возможна серотерапия).
Комбинация этих двух подходов сможет долгие годы удерживать виремию на минимальном уровне, но без Т клеточной вакцины полностью удалить вирус из организма не удастся.
1.11. Почему в Западной Европе инфицируемость ВИЧ-1 снижается, а в России растет?
не все пациенты, нуждающиеся в лечении, могут получить препараты
+есть люди, кто не верит в ВИЧ, недостаточно социальной рекламы про этот вирус.
1.12. Мутации в каком гене приводят к дефектам в функциях Т регуляторных клеток? Как называется этот синдром у человека?
IPEX-синдром (Immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome) – синдром дисрегуляции иммунитета, полиэндокринопатии, энтеропатии, сцепленный с Х-хромосомой. Рецессивная тяжелая мультиорганная патология, вызванная мутациями гена FOXP3.
1.13. Какие технологии редактирования геномов основаны на компонентах бактериальных защитных систем?
Редактирование генома является одним из видов генной инженерии, в котором эндонуклеазы создают сайт-специфичные двухцепочечные разрывы в ДНК в определённом участке генома. Индуцированные двухцепочечные разрывы репарируются в процессе рекомбинации, что позволяет получать направленные мутации.
В этом методе используются 4 типа нуклеаз: мегануклеазы, нуклеазы с цинковыми пальцами (zinc fingers), нуклеазы TALEN, и система CRISPR-Cas.
Мегануклеазы – искусственные аналоги природных ферментов, найденных у некоторых прокариот и водорослей.
Нуклеазы с цинковыми пальцами — нуклеазы на основе белков, содержащих домен “цинковые пальцы”. Встречается примерно в половине транскрипционных факторов человека
TALEN — искусственные нуклеазы на основе TALE белков (TALEN). TALE (Transcription Activator — Like Effector) белки были обнаружены у бактерий рода Xanthomonas поражающих рис, перец, хлопок и другие растения. Когда бактерии заражают растение, TALE и др. белки проникают в растительные клетки, достигают ядра и связываются с промоторами генов, активируя экспрессию генов, способствующих выживанию бактерий и распространению инфекции.
Система CRISPR/Cas9 основана на иммунной системе бактерий.

В клетку вводится Cas9 и гид-РНК, комплементарная участку, который необходимо отредактировать. Cas9 узнает участок в 20-30 нуклеотидов, обычно такое место в геноме только одно, что позволяет обеспечить точность. Cas9 вносит разрыв по двунитевой цепи, дальше происходит репарация. Чтобы репарация прошла правильно, добавляют участок правильной ДНК. Она комплементарно связывается в месте разрыва, и на ее основе цепь сшивается.
1.14. Кто из первооткрывателей вируса ВИЧ выступил с лженаучной теорией? Каким образом эта теория помогла гомеопатии?
В 2014 г. Монтанье (Нобелевка по физиологии и медицине в 2008 году за расшифровку ВИЧ) выступил с новой идеей о том, что ДНК испускает слабое электромагнитное излучение, вызывающее структурные изменения в воде, которые сохраняются даже при минимальной концентрации биоматериала. Типа при минимальной концентрации лечебного вещества вода сохраняет свойства раствора первоначальной конц.
1.15. Почему у детей, появившихся на свет с помощью кесарева сечения, очень часто бывают дисбиозы?
Потому что при естественных родах закладывается микробиота.

Китайские врачи опробовали CRISPR-отредактированные клетки на пациенте с ВИЧ-инфекцией и Т-клеточной лейкемией. После облучения больному ввели его собственные кроветворные клетки, в которых разрушили ген CCR5. Отредактированные клетки прижились в организме и образовали разные типы клеток крови. Серьезных побочных эффектов не возникло. Правда, защитить пациента от вируса они не смогли — из-за низкой эффективности редактирования. Статья опубликована в журнале New England Journal of Medicine.
В 2017 году Лей Сюй (Lei Xu) из Центра исследований стволовых клеток пекинского университета и его коллеги запустили небольшое клиническое исследование, чтобы попробовать создать устойчивость к ВИЧ в клетках крови с помощью CRISPR/Cas9. В своей статье ученые отчитываются о первом пациенте, который прошел их новую терапию. Кроме технологии редактирования, которую использовали китайские ученые, есть и еще одна деталь, которая отличает их эксперимент от исследования Sangamo Therapeutics. Китайцы забирали у пациента не Т-клетки, а стволовые клетки крови. Расчет был на то, что кроветворные клетки приживутся в красном костном мозге и будут постоянно поставлять в организм пациента устойчивые к ВИЧ Т-лимфоциты.
Ученые работали с 27-летним пациентом, у которого кроме ВИЧ-инфекции диагностировали еще и Т-клеточную лейкемию. Его планировали лечить лучевой терапией, которая убивает существенную часть клеток крови, и пересадка кроветворных клеток ему понадобилась бы в любом случае. Ученые решили совместить лечение с экспериментальной процедурой: после облучения ввели больному уже отредактированные собственные клетки. В этот момент антиретровирусную терапию пришлось прервать, чтобы можно было оценить результат эксперимента.
CRISPR-модифицированные клетки прижились в организме и не вызвали острого отторжения. С начала эксперимента прошло уже 19 месяцев, и клетки с разрушенным геном CCR5 все еще можно найти в крови пациента — причем не только Т-лимфоциты, но и другие клетки крови. Это значит, что отредактированные кроветворные клетки работают полноценно и производят разные типы клеток, у которых мутация сохраняется.
Тем не менее, полностью отредактировать кроветворение пациента не удалось. Среди всех клеток, которые ученые у него забрали для редактирования, внести изменения в геном получилось лишь у 17,8 процентов. После возвращения в организм новые клетки начали конкурировать со старыми за заселение красного костного мозга. И в течение всего времени наблюдения они составляли лишь 5-8 процентов от общей кроветворной популяции.
Однако сделать пациента устойчивым к вирусу не удалось: после отмены ретровирусной терапии количество вирусной РНК в крови начало расти, и ему пришлось снова назначить лечение, чтобы инфекция не прогрессировала. В этом смысле китайский эксперимент, равно как и испытание Sangamo Therapeutics, не достиг заявленной цели. Причиной тому стала низкая эффективность редактирования. В китайском эксперименте она была ниже 20 процентов, в исследовании Sangamo Therapeutics — 11-28 процентов, и этого количества клеток недостаточно, чтобы справиться с инфекцией. Для того, чтобы ввести технологию редактирования генов в клиническую практику борьбы с ВИЧ, исследователям придется сначала повысить эффективность метода.
Тем не менее, авторы работы отмечают, что у их исследования есть и позитивный результат. Этот эксперимент — самое долгое на сегодняшний день наблюдение за CRISPR-отредактированными клетками в организме человека, и оно показывает, что такие клетки могут быть безопасны. Исследователи не обнаружили в клетках никаких незапланированных изменений (то есть следов нецелевого редактирования генома). Клетки также не превратились в опухолевые — о чем предупреждали некоторые ученые в 2018 году. Таким образом, китайская работа стала демонстрацией принципа: CRISPR-модифицированные клетки можно использовать в терапевтических целях без риска для пациента.
- 4048
- 3,5
- 2
- 8
Модифицированные с помощью CRISPR-Cas9 иммунные клетки получают возможность лучше атаковать опухоль.

Биология в Московском физтехе
Лаборатория геномной инженерии МФТИ — молодая и интенсивно развивающаяся лаборатория со многочисленными проектами и планами. Реализация большей части из них связана с использованием в качестве основного инструмента технологии CRISPR-Cas9. Одним из самых привлекательных направлений использования данной технологии является персонализированная медицина [1], желающая поставить себе на вооружение метод высокоточного геномного редактирования для борьбы со многими тяжелыми наследственными заболеваниями или злокачественными опухолями. Молекулярная технология CRISPR-Cas9 успешнее других претендует на роль этого универсального оружия, и первые шаги по ее применению к реальным пациентам подобны первым полевым испытаниям.
Откуда мы знаем про CRISPR-Cas9?
Превращение механизма бактериального иммунитета в инструмент редактирования геномов высших организмов потребовало решения ряда сложных задач, связанных, главным образом, с повышением точности определения участка ДНК, который распознается и вырезается комплексом белка Cas9 со специальной молекулой РНК, служащей для белка гидом к этому участку. Однако труды генных инженеров увенчались успехом и уже к 2013 году позволили создать удобный способ доставки молекулярного комплекса CRISPR-Cas9, который был опробован на культуре человеческих клеткок [6]. Будучи успешно испытанной на клетках многих модельных организмов и доказав свою эффективность на этой стадии, технология CRISPR-Cas9 приковала всеобщее внимание как перспективный инструмент в клинической практике для лечения многих заболеваний, включая наследственные и онкозаболевания. На настоящий момент развитие технологии вплотную подошло к проверке ее эффективности в клинических испытаниях.
Первый рывок в гонке клинических испытаний CRISPR-Cas
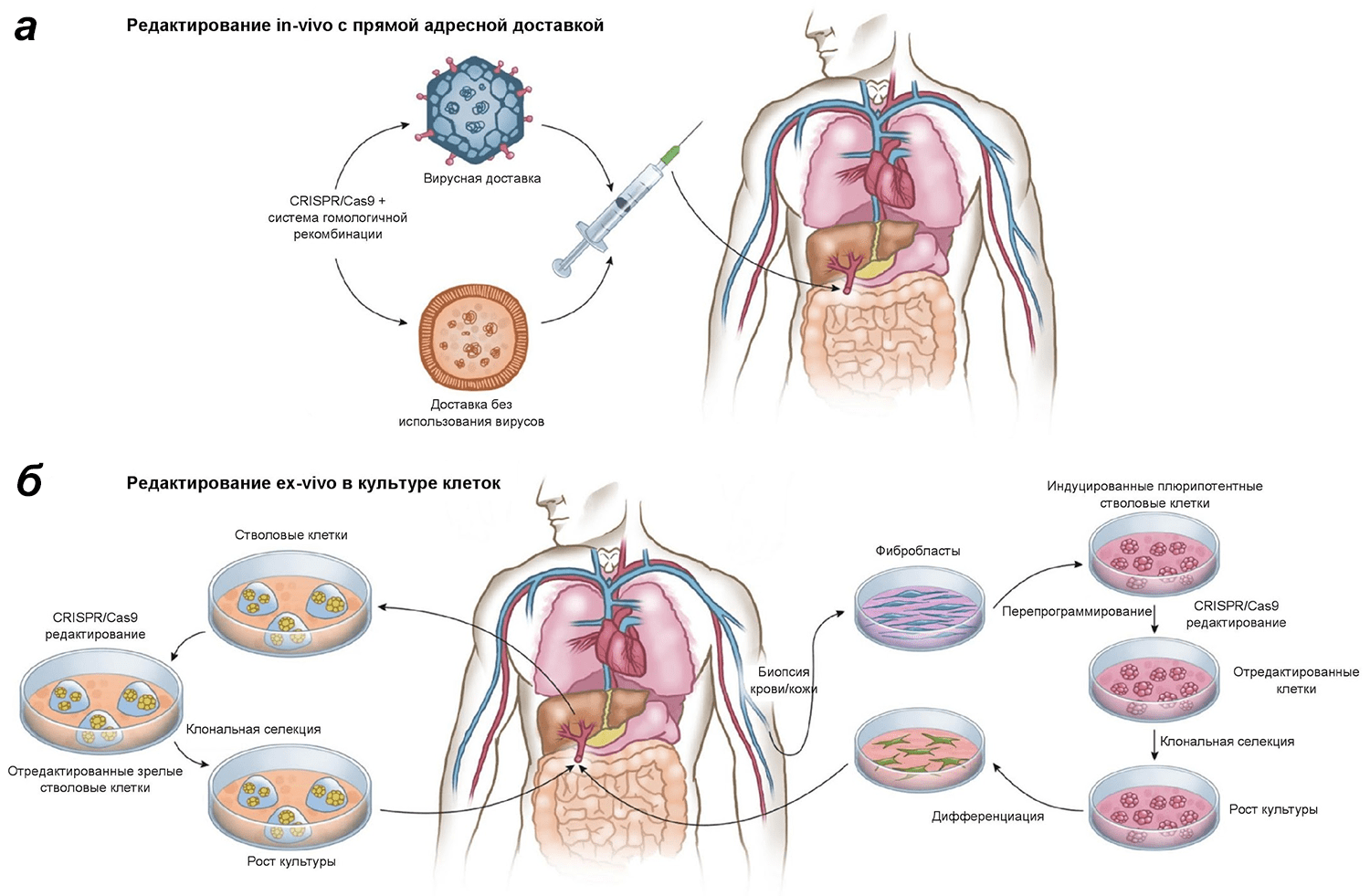
Рисунок 1. In vivo и ex vivo подходы к использованию CRISPR-Cas9 в генной терапии. Китайские исследователи использовали ex vivo подход к редактированию клеток пациента. Однако он — лишь один из двух возможных вариантов лечения патологий с помощью CRISPR-Cas9. а — In vivo CRISPR-Cas9-система доставляется прямо в организм пациента с использованием специальных векторов вирусного или не вирусного происхождения и позволяет произвести редактирование в организме самого пациента. б — Ex vivo редактированию с помощью CRISPR-Cas9 подвергаются, например, соматические стволовые или прогениторные клетки, которые были первоначально взяты у пациента. После редактирования клетки с измененным геномом отбирают, растят в культуре и трансплантируют (инъецируют) обратно пациенту.
Детальные результаты проведенного китайскими исследователями испытания пока не сообщаются, однако уже заявлено, что пациенту была произведена вторая инъекция. Также авторы поделились своими планами по проведению дальнейших испытаний с участием еще 10 пациентов. Каждому из них планируется произвести от двух до четырех инъекций, а затем всех будут тщательно наблюдать в течение последующих шести месяцев для выявления возможных серьезных негативных последствий. Независимо от первого успеха китайских коллег, американские исследователи еще в июле заявили о готовности развернуть в 2017 году масштабные клинические испытания с использованием CRISPR-Cas9 против рака простаты, почек и мочевого пузыря. Старт запланирован на начало 2017 года.
Уникальна ли CRISPR-Cas в качестве технологии геномного редактирования?
Несмотря на явное преимущество по уровню информационного освещения, технология CRISPR-Cas9 не является единственной технологией редактирования ДНК, которая может использоваться для лечения реальных заболеваний.
Однако эффективность редактирования оказалась невысокой — только в 25% клеток редактирование нужного гена прошло успешно. Тем не менее после инъекции редактированных клеток в прогнозе пациентов были отмечены позитивные изменения — у всех 12 человек после прекращения антиретровирусной терапии уровень ВИЧ восстанавливался гораздо медленнее, чем в норме, а уровень Т-лимфоцитов оставался достаточно высоким в течение нескольких недель. Интересно, что у одного из пациентов уровень вируса не восстанавливался в течение целых 12 недель после остановки терапии. Авторы, исследовав геном пациента, обнаружили, что он имеет одну мутировавшую копию гена CCR5, что, по всей видимости, и позволило ему лучше сопротивляться вирусу по сравнению с другими пациентами. Несмотря на достигнутые положительные результаты, испытание данной технологии выявило ряд сложностей, делающих их использование в терапии затруднительным. Во-первых, это недостаточная точность редактирования ДНК в клетках пациентов. Во-вторых, в ходе испытания у пациентов отмечались некоторые малоприятные побочные эффекты, вызванные инъекцией. Например, не исчезающий в течение нескольких дней ужасный запах, исходящий от тел пациентов, возникающий вследствие метаболизма диметилсульфоксида (ДМСО), который используется в качестве криоконсерванта для клеточной культуры [14].
Вторым видом технологии геномного редактирования стало использование фермента TALEN (Transcription activator-like effector nuclease) для спасения маленькой однолетней пациентки с лейкемией в Британии [15]. Испытать подобную технологию авторы исследования решились после того, как все остальные способы лечения ребенка потерпели неудачу. Исследователи использовали Т-лимфоциты, взятые у здорового донора, повысив их устойчивость к противоопухолевым препаратам и модифицировав с помощью технологии UCART (Universal Chimeric Antigene Receptor T-cells), позволяющей им атаковать опухолевые клетки, но не причинять вреда здоровым клеткам пациентки. Авторы признались, что инъекция подобных иммунных клеток с редактированной ДНК не позволяет однозначно вылечить заболевание, однако у пациента появляется шанс дождаться подходящего донора костного мозга. И в данном случае такой донор был найден. Модифицированные иммунные клетки позволили организму девочки побороть опухолевые клетки, а трансплантация — восстановить иммунную систему, сильно пострадавшую в ходе курса химиотерапии и борьбы с опухолью. Случай выздоровления юной пациентки получил широкий общественный резонанс и позволил технологиям редактирования генетической информации еще на шаг приблизиться к применению в клинической практике.
Комментарий Павла Волчкова, заведующего лабораторией геномной инженерии МФТИ

Рисунок 2. Павел Юрьевич Волчков, заведующий лабораторией геномной инженерии МФТИ
Первые шаги в виде первых клинических испытаний очень важны для внедрения технологии в клиническую практику. Они хорошо привлекают общественное внимание, что в свою очередь довольно хорошо стимулирует скорость интеграции технологии, а также увеличивает количество сопряженных разработок и позволяет привлечь дополнительное финансирование. Если смотреть на историю развития подходов к редактированию генома, то, начиная с 90-х годов, она будет идти плавно и поступательно с небольшими пиками, соответствующими тем или иным громким событиям, например, попыткам применения определенной технологии на пациентах. В 2014 и 2015 годах такими событиями стали первые применения ZNFs и TALEN для лечения пациентов с ВИЧ и лейкемией соответственно.
Важно понимать, что сам молекулярный механизм, производящий редактирование ДНК, это важная составляющая будущего клинического продукта, но одной ее недостаточно для того, чтобы лечить пациентов. В список сопутствующих технологий, необходимых для использования геномного редактирования в терапии, входят методы культивирования клеток, которые предполагается редактировать (например, Т-клетки иммунной системы), а также технологии доставки редактирующей молекулярной системы (например, использование вирусных векторов). Кроме того, развитие технологий геномного редактирования толкает вперед развитие приборостроения, поскольку машин, которые автоматически выполняли ли бы всю работу, связанную, например, с отобранными клетками, в клинике сейчас нет. Однако такие машины просто необходимы, поскольку нам важны время и автоматизация процесса для эффективной терапии.
Что же касается заболеваний, в лечении которых планируется попробовать использовать CRISPR-Cas9, то их список достаточно обширен. Editas — одна из крупнейших и многообещающих компаний, разрабатывающих клинические продукты на основе CRISPR-Cas9, — решила сфокусировать свое внимание на заболеваниях, лечение для которых на настоящий момент практически отсутствует или является недостаточно эффективным (см. таблицу).
| Наши программы | Механизм редактирования | Способы доставки | Коммерческие права |
|---|---|---|---|
| Заболевания глаз | |||
| Амавроз Лебера | NHEJ — небольшие делеции | AAV локальная инъекция | Editas |
| Генетические и инфекционные заболевания глаз Синдром Ушера, вирус простого герпеса первого типа (HSV-1) | NHEJ | AAV локальная инъекция | Editas |
| Редактирование Т-клеток | |||
| Редактирование генов в Т-клетках для терапии рака | NHEJ | RNP ex vivo | Juno Therapeutics |
| Дополнительные исследовательские программы | |||
| Доброкачественные гематологические заболевания Бета-талассемия, серповидноклеточная анемия | HNJEJ & HDR | RNP ex vivo | Editas |
| Генетические заболевания мышц Миодистрофия Дюшенна | NHEJ — малые и большие делеции | AAV или LNP | Editas |
| Генетические заболевания легких Муковисцидоз | HNJEJ & HDR | AAV или LNP | Editas |
| Генетические и инфекционные заболевания печени Дефицит альфа-1-антитрипсина | HNJEJ & HDR | AAV или LNP | Editas |
Основные клинические направления, которые Editas выбрала для исследований, можно разделить на три группы.
В дополнительную группу также можно выделить инфекционные заболевания, например, герпетическое поражение глаз, для которых существуют методы лечения, однако они недостаточно эффективны или подразумевают сильное хирургическое вмешательство.
Для всех групп заболеваний в качестве корректирующего механизма Editas планирует использовать технологии, основанные на разных способах репарации ДНК после ее разрезания Cas9. Эти технологии включают в себя такие механизмы репарации, как негомологичное соединение концов (non-homologous end joining, NHEJ) и гомологичную рекомбинацию (homology directed repair, HDR) [16].
Старт клинических испытаний намечен на 2017 год, и Editas — не единственная компания, заявившая о них. Подобные схемы будущих испытаний уже предложили другие крупные компании — Intellia Therapeutics и Crispr Therapeutics.
Никто не застрахован от ошибок
Несмотря на громкий успех китайских исследователей, менее чем через неделю это событие оказалось омрачено печальной новостью из США. В ходе клинический испытаний, проводимых компанией Juno Therapeutics по редактированию Т-лимфоцитов пациентов с острым лимфобластным лейкозом, двое пациентов скончались по причине проявившихся осложнений после трансплантации редактированных клеток. На данный момент FDA — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) — приостановило испытания до полного выяснения обстоятельств и причин гибели пациентов. Некоторые эксперты предполагают, что данный прецедент может серьезно ограничить Juno в дальнейших разработках технологии CAR (chimeric antigen receptor) для модификации иммунных клеток онкопациентов.
Случившиеся последовательно успех и неудача использования CRISPR-Cas9 в клинических испытаниях — хороший пример того, насколько сложен путь вхождения технологий геномного редактирования в практику для лечения реальных пациентов. Отбросив весь информационный шум, объективно можно сказать, что говорить об эффективности технологии, а главное о ее безопасности — довольно рано. Пока у нас нет данных успешных клинических испытаний с участием большого числа пациентов, ажиотаж вокруг развивающейся генной терапии будет подкрепляться исключительно общественными ожиданиями, но никак не реальными клиническими показателями. Тем не менее наши ожидания от технологий геномного редактирования огромны, и на настоящий момент представить ближайшее будущее без этих технологий довольно сложно (см. видео).
видео сделала группа Kurzgesagt и перевёл портал Naked Science
Поскольку антиретровирусная терапия требует пожизненного режима лечения, исследование , чтобы найти более постоянное лечение для ВИЧ - инфекция в настоящее время. Можно синтезировать нуклеотиды цинковых пальцев с компонентами цинка пальца , который избирательно (селективно) почти связываются со специфическими участками ДНК . Концептуально, ориентация и редактирование могло бы сосредоточиться на хозяин клеточных корецепторы на ВИЧ или на провирусной ДНК ВИЧ.
содержание
Хост клеточных корецепторов для ВИЧ
Кроме того , было отмечено , что 20% кавказского населения обладают мутацию, которая называется CCR5-Δ32 (частота 0.0808 для гомозиготной аллели), который предотвращает CCR5 хемокинов рецепторный белок, который является основным средством вирусного доступа в клетку, из выражается на поверхности их CD4 + Т-клеток . Лица , которые гомозиготные по этой мутации имеют иммунитет к штаммам ВИЧ , которые используют рецептор CCR5 для доступа к ячейке, в то время как те , которые являются гетерозиготными по этой мутации были найдены для снижения вирусной нагрузки в плазме и замедлить прогрессирование СПИДА. Объединив эти факты, исследователи предложили новый метод лечения для ВИЧ . Этот метод пытается лечить инфекцию путем разрушения гена CCR5, такие , как введение CCR5-Δ32 мутации с использованием рекомбинантного аденовирусного вектора или принуждением репарации ДНК с помощью негомологичного конца соединения, который склонен к ошибкам и приводит к нефункциональному геном. Как следствие, в результате чего в выражении нефункциональных CCR5 ко-рецепторов на CD4 + Т - клеток, обеспечивающих иммунитет против инфекции.
В цинковых пальцах нуклеазы , которые были синтезированы для этого лечения производится путем комбинирования FokI рестрикции типа II эндонуклеаз с конструированными цинковыми пальцами. Количество цинка пальцев , прикрепленных к эндонуклеазе контролирует специфичность ZFN , так как они разработаны , чтобы предпочтительно связывается со специфическими последовательностями оснований в ДНК . Каждый ZFN состоит из нескольких цинковых пальцев и один нуклеазы фермента .
ДНК ВИЧ провирусных
цинковый палец связывания
Каталитический домен FokI должен димеризоваться расщеплять ДНК на целевом сайте, и требует, чтобы было два соседних цинковых пальцев нуклеаз (смотри рисунок), которые независимо друг от друга связываются с конкретной кодона в правильной ориентации и расстояния. В результате, два связывающие событие из двух цинковых пальца нуклеазы обеспечивает специфическое нацеливание ДНК. Специфика редактирования генома имеет важное значение для цинковых пальцев нуклеазы, чтобы быть успешным приложением. Следствие офф-таргетинга расщепления может привести к снижению эффективности модификации на-мишени в дополнение к другим нежелательным изменениям.
Точная конституция ZFNs, которые должны быть использованы для лечения ВИЧ до сих пор неизвестно. Связывание ZFNs для переделки Zif268 GeneLink, однако, было хорошо изучены и описано ниже , чтобы проиллюстрировать механизм , с помощью которого цинкового пальца домена ZFNs связывается с ДНК.
Амин - конец альфа - спираль части цинковых пальцев цели основных канавок ДНК спираль и связывает рядом с CCR5 , позиционированием гена FokI в подходящем месте для расщепления ДНК.
Цинковые пальцы повторяют структурные белковые мотивы с функцией распознавания ДНК , которые соответствуют в основных канавках ДНК. Три цинковые пальцы расположены в полукруглой или С-образное расположение. Каждый цинковый палец состоит из антипараллельных бета - листов и с альфа - спирали , удерживаемых вместе с помощью иона цинка и гидрофобных остатков.
Атом цинка ограничен в тетраэдрической конформации путем координации Cys3, Cys6, His19, и His23 и цинка - сера расстояние 2,30 +/- 0,05 ангстрем и цинка - расстояния Азота облигаций 2,0 +/- 0,05 ангстрем.
Каждый цинковый палец имеет аргинин (Arg) , аминокислоты , выступающие из альфа - спирали , которая образует водородную связь с азотом 7 и кислородом 6 гуанина (гуа) , который расположен в 3' - конце сайта связывания. Arg-гуа связь стабилизирована аспарагиновой кислотой из 2 - го остатка, который позиционирует длинную цепь аргинина через водородную связь соли мост взаимодействие.
В остатке-2 (то есть, средний палец) цинка, гистидин 49 образует водородные связи с копланарным гуанином в паре оснований 6. штабелирование гистидина против тимина в паре оснований 5 ограничивает конформационную способность гистидина 49 , ведущую к увеличена специфичность к гистидин-гуанин водородной связи .
На 6 - остатке, пальцы 1 и 3 имеют аргинин жертвуя пару заряженных водородных связей с азотом 7 и кислородом 6 гуанина на 5' - конце усиливающего последовательность распознавания сайта из цинковых пальцев.
Гистидин , координированный с атомом цинка, который также является седьмым остаток в альфа - спирали из цинковых пальцев, координирует ион цинка через его N & epsi и водородные связи с фосфодиэфирным кислородом через Nδ на цепи первичной ДНК.
В дополнении к гистидину , законсервированный аргинин на вторых бета - цепи цинка пальцев вступает в контакт с фосфодиэфирным кислородом на цепи ДНК .
Кроме того, серин 75 на третьи палец водородных связей в фосфат между парами оснований 7 и 8, в качестве единственного контакта с магистральным вторичной цепью ДНК.
Nuclease димеризации и расщепление
Было обнаружено , что FokI не имеет никакой собственной специфичности в его расщеплении ДНК и что домен распознавания цинкового пальца дает избирательность цинку нуклеаз пальцев.
Специфичность обеспечивается димеризацией , что уменьшает вероятность расщепления за пределы участка. Каждый набор из цинковых пальцев специфично к нуклеотидной последовательности по обе стороны от гена - мишени 5-7 разделения между п.н. нуклеазы компонентами.
Димеризации двух ZFNs требуются , чтобы произвести необходимый двухцепочечный разрыв в пределах CCR5 гена , так как взаимодействие между FokI ферментом и ДНК является слабым. Этот разрыв ремонтируются естественными механизмами репарации клетки, в частности , не гомологичной конец соединения .
Вводя мутации CCR5
Введение в геном изменений зависит от любого из двух естественно ремонта механизмов ячейки: негомологичная конец присоединения (NHEJ) и гомологии направленного ремонта (HDR). Ремонт через NHEJ идет о путем лигирования конца разбитых нитей и, при возникновении ошибки, может производить небольшие вставки и делеции. HDR, с другой стороны, использует гомологичной цепи ДНК , чтобы восстановить ген-и делает использование этого механизма ремонта и обеспечения желаемой нуклеотидной последовательности позволяет для вставки гена или модификации.
При отсутствии гомологичной нуклеотидной последовательности оснований , которые могут быть использованы с помощью гомологичной рекомбинации механизма, основной DSB ремонта путь у млекопитающих через негомологичный конец соединительный (NHEJ). NHEJ , хотя способен восстанавливать поврежденный ген, является подверженным ошибкам. ДЖД являются, таким образом, введены в ген , пока ошибка в его ремонте не происходит , при которой точке ZFNs больше не способен связывать и димеризацию и мутация завершена. Для того, чтобы ускорить этот процесс, экзонуклеаза может быть введена , чтобы переварить концы нитей , образующихся на DSBs.
Ограничения
Увеличение количества цинковых пальцев повышает специфичность за счет увеличения числа пар оснований, что ZFN могут связываться с. Однако слишком много цинка пальцев могут привести к офф-мишени связывания и, таким образом, за пределами площадки расщепления. Это связанно с повышенной вероятностью цинковых пальцев связывания с частями генома за пределами интересующего гена.
Современные методы лечения ZFn сосредоточиться на CCR5 гена, никаких известных побочных эффектов в результате изменения CCR5 . Есть штаммы ВИЧ, которые способны использовать CXCR4 проникать в клетку - хозяина, минуя CCR5 вообще. Та же самая технология редактирования гена была применена к CXCR4 отдельно и в сочетании с CCR5
Несколько вопросов существуют с этим экспериментальным лечением. Одна из проблем заключается в обеспечении того , чтобы желаемая механизм восстановления является тот , который используется для восстановления DSB после добавления гена. Еще одна проблема с срыву CCR5 гена является то , что CXCR4 штаммы -специфический или двойной тропик все еще в состоянии получить доступ к ячейке. Этот метод может предотвратить прогрессирование ВИЧ - инфекции.
Для того, чтобы использовать в ZFNs в клинических условиях следующие критерии должны быть выполнены:
я) Высокая специфичность ДНК-связывающий - коррелирует с более высокой производительности и меньшей токсичности ZFNs. Engineered ZFNs принимать во внимание позиционные и контекстно-зависимых эффекты цинковых пальцев для увеличения специфичности.
б) Включить аллостерическую активацию из Foki однажды связанной с ДНК, для того , чтобы произвести только необходимый DSB.
III) Для того, чтобы обеспечить два разных цинковые пальцы нуклеазных субъединиц и ДНК донора к клетке, векторы, которые используются должны быть улучшены, чтобы уменьшить риск мутагенеза. К ним относятся вирусные векторы аденосателлитные, интегразы с дефицитом лентивирусов векторов и аденовируса типа 5 векторов.
v) В ходе гена нацеливания, генотоксичность , связанная с высокой экспрессией ZFNs может привести к клеточному апоптозу и , таким образом , должно быть тщательно проверено в лабораторном и в естественных условиях анализов трансформации.
Администрация лечения
Клетки , в которых мутации индуцированные экс виво отфильтровывается из лимфоцитов с помощью афереза , чтобы произвести аналогичные лентивирусы сконструированных лимфоцитов CD4 + Т-клетки . Они вновь вливаются в тело в виде разовой дозы 1 × 10 10 гена модифицированные аналогичные CD4 + Т-клеток. Вирусный вектор используется для доставки ZFNs , которые вызывают желаемую мутацию в клетки. Условия , которые способствуют этому процессу тщательно контролируют обеспечение производства CCR5 - штамм ВИЧ - резистентные Т - клетки .
Тимоти Рэй Браун , который перенес пересадку костного мозга в 2007 году для лечения лейкемии , был ВИЧ одновременно. Вскоре после операции ВИЧ снизился до неопределяемых уровней. Это результат костного мозга донора будучи гомозиготным по CCR5-Δ32 мутации. Эта новая мутация присвоила устойчивость к ВИЧ у реципиента, в конечном счете , приводит к почти полному исчезновению частиц ВИЧ в его организме. После почти 2 лет без антиретровирусной медикаментозной терапии, ВИЧ все еще может быть не обнаружен ни в одном из его тканей. Хотя этот метод был эффективен при снижении уровня инфекции, риски , связанные с костным мозгом трансплантатами перевешивают его потенциальную ценность как средства для лечения ВИЧ - инфекции.
Читайте также:


