Диметилпарафенилендиамина для диагностики гонококковой приготовление
Возбудителем гонореи является Neisseria gonorrhoeaе, вызывающая острые и хронические воспалительные поражения мочеполовых органов, слизистой оболочки ротоглотки и конъюнктивы глаза.
Материалом для исследования является гнойное отделяемое мочеполовых органов, прямой кишки или конъюнктивы глаз (при бленорее), суставной и перитонеальный экссудат. Строго регламентированными методами лабораторной диагностики гонореи являются микроскопическое и бактериологическое (культуральное) исследование. Методы микробиологической диагностики гонореи отражены в схеме 18 .
Схема 18. Методы микробиологической диагностики гонореи
Микроскопический метод заключается в исследовании мазков из исследуемого материала, окрашенных по Граму и метиленовым синим. При окрашивании препаратов на гонорею используют модификацию метода Грама (краситель генциан-виолет заменяют кристал-виолетом, а вместо фуксина применяют нейтральный красный; промывку препарата осуществляют после каждого этапа окраски). В мазках при острой гонорее обнаруживают большое количество полиморфноядерных лейкоцитов, внутри и вне которых расположены бобовидные грамотрицательные диплококки; сопутствующая микрофлора либо минимальна, либо отсутствует вовсе (рис. 25). При хронической гонорее в ряде случаев типичный гонококк в мазках не выявляется, либо выглядит нетипично в виде мелких пылевидных или крупных шарообразных образований, нередко 2 клетки гонококка располагаются под углом друг к другу, при этом обнаруживается обильная сопутствующая микрофлора, лейкоциты, эпителиальные и другие клетки. В качестве экспресс-метода диагностики может использоваться ИФМ.
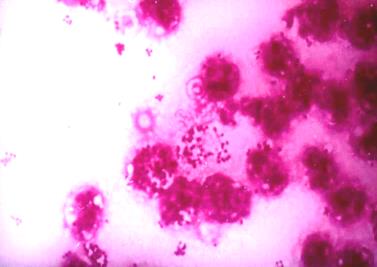
Рис. 25. Возбудитель гонореи(Neisseria gonorrhoeaе) в мазках из уретры больного острой гонореей. Внутри и внеклеточно расположенные грамотрцательные диплококки, обилие лейкоцитов.
Бактериологический метод.Гонококк отличается высокой чувствительностью к различным неблагоприятным факторам, поэтому культуральное исследование необходимо проводить сразу после отбора материала. Посев производят на специальные питательные среды. Основой этих сред является МПА из кроличьего мяса с добавлением дрожжевого аутолизата, гидролизата казеина или гемогидрализата и сыворотки крупного рогатого скота. Асцитическая жидкость и яичный желток в качестве добавок к среде для культивирования гонококка в настоящее время не применяются. Второй тип питательных сред является селективным и включает в свой состав, помимо вышеуказанных компонентов, антибиотики (полимиксин, линкомицин, а для диагностики фарингеальной гонореи – оротовую кислоту). Посевы выращивают при 37 0 С в течение 24-72 часов в атмосфере с повышенным содержанием СО2. Колонии гонококков круглые, прозрачные, в виде капелек росы. Типичные для гонококков колонии пересевают в пробирки со средой для культивирования гонококка для получения чистых культур, которые идентифицируют по морфологическим и сахаролитическим свойствам на средах "пестрого" ряда (полужидкий агар с сывороткой и углеводом) или с помощью микротест-систем. В мазках из чистых культур гонококки располагаются не попарно, а отдельно. В биохимическом отношении гонококки малоактивны и ферментируют только глюкозу с образованием кислоты, вырабатывают оксидазу. Для выявления оксидазы применяют пробу с 1% водным раствором диметилпарафенилендиамина или диэтилпарафенилендиамина, которые окрашивают колонии гонококка сначала в розовый, затем в красный, а через несколько минут – в черный цвет. Исследуют также чувствительность гонококков к антибиотикам и его бета-лактамазную активность.
Серологический метод (определение антител к гонококку в крови пациентов с помощью РСК и ИФА) не является строго регламентированным, не представляет диагностической ценности, не является методом контроля эффективности проводимого лечения и в реальной практике в настоящее время не используется.
Генодиагностика. Направлена на обнаружение специфических фрагментов ДНК гонококка с помощью ПЦР и может быть использована в качестве дополнительного высокоинформативного метода диагностики гонореи.
Не нашли то, что искали? Воспользуйтесь поиском:
Глава 17. Гонококки
Neisseria gonorrhoeae входят в семейство Neisseriaceae, род Neisseria. Гонококки обнаружены Нейссером в 1879 г. и в честь его названо все семейство.
Морфология. Гонококки - это диплококки, состоящие из двух бобовидных кокков, лежащих вогнутыми сторонами друг к другу (напоминают кофейные зерна). Размер гонококков 1,2-1,3 × 0,7-0,8 мкм. Они полиморфны, наряду с крупными встречаются очень мелкие, неправильной формы L-формы бактерий. Гонококки неподвижны, спор не имеют. В патологическом материале (гное) обнаруживают капсулообразное вещество. Грамотрицательны. Под влиянием лекарственных и других веществ быстро изменяются: появляются грамположительные формы. В патологическом материале располагаются внутриклеточно (в лейкоците), но могут быть вне клетки. Могут находиться в виде отдельных кокков (см. рис. 4).
Культивирование. Гонококки - аэробы. Очень требовательны к питательным средам. Растут на средах, содержащих нативный белок (человеческий) - кровь, сыворотку, при температуре 37° С и рН среды 7,2-7,4. Среды должны быть свежеприготовленными и влажными. Посев следует производить сразу после взятия материала. На сывороточной среде гонококки образуют мелкие колонии 1-2 мм, прозрачные, блестящие с ровными краями, напоминающие капельки росы. На кровяной среде гемолиза не дают. В сывороточном бульоне они дают слабое помутнение и пленку, которая оседает на дно пробирки. При скудном росте через 24 ч посевы оставляют в термостате на вторые сутки.
Ферментативные свойства. Сахаролитические свойства слабо выражены. Гонококки расщепляют только один сахар - глюкозу с образованием кислоты. Протеолитическими свойствами не обладают.
Токсинообразование. В клеточной стенке гонококков имеется токсическая субстанция - липополисахарид (мало изучен).
Антигенная структура. Антигенная структура неоднородна и легко изменяется под влиянием факторов внешней среды. Общепринятого деления гонококков на серовары и серотипы пока нет.
Устойчивость к факторам окружающей среды. Во внешней среде гонококки мало устойчивы. При температуре 56-60° С они погибают. При температуре 40° С их жизнеспособность резко снижается. Низкие температуры и высушивание их быстро губят. Но в гное они сохраняются до 24 ч. Дезинфицирующие растворы - 1% раствор фенола, сулема 1:1000 убивают гонококки в течение нескольких минут. Особенно гонококки чувствительны к солям серебра - 1% раствор серебра нитрата губит их сразу. УФ-лучи убивают их в течение нескольких минут.
Восприимчивость животных. Животные не чувствительны к гонококку. Однако внутрибрюшинное введение белым мышам гонококкового токсина вызывает их гибель.
Источники инфекции. Больной гонореей человек.
Пути передачи. Контактно-бытовой (половой), реже через зараженные предметы (полотенце, губки и др.).
Заболевания у человека. Гонорея и бленнорея.
Патогенез. Естественным хозяином гонококков является больной человек. Гонококки проникают через слизистые оболочки уретры (у женщин - уретры и шейки матки). Фактором патогенности гонококков является наличие у них пилей, которые, соединяясь с микроворсинками цилиндрического эпителия, способствуют проникновению гонококка внутрь клетки эпителия, обусловливая в слизистой оболочке острый воспалительный процесс.
Клинически гонорея проявляется болями при мочеиспускании, выделениями гноя из уретры и влагалища. Заболевание протекает остро, но иногда переходит в хроническую форму. Гонококки могут вызвать гонорейный конъюнктивит - бленнорею (гнойное воспаление слизистой оболочки глаз у новорожденных). Гонококки редко проникают из уретры в другие органы, но иногда они могут быть причиной артритов, эндокардитов и т. д.
Иммунитет. Естественной резистентности к гонококкам нет. Перенесенное заболевание также не создает иммунитета. Наблюдающийся фагоцитоз носит незавершенный характер.
Профилактика. Санитарное просвещение. Повышение культурно-гигиенического уровня. Специфической профилактики нет. Для профилактики бленнореи детям сразу после рождения обязательно вводят в конъюнктивальный мешок 1-2 капли 30% раствора альбуцида.
Лечение. Антибиотики (пенициллин, бициллин, стрептомицин и др.). Применяют также сульфаниламидные препараты. При хронической форме используют гонококковую вакцину.
1. Опишите морфологические свойства гонококков.
2. Каковы ферментативная активность и токсинообразование гонококков?
3. Какова устойчивость гонококков. К какому препарату гонококки особенно чувствительны?
4. Какие заболевания вызывают гонококки и их патогенез.
Цель исследования: выявление гонококков и противогонококковых антител.
1. Отделяемое слизистой оболочки уретры у мужчин.
2. Отделяемое слизистой оболочки уретры и шейки матки у женщин.
3. Гнойные выделения из глаз.
4. Кровь для получения сыворотки.

Способы сбора материала
Примечание. Для бактериоскопического и бактериологического исследования материал берут: 1) до начала лечения антибиотиками: 2) не ранее чем через 10 дней после окончания лечения антибиотиками; 3) не ранее чем через 2 ч после последнего мочеиспускания; 4) не ранее чем через 2 ч после спринцевания.
1. Микроскопический (главным образом используется при острых формах).

Первый день исследования
Вынимают посевы из термостата и просматривают их. Изучают колонии. Делают мазки. При наличии подозрительных грамотрицательных диплококков колонии пересевают на скошенную среду в пробирках (среда должна быть свежеприготовленной и содержать достаточное количество конденсата) и ставят пробу на оксидазу. Для этого пипеткой на колонию наносят каплю 1% раствора диметилпарафенилендиамина, колонии изменяют цвет от темно-коричневого до черного.
Вынимают посевы из термостата, делают мазки со скошенного агара, окрашивают по Граму и микроскопируют. Засевают на среды Гисса (лактозу, глюкозу, маннит и мальтозу). Эти углеводы должны содержать 30% сыворотки крови. Засеянные пробирки ставят в термостат.
Вынимают пробирки из термостата, при отсутствии роста оставляют их в термостате еще на 1-2 дня. При наличии роста учитывают результаты (табл. 28).
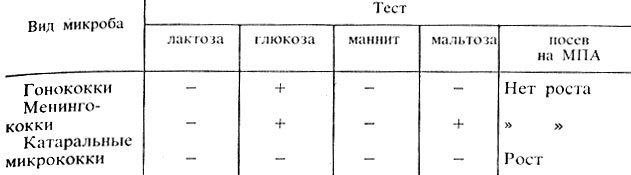
Таблица 28. Дифференциация гонококков от других нейссерий
Третья неделя заболевания. При хроническом течении заболевания и в сомнительных случаях ставят РСК с сывороткой больного (см. главу 12). В качестве антигена используют убитую культуру гонококков, которую готовят в производственных условиях. Можно применить реакцию непрямой гемагглютинации (см. главу 12).
1. Какой материал служит для выявления гонококков и каким способом его получают?
2. Через сколько времени после мочеиспускания (или спринцевания у женщин) можно брать материал для исследования?
3. Какой метод исследования является основным при острой форме и какой - при хронической форме гонореи?
4. Когда и какую серологическую реакцию ставят при подозрении на гонорею?
5. От каких микроорганизмов необходимо дифференцировать гонококки?
Получите у преподавателя препарат. Изучите его и зарисуйте гонококки, расположенные внутри лейкоцита и вне его при окраске по Граму.
Желточная среда. К 100 мл МПА из кроличьего мяса добавляют 15 мл желтка (свежего куриного яйца), 6 мл индикатора фенолового красного, 1,5 мл сахара, растворенного в 1 мл стерильной дистиллированной воды.
Питательная среда асцит-агар. К фильтрату бульона, приготовленного из кроличьего мяса, добавляют 2% агар, 1% пептон и 0,5% хлорид натрия. Нагревают до растворения агара, устанавливают рН 7,4-7,5, подщелачивают 20% гидроксидом натрия. Среду доводят до кипения, фильтруют, разливают в стерильные флаконы и стерилизуют в автоклаве 15 мин при 115° С.
Рецепты безасцитных питательных сред (МПА рН 7,4-7,5).
1) мясной воды из кроличьего мяса или бычьих сердец - 100 мл
гидролизата казеина - 2 мл
дрожжевого аутолизата - 2 мл
сыворотки крови крупного рогатого скота - 20 мл
2) мясной воды из кроличьего мяса или бычьих сердец - 100 мл
5% раствор гемогидролизата - 2 мл
дрожжевого аутолизата - 2 мл
сыворотки рогатого скота - 20 мл
3) мясной воды из кроличьего мяса или бычьих сердец - 100 мл
желтка куриного яйца - 10 мл
сыворотки крови рогатого скота - 20 мл
Рост гонококков на этих средах обильный. Колонии гонококка могут быть выявлены с помощью пробы на оксидазу, при которой они окрашиваются в красный цвет, переходящий в черный.
Эффективность бактериологического метода исследования в
значительной степени определяется качеством питательных сред. В
нашей стране наиболее широко апробированы и используются два вида
питательных сред: асцит-агар и безасцитные питательные среды.
Основой обеих сред является мясопентонный агар (МПА) из мяса
кроликов или свежих бычьих сердец. Методика его приготовления
заключается в следующем. Мясо кролика освобождают от жира и
сухожилий, пропускают через мясорубку или измельчают ножом,
взвешивают, заливают двойным объемом водопроводной воды и в таком
виде оставляют в холодильнике при 4ё на сутки для экстрагирования.
Затем массу нагревают до кипения, кипятят 10 минут, охлаждают и
фильтруют через марлю. К фильтрату добавляют 2% агар-агара, 1%
пептона и 0,5% хлорида натрия, нагревают до растворения агар-агара
и устанавливают рН=7,5-7,6 (подщелачивание производят 20%
раствором едкого натрия). Среду доводят до кипения, фильтруют
через ватно-марлевый фильтр, разливают по стерильным флаконам или
колбам и стерилизуют в автоклаве 15-20 минут при 0,5 атмосферы по
Техника приготовления МПА из свежих бычьих сердец та же,
только кипячение массы измельченных сердец в воде следует
производить 20 минут вместо 10.
Возможно приготовление основы питательной среды без пептона.
При этом пользуются вышеизложенной методикой приготовления МПА, но
исключают из его состава пептон, измельченное мясо кролика кипятят
5 минут вместо 10 и стерилизуют среду в автоклаве в течение 10
минут при 0,8 атмосферы по манометру (117ё).
Асцитическая жидкость должна быть получена от больных с
асцитом, причиной которого является сердечная недостаточность, и
не должна содержать желчных пигментов. Забор асцитической жидкости
производят через троакар в стерильную бутыль и добавляют к ней 5%
хлороформа для наркоза. В течение 10 дней жидкость перемешивают с
хлороформом путем вращения бутыли, затем ее оставляют при
комнатной температуре до полного оседания хлороформа на дно бутыли
и просветления жидкости. После этого по мере надобности прозрачную
асцитическую жидкость разливают по 50 мл в стерильные колбы с
ватными пробками и ежедневно в течение 3 дней их помещают в
водяную баню при температуре 56ё на 1 час для испарения хлороформа
через ватную пробку. После проверки асцитической жидкости на
стерильность она может быть использована для обогащения
питательной среды для выделения гонококка в концентрации 1/3 и 1/4
объема среды, что определяют опытным путем.
Рецепты безасцитных питательных сред
1. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, гидролизат казеина для парентерального
белкового питания - 2 мл, дрожжевой аутолизат - 2 мл, сыворотка
крови крупного рогатого скота - 20 мл (среда КДС-1).
2. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, 5% раствор гемогидролизата - 2 мл,
дрожжевой аутолизат - 2 мл, сыворотка крови крупного рогатого
скота - 20 мл (среда ГДС-2).
3. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, среда 199 для культур тканей без
антибиотиков - 20 мл, дрожжевой аутолизат - 2 мл, сыворотка крови
крупного рогатого скота - 20 мл (среда 199-СДС).
4. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, желток свежего куриного яйца - 10 мл,
сыворотка крови крупного рогатого скота - 20 мл (среда ЖС).
Яичный желток получают стерильно из диетических куриных яиц
непосредственно перед приготовлением среды. Для этого,
предварительно обработав спиртом, скорлупу вскрывают стерильным
пинцетом и содержимое яйца выливают в стерильную воронку. После
того как белок вытечет, оставшийся в воронке желток переносят в
стерильную посуду и мерной пипеткой берут необходимый для
изготовления питательной среды объем желтка.
Приготовление дрожжевого аутолизата заключается в следующем.
Пекарские дрожжи измельчают и закладывают в бутыль, превышающую по
объему взятые дрожжи в 4 - 5 раз, и оставляют для аутолиза на двое
суток в сушильном шкафу или термостате при 60ё. Затем густую
коричневую массу разбавляют тройным объемом теплой водопроводной
воды, хорошо перемешивают и дважды центрифугируют по 10 минут при
1000 оборотов в минуту (до просветления жидкости). Надосадочную
жидкость сливают, добавляют к ней 0,5% хлористого натрия, доводят
рН до 7,4-7,5 и автоклавируют 30 минут при 1 атмосфере по
манометру (120ё). Хранят в мелкой расфасовке в холодильнике при
Дрожжевой аутолизат может быть заменен 1,5% раствором
экстракта кормовых дрожжей (ЭКД) в том же количестве (2 мл) 1,5%
раствор ЭКД готовят в лаборатории из сухого ЭКД, растворяя его в
стерильной дистиллированной воде. Приготовленный таким образом
жидкий экстракт разливают по стерильным пробиркам и стерилизуют в
автоклаве при 0,5 атмосферы по манометру в течение 20 минут.
Во всех вышеуказанных питательных средах сыворотка крови
крупного рогатого скота может быть заменена нормальной нативной
сывороткой для бактериологических питательных сред, которая
является той же самой сывороткой, но с добавлением консерванта.
Приготовление обогащенной среды
МПА, находящийся во флаконе или колбе, растапливают в водяной
бане, охлаждают до 56-58ё и добавляют к нему ингредиенты в
соотношениях, указанных ранее в рецептах. Обогащенный МПА по 3-3,5
мл разливают в стерильные пробирки, среду скашивают и увлажняют
0,5 мл стерильного мясопептонного бульона или изотонического
раствора хлорида натрия после того, как она застынет. Для проверки
на стерильность среду помещают в термостат при 35-37ё на сутки.
Все вышеуказанные безасцитные среды, кроме яичной, прозрачны,
на них легко дифференцировать колонии микроорганизмов. Среда,
обогащенная яйцом, отличается мутностью, она желтая, выросшие на
ней колонии, в частности, гонококки, плохо различимы. Однако рост
гонококка на этой среде обильный и его колонии легко могут быть
обнаружены путем обработки роста 1% раствором
диметилпарафенилендиамина или другого реактива на оксидазу,
который окрашивает колонии гонококка в красный цвет, хорошо
контрастирующий на желтом фоне среды. Использование желточной
среды без обработки роста микроорганизмов реактивом на оксидазу не
Качество каждой новой серии питательной среды лабораторного
изготовления необходимо проверять путем посева на нее
патологического материала от больных, у которых бактериоскопически
Срок хранения МПА в холодильнике при 4ё не должен превышать 1
месяц, обогащенной среды - 7 суток.
В связи с тем, что для вышеуказанной среды возможен малый срок
хранения, разработана методика производственного изготовления
лиофилизированной безасцитной питательной среды, которая под
названием "Питательная среда для выделения гонококков, сухая"
выпускается в двух флаконах: часть I (основа среды) и часть II
(обогащающие вещества). Для приготовления рабочей среды в часть I
нужно добавить 100 мл стерильной дистиллированной воды и подогреть
в водяной бане при 100ё до полного растворения содержимого флакона
(в пределах 30 минут). Лишнее время выдерживать среду в водяной
бане не следует, т.к. это снижает ее качество. В часть II вносят
24 мл стерильной дистиллированной воды (растворение обогащающих
веществ наступает немедленно). Затем при соблюдении условий
стерильности часть II переносят в охлажденную до 56ё часть I,
смешивают, разливают по стерильным пробиркам, скашивают и
увлажняют как описано ранее.
Сухая среда готовится из кроличьего мяса или бычьих сердец,
помимо приведенных в рецепте 1 (среда КДС-1) обогащающих веществ
она содержит оротовую кислоту в концентрации 1 мкг/мл. Среда
высокого качества, удобна для использования в бактериологических
лабораториях, т.к. для перевода сухой среды в рабочую требуется
лишь стерильная дистиллированная вода.
Использование безасцитной питательной среды с добавлением
антибиотиков и оротовой кислоты дает хорошие результаты при
бактериологической диагностике, в том числе экстрагенительной
гонореи: гонореи миндалин и глотки, прямой кишки. Антибиотики
добавляют для подавления роста сопутствующей гонококку
бактериальной флоры, что повышает интенсивность роста гонококка,
облегчает обнаружение его единичных колоний и выделение в чистой
культуре. Добавляют 20,0 ЕД/мл полимиксина М сульфата и 6,2 ЕД/мл
ристомицина сульфата; вместо последнего можно использовать
линкомицин гидрохлорид - 2 мкг/мл. Оротовую кислоту вводят в
состав питательной среды в количестве 1 мкг/мл.
Для этого берут навеску оротовой кислоты 1 мг (1000 мкг) и
разводят в 1,0 мл стерильной дистиллированной воды (получают
рабочий раствор, содержащий 1000 мкг который может сохраняться в
холодильнике в течение 10 дней) и стерилизуют в водяной бане 15
минут, затем отбирают 0,1 мл полученного раствора и добавляют к
100 мл обогащенной питательной среды. Среду с антибиотиками
необходимо использовать одновременно со средой без антибиотиков
(одна пробирка со средой с антибиотиками, другая - без них), т.к.
хотя и редко, но встречаются штаммы гонококка, чувствительные к
Среда сохранения (транспортировки)
Состав среды сохранения: 1) 1 литр дистиллированной воды,
свободной от хлора, 30 г агар-агара; 2) 900 мл дистиллированной
воды, свободной от хлора, 2 мл тиогликоловой кислоты, 12 мл 1М
раствора едкого натрия, 100 мл 20% водного раствора натрия
фосфорнокислого однозамещенного, 20 мл 1% раствора хлористого
кальция. Последнюю смесь (2) прибавляют к свежеприготовленному
агару (1), доводят рН до 7,3-7,4, по 10 мл среду разливают в
стерильные пробирки, стерилизуют текучим паром в течение 1 часа.
Ватные тампоны на деревянных палочках или стержнях из
нержавеющей стали диаметром около 2 мм, вмонтированные в ватные
пробки, кипятят 20 минут в фосфатном буфере, рН=7,4, и
импрегнируют в течение 24 часов в 1% водной суспензии тонко
измельченного древесного угля. После высушивания ватные тампоны
подправляют, вставляют в бактериологические пробирки
соответствующего диаметра (равного диаметру пробирок со средой) и
стерилизуют в автоклаве 20 минут при 1 атмосфере (температура
Для приготовления фосфатного буфера готовят два раствора: 1
раствор - в 1 л дистиллированной воды растворяют 28,4 г натрия
фосфорнокислого двухзамещенного (0,2М); 2 раствор - в 1 л
дистиллированной воды растворяют 27,8 г лимонной кислоты (0,1 М).
Смешивают 181,7 мл 1 раствора и 18,3 мл 2 раствора.
Производство посева с использованием среды сохранения
осуществляется следующим образом. Врач, осматривающий больного,
извлекает из пробирки тампон, вводит его в очаг заболевания на
несколько секунд для пропитывания (можно сделать несколько
движений по и против часовой стрелки), извлекает его, не касаясь
окружающих предметов, в пробирку со средой сохранения. Поверх
ватной пробки пробирку закрывают резиновой соской. До отправки
материала в бактериологическую лабораторию посевы сохраняют при 4ё
в холодильнике минимальный срок, но не более суток. Одновременно
берут патологический материал и делают мазки для
бактериоскопического исследования, которые направляют в
лабораторию вместе с посевом. В бактериологической лаборатории
немедленно после поступления тампоны с патологическим материалом
вынимают из среды сохранения и ими производят посев по поверхности
скошенной питательной среды в пробирках. Каждым тампоном делают
посев на питательную среду в двух пробирках. Посев по поверхности
питательной среды следует производить зигзагообразными движениями
вдоль поверхности среды, вращая тампон. Если диаметр пробирок со
средой сохранения и питательной средой аналогичен, можно тампон
после посева оставить во второй пробирке в соприкосновении с
питательной средой. Посевы помещают в термостат и выращивают при
36-37ё в эксикаторе. Следует иметь в виду, что при использовании
среды сохранения рост гонококка может наступить позже, чем при
непосредственном посеве патологического материала на питательную
Работа с культурами
Выращивание гонококков можно производить в пробирках или
чашках Петри; первый способ обеспечивает значительную экономию
среды. Для повышения процента высеваемости гонококков засеянные
питательные среды помещают в термостат в эксикаторе с 20%
содержанием углекислого газа, который получают в результате
реакции между серной кислотой и бикарбонатом натрия: в эксикатор
объемом 5 литров помещают стакан с 50 мл 10% серной кислоты, в
Читайте также:


