Гематоэнцефалический барьер при вич
Обнаружение ВИЧ в эндотелиальных клетках капилляров мозга и способность вируса инфицировать эти клетки in vitro указывают на то, что эндотелий может выступать в качестве первичного места проникновения ВИЧ. Впоследствии, как наблюдалось в культуре клеток глиомы (астроцитов), ВИЧ может инфицировать астроциты, связанные с ге-матоэнцефалическим барьером.
Таким образом, циркулирующий в крови ВИЧ способен сначала инфицировать клетки эндотелия сосудов в мозге, а затем отпочковываться от их базолатеральной поверхности и инфицировать астроциты. Другой механизм может заключаться в инфицировании астроцитов путем диапедеза инфицированных клеток или переноса ВИЧ через эндотелиальные клетки с помощью трансцитоза, без инфицирования самих эндотелиальных клеток.
Недавно было показано, что в этом процессе участвует оболочка вируса. Последующие мутационные изменения вируса могут определять его способность распространяться из астроцитов и вызывать поражение ЦНС (т.е. выступать в качестве нейровирулентного штамма).
Ранние наблюдения, сделанные на SIV, говорят в поддержку необходимости проникновения вируса через гематоэнцефалический барьер при инфицировании мозга. Штаммы SIV, обладающие сродством к лимфоцитам, не могут реплицироваться в мозге, и некоторые изоляты вирусов, обладающие сродством к макрофагам, не могут вызывать заболеваний ЦНС у приматов, если они не введены непосредственно в мозг.
Также стоит отметить, что репликация штаммов SIV, обладающих сродством к макрофагам, в крови и других тканях исследованных животных не вызывала развития заболевания (например, через циркулирующие цитокины) и инфицированные Т-клетки и макрофаги не обнаруживались в ЦНС. Таким образом, у животных проникновение свободного вируса, по-видимому, является первичным этапом нейропатогенеза. Впоследствии может произойти появление нейротропных штаммов.
Изучение межвирусных рекомбинантов SIV подтверждает, что само по себе сродство к макрофагам не является достаточным условием для развития неврологических заболеваний. Участки трансмембранного белка оболочки и/или nef отвечают за свойство нейровирулентности. По-видимому, необходима эволюция вируса, поскольку некоторые исследования указывают на то, что ряд штаммов SIV обладают нейроинвазивностью, но не проявляют патогенных свойств. Кроме того, нейропатогенные вирусы не обязательно способны проникать через гематоэнцефалический барьер.
Таким образом, неспособность вируса инфицировать эндотелиальные клетки мозга (или проникать через фенестры между ними) и способность инфицировать определенные клетки мозга (например, микроглию и астроциты) могут представлять собой важные факторы, определяющие нейротропные свойства вируса.
Некоторые исследования указывают на то, что пассаж штаммов SIV, обладающих сродством к макрофагам, in vivo может приводить к отбору вируса, который легко проникает через кровь в мозг обезьян, вызывая развитие заболеваний ЦНС. Определенная группа нейровирулентных SIV со сродством к макрофагам (R5), по-видимому, вызывает развитие заболеваний мозга после проникновения через гематоэнцефалический барьер.
Было показано, что некоторые SIV с подтвержденными нейротропными свойствами способны инфицировать эндотелиальные клетки. В этом случае нейропатогенез вируса лейкемии мышей определяется его способностью инфицировать эндотелиальные клетки капилляров мозга.
Поскольку астроциты участвуют в поддержании целостности гематоэнцефалического барьера, такое предполагаемое инфицирование мозгового эндотелия и впоследствии астроцитов (см. ниже) способно вызывать нарушение гематоэнцефалического барьера. Инфицирование эндотелиальных клеток также может приводить к выделению TNF, вызывающему увеличение проницаемости эндотелия и усиление экспрессии молекул адгезии, что способствует проникновению инфицированных вирусом клеток.
Кроме того, другие провоспалительные цитокины, в частности IL-6 и IL-10, вырабатываемые активированными клетками иммунной системы, могут влиять на миграцию инфицированных и неинфицированных моноцитов через эндотелий. Вирусные белки Tat и gp41 также способны увеличивать проницаемость гематоэнцефалического барьера и нарушать его целостность. Токсические вещества, а также инфицированные клетки могут проникать в мозг и вызывать развитие деменции и других неврологических расстройств.
Аргументы против этой теории заключаются в том, что другие вирусы, например ЦМВ, способны инфицировать эндотелиальные клетки и астроциты, но, очевидно, не вызывают развития таких неврологических расстройств, как, например, вакуолярная миелопатия, которая встречается при ВИЧ-инфекции. Однако ЦМВ может вызывать развитие вирулентного энцефалита у больных СПИДом.
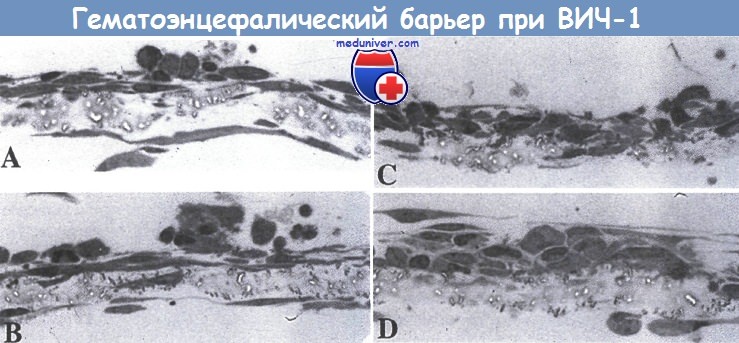
Исследование с помощью световой микроскопии миграции ВИЧ-1-инфицированных и неинфицрованных моноцитов через гематоэнцефалический барьер на модели эндотелия микрососудов костного мозга.
(А) Неинфицированные контрольные моноциты.
(В) ВИЧ-инфицированные клетки, добавленные к гематоэнцефалическому барьеру; они атакуют, но не повреждают эпителиальные клетки микрососудов костного мозга, и астроциты остаются интактными. Активированные с помощью липополисахарида
(С) и ВИЧ-инфицированные
(D) моноциты вызывают изменения морфологии эндотелиальных клеток, и моноциты проникают сквозь барьер. Можно видеть частичное отделение астроцитов от мембраны в местах активной миграции моноцитов; увеличение, х 126,000. 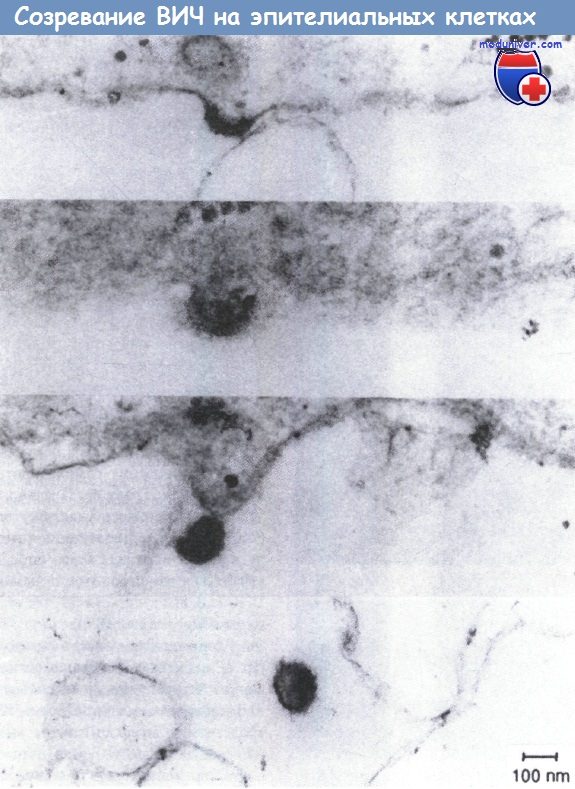
Созревание ВИЧ-1 на базолатеральных поверхностях поляризованных эпителиальных клеток. Монослой клеток обезьяны выращивали до конфлуентного состояния на фильтрах Millicel-HA и подготавливали для электронной микроскопии.
Можно наблюдать все стадии сборки вирусных частиц, от первых признаков отпочкования (наверху) до окончательного высвобождения дочерних вирионов (внизу).
Лечение. Стратегия профилактики и лечения предусматривает борьбу с самой ВИЧ-инфекцией, симптоматическое лечение при поражении нервной системы, лечение оппортунистических инфекций и заболеваний, консультирование, санитарно-просветительную работу. Специфическое лечение включает противовирусную и иммунотерапию.
Проведены клинические испытания более 30 препаратов с противовирусным действием для лечения ВИЧ-инфекции. Наиболее известен ретровир (зидовудин, АZТ, азидотимидин), дающий доказанный виростатический эффект. Ретровир является конкурентным ингибитором обратной транскриптазы, отвечающей за образование провирусной ДНК на матрице ретровирусной РНК. Активная трифосфатная форма ретровира, являясь структурным аналогом тимидина, конкурирует с эквивалентным производным тимидина за связывание с ферментом. Эта форма ретровира не имеет необходимых для синтеза ДНК 3'-ОН группировок. Таким образом, цепь провирусной ДНК не может наращиваться. Конкуренция ретровира с обратной транскриптазой ВИЧ примерно в 100 раз больше, чем с альфа-полимеразой клеточной ДНК человека. Критерием для назначения азидотимидина является снижение уровня Т-хелперов ниже 250—500 на 1 мм? или появление вируса в крови. Препарат используется для лечения больных СПИДом во всех стадиях, показано его благоприятное влияние на больных с ВИЧ-ассоциированным познавательно-двигательным комплексом, включая СПИД-деменцию и миелопатию, а также с ВИЧ-ассоциированными полиневропатиями, миопатиями. Ретровир используется для профилактики развития неврологических проявлений ВИЧ-инфекции и оппортунистических процессов. Препарат проникает через ГЭБ, его уровень цереброспинальной жидкости составляет около 50 % от уровня в плазме. В качестве начальной дозы для больных с массой тела около 70 кг рекомендуется принимать по 200 мг каждые 4 ч (1200 мг в день). В зависимости от клинического состояния больных и лабораторных показателей дозировки могут варьировать от 500 до 1500 мг в день. Необходимость в подборе индивидуальных доз может возникать у больных с проявлениями побочных эффектов или при тяжелых проявлениях СПИДа с истощением ресурсов костного мозга, что проявляется лейкопенией и анемией. Для уменьшения выраженности гематоксических эффектов препарат часто сочетают с эритро– или гемопоэтином, витамином В12. Среди других возможных побочных эффектов следует отметить анорексию, астению, тошноту, поносы, головокружения, головную боль, лихорадку, нарушения сна, извращения вкуса, сыпь, снижение психической активности, появление чувства тревоги, учащение мочеиспускания, генерализованные боли, озноб, кашель, одышку. Убедительных данных об особенностях острой передозировки пока нет, при проявлении побочных эффектов при длительном приеме может быть полезен гемодиализ. В настоящее время ретровир остается единственным формально разрешенным противовирусным препаратом для лечения СПИДа, в том числе первичных поражений нервной системы. Учитывая большое количество тяжелых побочных эффектов ретровира, в настоящее время ведутся клинические испытания других нуклеозидных производных, у которых миелотоксическое действие выражено слабее.
Учитывая роль аутоиммунных реакций в развитии поражений периферической нервной системы при СПИДе, для лечения в некоторых случаях эффективны кортикостероиды и цитостатики, плазмаферез. Для коррекции иммунодефицита используют различные иммуностимуляторы. Среди них цитокины (альфа– и бета-интерфероны, интерлейкины и др.), иммуноглобулины, гемопоэтические факторы роста. Восстановительная иммунотерапия до последнего времени не давала значительных клинических эффектов, позволяя только несколько затормозить развитие патологического процесса. В последние годы редко осуществляют пересадку костного мозга из-за большого количества побочных реакций и незначительной эффективности этой процедуры. Исследуется использование факторов тимуса, растворимого рекомбинантного рецептора Т-лимфоцитов С04, способного предупреждать попадание вируса в клетку, рекомбинантных и высокоочищенных белков оболочки ВИЧ в качестве вакцин.
Прогноз. При наличии неврологических проявлений СПИДа, как правило, неблагоприятный. Пока не известны случаи излечения от ВИЧ-инфекции, хотя возможно многолетнее бессимптомное вирусоносительство. Основное значение в борьбе с ВИЧ-инфекцией придается профилактическим мероприятиям, которые уже позволили снизить темпы роста числа инфицированных лиц.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Авторы, проанализировав материалы, полученные при исследовании 166 случаев менингоэнцефалита разной этиологии у ВИЧ-инфицированных лиц, получили результаты, которые свидетельствуют, что изменения структуры гематоэнцефалического барьера и его элементов, а также биохимические сдвиги в спинномозговой жидкости у всех исследовавшихся больных имели общий характер и одинаковую направленность. Поскольку менингоэнцефалит у обследованных был вызван различными этиологическими факторами, авторы приходят к заключению, что поражение головного мозга у них обусловлено в первую очередь изменениями гематоэнцефалического барьера, связанными с внедрением ВИЧ. Присоединение оппортунистической инфекции того или иного вида только усиливает отдельные механизмы повреждения, что проявляется клиническими особенностями менингоэнцефалита, в то время как основной патологический процесс остается в этих случаях очень сходным, так как обусловлен действием ВИЧ.
Автори, проаналізувавши матеріали, отримані при дослідженні 166 випадків менінгоенцефаліту різної етіології у ВІЛ-інфікованіх осіб, отримали результати, які свідчать, що зміни структури гематоенцефалічного бар’єра і його елементів, а також біохімічні зрушення в спинномозковій рідині в усіх хворих, які досліджувалися, мали загальний характер і однакову спрямованість. Оскільки менінгоенцефаліт в обстежених був викликаний різними етіологічними чинниками, автори дійшли висновку, що ураження головного мозку в них обумовлене в першу чергу змінами гематоенцефалічного бар’єра, пов’язаними з укоріненням ВІЛ. Приєднання опортуністичної інфекції того або іншого виду лише підсилює окремі механізми пошкодження, що проявляється клінічними особливостями менінгоенцефаліту, тоді як основний патологічний процес залишається в цих випадках дуже схожим, оскільки обумовлений дією ВІЛ.
While analyzing data of examination of 166 cases of meningoencephalitis of various etiology, the authors obtained results, that testify to changes of blood-brain barrier and its elements, and biochemical shifts in cerebrospinal fluid in all examined patients were of general character and the same direction. Since meningoencephalitis in examined patients was caused by different etiological factors the authors arrived at a conclusion that brain injury in them was associated with blood-brain barrier changes caused by HIV. Addition of opportunistic infection of someone or other type enhanced particular mechanisms of injury, that’s evident with clinical features of meningoencephalitis, as well as main pathological process remains very similar in these cases, because it’s associated with HIV action.
ВИЧ-инфекция — вирусное заболевание, характеризующееся длительным (от 2–3 недель до 8–18 лет) латентным периодом, полиморфной клинической картиной, прогрессирующей деструкцией иммунной системы и летальным исходом.
По прогностическим оценкам UNAIDS, распространение ВИЧ-инфекции в Украине составляет более 1,63 % населения (отчет 2008 г.). С начала эпидемии до 1 января 2010 года, по оценочным данным, в Украине зарегистрировано 360 тыс. ВИЧ-инфицированных лиц в возрасте от 15 лет и старше.
Согласно данным многочисленных исследователей [1, 6, 9, 10], у 50–90 % больных ВИЧ-инфекцией в стадии СПИДа регистрируются неврологические осложнения. Особо следует подчеркнуть, что в 20 % случаев они бывают первыми клиническими проявлениями заболевания ВИЧ-инфекцией.
Поражение центральной нервной системы (ЦНС), протекающее на фоне ВИЧ-инфекции в виде менингоэнцефалитов, — одна из ведущих причин летального исхода у больных с тяжелой иммуносупрессией.
Клинические проявления и течение энцефалитов и менингоэнцефалитов у больных с ВИЧ-инфекцией значительно отличаются от классических. В первую очередь отличается спектр возбудителей заболевания — это так называемые оппортунистические инфекции, различные микроорганизмы, вызывающие заболевание только на фоне иммунодефицита. Кроме того, клиника энцефалита наслаивается на имеющиеся у пациентов поражения ЦНС, вызванные непосредственно воздействием вируса иммунодефицита, что усугубляет прогноз заболевания [3, 7, 8].
Развитие оппортунистических инфекций в центральной нервной системе у больных ВИЧ-инфекцией в стадии СПИДа связано с прогрессированием общей иммуносупрессии, а также с непосредственным проникновением вируса или инфицированных им клеток в мозг. Этот процесс теснейшим образом связан с состоянием гематоэнцефалического барьера, поскольку основными типами клеток, которые поражаются вирусом иммунодефицита (ВИЧ) в мозге, являются макрофагоподобные клетки, происходящие из микроглии, либо проникающие резидентные макрофаги периферической крови. Также установлена способность ВИЧ поражать клетки эндотелия капилляров in vitro [2, 4, 5].
В то же время в имеющейся литературе мы не встретили данных об особенностях изменения структурных элементов гематоэнцефалического барьера у больных ВИЧ-инфекцией с разными формами поражения ЦНС, что обусловливает актуальность проведенных нами исследований.
Материалы и методы исследований
Материалом настоящего исследования послужили данные, полученные при обследовании 166 больных менингоэнцефалитом на фоне ВИЧ-инфекции, которые находились на лечении в стационаре Одесского областного центра по профилактике и борьбе со СПИДом. Из общего числа обследованных 106 человек были выписаны с улучшением и 60 умерли.
Всем больным проводили комплексное клиническое обследование, включавшее данные объективного неврологического наблюдения, компьютерную или магнитно-резонансную томографию, серологическое исследование сыворотки и иммунологические показатели крови (уровень СД4); методом полимеразной цепной реакции исследовали спинномозговую жидкость (СМЖ) для выявления этиологического фактора менингоэнцефалита, а также проводили комплексное биохимическое исследование ликвора.
Для гистологического исследования кусочки коры и белого вещества полушарий мозга фиксировали в 4% параформе, проводили через спирты возрастающей концентрации и заливали в целлоидин. Из полученных блоков изготовляли микротомные срезы толщиной 7 мкм. Полученные срезы окрашивали тионином и гематоксилин-эозином, импрегнировали коллоидным серебром (по Бильшовскому). Гистологические препараты исследовали под световым микроскопом фирмы Zeizz (модель Prima Star). Оценивали состояние эндотелия сосудов микроциркулярного русла, который является основным элементом гематоэнцефалического барьера, а также состояние астроцитарной глии и микроглии.
Результаты и их обсуждение
Этиологические причины, вызывавшие менингоэнцефалит у обследованных больных, приведены в табл. 1.
/030/030.jpg)
Как видно из табл. 1, у 50 % умерших и 33 % выписанных с клиническим улучшением больных этиология менингоэнцефалита осталась неуточненной. Можно полагать, что у части этих больных развитие менингита непосредственно связано с проникновением ВИЧ в вещество головного мозга. Среди менингоэнцефалитов уточненной этиологии наиболее частой причиной был токсоплазмоз — 29,5 % всех случаев, криптококк — 12,7 %, микобактерии туберкулеза — 12,0 %, цитомегаловирус — 6,6 %. Сравнивая процентное соотношение исходов менингитов и менингоэнцефалитов, можно отметить, что наиболее благоприятно протекает токсоплазменная инфекция.
Анализируя клиническую картину развития менинги-та/менингоэнцефалита у обследованных больных, мы можем отметить следующее: у большинства больных, независимо от этиологического фактора, была выявлена картина подострого энцефалита. Общими для всех форм клиническими проявлениями были лихорадка, головные боли, спутанность сознания, менингеальные знаки, очаговые неврологические нарушения. Следует заметить, что для больных с менингоэнцефалитом неуточненной этиологии вышеперечисленные симптомы были довлеющими. При остальных формах имели место некоторые отличия. Для токсоплазмозного менингоэнцефалита характерно преобладание лихорадочного состояния и очаговых неврологических проявлений; для цитомегаловирусного менингоэнцефалита — спутанность сознания в форме делирия и нарушение функции черепно-мозговых нервов; для туберкулезного — изменения психики от оглушенности до бреда или сопора; для криптококкового менингоэнцефалита — подострый характер течения менингита с умеренным общемозговым интоксикационным синдромом.
Результаты исследования СМЖ в зависимости от этиологии менингоэнцефалита представлены в табл. 2.
/031/031.jpg)
Как следует из табл. 2, эти изменения во многом были сходны: развитие менингоэнцефалита у ВИЧ-ин-фицированных всегда сопровождается достаточно значительным повышением содержания белка в спинномозговой жидкости. Следует отметить, что повышение было сопоставимым при разных этиоформах менингоэнцефалита. Для туберкулезного менингоэнцефалита увеличение было наибольшим. Содержание глюкозы в спинномозговой жидкости приближено к норме у больных с токсоплазменной и цитомегаловирусной этиологией менингоэнцефалита, значительно снижено при туберкулезном и криптококковом менингоэнцефалитах. Что касается цитоза (количество клеток в 1 мл спинномозговой жидкости), то изменение этого показателя теснее, чем других, связано с этиологией менингоэнцефалита. Наибольший цитоз отмечался при туберкулезном менингоэнцефалите, а наименьший — при токсоплазмозном и криптококковом менингоэнцефалитах. Для СМЖ во всех исследованных случаях независимо от этиологии менингоэнцефалита характерны нейтрофилез или лимфоцитоз спинномозговой жидкости. Особенностью туберкулезного менингоэнцефалита было самое большое содержание лимфоцитов в спинномозговой жидкости и самое низкое содержание нейтрофилов среди исследованных случаев.
В целом мы можем констатировать, что развитие менингоэнцефалита у ВИЧ-инфицированных больных, независимо от этиологии этого страдания, сопровождается однонаправленным и близким по значениям изменением показателей спинномозговой жидкости.
Морфологические исследования состояния компонентов гематоэнцефалического барьера у больных с ВИЧ-инфекцией, погибших при явлениях менингоэнцефалита, показали, что в них имеют место выраженные изменения. В капиллярах микроциркулярного русла имеет место набухание эндотелия. Базальная мембрана утолщена, рыхлая, местами наблюдается ее зернистый распад. Вокруг капилляров скопление клеточных элементов лимфоидного вида. В базальной мембране капилляров и мелких сосудов (артериолы, венулы) коллаген IV типа распределен неравномерно, участки с его умеренным количеством чередуются с участками, где определяются лишь единичные его волокна. В мелких артериях, как и в капиллярах, эндотелий набухший, местами его клетки нагромождены, цитоплазма их мутная, встречаются вакуоли. Базальная мембрана разрыхлена, местами с явлениями зернистого распада. Эластическая мембрана в них по протяженности неравномерной толщины. Периваскулярные пространства расширены, чаще пустые.
Астроциты, окружающие сосуды микроциркулярного русла, изменены. Количество их визуально мало отличается от данных контроля — 2–5 вокруг сосудов поверхностных слоев коры и 1–3 в глубоких слоях коры и белом веществе (в норме 1–5 и 3–5 соответственно). Размеры тел астроцитов визуально несколько увеличены, хотя есть астроциты обычных размеров. Форма округлая или полигональная. В теле астроцитов вокруг ядра зернистость, размеры зерен различны. В контроле такая зернистость не определяется. Отростки многочисленны, частью гладкие, частью ветвистые. Кроме того, часто о наличии астроцитов можно судить только по наличию отростков, т.к. на месте их тел определяется только скопление гранул разных размеров. Вокруг некоторых сосудов, в отличие от контроля, астроциты не определялись. Следует отметить, что изменения в составляющих гематоэнцефалического барьера были одинаковыми у больных с давностью серологической верификации ВИЧ-инфекции 3 года и давностью верификации более 5 лет, т.е. длительность патологического процесса не влияла на характер и распространенность изменений. Вместе с тем только у больных с менингоэнцефалитом установленной этиологии определялись сосуды без астроцитарной муфты и астроциты с гранулярным распадом тела.
Таким образом, результаты нашего исследования показали, что развитие менингоэнцефалита у ВИЧ-инфицированных сопровождается сходными изменениями биохимических показателей спинномозговой жидкости и компонентов гематоэнцефалического барьера. Особенности клинических проявлений, в свою очередь, коррелировали с характером этиофактора. Можно полагать, что фоновые изменения в головном мозге обусловлены прежде всего проникновением ВИЧ, а это возможно потому, что существенно повреждается гематоэнцефалический барьер. Присоединение оппортунистической инфекции и связанные с этим клинические проявления заболевания, по-видимому, усиливают отдельные уже проявившиеся механизмы повреждения, так как в целом изменения головного мозга при менингоэнцефалите с неустановленной этиологией сопровождаются такими же по выраженности и характеру изменениями мозга, как и при менингоэнцефалитах установленной этиологии.
1. ВІЛ-інфекція в Україні. Інформаційний бюлетень № 35. — К.: МОЗ України, Укр. центр профілактики і боротьби зі СНІДом, 2011. — 62 с.
2. Евтушенко С.К. и соавт. Диагностика и лечение поражений нервной системы у ВИЧ-инфицированных лиц при первичном и вторичном нейро-СПИДе. Методические рекомендации, утв. МЗ Украины, 2001. — 42 с.
3. Евтушенко С.К. и соавт. НейроСПИД как одна из актуальных проблем современной практической неврологии // Международный неврологический журнал. — 2006. — № 5(9). — С. 147-157.
4. Гойдык В.С. Токсоплазменный энцефалит у ВИЧ-ин-фицированных пациентов в неврологической практике / В.С. Гойдык, Н.А. Гуменюк, А.И. Гоженко // Український неврологічний журнал. — 2011. — № 2. — С. 71-75.
5. Леви Д.Э. ВИЧ и патогенез СПИДа: Монография / Д.Э. Леви; перевод 3-го издания с англ. Е. А. Монастырской. — М: Научный мир, 2010. — 736 с.
6. Маски ВИЧ-инфекции в клинике внутренних болезней / И.П. Кайдашев, Н.Д. Герасименко, В.В. Горбатенко [и др.] // Український терапевтичний журнал. — 2007. — № 2. — С. 57-65.
7. Сотниченко С.А. Анализ летальных исходов при ВИЧ-инфекции / С.А. Сотниченко // Эпидемиология и инфекц. болезни. — 2010. — № 4. — С. 31-34.
8. Тимченко В.Н. Поражение нервной системы при ВИЧ-ин-фекции / В.Н. Тимченко // Детские инфекции. — 2009. — Т. 8, № 1. — С. 32-35.
9. Яковлев Н.А. НейроСПИД: Неврологические расстройства при ВИЧ-инфекции, СПИДе / Н.А. Яковлев, Н.М. Жулев, Т.А. Слюсарь. — М.: МИА, 2005. — 278 с.
Особенности изменения гематоэнцефалического барьера ВИЧ-инфицированных больных с разными этиологическими возбудителями менингоэнцефалита
Авторы, проанализировав материалы, полученные при исследовании 166 случаев менингоэнцефалита разной этиологии у ВИЧ-инфицированных лиц, получили результаты, которые свидетельствуют, что изменения структуры гематоэнцефалического барьера и его элементов, а также биохимические сдвиги в спинномозговой жидкости у всех исследовавшихся больных имели общий характер и одинаковую направленность. Поскольку менингоэнцефалит у обследованных был вызван различными этиологическими факторами, авторы приходят к заключению, что поражение головного мозга у них обусловлено в первую очередь изменениями гематоэнцефалического барьера, связанными с внедрением ВИЧ. Присоединение оппортунистической инфекции того или иного вида только усиливает отдельные механизмы повреждения, что проявляется клиническими особенностями менингоэнцефалита, в то время как основной патологический процесс остается в этих случаях очень сходным, так как обусловлен действием ВИЧ.
Автори, проаналізувавши матеріали, отримані при дослідженні 166 випадків менінгоенцефаліту різної етіології у ВІЛ-інфікованіх осіб, отримали результати, які свідчать, що зміни структури гематоенцефалічного бар’єра і його елементів, а також біохімічні зрушення в спинномозковій рідині в усіх хворих, які досліджувалися, мали загальний характер і однакову спрямованість. Оскільки менінгоенцефаліт в обстежених був викликаний різними етіологічними чинниками, автори дійшли висновку, що ураження головного мозку в них обумовлене в першу чергу змінами гематоенцефалічного бар’єра, пов’язаними з укоріненням ВІЛ. Приєднання опортуністичної інфекції того або іншого виду лише підсилює окремі механізми пошкодження, що проявляється клінічними особливостями менінгоенцефаліту, тоді як основний патологічний процес залишається в цих випадках дуже схожим, оскільки обумовлений дією ВІЛ.
While analyzing data of examination of 166 cases of meningoencephalitis of various etiology, the authors obtained results, that testify to changes of blood-brain barrier and its elements, and biochemical shifts in cerebrospinal fluid in all examined patients were of general character and the same direction. Since meningoencephalitis in examined patients was caused by different etiological factors the authors arrived at a conclusion that brain injury in them was associated with blood-brain barrier changes caused by HIV. Addition of opportunistic infection of someone or other type enhanced particular mechanisms of injury, that’s evident with clinical features of meningoencephalitis, as well as main pathological process remains very similar in these cases, because it’s associated with HIV action.
ВИЧ-инфекция, менингоэнцефалит, гематоэнцефалический барьер.
ВІЛ-інфекція, менінгоенцефаліт, гематоенцефалічний бар’єр.
HIV-infection, meningoencephalitis, blood-brain barrier.
ВИЧ-инфекция — вирусное заболевание, характеризующееся длительным (от 2–3 недель до 8–18 лет) латентным периодом, полиморфной клинической картиной, прогрессирующей деструкцией иммунной системы и летальным исходом.
По прогностическим оценкам UNAIDS, распространение ВИЧ-инфекции в Украине составляет более 1,63 % населения (отчет 2008 г.). С начала эпидемии до 1 января 2010 года, по оценочным данным, в Украине зарегистрировано 360 тыс. ВИЧ-инфицированных лиц в возрасте от 15 лет и старше.
Согласно данным многочисленных исследователей [1, 6, 9, 10], у 50–90 % больных ВИЧ-инфекцией в стадии СПИДа регистрируются неврологические осложнения. Особо следует подчеркнуть, что в 20 % случаев они бывают первыми клиническими проявлениями заболевания ВИЧ-инфекцией.
Поражение центральной нервной системы (ЦНС), протекающее на фоне ВИЧ-инфекции в виде менингоэнцефалитов, — одна из ведущих причин летального исхода у больных с тяжелой иммуносупрессией.
Клинические проявления и течение энцефалитов и менингоэнцефалитов у больных с ВИЧ-инфекцией значительно отличаются от классических. В первую очередь отличается спектр возбудителей заболевания — это так называемые оппортунистические инфекции, различные микроорганизмы, вызывающие заболевание только на фоне иммунодефицита. Кроме того, клиника энцефалита наслаивается на имеющиеся у пациентов поражения ЦНС, вызванные непосредственно воздействием вируса иммунодефицита, что усугубляет прогноз заболевания [3, 7, 8].
Развитие оппортунистических инфекций в центральной нервной системе у больных ВИЧ-инфекцией в стадии СПИДа связано с прогрессированием общей иммуносупрессии, а также с непосредственным проникновением вируса или инфицированных им клеток в мозг. Этот процесс теснейшим образом связан с состоянием гематоэнцефалического барьера, поскольку основными типами клеток, которые поражаются вирусом иммунодефицита (ВИЧ) в мозге, являются макрофагоподобные клетки, происходящие из микроглии, либо проникающие резидентные макрофаги периферической крови. Также установлена способность ВИЧ поражать клетки эндотелия капилляров in vitro [2, 4, 5].
В то же время в имеющейся литературе мы не встретили данных об особенностях изменения структурных элементов гематоэнцефалического барьера у больных ВИЧ-инфекцией с разными формами поражения ЦНС, что обусловливает актуальность проведенных нами исследований.
Материалы и методы исследований
Материалом настоящего исследования послужили данные, полученные при обследовании 166 больных менингоэнцефалитом на фоне ВИЧ-инфекции, которые находились на лечении в стационаре Одесского областного центра по профилактике и борьбе со СПИДом. Из общего числа обследованных 106 человек были выписаны с улучшением и 60 умерли.
Всем больным проводили комплексное клиническое обследование, включавшее данные объективного неврологического наблюдения, компьютерную или магнитно-резонансную томографию, серологическое исследование сыворотки и иммунологические показатели крови (уровень СД4); методом полимеразной цепной реакции исследовали спинномозговую жидкость (СМЖ) для выявления этиологического фактора менингоэнцефалита, а также проводили комплексное биохимическое исследование ликвора.
Для гистологического исследования кусочки коры и белого вещества полушарий мозга фиксировали в 4% параформе, проводили через спирты возрастающей концентрации и заливали в целлоидин. Из полученных блоков изготовляли микротомные срезы толщиной 7 мкм. Полученные срезы окрашивали тионином и гематоксилин-эозином, импрегнировали коллоидным серебром (по Бильшовскому). Гистологические препараты исследовали под световым микроскопом фирмы Zeizz (модель Prima Star). Оценивали состояние эндотелия сосудов микроциркулярного русла, который является основным элементом гематоэнцефалического барьера, а также состояние астроцитарной глии и микроглии.
Результаты и их обсуждение
Этиологические причины, вызывавшие менингоэнцефалит у обследованных больных, приведены в табл. 1.
/030/030.jpg)
Как видно из табл. 1, у 50 % умерших и 33 % выписанных с клиническим улучшением больных этиология менингоэнцефалита осталась неуточненной. Можно полагать, что у части этих больных развитие менингита непосредственно связано с проникновением ВИЧ в вещество головного мозга. Среди менингоэнцефалитов уточненной этиологии наиболее частой причиной был токсоплазмоз — 29,5 % всех случаев, криптококк — 12,7 %, микобактерии туберкулеза — 12,0 %, цитомегаловирус — 6,6 %. Сравнивая процентное соотношение исходов менингитов и менингоэнцефалитов, можно отметить, что наиболее благоприятно протекает токсоплазменная инфекция.
Анализируя клиническую картину развития менинги-та/менингоэнцефалита у обследованных больных, мы можем отметить следующее: у большинства больных, независимо от этиологического фактора, была выявлена картина подострого энцефалита. Общими для всех форм клиническими проявлениями были лихорадка, головные боли, спутанность сознания, менингеальные знаки, очаговые неврологические нарушения. Следует заметить, что для больных с менингоэнцефалитом неуточненной этиологии вышеперечисленные симптомы были довлеющими. При остальных формах имели место некоторые отличия. Для токсоплазмозного менингоэнцефалита характерно преобладание лихорадочного состояния и очаговых неврологических проявлений; для цитомегаловирусного менингоэнцефалита — спутанность сознания в форме делирия и нарушение функции черепно-мозговых нервов; для туберкулезного — изменения психики от оглушенности до бреда или сопора; для криптококкового менингоэнцефалита — подострый характер течения менингита с умеренным общемозговым интоксикационным синдромом.
Результаты исследования СМЖ в зависимости от этиологии менингоэнцефалита представлены в табл. 2.
/031/031.jpg)
Как следует из табл. 2, эти изменения во многом были сходны: развитие менингоэнцефалита у ВИЧ-ин-фицированных всегда сопровождается достаточно значительным повышением содержания белка в спинномозговой жидкости. Следует отметить, что повышение было сопоставимым при разных этиоформах менингоэнцефалита. Для туберкулезного менингоэнцефалита увеличение было наибольшим. Содержание глюкозы в спинномозговой жидкости приближено к норме у больных с токсоплазменной и цитомегаловирусной этиологией менингоэнцефалита, значительно снижено при туберкулезном и криптококковом менингоэнцефалитах. Что касается цитоза (количество клеток в 1 мл спинномозговой жидкости), то изменение этого показателя теснее, чем других, связано с этиологией менингоэнцефалита. Наибольший цитоз отмечался при туберкулезном менингоэнцефалите, а наименьший — при токсоплазмозном и криптококковом менингоэнцефалитах. Для СМЖ во всех исследованных случаях независимо от этиологии менингоэнцефалита характерны нейтрофилез или лимфоцитоз спинномозговой жидкости. Особенностью туберкулезного менингоэнцефалита было самое большое содержание лимфоцитов в спинномозговой жидкости и самое низкое содержание нейтрофилов среди исследованных случаев.
В целом мы можем констатировать, что развитие менингоэнцефалита у ВИЧ-инфицированных больных, независимо от этиологии этого страдания, сопровождается однонаправленным и близким по значениям изменением показателей спинномозговой жидкости.
Морфологические исследования состояния компонентов гематоэнцефалического барьера у больных с ВИЧ-инфекцией, погибших при явлениях менингоэнцефалита, показали, что в них имеют место выраженные изменения. В капиллярах микроциркулярного русла имеет место набухание эндотелия. Базальная мембрана утолщена, рыхлая, местами наблюдается ее зернистый распад. Вокруг капилляров скопление клеточных элементов лимфоидного вида. В базальной мембране капилляров и мелких сосудов (артериолы, венулы) коллаген IV типа распределен неравномерно, участки с его умеренным количеством чередуются с участками, где определяются лишь единичные его волокна. В мелких артериях, как и в капиллярах, эндотелий набухший, местами его клетки нагромождены, цитоплазма их мутная, встречаются вакуоли. Базальная мембрана разрыхлена, местами с явлениями зернистого распада. Эластическая мембрана в них по протяженности неравномерной толщины. Периваскулярные пространства расширены, чаще пустые.
Астроциты, окружающие сосуды микроциркулярного русла, изменены. Количество их визуально мало отличается от данных контроля — 2–5 вокруг сосудов поверхностных слоев коры и 1–3 в глубоких слоях коры и белом веществе (в норме 1–5 и 3–5 соответственно). Размеры тел астроцитов визуально несколько увеличены, хотя есть астроциты обычных размеров. Форма округлая или полигональная. В теле астроцитов вокруг ядра зернистость, размеры зерен различны. В контроле такая зернистость не определяется. Отростки многочисленны, частью гладкие, частью ветвистые. Кроме того, часто о наличии астроцитов можно судить только по наличию отростков, т.к. на месте их тел определяется только скопление гранул разных размеров. Вокруг некоторых сосудов, в отличие от контроля, астроциты не определялись. Следует отметить, что изменения в составляющих гематоэнцефалического барьера были одинаковыми у больных с давностью серологической верификации ВИЧ-инфекции 3 года и давностью верификации более 5 лет, т.е. длительность патологического процесса не влияла на характер и распространенность изменений. Вместе с тем только у больных с менингоэнцефалитом установленной этиологии определялись сосуды без астроцитарной муфты и астроциты с гранулярным распадом тела.
Таким образом, результаты нашего исследования показали, что развитие менингоэнцефалита у ВИЧ-инфицированных сопровождается сходными изменениями биохимических показателей спинномозговой жидкости и компонентов гематоэнцефалического барьера. Особенности клинических проявлений, в свою очередь, коррелировали с характером этиофактора. Можно полагать, что фоновые изменения в головном мозге обусловлены прежде всего проникновением ВИЧ, а это возможно потому, что существенно повреждается гематоэнцефалический барьер. Присоединение оппортунистической инфекции и связанные с этим клинические проявления заболевания, по-видимому, усиливают отдельные уже проявившиеся механизмы повреждения, так как в целом изменения головного мозга при менингоэнцефалите с неустановленной этиологией сопровождаются такими же по выраженности и характеру изменениями мозга, как и при менингоэнцефалитах установленной этиологии.
1. ВІЛ-інфекція в Україні. Інформаційний бюлетень № 35. — К.: МОЗ України, Укр. центр профілактики і боротьби зі СНІДом, 2011. — 62 с.
2. Евтушенко С.К. и соавт. Диагностика и лечение поражений нервной системы у ВИЧ-инфицированных лиц при первичном и вторичном нейро-СПИДе. Методические рекомендации, утв. МЗ Украины, 2001. — 42 с.
3. Евтушенко С.К. и соавт. НейроСПИД как одна из актуальных проблем современной практической неврологии // Международный неврологический журнал. — 2006. — № 5(9). — С. 147-157.
4. Гойдык В.С. Токсоплазменный энцефалит у ВИЧ-ин-фицированных пациентов в неврологической практике / В.С. Гойдык, Н.А. Гуменюк, А.И. Гоженко // Український неврологічний журнал. — 2011. — № 2. — С. 71-75.
5. Леви Д.Э. ВИЧ и патогенез СПИДа: Монография / Д.Э. Леви; перевод 3-го издания с англ. Е. А. Монастырской. — М: Научный мир, 2010. — 736 с.
6. Маски ВИЧ-инфекции в клинике внутренних болезней / И.П. Кайдашев, Н.Д. Герасименко, В.В. Горбатенко [и др.] // Український терапевтичний журнал. — 2007. — № 2. — С. 57-65.
7. Сотниченко С.А. Анализ летальных исходов при ВИЧ-инфекции / С.А. Сотниченко // Эпидемиология и инфекц. болезни. — 2010. — № 4. — С. 31-34.
8. Тимченко В.Н. Поражение нервной системы при ВИЧ-ин-фекции / В.Н. Тимченко // Детские инфекции. — 2009. — Т. 8, № 1. — С. 32-35.
9. Яковлев Н.А. НейроСПИД: Неврологические расстройства при ВИЧ-инфекции, СПИДе / Н.А. Яковлев, Н.М. Жулев, Т.А. Слюсарь. — М.: МИА, 2005. — 278 с.
Читайте также:


