Клеточный и гуморальный иммунитет при вич
Иммунная система и ВИЧ
Как работает иммунная система (до появления ВИЧ)
Некоторые способы защиты от инфекций достаточно просты:
- Например, ваша кожа является основным барьером
Если кожа у вас повреждена, например, есть небольшой порез или царапина (для вирусов типа ВИЧ) или повреждения дыхательных путей (в случае туберкулеза), ваше тело будет использовать разные клетки для атаки и разрушения новой инфекции.
Говоря об иммунной системе, обычно используется два медицинских термина:
- Антиген – слово для обозначения маленьких частиц вызывающего инфекцию материала, разрушенного в теле, которые распознаются иммунной системой.
- Антитело – тип протеина, производимого определенными белыми кровяными тельцами в ответ на появление чужеродных веществ (антигенов). Антитела связаны только с определенными антигенами. Такое связывание помогает разрушать антигены. Одни антитела разрушают антигены непосредственно, другие облегчают процесс разрушения антигенов белыми кровяными тельцами.
КЛЕТОЧНЫЙ И ГУМОРАЛЬНЫЙ ИММУНИТЕТ

КАК ВИЧ ВЗАИМОДЕЙСТВУЕТ С ИММУННОЙ СИСТЕМОЙ
ВИЧ – вирус, с которым организму особенно трудно справляться. Это происходит оттого, что вирус использует для собственного воспроизводства те же клетки, которые использует организм для борьбы с инфекцией. ВИЧ-инфекция заставляет инфицированные клетки отмирать быстрее, а также давать сигналы другим клеткам отмирать быстрее.
Эти два фактора напоминают собаку, гоняющуюся за собственным хвостом!
- ВИЧ-инфекция заставляется организм производить больше клеток CD4 для борьбы с новым вирусом.
- Новые клетки становятся новыми мишенями для инфицирования и репродукции ВИЧ
- Организм отвечает тем, что производит больше клеток для противодействия вирусу.
Через некоторое время Т-клетки, в которые проник ВИЧ, истощаются и погибают (у большинства людей через 6 месяцев после инфицирования). Через много лет организм чрезмерно устает, иммунная система изнашивается.

Эту часть тяжело понять. Основная мысль состоит в том, что ВИЧ изматывает иммунную систему, производя все больше и больше клеток.
Тем не менее, эти клетки также быстро умирают и иммунная система работает без успеха. Поэтому количество клеток CD4 в вашем организме снижается.
АРВ терапия блокирует быструю репродукцию ВИЧ и приводит иммунную систему вашего организма почти в нормальное состояние.
Модель количества CD4 после инфицирования ВИЧ без терапии
Количество CD4 (полное название: количество CD4+ Т-лимфоцитов, но также называют количество CD4+ Т-клеток или Т4) – это результат анализа крови, который показывает, сколько таких клеток содержится в кубическом миллиметре крови.
Среднее количество CD4 для ВИЧ-негативного человека колеблется между 600 и 1600, но у некоторых людей этот уровень может быть выше или ниже.
- Через несколько недель после инфицирования ВИЧ количество CD4 обычно падает.
- Потом, по мере того, как иммунная система начинает сопротивляться, оно снова повышается, хотя не до того уровня, который был до инфицирования ВИЧ.
- Этот уровень обычно называют контрольной точкой CD4, которая, как правило, стабилизируется на протяжении 3-6 месяцев после инфицирования, но этот процесс может продолжаться гораздо дольше.
- В последующем количество CD4 с годами постепенно снижается. Средний уровень падения количества CD4 составляет около 50 клеток/мм3 ежегодно. В зависимости от человека, эта скорость может быть выше или ниже.

Иммунная система большинства людей успешно контролирует ВИЧ, не требуя лекарств долгие годы.
КАК БЫСТРО ПРОГРЕССИРУЕТ ВИЧ У РАЗНЫХ ЛЮДЕЙ
Время, на протяжении которого происходит падение количества CD4 (например, до уровня 200 клеток/мм3), различно для разных людей.
Приблизительное время снижения количества CD4 до уровня 200 клеток/мм3 у ВИЧ+ людей:
В связи с тем, что вирусы являются патогенами внутриклеточными, каждый представитель мира вирусов имеет тропность к определенному типу клеток. Тропизм вируса определяется наличием на клетке-мишени рецептора для данного вируса, а также возможность генома вируса встроиться в геном клетки.
а) конкретный вирус взаимодействует только с определенными рецепторами;
б) на клетке могут быть рецепторы для различных типов вирусов;
в) рецепторы для определенного вируса могут быть на клетках различных типов.
Рецепторную функцию выполняют различные структуры (лиганды): белки, липиды, углеводные компоненты белков и липидов.
Рецепторы локализованы на плазматической мембране, выполняют важнейшие функции жизнеобеспечения клетки — проникновение в нее гормонов, питательных веществ, факторов роста и регуляции, хемокинов и т. п. Вирус использует эти рецепторы в своих целях. Рецепторы созданы для жизнеобеспечения клетки, а не для вируса, вирус лишь к ним приспособился, используя их в целях возможности зацепиться за клетку.
Рецепторы, независимо от их биохимического строения, имеют общую структурную характеристику, а именно состоят из участка, расположенного вне клетки, участка, локали-зованного внутримембранно и участка, погруженного в цитоплазму.
Помимо рецепторов наружная мембрана (оболочка) клетки покрыта антигенами, которые необходимы клетке, чтобы иммунная система не спутала ее с чужеродной клеткой (например, мутировавшей в раковую или инфицированную вирусом) и не уничтожила. Одним из таких антигенов является антиген CD4, расположенный на Т-хелперах. CD4 антиген выполняет важнйшую роль в распознавании Т-хелпером антигенов микробов и вирусов. Именно его использует вирус иммунодефицита человека для того, чтобы проникнуть в клетку. Следовательно, антиген CD4 является рецептором для вируса иммунодефицита (к примеру, для вируса гепатита рецептор иного строения расположен на печеночных клетках).
Феномен устойчивости к ВИЧ-1 установлен в 1995 г. американскими учеными, проводившими обследование популяции наркоманов и гомосексуалистов, зараженных ВИЧ. Было выявлено несколько человек, которые, несмотря на общую иглу и половую связь, не заболевали, хотя их партнеры и болели, и даже умерли. У резистентных к ВИЧ-инфекции нашли мутацию генов рецептора хемокина CCR5. Причем никаких иных биологических особенностей у людей, устойчивых к СПИДу, не обнаружено.
Дальнейшие исследования показали, что наряду с рецептором CD4 для проникновения в Т-клетку/хелпер или макрофаг вирусу необходим дополнительный рецептор (коре-цептор), которым, как было установлено в 1996 г., является рецептор одного из хемокинов — CCR5. Хемокины не созданы природой для вирусов, с их помощью выполняются иммунокомпетентными клетками важнейшие функции, в том числе хемокины определяют направленность движения иммунокомпетентных клеток (Т-хелпер, Т-супрессор, макрофаг и др. клетки — это клетки иммуннокомпетентиые, т. е. выполняют определенные функции в защите организма) в очаг инфекции, чтобы его уничтожить.
Хемокины — полипептиды, вызывающие движение клеток в определенной направленности. У человека выделено около 40 отдельных подобных белков, их подразделили на альфа (СХС)- и бета-хемокины (СС). Именно рецептор представителя бета-хемокинов CCR5 в комплексе с основным для ВИЧ рецептором - CD4 определяют проникновение вируса в Т-хелпер.
У некоторых людей гены, определяющие синтез хемокина (полипептид) CCR5, подверглись изменению (мутации), в силу чего синтезируется нефункционирующий рецептор CCR5, что препятствует проникновению ВИЧ из крови в клетку, а следовательно, и развитию болезни. При этом иммунная система людей, имеющих дефект по CCR5 гену, функционирует вполне нормально.
Как известно, каждый ген представлен двумя копиями: отца и матери. Если же у человека отсутствует ген этого рецептора, проникновение ВИЧ в клетку невозможно. Попавший в кровь вирус у этих лиц не представляет опасности, поскольку сам по себе очень нестойкий. Экспериментально доказано, что врученная в кровоток живая культура ВИЧ-1, не способная проникнуть в клетки, погибает за 15 мин.
Как показали исследования новосибирских ученых, примерно 10,4 % людей имеют подобную мутацию гена рецептора хемокина CCR5, а значит, не восприимчивы к ВИЧ-инфекции. Подобный ген выявлен у многих финно-угорских народов Западной Сибири (11,1 %), удмуртов (9,8%), баш-киров (10%), мордвы (16,3%). Этой мутации практически нет у представителей негроидной расы, она очень редко встречается у афроамериканцев.
Другую популяцию составляют люди, несущие одну копию мутантного гена, их в мире насчитывается более 30-40%. По данным одних исследователей они инфицируются с той же вероятностью, как и несущие два нормальных гена рецептора хемокина CCR5, по данным других — они более устойчивы к действию вируса
Итальянские иммунологи в течение четырех лет наблюдали за 90 добровольцами, у половых партнеров которых имелась ВИЧ-инфекция. Было установлено, что эти люди остаются невосприимчивыми к ВИЧ благодаря наличию у них специфических антител. Эти антитела модифицируют рецептор CCR5, вследствие чего клетки макроорганизма становятся недоступными для внедрения вируса иммунодефицита. По мнению авторов, результаты данного открытия могут быть использованы при разработке новых, более эффективных антиретровирусных препаратов, а также при поисках вакцины против СПИДа (CDC,2000).
Проникнув в CD4+ клетки, ВИЧ сразу же начинает репликацию, при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. А отсюда вытекает, что все регуляторы, активирующие С04+клетки, обеспечивают увеличение репликации вируса. К подобным регуляторам относятся ФНО, фактор, стимулирующий колонии гранулоцитов/ макрофагов, ИЛ-6. К негативным регуляторам, тормозящим репликацию вируса, относятся ИФ, трансформирующий фактор роста. Так, установлено, что ФНО-а активирует транскрипцию провирусной ДНК ВИЧ 1 в хронически инфицированных Т-клетках и макрофагах. Моноциты продуцируют ФНО-а, они не только индуцируют экспрессию ВИЧ-инфицированными клетками, но они также стимулируют активацию лагентного провируса ВИЧ. Синхронно с ФНО-а действуют ИЛ-6 и фактор, стимулирующий колонии гранулоцитов/макрофагов.
Выделено два типа СD4+-клеток: Т-хелперы-1 и Т-хелперы-2. Т-хелперы-1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Т-хелперы-2 - цитокины, усиливающие антителогенез. Соотношение Т-хелперы-1 и Т-хелперы-2 взвешенно и конкурентно, суперэкспрессия цитокинов одного типа клеток ведет к супрессии другого. У больных ВИЧ-инфекцией идет угнетение Т-хелперов-1, чем обеспечивается и вирусная патология и оикогенез.
Жизненный цикл ВИЧ после проникновения в организм носит последовательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона и клетки, проникновение вируса внутрь клетки, высвобождение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и после-дующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождением из клетки, влекущим за собой гибель клетки-мишени.
Сродство вирусного мембранного гликопротеида gp120 (gp105 в случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень избирательного поражения клеточных структур. Поэтому в патологический процесс вовлекаются в первую очередь и в большей степени CD4+ лимфоциты, моноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов легких, микроглия и другие клетки нервной системы, имеющие С04-рецепторы. Так же поражаются В - и О-лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника, клетки Лангерганса. Причем последние инфицируются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только имму-нокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, определяют иолитропность ВИЧ и полиморфизм клинической картины. Степень поражения тех или иных, содержащих CD4 рецепторы клеток зависит от плотности этих рецепторов на мембране клеток. Наиболее высока плотность на Т-хелперной субпопуляции лимфоцитов, что и определяет во многом патогенез болезни. Но степень поражения клеток-мишеней вирусом зависит также и от возможности репликации вируса в том или ином виде клеток. Очевидно, осуществляется репликация в основном в лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на СD4+-лимфоциты вирус оказывает цитопати-ческое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью, вирионы оформляются в округлые частицы еще в цитоплазме клетки и по выходе из нее не оказывают цитонекротического действия. Тем не менее, моноциты/ макрофаги претерпевают значительные ультраструктурные изменения. Проведенное нами изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноцитов/макрофагов, основных продуцентов фактора некроза опухолей и интерлейкина lb (выполняющих роль передатчика Т-лимфоцитам антигенспецифических сигналов, необходимых для их активации в иммунном ответе). Увеличение продукции некоторых цитокинов способствует экспрессии вируса. Так, исследования Н. М. Калининой (1996) показали резкое увеличение провоспалительных цитокинов ФНО-а (до 428 при норме 38,9 пг/мл у взрослых и до 1363 у детей при норме 108,8 пг/мл в стадии IIIB) и ИЛ-lb. С гиперпродукцией ФНО-а, ИЛ-lb и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНО-а при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ Т-хелперы. В то же время было установлено, что ВИЧ ингибирует продукцию ИЛ-2 и ИФ-g Т-хелперами первого типа и не ингибирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирусной оболочки с помощью белка gp41 с мембраной клетки. Помимо того вирусный белок gp41 обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки — синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными. Но синцитий в основном индуцируют вирусы, выделенные от больных с клиническими проявлениям ВИЧ-инфекции и не образуют выделенные от инфицированных, не имеющих клинических проявлений.
Раньше полагали, что с момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интегрированного в геном ДНК-провируса. Считалось, что в этот период нет процессов транскрипции и трансляции с вирусных генов, а поэтому и экспрессии вирусных белков, нет иммунного ответа на вирус, как в виде специфических иммуноглобулинов, так и сенсибилизированных лимфоцитов. Но последние исследования показали, что сразу после проникновения вируса в клетку начинается и трансляция, и транскрипция.
В период инфекционного процесса, когда возбудитель находится в геноме клетки в виде ДНК-провируса, его можно обнаружить лишь такими методами, как полнмераз-ная цепная реакция (ПЦР), гибридизация нуклеиновых кислот со специфическими зондами.
Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфические антигены (например, вирусы группы Herpes), неспецифические антигены (например, митогены типа фитогемагглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например, монофосфат липида из сальмонелл). К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, в частности дексаметазон и гидрокортизон, ультрафиолетовое облучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность, более прогрессирующее течение ВИЧ-инфекции имеют психически неуравновешенные лица, дезадаптированные по сравнению с людьми, имеющими уравновешенную психику.
Довольно сложен механизм репликации вируса в инфицированной клетке. Известно, что в цитоплазме информация с вирусной РНК посредством обратной транскриптазы (ревертазы) переписывается на ДНК клетки, первоначально образуется однонитевая структура, затем та же обратная транскриптаза обеспечивает образование второй нити, а линейная промежуточная форма ДНК вируса транспортируется в ядро, где с помощью фермента интегразы интегрирует с ДНК клетки, превращаясь в ДНК-провирус.
Исключительно важный этап патогенеза болезни — сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Сборка происходит на плазматической мембране лимфоцита, куда поступают все компоненты вирусной частицы, в том числе и белки-предшественники. Завершается процесс почкованием вирусных частиц с клеточной поверхности. Отличительной чертой ВИЧ является взрывной характер процессов активации транскрипции, син-теза белков-предшественников, сборки вирионов и их почкования.
Ключевой вопрос патогенеза ВИЧ-инфекции — механизм иммунного повреждения. Как установлено, в составе белков gp120, главного комплекса гистосовместимости (HLA) класса II и CD4-peuemopoB имеются сходные участки, что определяет перекрестное реагирование образующихся к ВИЧ антител с этими структурами. Например, происходит блокада кооперации CD4+ лимфоцитов и HLA II. Антитела к gp120 ВИЧ реагируют с CD4, обусловливая неадекватную стимуляцию CD4* клеток. На всех ядросодержащих клетках имеются антигены HLA I, вирус же нарушает синтез этих антигенов, участвующих в распознавании CD8+ лимфоцитами (Т-супрессорами) зараженных вирусом клеток, что тормозит процесс лизиса инфицированных клеток.
Многочисленными исследованиями показано, что взаимодействие gp 120 ВИЧ-1 с мембраной CD4+-лимфоцитов определяет не только отрицательные реакции инфицированных клеток, но и приводит к программированной клеточной гибели — апоптозу зрелых СD4+-лимфоцитов или CD34+ гемопоэтических клеток-предшественников даже при отсутствии их инфицирования вирусом.
Формирование иммунодефицита при ВИЧ-инфекции не ограничивается только поражением лимфоцитов с СD4-фенотипом. Так, нарушение синтеза белков HLA I ведет к ингибированию функции лимфоцитов с С08-фенотнпа, т. е. Т-супрессоров. Белок вируса р15 оказывает супрессивное действие на продукцию Т-клетками ИЛ-2 и интерферона-g. Известно, что для дифференцировки Т-эффекторов из Т-предшественников необходимы ИЛ-2, гамма-интерферон и ИЛ-6. А с продукцией ИЛ-2 и других цитокинов тесно связана функция цитотоксических Т-лимфоцитов, ответственных за противовирусную и противоопухолевую защиту организма. Все это патогенетически определяет характерную для ВИЧ-инфекции СПИД-ассоциированную вирусную и онко-патологию.
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность гранулоцитов.
Таким образом, поражение иммунной системы при ВИЧ-инфекции носит системный характер, проявляясь глубокой супрессией Т - и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят закономерные изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты, функциональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных комплексов, продуктов катаболизма клеточных рецепторов (Р-белки). происходят характерные изменения нуклеиновых кислот иммунокомпетентных клеток и активности в них ферментов основных обменных циклов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность СD8+-лимфоцитов, NK-клеток, нейтрофилов.
Нарушение иммунного статуса клинически проявляется инфекционным, аллергическим, аутоиммунным и лимфопролиферативным синдромами иммунологической недостаточности, синдромом, свойственным болезни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
Таким образом, в основе патогенеза ВИЧ/СПИД лежат:
1. Гибель СD4+-лимфоцитов и их предшественников в костном мозге. Характерна значительная гибель этих клеток при их ничтожном заражении (5%). Возможна гибель в меньших размерах макрофагов, моноцитов.
2. При покидании вирусом клетки в ее мембране образуются отверстия, вследствие чего клетка разбухает и гибнет (Т4-лимфоцит).
3. Слияние до 500 незараженных клеток с образованием нежизнеспособного синцития.
4. Активация деятельности иммунной системы путем связывания антител с оболочкой и лизисом клетки-хозяина.
5. Вирусу иммунодефицита человека свойственна высокая изменчивость. В условиях эксперимента доказано, что новые копии ВИЧ в антигенном отношении отличаются от предшественников и менее подвержены воздействию нейтрализующих антител. В организме человека постоянно идет селекция более агрессивных и патогенных вирусов. По мере прогрессирования заболевания выделяются штаммы, которые быстрее и продуктивнее реплицируются.
Патогенез ВИЧ-инфекции носит фазовый характер, условно можно выделить 6 стадий:
а) инкубационный период или первичная латентная — серонегативная, продолжительностью до 3 мес и больше;
б) 1 стадия — выраженной вирусной репродукции и первичного иммунного ответа — серопозитивная, продолжительностью до 6-12 мес;
в) 2 стадия — гиперреактивности гуморального иммунитета, продолжительностью до 3-5 лет;
г) 3 стадия — компенсированного иммунодефицита (число Т-лимфоцитов не менее 400 в 1 мкл., Т4:Т8 не менее 0,6);
д) 4 стадия — выраженного угнетения клеточного иммунитета и начала декомпенсации гуморального иммунитета с угасанием 3 из 4 кожно-аллергических реакций;
е) 5 стадия — полного отсутствия реакций гиперчувствительности замедленного типа и развитием локальных оппортунистических инфекций;
В организм человека ВИЧ проникает в виде свободной или связанной с клеткой частички, после чего он начинает размножаться и инфицировать другие клетки. Через 3-8 нед после заражения развивается острый процесс, у половины клинически выраженный и похожий на грипп или мононуклеоз, длится около недели — стадия сероконверсии. В половине случаев эта стадия протекает бессимптомно. Затем все симптомы исчезают и проявления болезни отсутствуют в течение нескольких недель, месяцев и даже лет. В этот период вирус размножается и уже может быть выделен в лабораторных условиях.

Рис. 1. Взаимосвязь жизненного цикла SIV/HIV и иммунных нарушений CTL— цитотоксические Т-лимфоциты
Динамика взаимосвязи жизненного цикла ВИЧ и иммунных нарушений в организме человека представлена на рис. 1.
14 октября 2013
- 19597
- 15,7
- 2
- 3
Распространенность СПИДа в мире на 2009 год.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
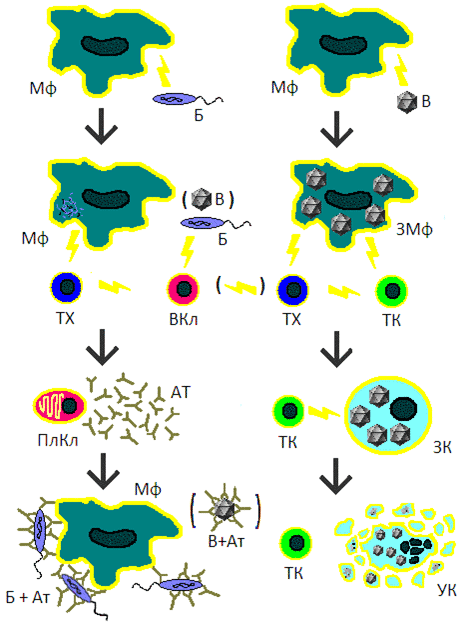
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
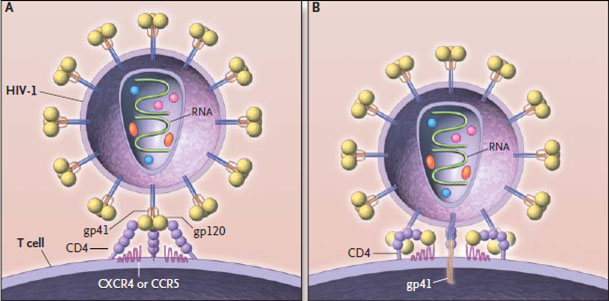
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
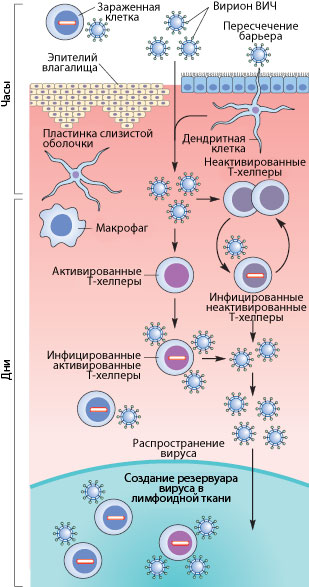
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
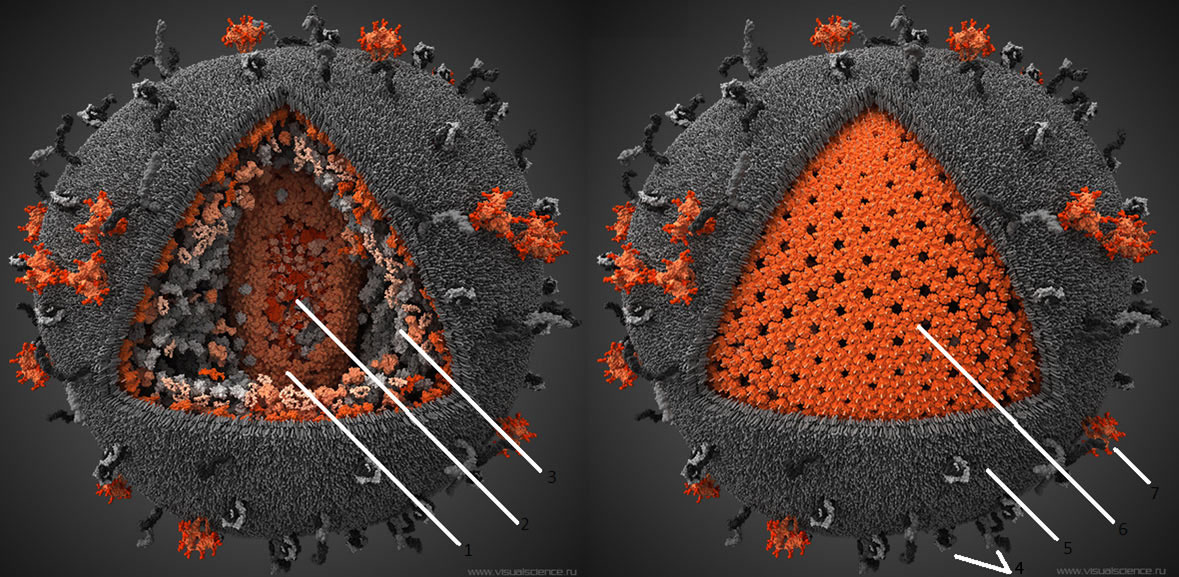
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Читайте также:


