Молекулярно генетический метод выявления вич
На сегодняшний день существует 3 основных подхода для проведения молекулярных исследований в области ВИЧ-инфекции: полимеразная цепная реакция (ПНР); изотермальная амплификация (NASBA) и bDNA (разветвленная ДНК-гибридизация).
Полимеразная цепная реакция (ПЦР), изобретенная в 1983 году американским биохимиком Кэри Муллисом, представляет собой многократное увеличение числа копий (амплификация) специфического участка ДНК с помощью фермента ДНК-полимеразы in vitro. При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами (короткими синтетическими олигонуклеотидами длиной 18—30 оснований). Каждый из праймеров комплементарен одной из цепей двухцепочечной матрицы.
Первая публикация, посвященная методу ПЦР, появилась в 1985 году в журнале Science (Saiki, 1985). Для проведения амплификации необходимы следующие компоненты: ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент); праймеры, комплементарные последовательностям ДНК на границах определяемого специфического фрагмента; смесь дезоксинуклеотидтрифосфатов (дНТФ) (смесь четырех дНТФ, являющихся материалом для синтеза новых комплементарных цепей ДНК); фермент Taq-полимераза (термостабильная ДНК-полимераза, с помощью которой происходит элонгация цепей праймеров путем последовательного присоединения нуклеотидных оснований к растущей цепи синтезируемой ДНК); буферный раствор.
Каждый цикл амплификации включает 3 этапа, протекающих в различных температурных режимах (рис. 4): 1 этап: Денатурация ДНК (расплетение двойной спирали). Протекает при 93-95 в течение 30-40 сек. 2 этап: Присоединение праймеров (отжиг). Присоединение праймеров происходит комплементарно к соответствующим последовательностям на противоположных цепях ДНК на границах специфического участка. Для каждой оригинальной пары праймеров требуется своя температура отжига, значения которой располагаются в интервале 50-65С. Время отжига -20-60 сек. 3 этап: Достраивание цепей ДНК (элонгация). Комплементарное достраивание цепей ДНК происходит от 5 -конца к 3 -концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служат добавляемые в раствор дезоксирибонуклеотидтрифосфаты (дНТФ). Процесс синтеза осуществляется ферментом термостабильной ДНК-полимеразой (Taq полимеразой) и проходит при температуре 70-72С. Время протекания синтеза - 20-40 сек. Образовавшиеся в первом цикле амплификации новые цепи ДНК служат матрицами для второго цикла амплификации, в котором происходит образование искомого специфического фрагмента ДНК (ампликона). В последующих циклах амплификации ампликоны служат матрицей для синтеза новых цепей. Таким образом, происходит накопление ампликонов в растворе по формуле 2П, где п - число циклов амлификации. Поэтому, даже если в исходном растворе первоначально находилась только одна двухцепочечная молекула ДНК, то за 30-40 циклов в растворе накапливается около 10 молекул ампликона. Этого количества достаточно для достоверной визуальной детекции этого фрагмента методом электрофореза в агарозном геле. Процесс амплификации проводится в специальном программируемом термостате (амплификаторе), который по заданной программе автоматически осуществляет смену температур согласно числу циклов амплификации.
Изотермальная амплификация (NASBA). В основе метода NASBA лежит реакция транскрипционно опосредованной амплификации, в ходе которой происходит увеличение количества РНК, транскрибируемой со специального промотора (используется промотор для Т7-полимеразы), входящего в состав специфического праймера, который отжигается в определенном месте РНК- (и или ДНК) мишени. Если в случае первичной мишени используется РНК-матрица, то первые стадии процесса формируют полноценную структуру промотора ДНК-зависимой РНК-полимеразы фага Т7 для инициирования транскрипции. Для достраивания второй цепи ДНК после первого этапа - обратной транскрипции используется фермент РНК-зависимая ДНК-полимераза (обратная транскриптаза). Фермент РНКаза Н удаляет матричную РНК после синтеза первой цепи ДНК и, следовательно, делает процесс "денатурации" ДНК-РНК гибрида (за счет гидролиза РНК) автоматически воспроизводимым в каждом последующем цикле амплификации. Фермент ДНК-зависимая РНК-полимераза транскрибирует за один цикл, время которого составляет 5-15 мин., 105копий фрагментов РНК. Таким образом, в течение 40-50 мин изотермической транскрипционно опосредованной амплификации ДНК или РНК в растворе образуется 10-10 копий. В отличие от ПЦР амплификация в NASBA протекает изотермически — при +41 С, что позволяет отказаться от оборудования, обеспечивающего циклическое изменение высоких температур.
В России тесты, основанные на методе изотермальной амплификации, не используются для диагностики ВИЧ-инфекции.
Разветвленная ДНК (bDNA). Метод гибридизации с использованием разветвленных зондов представляет собой пример амплификационных технологий, позволяющих усиливать в ходе определения сигнал. В результате многоступенчатого процесса гибридизации происходит присоединение многочисленных зондов, коньюгированных с молекулами фермента, окисляющего специальный субстрат и запускающий таким образом хемилюминесценцию.
Недостатком тестов, основанных на методе bDNA, является невозможность проведения исследований по выявлению возбудителя инфекции. Методика предназначена только для количественных определений. В России единичные лаборатории имеют оборудование для bDNA и проводят количественные определения вирусной нагрузки ВИЧ и вирусных гепатитов.
Ранняя диагностика заболеваний – залог успешного лечения. Ставшее крылатым выражение, особенно актуально для ВИЧ-инфекции. Ведь заболевание неизлечимо полностью, и только своевременная диагностика позволяет взять течение болезни под контроль и выбрать тактику лечения, чтобы жить полноценной жизнью.

Ранний срок диагностики ВИЧ – со 2 недели от предположительного заражения.
Важность клинической диагностики ВИЧ
В понимании многих людей ВИЧ-инфицированный человек выглядит болезненно, изнеможенно. Он кашляет, чихает, чешется, стонет, у него все болит… На самом деле это не так! Проблема в том, что после инфицирования ВИЧ и в последующий инкубационный период симптомы полностью отсутствуют. Затем наступает острая фаза, на протяжении которой присутствуют симптомы, напоминающие ОРВИ или грипп. Но и они вскоре проходят, и наступает, так называемый, латентный период – продолжительный промежуток времени, когда ВИЧ-инфекция себя ничем не выдает. С момента инфицирования и до стадии пред-СПИДа может пройти порядка 10 лет, в течение которых, ни сам пациент, ни его окружение, даже и не подозревают о болезни. А когда она уже на полную мощность заявляет о себе, контролировать ее очень трудно. Сложно противостоять осложнениям ВИЧ, поддерживать практически разрушенную иммунную систему человека.
Очень важно понимать, что, хотя и есть группы риска – гомосексуалисты, наркозависимые и девушки легкого поведения – в основной массе, пациенты с ВИЧ-инфекцией – это обычные люди. Они учатся, ходят на работу, посещают общественные места, знакомятся в интернете – в общем, живут как все. К сожалению, но от ВИЧ никто не застрахован. Незащищенный половой контакт в порыве страсти, заветное тату без соблюдения стерильности, маникюр за полцены у начинающего мастера, уличная драка – все эти и множество других житейских ситуаций могут обернуться инфицированием ВИЧ.
Не ошибается лишь тот, кто не живет! Мы не можем знать все наперед, не можем исправить уже совершенных ошибок, но мы можем предпринять простые шаги для исправления их последствий – обратиться в ближайший кожно-венерологический диспансер, в местную клинику или специализированный СПИД-центр для сдачи анализов и ранней диагностики ВИЧ.
Благоприятные сроки для диагностики ВИЧ
Факт возможного инфицирования и плохое самочувствие без видимых причин – два веских основания для обращения к специалистам. Но отрицательный результат тестирования на антитела не всегда означает, что человек не инфицирован, так как существует период “серонегативного окна” (время между заражением и появлением антител), который составляет около трех месяцев. Поэтому лучше повторить их спустя 3 месяца с момента возможного инфицирования. Если же ответ опять будет отрицательным, но ваша тревога не проходит, и вы уверены в заражении ВИЧ, тогда лабораторную диагностику необходимо повторить спустя 6 месяцев после факта заражения.
Что касается плохого самочувствия, то поводом провериться на ВИЧ может быть сочетание следующих симптомов:
- увеличение лимфатических узлов на шее, в паху, в области подмышек;
- лихорадка;
- мышечные или головные боли;
- молочница и грибковые поражения, в том числе кандидоз полости рта;
- воспаление слизистой носа, рта или глотки;
- ночная потливость;
- ломота в суставах;
- длительная диарея;
- тошнота, рвота;
- резкое снижение массы тела;
- высыпания на коже.
Важно понимать, что с момента, когда проявляются первые признаки ВИЧ-инфекции и до момента, когда заболевание переходит в латентную стадию, проходит очень мало времени – около 3-6 недель с факта инфицирования. Нельзя упускать из вида этот промежуток времени! Поскольку последующие 8-10 лет вы будет жить, нормально себя чувствовать и даже не подозревать о том, что больны ВИЧ-инфекцией. Драгоценное время будет упущено.
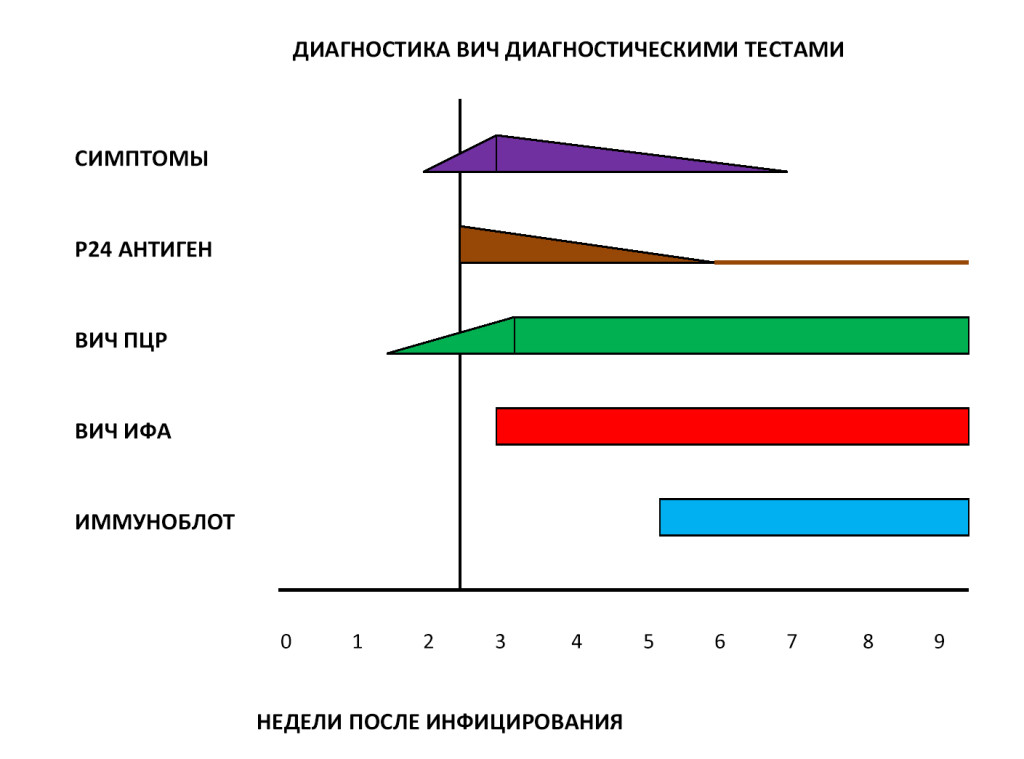
Современные методы диагностики ВИЧ
В настоящее время в диагностике ВИЧ используется двухуровневый подход – косвенные и прямые тесты. Косвенные тесты позволяют обнаружить в крови пациента специфические антитела к ВИЧ, а прямые тесты помогают выявить собственно сам ВИЧ и определить степень вирусной нагрузки на организм. В России стандартная диагностика ВИЧ включает следующие методы лабораторных исследований:
- ИФА (иммуноферментный анализ).
- Иммуноблот (иммунный блоттинг).
Также могут быть применены следующие методики:
- Экспресс-тест ИХА (иммунохроматография).
- ПЦР (полимеразная цепная реакция).
Диагностические принципы лабораторных исследований и степень их достоверности приведены в нижеследующей таблице.
Своевременная диагностика ВИЧ-инфекции позволяет предотвратить осложнения, связанные с поздней стадией ВИЧ-инфекции, снизить риск трансмиссии ВИЧ-инфекции, своевременно назначить ВААРТ, снизить заболеваемость и летальность ВИЧ-инфицированных больных.
Однако ранняя диагностика ВИЧ-инфекции является проблемой во всем мире. Так по данным центра по контролю заболеваемости, Атланта, у 41% ВИЧ- инфицированных больных СПИД развивается в течение 1 года после установления диагноза, что затрудняет предотвращение неблагоприятных исходов. Все диагностические тесты на ВИЧ можно условно разделить на 2 группы:
1. Тесты, позволяющие установить факт инфицирования ВИЧ
2. Тесты, позволяющие контролировать течение (мониторинг) ВИЧ-инфекции у инфицированного человека (установить стадию ВИЧ-инфекции, определить показания к началу терапии, оценить эффективность терапии).
3. Установление факта инфицированности ВИЧ.
Серологические тесты:
* определение антител к ВИЧ (ИФА, иммуноблот)
* определение антигена Р24
Молекулярно-генетические тесты:
* Определение РНК вируса
* Определение ДНК провируса
Прямые тесты на ВИЧ. Диагноз ВИЧ-инфекции можно поставить не только на основании косвенных признаков (наличия антител к ВИЧ), но и на основании прямых доказательств присутствия вируса. К прямым тестам относят:
* Выделение вируса в культуре клеток -- исследование, которое приберегают для особых случаев: оно требует специального оборудования и подготовки; в клинической практике не используется.
* Тест на антиген р24 (скрининг-тесты четвертого поколения помимо антител к ВИЧ выявляют и антиген р24);
* Вирусные нуклеиновые кислоты (то есть генетический материал ВИЧ) провирусную кДНК в лейкоцитах, вирусную РНК.
В связи с возможностью получения ложнопозитивных и ложнонегативных результатов при серологическом тестировании на ВИЧ у части обследуемых применяются молекулярно-генетические методы тестирования - определение вирусной РНК или провирусной ДНК ВИЧ методом ПЦР.
Пациенты, которым проводится диагностика ВИЧ с использованием ПЦР:
* больные с агаммаглобулинемией
* острая ретровирусная инфекция
* Доноры, иностранные граждане, лица с клиническими симптомами заболеваний (лихорадка, лимфаденопатия, потеря массы тела, рецидивы пневмоний, серозный менингит неустановленной этиологии, энцефалит неустановленной этиологии, нейропатии, слабоумие и др.). Больные с подозрением или подтвержденным диагнозом (рецидивы бактериальных инфекций, кандидоз, криптококкоз, туберкулез, сепсис, саркома, мононуклеоз, образования головного мозга, лимфомы и др.). Новорожденные с задержкой развития, аномалии, маловесные, масса менее 2500. Больные парентеральными гепатитами, беременные, реципиенты препаратов крови, жидкостей, дети, рожденные ВИЧ-инфицированными, дети на гособеспечении, лица с ИППП, наркоманы, пенитенциарная система, наличие эпидпоказаний, анонимно.
Исследования, позволяющие осуществлять мониторинг ВИЧ-инфекции:
1. Определение уровня лимфоцитов CD4+B сыворотке крови (иммунограмма методом моноклональных антител)
2. Определение вирусной нагрузки ВИЧ в крови инфицированного (ПЦР)
3. Определение мутаций резистентности ВИЧ к антиретровирусным препаратам (ПЦР, генетический анализ ВИЧ).
Данный метод позволяет определить состояние иммунной системы инфицированного человека. Уровень СD4+лимфацитов является одним из важнейших лабораторных показателей для решения вопроса о назначении ВААРТ и для оценки эффективности проводимой терапии. Нормальные диапазоны уровня СD4+лимфоцитов у взрослых находятся в пределах 500-1400 в 1 мкл. В случае отсутствия возможности определения показателя СD4+лимфоцитов (исследования являются дорогостоящими и требуют специально оборудованной лаборатории) при решении вопроса о назначении APT допустимо ориентироваться на абсолютное количество лимфоцитов в общем анализе крови. Показанием к назначению ВААРТ является абсолютное количество лимфоцитов менее 1,0х 10 /л.
Определение вирусной нагрузки (ВГ) ВИЧ в крови инфицированного (ПЦР). Исследование так называемой вирусной нагрузки сегодня в клинической практике незаменимо:оно позволяет как оценивать прогноз, так и следить за эффективностью лечения. Знание исходного (до начала ВААРТ) уровня ВН пациента является дополнительным критерием начала ВААРТ. Считается, что уровень ВН выше 100 000 копий/мл -- пороговый уровень для старта терапии у взрослых и детей старше 1 года жизни. Мониторинг ВН на фоне ВААРТ является критерием эффективности терапии. Так, при эффективной терапии уровень ВН должен снижаться и достигать неопределяемого уровня (менее 50 копий/мл).
Для диагностики ВИЧ-инфекции проводят серологические, вирусологические, молекулярно-генетические и иммунологические исследования.
Серологический метод является наиболее доступным для практических лабораторий. Он заключается в обнаружении в испытуемой сыворотке специфических антител к антигенам ВИЧ, реже выявляют присутствие ВИЧ-антигенов.
Антитела появляются через 1-3 месяца после инфицирования и обнаруживаются на всех стадиях ВИЧ-инфекции, При развитии СПИДа их титр значительно снижается.
Основной диагностической реакцией для обнаружения антител является ИФА. Разработаны различные тест-системы ИФА, в том числе более совершенные системы 3-4 поколения. Постановка ИФА в значительной степени автоматизирована.
Обычно вначале проводят быстрое скрининговое исследование испытуемой сыворотки. При обнаружении антител к диагностикуму ВИЧ, сыворотку исследуют дважды, используя разные серии диагностикума или различные тест-системы. При положительном результате (даже в одной пробе), который считается предварительным, проводят подтверждающее экспертное исследование. Это необходимо, так как бывают ложноположительные реакции. Подтверждающую проверку проводят методом иммуноблотинга (вестерн-блот), выявляя наличие специфических антител к гликопротеинам gр120 и gр41, а также белкам р24 и р21. Реакция считается положительной при наличии антител хотя бы к одному белку оболочки ВИЧ и к одному белку сердцевины вируса, например gр41 и р24.
Методом ИФА возможно выявить ВИЧ-антигены в крови и лимфоцитах в более ранние сроки, чем антитела, однако это удается не всегда.
Разработана также количественная ПЦР, выявляющая концентрацию вирусной РНК в плазме крови (тест вирусной нагрузки). Этот тест определяет количество копий РНК/мкл и позволяет прогнозировать течение ВИЧ-инфекции, рекомендовать сроки начала специфического лечения и следить за его эффективностью.
Иммунологические исследования. Обследуют состояние иммунной системы организма (иммунный статус). Снижение количества Т4-лимфоцитов до 400-500 клеток/мкл, коэффициент соотношения Т4/ Т8-лимфоцитов ниже 0,6, а также резкое повышение количества IgА, IgD, IgЕ и циркулирующих иммунных комплексов, являются косвенными доказательствами наличия ВИЧ-инфекции.
Диагностика ВИЧ-инфекции у новорожденных затруднена. С первых дней жизни и в течение нескольких месяцев у них в крови могут циркулировать специфические антитела класса IgD, полученные пассивно от ВИЧ-инфицированной матери, что не является доказательством зараженности ребенка. Поэтому на первом году жизни у ребенка выявляют ВИЧ-антигены, определяют присутствие провирусной ДНК с помощью ПЦР или выделяют вирус в культуре клеток. Также диагностическое значение может иметь выявление антител класса IgА и повышение их титра.
7. Особенности вирусологического метода диагностики (культивирование, индикация, идентификация вируса)
Вирусологическое исследование заключается в выделении ВИЧ из биологических жидкостей и лимфоидных клеток обследуемого человека на различных культурах клеток (линии клеток Н2, MOLT, СЕМ и др.). Это трудоемкий дорогостоящий метод, доступный для специальных лабораторий, применяемый, главным образом, для научных и эпидемиологических целей, реже для диагностики ВИЧ-инфекции (в основном - у детей).
8. Противовирусный иммунитет - нет
При попадании ВИЧ-инфекции в организм, иммунитет сразу же активизируется. Начинают вырабатываться CD8+ Т-лимфоциты, которые пытаются вывести вирус из организма. На время они даже блокируют развитие болезни, а также контролируют ее распространение в организме.
Однако со временем эти клетки иммунитета сами уничтожаются инфекцией, а, следовательно, их число резко уменьшается, что приводит к острому периоду ВИЧ-инфекции, постепенно переходящей в СПИД.
Клетки иммунитета, а в первый черед с вирусом начинают борьбу CD4+ Т-лимфоциты, быстро разрушаются. Инфекция воздействует и на структуру клеток, в результате чего они слипаются, образуя синцитии. Такие новые образования подвержены разрушению, т.к. их начинают атаковать клетки иммунитета человека. Происходит так называемый аутоиммунный сбой, когда лейкоциты не распознают вирусы и атакуют себя.
9. Специфическая профилактика
Общие меры профилактики аналогичны применяемым при гепатите В, гепатите С и других инфекциях, передающимся половым путем.
Специфическая профилактика ВИЧ-инфекции отсутствует. Ведутся интенсивные исследования по получению эффективных вакцин.
10. Этиотропное лечение
ВИЧ-инфекция не поддается окончательному излечению имеющимися лекарственными средствами. Поэтому основной целью лечения является максимально возможное продление и улучшение качества жизни больного с сохранением его работоспособности, а при возникновении вторичных заболеваний — замедление их развития и снижение тяжести.
Лечение ВИЧ-инфекции является комплексным и включает антиретровирусную терапию, направленную непосредственно на возбудителя, иммунокоррегирующую терапию посредством иммуномодуляторов, лечение оппортунистических инфекций и опухолей соответствующими антибиотиками, химиопрепаратами, облучением.
Антиретровирусная терапия осуществляется химиопрепаратами, нарушающими репродукцию вируса. Многие из них являются токсичными, требуют 2-3 кратного ежедневного приема и длительных повторных курсов лечения. Как правило, это дорогостоящие препараты. В лабораториях мира проводится постоянная работа по получению эффективных, менее токсичных и более удобных для применения химиопрепаратов.
В России разрешены к применению 15 антиретровирусных препаратов, среди них два - отечественного производства.
Антивирусные препараты отличаются по химическому составу и механизму действия, их можно подразделить на группы.
1. Ингибиторы обратной транскриптазы - нуклеозидные и нуклеотидные аналоги. Эти препараты встраиваются в нить ДНК, формирующуюся при участии обратной транскриптазы на вирусной РНК-матрице и блокируют синтез ДНК. Тем самым нарушается процесс обратной транскрипции, а, следовательно, и репродукция ВИЧ. Различают нуклеозидные аналоги тимидина и аналоги других нуклеозидов.
Производные тимидина: - Азидотимидин (АЗТ, Зидовудин, Ретровир, Тимидин - производства России);
- Фосфазид (Россия) - (фосфорилированный АЗТ, менее токсичен, дольше не выводится из организма. Производные других нуклеозидов:
- Диданозин (Видекс) - производное аденина;
- Зальцитабин (Хивид,- Ламивудин (Эпивир) – производные цитозина;
- Абакавир (Зиаген) - производное гуанина.
Комбинированный препарат — Комбивир (Зидовудин + Ламивудин).
2. Ингибиторы обратной транскриптазы - ненуклеозидные аналоги. Препараты соединяются с активным центром обратной транскриптазы и блокируют ее.
- Невирапин (Вирамун); Ифавиренц (Стокрин).
К этим препаратам быстро формируется лекарственная устойчивость ВИЧ, поэтому их применяют в комбинации с антивирусными препаратами из других групп.
3. Ингибиторы протеазы ВИЧ. Препараты обладают высокой токсичностью, требуют 3-х кратного приема в сутки совместно с пищей, соблюдения диеты. Это самые дорогостоящие препараты. Все это ограничивает их применение.
Выявлено, что при приеме одновременно двух препаратов, ингибиторов протеазы, из которых один Ритонавир, лечебная доза препаратов значительно снижается. Ингибиторы протеазы обязательно комбинируют с антиретровирусными препаратами из первой группы.
Таким образом, основными антивирусными препаратами для лечения ВИЧ-инфекции являются ингибиторы обратной транскриптазы - производные тимидина. Только они пригодны для монотерапии - лечения одним препаратом. Более эффективно их совместное применение с препаратами той же группы - производными других нуклеозидов, то есть битерапия. Еще более интенсивной является тритерапия, при которой к этим двум препаратам добавляют третий - ингибитор обратной транскриптазы с иным механизмом действия (ненуклеозидный аналог) или ингибитор протеазы. Иногда используют схему лечения четырьмя препаратами.
Совместное применение нескольких препаратов уменьшает риск возникновения лекарственной устойчивости ВИЧ.
Антивирусную моно- или битерапию ВИЧ-инфекции проводят во 2-й стадии заболевания при возникновении ранних клинических проявлений, например: неосложненных или с присоединением вторичных оппортунистических инфекций. После нормализации состояния и значительного повышения количества СD4 + -лимфоцитов/мкл лечение прекращают.
Лечение возобновляют в конце 3 стадии (латентной), применяя интенсивную терапию несколькими антивирусными препаратами. Показанием к возобновлению лечения служит снижение количества СD4 + -клеток/мкл и присоединение оппортунистических инфекций. Лечение проводят 12-недельными курсами с перерывами во время ремиссий до конца жизни больного.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
При болезнях с длительным инкубационным периодом и разнообразной клинической симптоматикой, одной из которых является СПИД, исключительно велика роль лабораторных методов диагностики. Существует несколько методов лабораторной диагностики СПИДа: выделение вируса, выявление антител к ВИЧ, обнаружение антигенов или других компонентов ВИЧ, выявление иммунологических нарушений.
Установлено, что ДНК ВИЧ может находиться в геноме человека как минимум три года без признаков активности и антитела к ВИЧ (по которым его и обнаруживают) не появляются. Это один из примеров сложности проблемы СПИДа - ведь при переливании крови, клетки которой несут такой "спящий" вирус, вполне возможно заражение. Но всё же типичной является ситуация, когда организм начинает вырабатывать антитела через 6 - 12 недель, реже - через 8 месяцев после инфицирования.
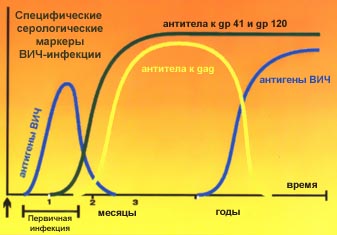 |
I. Выявление антител к ВИЧ
Выявление антител к ВИЧв сыворотке крови - наиболее распространенный прием в лабораторной диагностике ВИЧ-инфекции. Хотя положительный результат исследования при определении антител к ВИЧ не является окончательным критерием оценки состояния и прогноза болезни, он дает возможность с достаточной долей вероятности установить факт инфицирования. Данный вид диагностики обладает достаточно высокой чувствительностью, однако далеко не 100% специфичен из-за возможности получения ложноположительных и ложноотрицательных результатов. Это происходит из-за того, что в инфицированном организме на разных стадиях болезни продуцируются и персистируют антитела к различным структурным и регуляторным белковым компонентам ВИЧ (описание последних см. выше). ля выявления антител к ВИЧ чаще всего используют метод иммуноферментного анализа (ИФА). При проведении ИФА в 3 — 5% случаев возможны ложноотрицательныерезультаты - если инфицирование произошло относительно недавно и уровень антител еще очень низкий, или в терминальной стадии болезни, характеризующейся тяжелым поражением иммунной системы с глубоким нарушением процесса антителообразования. Поэтому при наличии данных, свидетельствующих о контакте с инфицированными ВИЧ обычно проводят повторные исследования через 2 - 3 мес. Но даже при повторных исследованиях удается выявить не всех инфицированных лиц, так как существуют сероотрицательные носители ВИЧ, т.е. те, у которых антитела не вырабатываются в течение очень длительного времени. В США количество таких ложноотрицательных исследований составляет около 1% в год. Причиной ложноположительныхрезультатов ("обнаружению" ВИЧ там, где его нет) при постановках ИФА является наличие у пациентов аутоиммунных процессов, антител к ревматоидному фактору, вирусу Эпштейна - Барр, молекулам главного комплекса гистосовместимости. Частота ложноположительных результатов при использовании различных тест-систем (разных диагностических наборов) колеблется от 0,02 до 0,5%. Число ошибочных результатов можно значительно снизить при использование в качестве антигена рекомбинантных белков ВИЧ. Чувствительность и специфичность тест-систем для ИФА в этом случае можно сравнить с иммунным блоттингом.
Иммунный блоттинг(иммуноблот, Western Blot, вестерн-блот) - сочетает в себе иммуноферментный анализ (ИФА) с предварительным электрофоретическим переносом на нитроцеллюлозную полоску (стрип) антигенов вируса. Иммуноблот (ИБ) включает в себя несколько стадий. Подготовка стрипа. Предварительно очищенный и разрушенный до составных компонентов вирус иммунодефицита (ВИЧ) подвергается электрофорезу, при этом входящие в состав ВИЧ антигены разделяются по молекулярному весу. Затем методом блоттинга (аналог выдавливания на "промокашку" избытка чернил) антигены переносят на полоску нитроцеллюлозы, которая отныне содержит невидимый пока глазом спектр антигенных полос, характерный для ВИЧ. Исследование пробы.На нитроцеллюлозную полоску наносится исследуемый материал (сыворотка, плазма крови пациента и т.п.), и если в пробе есть специфические антитела, то они связываются со строго соответствующими им (комплиментарными) антигенными полосами. В результате последующих манипуляций результат этого взаимодействия визуализируется - делается видимым. Трактовка результата.Наличие полос в на определённых участках нитроцеллюлозной пластины подтверждает присутствие в исследованной сыворотке антител к строго определённым антигенам ВИЧ.
В настоящее время иммунный блоттинг (иммуноблот, ИБ) является основным методом для подтверждения наличия вирусспецифических антителв исследуемой сыворотке. В некоторых случаях ВИЧ-инфекции, до развития сероконверсии, специфические антитела более эффективно выявляются методом ИБ, чем ИФА. При исследовании методом ИБ обнаружено, что чаще всего в сыворотках больных СПИДом выявляются антитела к gp 41, причем обнаружение р24 у лиц, обследуемых с профилактической целью, требует дополнительных исследований на наличие у них ВИЧ-инфекции. Тест-системы для ИБ на основе рекомбинантных белков, полученных путем генной инженерии, оказались более специфичными, чем обычные системы на основе очищенного вирусного лизата. При использовании рекомбинантного антигена формируется не диффузная, а четко выраженная узкая полоска антигена, легко доступная для учета и оценки.
Всемирная Организация Здравоохранения (ВОЗ, 1991) рекомендует следующую оценку результатов исследований, проведенных методом ИБ:
Положительный результат — обнаружение в сыворотке антител к двум вирусным белкам из группы env с наличием или отсутствием белков — продуктов других структурных генов (gag, pol);
Отрицательный результат— отсутствие антитела к вирусспецифическим белкам;
Неопределенный результат — обнаружение в сыворотке антител к белкам из групп gag, pol.
Как правило, неопределенная реакция в ИБ связана с наличием белков - продуктов экспрессии гена gag ВИЧ-1 р15/17, р24 и р55, что может свидетельствовать как о ложноположительной реакции, так и о возможности инфицирования ВИЧ-1.
Читайте также:


