Оксидазный тест на гонококки
Оксидазные диски
| Оксидазные диски | DD018 |
Используются для дифференциации представителей родов Neisseria, Alcaligenes, Aeromonas, Vibrio, Campylobacter и Pseudomonas (обладают оксидазной активностью) от энтеробактерий (оксидазоотрицательные).
Во флакончиках находятся стерильные диски из фильтровальной бумаги, пропитанные оксалатом N,N-диметил-парафенилендиамина, аскорбиновой кислотой и a -нафтолом. С использованием таких дисков отпадает необходимость в ежедневном приготовлении свежего реактива на оксидазу. Для осуществления дыхания (биологического окисления с целью получения энергии) у некоторых бактерий имеется цитохромоксидаза, либо индофенолоксидаза – железосодержащий белок, гемопротеин, который катализирует перенос электронов от вещества-донора (например, НАД-Н) к веществам-реципиентам (обычно О2). Бесцветный N,N-диметил-парафенилендиамин служит искусственным реципиентом электронов. В ходе оксидазного теста из него в результате окислительно-восстановительных реакций с участием микробной оксидазы образуется индофенол – вещество синего цвета. Оксидазный тест полезен для первичной характеристики аэробных грамотрицательных бактерий из родов Aeromonas, Plesiomonas, Pseudomonas, Campylobacter и Pasteurella.
Gordon и McLeod (1), используя способность некоторых бактерий в ходе окислительно-восстановительных реакций образовывать индофенол из диметилпарафенилендиамина и a -нафтола, предложили применять оксидазный тест для идентификации гонококков. Gaby и Hadley (2) предложили использовать более чувствительный метод с использованием оксалата N,N-диметил-парафенилендиамина (при этом все стафилококки стабильно давали отрицательный результат). В случае положительной реакции (наличие цитохромоксидазы) из оксалата N,N-диметил-парафенилендиамина и a -нафтола образуется синий индофенол.
Оксидазный тест проводят путем снятия микробной колонии и растирания ее по оксидазному диску. Учет реакции ведут в течение 5–10 секунд при 25–30°С. Замедленные положительные реакции появляются через 10–60 секунд. Отсутствие изменения цвета на диске или развитие окраски через 60 и более секунд расценивают, как отрицательную реакцию.
Реакции референс-штаммов в течение 5–10 секунд при 25–30°С
| Штаммы микроорганизмов (АТСС) | Реакция (результат) | Цвет |
| Pseudomonasaeruginosa (27853) | + | Темно-лиловый, синий |
| Staphylococcus aureus (25923) | – | Не меняется |
| Neisseria gonorrhoeae (19424) | + | Темно-лиловый, синий |
| Escherichia coli (25922) | – | Не меняется |
- Во избежание ложноположительных реакций не применяйте стальную или нихромовую проволоку для оксидазного теста, т. к. возможно поверхностное окисление этих металлов.
- Для оксидазного теста не подходят культуры, выращенные на средах и индикаторами (например, на среде Эндо, МакКонки и др.).
- Для учета результатов важно соблюдение временного интервала (5–10 сек).
- Оксидазный тест, ввиду его важности для идентификации, надо проводить со всеми грамотрицательными бактериями.
- Выработка цитохромоксидазы может подавляться на средах, где идет ферментация углеводов (например, на агаре МакКонки), поэтому возможны ложноотрицательные результаты теста с культурами родов Vibrio, Aeromonas, Plesiomonas.
Диски хранить при 0…+8°С. Не используйте реактивы после истечения срока годности
НИЕ: материалы надо держать во влагонепроницаемых контейнерах с поглотителем влаги. Перед тем, как открыть контейнер, надо дать ему нагреться до комнатной температуры.
2. Методы идентификации грам (-) бактерий.
2.1. Оксидазный тест.
2.2. Индольный тест.
2.3.Ферментация углеводов (“пестрый ряд”).
2.7.Тест с трибутирином (для идентификации M.catarrhalis).
2.8.Тесты декарбоксилирования и гидролиза аминокислот.
2.10.Сероводородный тест (H2S-тест).
2.14.Тест с метиловым красным.
2.17.Окислительно-ферментативный (ОФ) тест.
2.1. Оксидазный тест.
Принцип. Определенные виды бактерий вырабатывают либо цитохромоксидазу, либо индофенолоксидазу (железосодержащий гемопротеин), которые катализируют перенос электронов от донаторов водорода (НАДН) к акцепторам (обычно кислороду). В оксидазном тесте бесцветный краситель p-фенилендиамин дигидрохлорид, используемый как искусственный акцептор электронов, при участии оксидазы окисляется и образует окрашенное вещество индофенол синий. Тест используют для первичной характеристики грам(-) бактерий. Особую помощь он оказывает при идентификации бактерий родов Aeromonas, Plesiomonas, Pseudomonas, Campylobacter, Pasteurella, Neisseria.
Реагенты. Можно использовать готовые реагенты или готовить их в лаборатории. Для приготовления 1% раствора тетраметил-p-фенилендиамин дигидрохлорида добавляют 5 мл дистиллированной воды к 50 мг порошка реагента (заготовленные впрок навески реагента хранят в укупоренных пластиковых или стеклянных пробирках) и тщательно перемешивают. Реактив готовят ежедневно. Неиспользованный остаток реактива сбрасывают.
Коммерческие тесты представляют собой импрегнированные реагентом полоски или диски фильтровальной бумаги.
Контроль качества проводят в день постановки теста с культурами P. aeruginosa АТСС 27853 (положительный контроль) и E. coli АТСС 25922 (отрицательный контроль).
Прямой способ на чашках: Наносят 1 каплю реагента непосредственно на изучаемую колонию и наблюдают появление темно-фиолетового окрашивания.
Непрямой способ на фильтровальной бумаге.
Þ Помещают полоску (диск) фильтровальной бумаги в пустую чашку Петри и капают 1-2 капли реактива, либо используют готовые полоски, импрегнированные реагентом, и смачивают их деионизированной водой.
Þ Стерильным аппликатором или посевной петлей берут исследуемую колонию и размазывают ее по полоске или диску.
Þ При положительной реакции через 10-30 сек. Появляется окрашивание интенсивно синего или фиолетового цвета. При отрицательной реакции цвет не изменяется. При неопределенном результате, когда окрашивание появляется позже 30 сек., исследование необходимо повторить со свежей культурой (18-24-часовой). Как правило, грам (-) бактерии с замедленной оксидазной реакцией не принадлежат к семейству Enterobacteriaceae, так как они не продуцируют фермент цитохромоксидазу.
Ограничения и предосторожности.
1) Нельзя использовать для посева культуры петли или проволоку из нержавеющей стали или нихрома, так как может наблюдаться ложно положительная реакция за счет образования продуктов окисления при обжиге петли в пламени для стерилизации.
2) Изучение бактерий, выросших на агаре МакКонки, Левина или других дифференциальных средах, не подходит для этого теста, так как индикаторы с этих сред могут дать ложно отрицательную реакцию.
3) Ложно отрицательная реакция может наблюдаться в смешанных культурах, относящихся к родам Pseudomonas и Neisseria, так как те виды Pseudomonas, которые вырабатывают оксидазу, также продуцируют некую ингибирующую субстанцию, влияющую на выработку оксидазы Neisseria spp.
4) Импрегнированную реагентом бумажную полоску после смачивания используют только 1 раз.
5) Результаты следует учитывать не более 30 сек.
6) Во избежание ошибок при выборе схемы идентификации оксидазный тест следует применять для всех грам (-) бактерий.
Гонококки (Neisseria gonorrhoeae) относятся к грамотрицательным кокам, встречающимся преимущественно парами. Бактерия вызывает триппер (гонорею). Это инфекционный процесс с преимущественным поражением слизистых оболочек мочеполового аппарата.
В редких случаях становится причиной бленнореи – гнойного патологического процесса соединительной оболочки глазного яблока. Диагностика гонококков требуется пациентам после незащищенной сексуальной близости с малознакомым партнером. Либо при подозрениях на инфицирование (иногда патологический возбудитель передается через полотенце или мочалку).
Лабораторная диагностика гонококков состоит из:
- микроскопического метода (окраска двух мазков)
- бактериологического (посев на питательные среды)
- реакции Борде-Жангу (серология)
- ПЦР
Свойства гонококка Neisseria gonorrhoeae
Гонококки – разновидность грамотрицательных диплококков, относятся к роду Neisseria. Для гонококков характерна высокая выживаемость в условиях организма. Вне приемлемой среды обитания для жизнедеятельности (во внешней среде) бактерии гибнут.
Также это происходит в результате высыхания субстрата при температуре от 40 градусов. Быстро погибают под воздействием антисептических и антибактериальных растворов, солей серебра и в мыльной воде.
Как выглядят гонококки?
Две половинки парной бактерии схожи на кофейные зерна, соприкасающиеся друг с другом вогнутой стороной. Под угрозой гибели (к примеру, на фоне антибиотикотерапии) трансформируются в L-форму.

Методы лабораторной диагностики
Инкубационный период длится от 3 до 7-ми дней с момента инфицирования. Дальнейшая клиника проявляется острыми симптомами. Это слизистые, с примесями гноя выделения из половых путей, чувство жжения, болезненность в уретре, в особенности при опорожнении мочевого пузыря).
Либо болезнь принимает бессимптомное течение. Анализ на гонококки Нейссера проводится различными способами.
Наиболее информативным считается ПЦР, так как позволяет обнаружить ДНК-возбудителя уже в первые несколько дней после проникновения бактериального агента в организм. У женщин в несколько раз чаще гонококковая инфекция имеет хроническую форму, при которой симптомы отсутствуют.
Возможность выявить гонококки в мазке ПЦР можно через 2-3 дня после сексуального контакта с зараженным партнером. Также применяются другие методы исследования, не менее информативные и позволяющие дополнительно определить чувствительность бактерий к антибиотику.
Микроскопический (бактериоскопический) метод
Анализ на гонококки проводится с использованием микроскопа и методики окраски двух мазков – по Грамму и с применением 1% жидкого раствора метиленового синего и 1% Эозина.
Для исследования наибольшую ценность представляют патологические жидкости. Забор которых производится из мочеиспускательного канала, влагалища, ануса, глотки или крови.
Метод Грамма
Обнаружить гонококки можно с помощью двойной окраски с применением двух красителей.
Первый – основной, второй считается дополнительным. Помимо красителей используется спирт и различные кислоты. Их действие заключается в обесцвечивании бактериального агента. Для выявления возбудителя гонореи применяются анилиновые красители (кристаллвиолет, метиловый фиолетовый) и дополнительные.

После обесцвечивания грамотрицательных диплококков используется фуксин. Он придает гонококкам красный окрас, определяющего идентифицирующего наличие гонококка.
Ход исследования:
- Биоматериал наносят на предметное стекло тонким слоем
- Следующий этап – сушка
- Проводится окраска анилиновыми красителями, промывка водой и использование раствора Люголя
- После высыхания материал фиксируется – необходимо для того, чтобы бактериальные клетки остались на поверхности стекла и не смылись. Для фиксации применяют один из двух методов – облучение бактериального агента высокими температурами либо применение специальных препаратов, приводящих к коагуляции цитоплазмы
- Далее стекло промывают и дополнительно применяют контрастные краски, после чего бактерии выделяются красным либо розовым цветом, после чего их легко обнаружить
Применение метиленового синего в микроскопическом исследовании
Взятый биоматериал наносится на предметное стекло и фиксируется 96 % этанолом либо над спиртовой горелкой. После полного высыхания мазка выполняется его окрас 1% р-ром метиленовой синьки. Спустя 1 минуту предметное стекло промывают в проточной воде комнатной температуры, подсушивают и помещают под микроскоп для изучения.
Анализ мазка на гонококк позволяет отличить патологическую микрофлору, которая принимает выраженный синий окрас (может иметь различные оттенки). Под микроскопом отличаются бактерии, размещенные парно, их бобовидная форма.
Характерной особенностью остро протекающего инфекционного заболевания является месторасположение возбудителя. То есть внутри гранулоцитарных лейкоцитов, которые выявляются в больших количествах на эпителии и в слизистой.
Для хронического течения характерно отсутствие гонококков при данном исследовании. В единичных случаях бактериальный агент идентифицируется, но в нетипичном для него виде.
Гонококки представлены мелкими или крупными шарообразной формы формированиями. Также выявляется другая патологическая флора, клетки эпителия и белые кровяные клетки (лейкоциты).
Бактериологический способ
Бактериологический или культуральный метод – производится посев биоматериала больного на питательные среды с белками, имеющими нативную пространственную структуру, сыворотку.
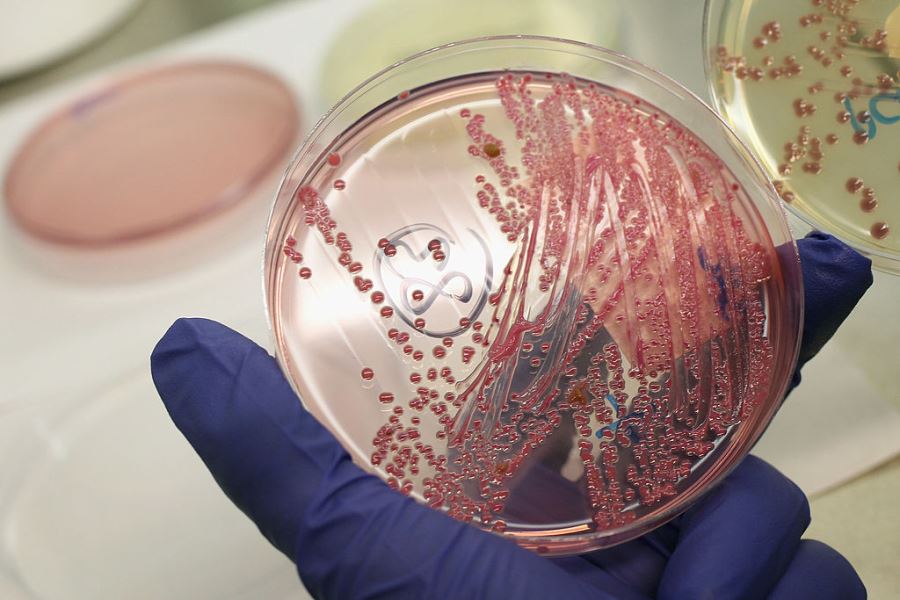
Чаще применяются безасцитные питательные среды. Основой которых является мясопентонный агар (производится из мяса кроликов или бычьих сердец). По результатам посевов на гонококки определяется не только возбудитель инфекции, но и его чувствительность к антибиотикам.
Точность и достоверность исследования во многом зависит от правильности сбора биоматериала. Важно использовать стерильные емкости и соблюдать правила подготовки к сбору анализа.
Сдача крови производится медицинским работником в условиях лаборатории.
Мочу пациенты собирают самостоятельно, используя для этого стерильную емкость.
Доставка биоматериала должна быть быстрой.
Мазки из половых путей или уретры выполняются в лаборатории и сразу наносятся на питательные среды. Очень важно провести диагностику до начала приема антибактериальных средств. В противном случае результативность проведенного анализа дает недостоверные результаты.
Если обследование назначается для контроля проведенной терапии, следует выждать не менее 10-ти дней после приема последней дозы антибиотика. При острой необходимости анализ проводится раньше.
Для исследования, отделяемого из половых путей у женщин производится забор материала через две недели после окончания менструации. За несколько часов запрещается опорожнение мочевого пузыря.
Мужчинам перед сдачей выделяемой слизи на анализ следует удержаться от посещения туалета в течение 4-5 часов.
Через сколько времени будет готов результат?
Культуральный метод занимает от 4-х дней. Все зависит от исследуемого материала – исследование каловых масс занимает от 3-4 дней до недели.
Соскоб из уретры будет готов в течение 7-ми дней, кровь – через 10. Несмотря на длительность диагностики, предварительные результаты анализа озвучиваются на 3-ий день.
Что показывает бактериологическая диагностика?
Расшифровка исследования включает информацию о наличии бактериального агента, а также о его концентрации. Определение количества присутствующей патологической микрофлоры имеет большое значение.
Выделяют 4 степени роста гонококков:
- 1 степень (отсутствует рост бактерий на твердой среде, на жидкой – незначительный рост)
- 2 степень (рост до 10 колоний)
- 3-я (рост от 10 до 100 колоний)
- 4-я (больше 100 колоний)

Первые две степени не являются этиологическими факторами развития болезни.
В данном случае говорят о загрязненности исследуемого биоматериала. Последние две степени (3 и 4) говорят о том, что присутствующие микроорганизмы стали причиной развития инфекционных процессов.
Окончательная расшифровка (подсчет колоний КОЕ/мл) имеет следующий вид:
- 102 – 103/мл – 1 колония
- 104/мл – 0т 2 до 5 колоний
- 105/мл – от 6 до 15 колоний
- 106/мл и более – от 16 колоний
Диагностика имеет весомое значение для контроля проводимой антибиотикотерапии и позволяет оценить ее эффективность.
Серологический метод
Методика основывается на иммунологической реакции выявления антител (Реакция Борде-Жангу) в плазме крови больного с подозрением на заражение гонококковой инфекцией. Зачастую используется для диагностики бессимптомных форм патологии.
В современной исследовательской практике серологический метод мало информативен. Не применяется для контролирования состояния после медикаментозной терапии.
Диагностика методом ПЦР
Определение гонококков при анализе ПЦР наиболее точный метод. Позволяет уже в впервые дни после заражения идентифицировать бактериального возбудителя.
Для получения максимально верных результатов огромное значение имеет подготовка:
- исключить сексуальный контакт за сутки
- после приема антибиотиков должно пройти не менее 7-ми дней
- перед взятием мазка запрещается посещение туалета за 2-3 часа
- не проводится у женщин вовремя месячных
Для диагностики триппера производится забор материала из мочеиспускательного или цервикального канала, можно использовать мочу.

Если в исследуемом биоматериала обнаруживают ДНК гонококков – это говорит о наличии гонореи. Информативность диагностики составляет 98%. Анализ проводится в течение 1-3 дней, что зависит от оснащенности лаборатории и квалификации специалистов.
Основным преимуществом исследования на гонококки является возможность выявления бактериального возбудителя даже при условии его минимальной концентрации в мазке (моче). В лабораторных условиях производится размножение генов возбудителя.
Клонирование ДНК участка, даже если он единичный, позволяет выявить всю имеющуюся патологическую флору в материале. Так, в большинстве случаев исследование на гонококки определяет одновременно диплококков и трихомонад, которые также передаются при половом акте.
Анализ ПЦР высоко информативен на ранних стадиях. Поэтому диагностика рекомендуется пациентам при частой смене половых партнерах или случайной сексуальной связи, в первые дни после интимной связи. Проведенная терапия на начальных стадиях болезни предотвращает развитие неприятных симптомов и возможные осложнения.
Расшифровка анализа ПЦР на гонококки выглядит следующим образом:
- высокий уровень лейкоцитов (свыше 10-ти говорит о присутствии воспалительного очага, свыше 20 – острое воспаление)
- повышенная концентрация клеток эпителия (более 10 в поле зрения)
- наличие грамотрицательных кокков, характерной формы
О чем говорит отсутствие гонококковой инфекции в исследуемом материале?
Если в ходе обследования с применением одного из методов в мазке не были обнаружены гонококки? Это говорит о том, что пациент полностью здоров. Либо о том, что в исследуемом материале, взятом из половых путей или уретры, бактерия отсутствует, но может быть обнаружена в других частях тела.
Для подтверждения диагностики выполняется забор материала из ротовой полости, прямой кишки или конъюнктивы глазного яблока. Если симптоматические проявления локализуются вне половой системы, а присутствие гонококков исключено, выполняются другие методы обследования для идентификации возбудителя патологии.
Диагностика после проведенного лечения
При обнаружении гонококковой инфекции лечащий врач-венеролог назначает комплексное лечение. Его основой является антибиотикотерапия.

Так как бактерии быстро адаптируются к пенициллинам, применяются препараты цефалоспоринового ряда. Чаще назначается Цефтриаксон для инъекций либо перорально Цефиксим.
Длительность лечения составляет 10-14 дней. Спустя 2-3 суток после приема последней дозы исследуют мазок из урогенитального тракта на выявление гонококков. Отрицательные результаты говорят о правильно проведенном лечении.
Диагностика после лечения также проводится второй раз через две недели. Отсутствие бактериального возбудителя означает полное выздоровление, больного снимают с учета у венеролога. Обследованию подлежат все половые партнеры.
Как подготовиться к диагностике гонококков?

Для предотвращения получения в ходе диагностики ложноположительных результатов перед взятием материала пациентам необходимо как следует подготовиться.
Соблюдение подготовительного этапа одинаково требуется представителям женского и мужского пола.
Подготовка
Этап подготовки включает:
- Исключение сексуальной близости за трое суток до забора материала
- Прекращение медикаментозной терапии, не только антибактериальных средств, но и других лекарственных групп, в частности химический средств контарацепции (спермициды). При невозможности прекращения приема некоторых препаратов пациент заранее сообщает об этом врачу
- Исключается использование влагалищных суппозиториев, кремов и спреев
- Исключается спринцевание за 3 дня до процедуры
- Гигиена половых органов выполняется накануне вечером, в утро забора мазка и взятия крови подмывание запрещается
- Опорожнение мочевого пузыря производится за 3 часа до исследования. При наличии незначительного количества бактериальных возбудителей существует вероятность вымывания некоторой части совместно с мочой и получение ложноотрицательных результатов
- У женщин манипуляция проводится за 4-5 дней до начала предполагаемых месячных либо спустя несколько дней по завершению. В острых случаях проводится не зависимо от менструального кровотечения
Анализ мазка на выявление гонококка Нейссера выполняется перед началом медикаментозного лечения и несколько раз после окончания.
Методику исследования выбирает лечащий врач, который занимается расшифровкой результатов и разработкой схемы лечения. Самостоятельный прием антибактериальных средств на фоне возникшей клинической картины искажает результаты обследования.
При подозрении на гонорею обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
· визуальной оценки вида колоний,
· окраски материала подозрительных колоний по Граму;
Типичные колонии гонококков через 18 - 24 часа инкубации выпуклые прозрачные серо-белого цвета, имеют диаметр 0,5 - 1,0 мм. При дальнейшей инкубации колонии могут увеличиваться в размерах до 3,0 мм и уплощаться. Нередко на одной чашке можно встретить колонии разного вида.
Большие трудности возникают при идеитификации колоний гонококка в посевах из ротоглотки, т.к. при этом часто вырастают менингококки и непатогенные нейссерии, колонии которых сходны с колониями гонококков. Колонии менингококка выглядят голубоватыми, колонии непатогенных нейссерии - беловатыми, а гонококков - бесцветными, слизистыми. Размер, цвет, морфология и консистенция колоний могут варьировать в зависимости от применяемой питательной среды. Идентифицировать возбудителя можно только при определении сахаролитических свойств культур или другими тестами, подтверждающими видовую принадлежность микроорганизма.
Обнаружение оксидазоположительных грамотрицательных диплококков считается достаточным для их идентификации как N. gonorrhoeae при рутинной диагностике. Для определения цитохром-с оксидазы можно использовать один из рекомендованных методов:
· Полоска фильтровальной бумаги смачивается несколькими каплями реагента, затем на нее помещается бактериологической петлей материал из подозрительной колонии. Этот способ позволяет сохранить материал на чашке для проведения дальнейших исследований. Высокая чувствительность оксидазного теста не согласуется с его специфичностыо. Оксидазоположительными могут быть и другие бактерии, выделяющие цитохромную оксидазу, поэтому оксидазоположнтельные колонии микроорганизмов обязательно нужно исследовать микроскопически с окраской по Граму.
· Имеются коммерческие диски и полоски, содержащие диметил-р-фенилендиамина гидрохлорид. Платиновой петлей или стерильной стеклянной палочкой испытуемую культуру наносят на диск, предварительно слегка смоченный дистиллированной водой.
Темно-лиловое или синее окрашивание, появляющееся через 10 - 30 секунд, свидетельствует о положительной оксидазной реакции. Отсутствие изменения цвета - об отсутствии данного фермента.
При исследовании мазков, окрашенных по Граму, из культур учитываются морфология, расположение и окраска гонококков. После 18 - 24 часов культивирования гонококки представляют собой скопления грамотрицательных кокков и диплококков, имеющих более компактное расположение микроорганизмов в центре и разреженное и неравномерное распределение по периферии.
Наряду с интенсивно окрашенными в розово-красный цвет кокками встречаются и бледно-окрашенные формы. Более старые культуры (48 часов и более) трудно интерпретировать, т.к. отмечается большое количество полностью лизированных клеток. По мере старения культуры увеличивается полиморфность гонококков.
Для подтверждающей идентификации нейссерий используются тесты:
· изучение ферментативной активности;
· иммунологические тесты (прямая иммунофлюоресценция, коагглютинация);
· молекулярно-биологические методы (ПЦР).
Ферментативная активность Neis. gonorrеаеизучается в реакции окисления сахаров. Реакция может быть ложноположительной из-за контаминации исследуемых культур гонококков другими бактериями и ложноотрицательной при использовании гонококков, культивируемых более 24 часов (вследствие аутолиза микроорганизмов). Для предупреждения этих возможных факторов необходимо выделить чистую культуру гонококков путем пересева типичных колоний на чашки Петри с неселективной средой (шоколадный агар). Инкубация проводится в течение 18 - 24 часов.
Изучение ферментативной активности Neis. gonorrhoeaeможет проводиться в ростозависимых и ростонезависимых тестах. При проведении ростозависимых тестов сахара и другие субстраты (например, феноловый красный) вводятся непосредственно в питательную среду, на которой осуществляется рост гонококка. Однако в настоящее время эти тесты не могут быть рекомендованы, т.к. широко используемые ростонезависимые тесты дают возможность получить более быстрый (в течение нескольких часов) и специфический результат, позволяя идентифицировать исключительно Neis. gonorrhoeaeи исключить другие непатогенные нейссерий. Существуют коммерческие наборы для изучения ферментативной активности Neis. gonorrhoeae.
Оценка проводится по изменению цвета среды: при ферментации сахаров - от красного к желтому (результат положительный). Энзимсубстратные тесты с использованием ферментов (орто-нитрофенил-бета-галактозидаза (ONPG), гамма-глютамил аминопептидаза (GLU-AMP), гидроксипролил аминосинтидаза (PIP), гидроксипролин аминопептидаза (НРА), пролин аминопептидаза (Рго-АР)) предназначены для быстрой дифференциации между N. gonorrhoeae, N. meningitidis, N. tacarnicaи некоторыми штаммами N. cinerea и N. Catarrhalis. Результаты теста считаются положительными, если происходит изменение цвета среды - от бесцветного к желтому для ОФГ и от светло-желтого к интенсивно оранжевому для Глю-АП и Про-АЛ. Однако чувствительность и специфичиость этих быстрых энзимсубстратных тестов оказались неоптимальными.
Проведение видовой идентификации возможно также с использованием бактериологических анализаторов и коммерческих наборов реагентов.
Иммунологические тесты рекомендуется использовать только в референс-лабораториях для окончательного подтверждения N. gonorrhoeae.
Иммунологические тесты с использованием моноклональных антител для прямой иммунофлюоресценции (ПИФ), коагглютинации и иммуноферментного анализа являются высокочувствительными и специфичными для точной идентификации N. gonorrhoeae. Эти тесты могут проводиться с культурой нейссерий, выделенных при первичном посеве. При этом не требуется выделение чистой культуры гонококков, и изоляты могут быть идентифицированы на18 - 24 часа раньше, чем при изучении ферментативной активности N. gonorrhoea. Однако эти тесты дороже, чем ферментативные, коммерческие тест системы имеют меньший срок годности.
Тест основан на использовании флюоресцирующих моноклональных антител против очищенного РroВ белка наружной мембраны гонококка, ранее называвшегося 1 или главный белок наружной мембраны гонококка. Очень важно строгое следование инструкции производителя каждого отдельного теста.
Для выявления N. gonorrhoeaeмогут быть использованы ДНК/РНК методы, такие как полимеразно цепная реакция (ПЦР), а также методы, основанные на гибридизации. Однако результаты, полученные при использовании этих методов, должны оцениваться в связи с клинической ситуацией, т.к. после проведенного лечения гонореи в некоторых случаяхДНК может определяться в образцах до 2 - 3 недель после лечения.
Однако с целью получения живого микроорганизма и для определения чувствительности к антибиотикам проведение бактериологического исследования является необходимым у пациентов с клинической симптоматикой. В некоторых ситуациях молекулярно-биологические методы являются более чувствительными, чем культурадьный метод. Чувствительность культурального метода во многом определяется качеством питательной среды и условий транспортирования образца в лабораторию. При соблюдении условий транспортировки клинического материала в лабораторию, использовании качественных питательных сред, строгого проведения условий лабораторного исследования бактериаюгнческое исследование является методом выбора, и наоборот. Следовательно, выбор молекулярно-биологического или культурального метода зависит от организационных условий и качества проведения лабораторного исследования, а также от зпидемиологической ситуации в популяции. В популяции с повышенным риском распространения заболевания бактериологическое исследование является методом выбора. В популяции низкого риска, для скрининга и для исследования неинвазивных образцов, молекулярно-биологические методы подходят больше (к примеру, исследование мочи у мужчин и вагинальных образцов у женщин). Однако если метод используется для исследования популяции низкого риска и он не является высоко специфичным, возможно получение большого количества ложноположительных результатов. Молекулярно-биологические методы являются оптимальными для исследования образцов, полученных неинвазивным способом, но их чувствительность и специфичность вариабельны. Чувствительность молекулярно-биологических методов выше при исследовании образцов мочи у мужчин, по сравнению с женскими образцами. Оптимальным для женщин является исследование вагинальных материалов.
Читайте также:


