Патент на лечение вич
— Что это за препарат? Как он действует?
С.Г.: Изначально этот препарат разработан компаний AbbVie (тогда она называлась Abbott) и используется сейчас для лечения ВИЧ-инфекции. Он давно вышел на рынок — в США и Европе еще в начале 2000-х. ВОЗ его с середины 2000-х рекомендовала как предпочтительный для продолжения терапии пациентам, которые меняют схему лечения по тем или иным причинам — это может быть либо недостаточная эффективность для конкретного пациента или непереносимость.
Пока ВОЗ продолжает его рекомендовать как препарат второй линии для лечения ВИЧ-инфекции, но сейчас он постепенно переходит в альтернативные препараты для продолжения терапии: его место занимают более новые препараты, от этого постепенно отказываются.
Например, из европейских рекомендаций по лечению ВИЧ его недавно убрали. Специалисты говорят, что у лопинавира/ритонавира уже практически нет клинических преимуществ, по профилю безопасности также есть опциональные лекарства, которые его превосходят.
— Под безопасностью имеются в виду побочные эффекты? Какие? Как препарат действует?
С. Г.: Из побочных эффектов в основном диарея, тошнота, рвота, нарушение липидного обмена. По действию это ингибитор (блокатор.— “Ъ”) протеазы, а протеаза — это фермент, который участвует в репликации вируса, то есть препарат препятствует полной сборке вируса, вирусная нагрузка понижается и постепенно становится близкой к нулю.
— Так препарат действует именно по отношению к ВИЧ. А почему он стал одним из основных препаратов, который в России стали рекомендовать для лечения коронавирусной инфекции?
С. Г.: Были публикации, в частности 2004 года, которые показали в пробирке и на очень небольших группах пациентов признаки эффективности лопинавира/ритонавира в комбинации с другими препаратами для других разновидностей коронавируса (SARS-CoV-1). Грубо говоря, были публикации, которые дали основания предполагать, что этот препарат, в том числе в сочетании с другими препаратами, может быть эффективен в отношении коронавирусов. И уже с этим типом коронавируса в Китае и Италии пациентам давали ряд препаратов, в том числе лопинавир/ритонавир. И после этого ВОЗ инициировала исследование Solidarity, в котором пытаются определить, имеет ли он какую-то эффективность в отношении вируса, становится ли пациентам лучше от этого.
— Есть уже результаты исследования?
С. Г.: Их пока нет — исследование продолжается, но есть первые данные другого исследования, которые были опубликованы в журнале New England Journal of Medicine. В нем приняли участие 199 пациентов с тяжелой формой коронавирусной инфекции. И оно не показало дополнительной эффективности препарата.
Там было две группы: 100 человек получали некую стандартную терапию, а вторая группа (99 человек) дополнительно к ней получала лопинавир/ритонавир. Разницы нет.
По крайней мере на малой выборке в отношении тяжелых пациентов. Но продолжают оставаться идеи, что на ранних стадиях препарат может быть эффективен.
— Как возникла эта теория?
С. Г.: Это свидетельства от разных врачей из разных стран ведения пациентов с более легкой стадией заболевания, но систематизированных наблюдений нет. То есть официальная позиция в мире: пока доказанных научных данных об эффективности лопинавира/ритонавира нет. ВОЗ его в качестве препарата для лечения коронавирусной инфекции еще не рекомендовала, он был включен в промежуточные итальянские клинические рекомендации. В США пока говорят о том, что данных недостаточно.
— Сколько он был на российском рынке?
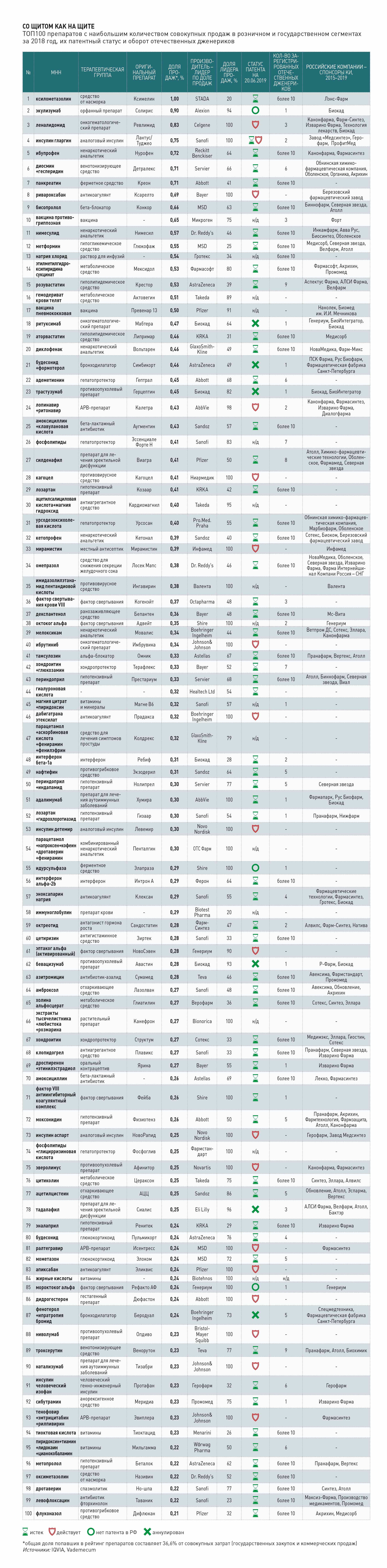
С. Г.: Калетра в России зарегистрирован в 2008 году и был востребованным препаратом. У врачей в условиях ограниченного количества опций была практика назначать его и для первой линии (впервые обратившиеся пациенты, не принимавшие ранее препаратов.— “Ъ”), и для второй линии. В свое время это привело к тому, что на калетру тратилось больше всего бюджетных средств.
— В каком объеме и когда использовался препарат в России? В каком объеме за границей? И что поменялось в последнее время?
А. М.: Несмотря на то что препарат не самый современный, он по-прежнему входит в треть схем лечения российских пациентов и на него ежегодно расходуется почти четверть бюджета на препараты для лечения ВИЧ. В 2019 году Минздрав РФ закупил 1 220 414 упаковок на сумму 4,7 млрд руб. Сейчас этот препарат продолжает оставаться под патентом, но за последние три года на рынке России зарегистрированы дженерики. Однако из них в закупках появился только калидавир — правда, закупается он в меньшем количестве, чем оригинальный препарат калетра.
С. Г.: Пациентские организации разных стран давно обращались к правительствам с просьбой вмешаться и каким-то образом допустить на рынки дженерики для лечения ВИЧ-инфекции. Это старая история: были акции активистов против патентной защиты калетры, например во время Международной конференции по ВИЧ в Амстердаме в 2018 году. И это был очень популярный препарат для выдачи принудительных лицензий разными странами — принудительную лицензию выдавали Таиланд, Эквадор, Индонезия. Также препарат привлекал внимание в связи с ценовой политикой — компания держала высокую цену. И патентная защита еще действует минимум до 2024 года.
И сейчас было решение Израиля о том, что они разрешают временно ввоз дженериков калетры в обход патента, но только для лечения коронавирусной инфекции.
Теперь подобные меры готовятся ввести Чили и Эквадор. Тут необходимо объяснить: на мировом рынке есть дешевые дженерики, но их официально можно продавать только в странах Африки. И компания AbbVie, как мне кажется, сейчас решила сыграть на опережение: 23 марта она заявила, что в связи с пандемией коронавируса отказывается от любых мер в отношении защиты своих прав на препарат калетра. То есть в компании приняли решении о непреследовании своих патентных прав, обязуясь не подавать в суд в случае поставки дженериков в те страны, где действует патент. И они разрешили лицензионным дженерикам поставлять их куда угодно, сняв все территориальные ограничения. Об этом компания сообщила Патентному пулу — организации, которая является посредником между производителем оригинального препарата и производителями дженериков. Но Пул пока не опубликовал официально эту информацию, хотя по запросу официально ее подтверждает. Важно, что компания снимает ограничения и для ВИЧ-инфекции тоже, то есть не только для коронавируса.
— За границей его продолжают использовать для лечения ВИЧ-инфекции?
С. Г.: В Европе постепенно прекращают. Он ушел из протоколов — европейских клинических рекомендаций. Ситуация на рынке варьируется от страны к стране.
— Цена в последнее время снизилась?
А. М.: Сейчас цена в России постепенно снижается, в том числе благодаря присутствию дженериков. Одно время произошло существенное снижение на уровне федеральных закупок, а следом и в субъектах РФ. Сейчас он стоит около 4,5 тыс. руб. за упаковку.
— Я видела, что цена сейчас составляет в аптеках 7–8 тыс. руб.
А. М.: Да, скорее всего, цена выросла в связи с повышением спроса из-за коронавируса: люди в панике бросились скупать препарат, если смогли найти. Обычно ВИЧ-положительные пациенты, которые получают лечение, обеспечиваются АРВ-препаратами бесплатно в профильных учреждениях, в розничных аптеках эти препараты, в том числе лопинавир/ритонавир, так просто не найдешь. Но в любом случае лопинавир/ритонавир включен в перечень ЖНВЛП и на него есть зарегистрированная предельная отпускная цена, поэтому на коммерческом рынке цена на него не сможет расти бесконечно. Видимо, сейчас это уже максимум. А в госзакупках цена не изменилась.
— В рекомендациях Минздрава России и Роспотребнадзора, которые были изданы ранее, говорится еще о нескольких препаратах для лечения от коронавируса, в частности предназначенных для гепатита C и малярии.
С. Г.: Они есть в итальянских рекомендациях (в частности, хлорохин). Есть информация, что хлорохин используют и в Бразилии. Пока в их отношении также нет четких доказательств эффективности. Необходимо помнить, что сейчас официальная позиция международного сообщества состоит в том, что пока нет препарата, в отношении которого эффективность в лечении новой коронавирусной инфекции была бы реально доказана. При этом сейчас ведутся разработки лекарств и вакцины от него, но это уже другая история, не касающаяся уже существующих препаратов.
Описание патента на изобретение RU2106878C1
Изобретение относится к терапевтическим агентам, используемым для лечения ВИЧ-инфекции с синдромом СПИД (приобретенного иммунодефицита).
Известно, что СПИД вызывается вирусом семейства ретро-вирусов, называемой БИЧ (вирус иммунодефицита человека). Заражение ВИЧ, однако, не приводит немедленно к открытым симптомам СПИДа. Единственным указанием на наличие вируса может быть присутствие антител к нему в крови инфицированного субъекта, который затем обозначается как "ВИЧ- положительный". Инфекция может быть латентной, не вызывая очевидных симптомов, и инкубационный период до развития СПИДа может варьировать от нескольких месяцев до десятилетий. Развитию собственно СПИДа может предшествовать появление СПИД-ассоциированного комплекса (ARC), который характеризуется необъяснимой лихорадкой, потерей веса, хроническим кашлем или диарреей.
Пока плохо понятны причины различия периодов между заражением и нарушением иммунной системы у зараженного субъекта. В настоящее время не известные факторы могут вызвать пролиферацию вируса с последующим разрушением иммунной системы. Жертвы этой болезни затем подвергаются различным инфекциям и заболеваниям, которые, несдерживаемые неисправной иммунной системой, ведут к их гибели.
Ассоциация между ВИЧ-инфекцией и туберкулезом хорошо известна. Ранний эффект ВИЧ-заражения состоит в реактивации
прежде неактивных туберкулезных бацилл. Поддержание резистентности к микробактериям является активным иммунологическим процессом, который компрометируется ВИЧ-инфекцией. У лиц, зараженных обеими инфекциями, наблюдается высокий процент реактивации латентных туберкулезных бацилл, и эта реактивация происходит задолго до проявления других ВИЧ/СПИД-ассоциированных инфекций, которые являются веским указанием на то, что важным действием ВИЧ-инфекции является разрушение тех иммунных функций, предположительно, Т-клеточных, которые поддерживают микробактериальные инфекции в латентном состоянии ("спячке").
Имеется также свидетельство того, что когда активный туберкулез накладывается на ВИЧ-инфекцию, происходит резкая потеря С4Т-клеток, которая приводит к очень быстрому развитию явных симптомов СПИДа. Это проявляется в том, что иммунные медиаторы, высвобождаемые при туберкулезе, ускоряют трансактивацию провируса ВИЧ.
Мы уже ранее описали использование антигенного и/или иммуно-регуляторного материала, полученного от Mycobacterium vaccae при лечении туберкулеза (см., например, патент Великобритании N 2 156 673 и патент США N 4 724 144). В нашей международной патентной заявке PCT/GB 90/01169 (публикация N WO 91/01751), мы описали использование того же самого материала для иммунопрофилактического лечения против СПИДа, т. е. для увеличения периода между заражением ВИЧ и развитием СПИДа.
Теперь мы обнаружили, что тот же самый терапевтический агент не только задерживает развитие СПИДа у ВИЧ-инфицированных пациентов, но также способен вызывать регрессию или даже исчезновение явных симптомов СПИДа даже у тех больных, у которых болезнь зашла далеко. Эти эффекты были обнаружены у пациентов, также страдающих от туберкулеза, но ожидается, что они возникают и у больных, страдающих ВИЧ-инфекцией со СПИДом и без ассоциированного туберкулеза.
Соответственно, изобретение обеспечивает использование антигенных и/или иммунорегуляторных материалов, полученных от Mycobacteriul vaccae, для производства медикамента, используемого в терапии СПИДа с ассоциированным туберкулезом или без него. Такой материал может вводиться субъекту, например, субъекту, который является ВИЧ-положительным и проявляет явные симптомы СПИДа, с инфекцией Mycobacterium tuberculosis или без нее количестве от 10 7 до 10 10 микроорганизмов на дозу, достаточном, по меньшей мере, для приостановления прогрессирования симптомов.
Удобно и потому предпочтительно, если терапевтический агент по изобретению включает убитые клетки M. vaccae, более предпочтительно, клетки убитые автоклавированием. Иммунотерапевтический агент обычно включает более чем 10 8 микроорганизмов на 1 мл разбавителя, предпочтительно от 10 8 до 10 11 убитых клеток M vaccae на 1 мл разбавителя. Изобретение охватывает в своем объеме антигенный и/или иммунорегуляторный материал от M. vaccae для использования при лечении ВИЧ-инфекции с или без СПИДа, а также с или без ассоциированного туберкулеза.
Разбавитель может быть свободен от пирогенов и представляет собой только физиологический солевой раствор для инъекций или боратный буфер с pH 8,0. Разбавитель должен быть стерилен. Подходящий боратный буфер имеет, например, следующий состав:
NaB4O7 10 H2O - 3,63 г
H3BO3 - 5,25 г
NaCl - 6,19 г
Твин - 0,0005%
Дистиллированная вода - До 1 л
Предпочтительным штаммом M. vaccae является штамм R877R, выделенный из грязевых образцов района Ланго в Центральной Уганде (J. L. Standard and R. C. Paul, Ann. Soc. Belge Med. Trop., 1973, 53, 141-389). Этот штамм является стабильным диким вариантом и принадлежит к подвиду aurum. Он может быть идентифицирован как принадлежащий к M. vaccae по биохимическим и антигенным критериям (R. Bomcke, S. E. Juhask., Zentr albl Bacteriol Parasitenkd Infection skv. Hyd. Akt. 1, 1964, 192, 133).
Этот штамм, обозначенный R877R., депонирован в Национальной Коллекции Типов Культур (NCTC) Центральной Лаборатории Народного Здоровья, Колиндейл Авеню, Лондон, 13 февраля 1984 под депозитарным номером NCTC 11659.
Для приготовления иммунотерапевтического агента, микроорганизм M. vaccae может выращиваться на подходящей твердой среде. Предпочтительная модифицированная жидкая среда Саутона, отвержденная агаром (S. V. Bayden and E. Sorkin J. Immunol., 1955, 75, 15).
Предпочтительно, твердая среда содержит 1,3% агара. Среду, инокулированную микроорганизмами, инкубируют в аэробных условиях для обеспечения роста микроорганизмов, обычно при З2 o C в течение 10 дней. Эти организмы собирают, взвешивают и суспендируют в разбавителе. Этот разбавитель может быть небуферным солевым раствором, но предпочтительно является борат-буферным и содержит поверхностно-активное вещество, такое как Твин 80, как описано выше. Суспензию разводят с получением 100 мг микроорганизмов на 1 мл. Для дальнейшего разведения предпочтительно используют боратный буфер, чтобы суспензия содержала 10 мг влажного веса микроорганизмов на 1 мл разбавителя. Суспензия эта затем может разливаться в 5 мл многодозовые капсулы. Хотя микроорганизмы в капсулах могут быть убиты с использованием радиации, например, от изотопа 60 Co в дозе 1,5 Мрад, или любыми другими средствами, например, химически, предпочтительно убивать микроорганизмы посредством их автоклавирования, например, при 10 psi в течение 10 мин (115-125 o C). Установлено, что автоклавирование дает более эффективный препарат, чем облучение.
Иммунотерапевтический агент обычно вводится инъекцией в объеме от 0,1 до 0,2 мл, предпочтительно, 0,1 мл, внутрикожно. Разовая доза будет обычно содержать от 10 7 до 10 10 убитых клеток M. vaccae. Предпочтительно, вводить пациентам разовую дозу, содержащую от 10 8 ^ до 10 9 убитых клеток M. vaccae. Однако, эта доза может повторяться в зависимости от состояния пациента.
Хотя иммунотерапевтический агент будет обычно вводиться внутрикожно инъекцией, также могут использоваться и другие пути введения, например, оральный.
Изобретение охватывает в своем объеме способ лечения ВИЧ-инфекции с или без СПИДа, включая СПИД, ассоциированный с туберкулезом, предусматривающий введение субъекту, страдающему ВИЧ-инфекцией, с или без СПИДа, и с или без ассоциированного туберкулеза, антигенный и/или иммунорегуляторный материал, полученный от M. Mycobacterium vaccae, в количестве от 10 7 до 10 10 микроорганизмов на дозу, достаточном для вызывания иммунной реакции, эффективной против симптомов СПИДа.
У 20-50% африканских пациентов с ВИЧ-инфекцией, туберкулез является первым симптомом развития СПИДа. Среди группы пациентов, лечившихся от туберкулеза, 17 было сероположительными согласно анализу ELISA Wellcome на HIVI. Всем пациентам были предписаны от туберкулеза стрептомицин, изоциазид, рифампицин и пиразинамид. Лечение было укороченным и не длилось более трех месяцев в каждом случае. Восемь из 17 пациентов получали терапевтический агент по настоящему изобретению и девять получали плацебо (солевой раствор). По прошествии примерно одного года только трое из тех, кто получал противотуберкулезные лекарства, остались живы, у всех троих был развитой туберкулез.
Семь из восьми пациентов, обработанных терапевтическим агентом по настоящему изобретению, стали отрицательными по анализу мазка мокроты на туберкулезные бациллы, а общее улучшение их состояния было подобно такому улучшению у туберкулезников, которые не были ВИЧ- положительными. Пять из восьми пациентов имели во время диагноза обширную лимфоаденопатию. Это было устранено во время последующего лечения. Только два пациента, которые были повторно исследованы серологически, при последующем исследовании оказались отрицательно реагирующими на HIVI.
Может быть выгодным, и это находится в объеме изобретения, использование более, чем одного штамма M. vaccae, и/или включение в терапевтический агент других микробактериальных антигенов. Также может быть включен туберкулин.
Терапевтический агент может также содержать BCG-вакцину (БЦЖ, Bacillus Calmette-Guerin), в частности, высушенную замораживанием форму этой вакцины, для усиления эффекта.
Терапевтический агент может содержать дальнейшие ингредиенты, такие как адъюванты, консерванты, стабилизаторы и т.д. Он может поставляться в виде стерильной жидкости для инъекций или в виде стерильной, высушенной замораживанием формы, которую восстанавливают в растворе перед ее использованием.
M. vaccae может быть использован как таковой или в виде экстракта^ или фракционной части организма для получения терапевтического агента по изобретению.
Пример. 1. M. vaccae выращивают на твердой питательной среде, включающей модифицированную среду Саутона, отвержденную 1,3% агара. Эту среду засевают микроорганизмами инкубируют в течение 10 дней при З2 o C для обеспечения роста микроорганизмов. Эти микроорганизмы затем собирают, взвешивают и суспендируют в разбавителе с получением 100 мг микроорганизмов на 1 мл разбавителя. Эту суспензию затем далее разбавляют буферным солевым раствором с получением суспензии, содержащей 10 мг влажного веса микроорганизмов на 1 мл разбавителя, и суспензируют в 5 мл многодозовые капсулы. Капсулы, содержащие живые микроорганизмы, затем автоклавируют, чтобы убить микроорганизмы и получить терапевтический агент по изобретению, который может быть, если нужно, еще более разведен для использования.
Этот иммунотерапевтический агент может быть введен посредством внутрикожной инъекции вышеописанным способом.
Похожие патенты RU2106878C1
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОТЕРАПЕВТИЧЕСКИЙ АГЕНТ И ЕГО ПРИМЕНЕНИЕ | 1995 |
| RU2139728C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПСИХИЧЕСКОГО ЗАБОЛЕВАНИЯ, СОСУДИСТЫХ ЗАБОЛЕВАНИЙ И ИХ ОСЛОЖНЕНИЙ | 1993 |
| RU2124367C1 |
| ПРИМЕНЕНИЕ Mycobacterium vaccae ДЛЯ РЕГУЛЯЦИИ ПО ТИПУ ОТРИЦАТЕЛЬНОЙ ОБРАТНОЙ СВЯЗИ Th2-АКТИВНОСТИ ИММУННОЙ СИСТЕМЫ | 1997 |
| RU2197989C2 |
| ЛЕЧЕНИЕ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА С ПОМОЩЬЮ ВЫДЕЛЕННОЙ MYCOBACTERIUM | 2013 |
| RU2670751C9 |
| ВАКЦИНЫ РЕКОМБИНАНТНЫХ ВНУТРИКЛЕТОЧНЫХ ПАТОГЕНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2001 |
| RU2266132C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИЧЕСКИЕ БАКТЕРИИ ИЛИ ИХ КОМПОНЕНТЫ, И СПОСОБ ЕЕ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ИММУННЫХ ЗАБОЛЕВАНИЙ КОЖИ | 2017 |
| RU2699540C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ АКТИВНОЙ ИНФЕКЦИИ MYCOBACTERIUM TUBERCULOSIS | 2013 |
| RU2659149C2 |
| ВАКЦИНА MYCOBACTERIUM TUBERCULOSIS | 2009 |
| RU2473365C1 |
| ВИРУС КОЗЬЕГО АРТРИТА-ЭНЦЕФАЛИТА, ОБЕСПЕЧИВАЮЩИЙ ИММУННУЮ ЗАЩИТУ ОТ ИНФЕКЦИИ ВИЧ-1 | 1997 |
| RU2194529C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПЕРСИСТИРУЮЩИХ ИНФЕКЦИЙ | 2006 |
| RU2434641C2 |
Реферат патента 1998 года СПОСОБ ЛЕЧЕНИЯ ВИЧ-ИНФЕКЦИИ
Изобретение относится к медицине, конкретно - к лечению инфекционных болезней, и касается способа лечения ВИЧ-инфекции со СПИДом. Авторами настоящего изобретения установлено, что антигенный и/или иммунорегуляторный материал, полученный из Mycobacterium vaccae в количестве от 10 7 до 10 1 0 микроорганизмов на дозу, вызывает регрессию или исчезнование явных симптомов СПИДа даже у больных с прогрессирующей формой болезни. 4 з.п.ф-лы.
Обсуждения последних пяти лет, что муссируется тема, главным образом касались ответа на вопрос, достаточно ли счесть здравоохранение одним из аспектов безопасности или угрозы, позволяющие вводить принудительное лицензирование, необходимо детализировать.
Кроме того, ФАС, в отличие от радикально настроенных сторонников волевого патентного обвала, предлагает добавить в статью 1360 ГК абзац, расширяющий полномочия Правительства РФ по назначению компенсации правообладателю: Кабмин сможет утвердить общий порядок расчета, но сумма всякий раз будет определяться индивидуально, пояснил Молчанов.
В Госдуме, куда документ, так или иначе, попадет, с темой хорошо знакомы: среди депутатов последних двух созывов обязательно находился адепт принудительного лекарственного лицензирования. Например, в конце 2014 года с таким предложением относительно лекарств для терапии тяжелых заболеваний к премьеру Медведеву обращался тогдашний глава Комитета по охране здоровья Сергей Калашников.
Инициативу парламентария затормозили на министреском уровне. Вероника Скворцова, в ответ на запрос правительственной комиссии по охране здоровья о целесообразности мероприятия, сообщила, что острой нужды в нем не видит: российские производители уже выпускают дженерики всех препаратов с истекшей патентной защитой и разрабатывают аналоги лекарств, срок действия патентов на которые скоро заканчивается.
В феврале 2018 года думский комитет по охране здоровья создал новую рабочую группу по принудительному лицензированию, правда, с тех пор провел лишь одно заседание, назначив второе на июль 2019‑го. Сферой внимания депутатов опять стали АРВ‑препараты.
В 2018 году этот показатель, по данным главного внештатного специалиста по ВИЧ Минздрава Евгения Воронина, составил 62% пациентской аудитории, к 2020 году Минздрав должен довести этот охват АРВ-терапией до 75%.
Коалиция в марте 2019 года обращалась в Госдуму, к руководителю межфракционной рабочей группы по совершенствованию законодательства в сфере лекобеспечения Андрею Исаеву с письмом об усугубляющейся эпидемиологической ситуации и низкой доступности АРВ‑терапии. В этой связи коалиция предлагает выдать принудительную лицензию на ралтегравир (Исентресс от MSD) и этравирин (Интеленс от J&J). Эти дорогие лекарства в 2018 году принимали всего около 5% пациентов, в плане‑графике закупок Минздрава на 2019 год на их приобретение зарезервировано около 5 млрд рублей – 24% общего бюджета централизованных закупок АРВ‑препаратов, намекают на возможную экономию в коалиции.
По словам Хуснулина, Минздрав, Минпромторг и отечественные фармпроизводители предложение лоббистов поддерживают, тогда как дистрибьюторы называют его неактуальным и даже вредным для инвестиционной привлекательности страны.
Страны ВТО, в том числе Россия, руководствуются принятым в 1994 году соглашением, регламентирующим решение споров по использованию объектов интеллектуальной собственности (ТРИПС). Гибкие положения ТРИПС, в том числе статья 31bis, позволяют производить и даже экспортировать защищенные патентами лекарства, но только в случае острой необходимости и при обязательном направлении в ВТО соответствующего запроса.
Принудительные лицензии по традиции испрашиваются на лекарства для терапии ВИЧ, гепатита С и онкозаболеваний. Опыт в отношении последних ограничивается несколькими примерами, демонстрирующими не очень высокую эффективность механизма. В 2008 году Таиланд получил принудительную лицензию на Гливек (иматиниб), но через некоторое время Novartis снизил цены на свой препарат для тайского рынка, и разрешение было аннулировано.
В 2012 году правительство Индии выдало компании Natco Pharma право на производство Нексавара (сорафениб) от Bayer с условием выплаты 6% роялти. Но затем местная Cipla выпустила на рынок дженерик сорафениба сразу на 75% дешевле стоимости оригинала, что сделало выплату роялти бессмысленной. В компании Bayer, комментируя Vademecum этот сюжет, рассказали, что использование инструмента принуждения в течение года привело к сокращению прямых иностранных вложений в экономику Индии на 65% и к потере примерно $10 млрд инвестиций конкретно в фармпром.
Куда успешнее принудительное лицензирование выглядит в сегменте противовирусных средств, в том числе АРВ‑препаратов и лекарств от гепатита С.
Если для онкопрепаратов крайне сложно предсказать потребность и перспективные позиции в лицензировании и даже перечень нозологий, то с ВИЧ и гепатитом С все иначе. В первом случае точно известно, что пациенту предстоит принимать препарат всю жизнь, для гепатита С вполне понятна продолжительность курса – до 12 недель в зависимости от генотипа вируса и выбранной схемы лечения.
В 2004 году Индонезия выдала лицензии на АРВ‑препараты ламивудин и невирапин, действовавшие до окончания в 2011‑2012 годах сроков патентной защиты. Разрешения эти предполагали выплату роялти – 0,5% с продаж. В декабре 2018 года Индонезия привела регламент в соответствие с требованиями ТРИПС, а кроме того, ограничила круг соискателей таких лицензий: в этом качестве может выступить только локальный производитель, обязующийся под угрозой отзыва разрешения организовать производство в течение пяти лет.
В 2006 году Всемирный банк, оценив доход на душу населения и число заболевших ВИЧ в Таиланде, разрешил использование в стране принудительных лицензий на АРВ‑препараты.
Получение такой лицензии на дженерик Калетры привело к экономии $24 млн в год, но вызвало противодействие оригинатора: компания Abbott (позже AbbVie) отозвала с тайского рынка препарат Aluvia, представляющий собой улучшенную – стабильную к повышению окружающей температуры – версию Калетры.
В 2014 году индийские производители Cipla, Mylan, Cadila, Ranbaxy и Hetero получили добровольные лицензии на ряд препаратов для лечения гепатита С от Gilead. И уже в марте 2016‑го Индия сообщила о готовности прекратить практику принудительных лицензий.
Соглашение с Gilead, кстати, разрешало индийским компаниям экспорт в другие страны региона, в том числе Малайзию, которая в 2019 году получила еще и принудительную лицензию на софосбувир: Минздрав посчитал, что ограниченное количество поставщиков не позволяет охватить терапией критически важную часть аудитории. Стоимость препаратов от гепатита С для малайзийских пациентов теперь не превышает $120 за курс, но считать это обстоятельство несомненным успехом политики принуждения пока рано.
Особого внимания заслуживает египетский кейс Gilead: национальный регулятор просто отклонил основные заявки американской компании на получение патентов, признав их не соответствующими действующему законодательству, и местные производители смогли беспрепятственно изготавливать дженерики софосбувира и АРВ‑препаратов от Gilead. Оригинатору не оставалось ничего другого, кроме как предложить свои продукты по так называемой программе доступа за 1% от обычной стоимости. Сейчас на египетском рынке свободно обращаются и оригинальные, и воспроизведенные препараты, что, к слову, создает соблазн для их контрабанды в Россию.
А вот Китай, не стесняясь, использовал заявки о возможном применении механизма принудительного лицензирования в отношении Тамифлю (осельтамивир) для давления на Roche. В результате оригинатор выдал КНР, бесконечно привлекательной численностью населения и высокой заболеваемостью, добровольную лицензию. В конце 2018 года Китай начал реформу системы лекобеспечения и в обмен на большие – до 70% – скидки разрешил ускоренную регистрацию своих продуктов без проведения национальных КИ таким гигантам, как Roche, Eli Lilly, Novartis, AstraZeneca и так далее.
В качестве аргумента в пользу принудительного лицензирования российские регуляторы порой приводят примеры европейских стран, США и Канады. Однако их практика, как правило, связана с вполне конкретными угрозами жизни и здоровью населения и очень редко становится инструментом давления на оригинатора.
Инициативы по Тамифлю, аналогичные китайской, выдвигались, например, в 2005 году в США, хотя прежде всего они имели целью склонить Roche к локализации производства, чтобы обеспечить бесперебойный доступ к препарату в период эпидемии птичьего гриппа.
Немногим ранее, в 2001 году, секретарь Министерства здравоохранения и социальных служб США Томми Томпсон угрожал Bayer выдачей принудительной лицензии на Ципробай (ципрофлоксацин). Томпсон посчитал необходимым создание стратегических запасов антибиотика на случай биологической атаки: в сентябре в редакции ряда СМИ и нескольким сенаторам Демократической партии пришли письма со спорами сибирской язвы. Дальше угроз пошло канадское правительство, по тем же мотивам аннулировавшее патенты Bayer на Ципробай.
В Европе прецедентов еще меньше. В 2017 году в Германии Федеральный суд по интеллектуальным правам одобрил выдачу принудительной лицензии MSD на препарат Исентресс (ралтегравир). Надо оговориться, MSD уже производила ралтегравир по лицензии от Shionogi, однако лицензионное соглашение действовало только на продажи в Европе. В 2016 году Shionogi не устроил размер отчислений в $10 млн, и она подала в суд на MSD, которая выступила со встречным требованием предоставить принудительную лицензию, предусматривающую уже глобальные продажи. Суд это требование удовлетворил.
Как утверждают наиболее радикально настроенные адепты принудительного лицензирования, международная практика статистически подтверждает пользу и эффективность применения этого механизма: подобные индийскому кейсу случаи снижения инвестиционной привлекательности страны единичны, зато гораздо больше примеров того, как глобальные компании спешат локализоваться, а раздаваемые неограниченному кругу лиц лицензии стимулируют развитие конкуренции и высокотехнологичного инновационного производства.
Читайте также:


