Период окна вич в сша
Число заболевших ВИЧ-инфекцией снизилось на 7% по сравнению с 2018 годом — такое значительное снижение наблюдается впервые с 2015 года.
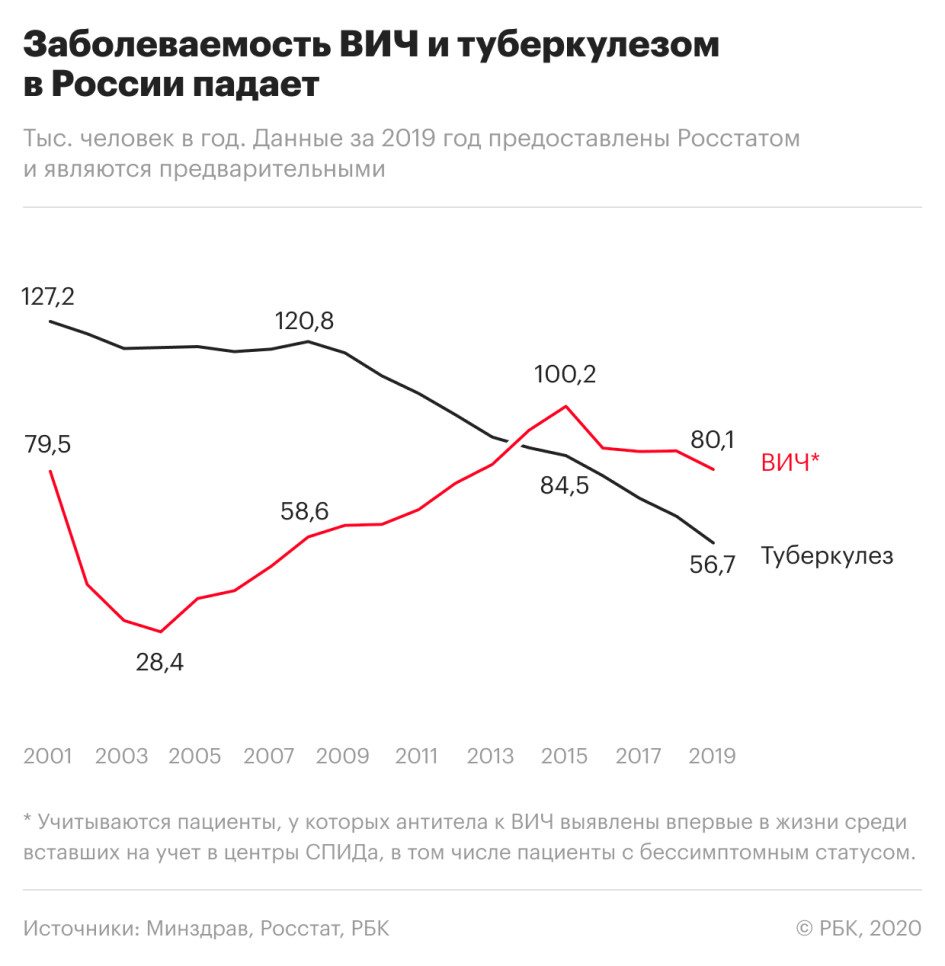
Смертность, связанная с ВИЧ, также уменьшилась — на 8% по сравнению с 2018 годом. В частности, от СПИДа, который развивается на фоне ВИЧ-инфекции, в прошлом году умерли 18,9 тыс. россиян.
При этом смертность от вызванных ВИЧ-инфекцией заболеваний значительно снизилась в регионах, которые являлись лидерами по этому показателю в предыдущие годы. Так, в Кемеровской области смертность по причинам, связанным с ВИЧ-инфекцией, снизилась на 11%, в Иркутской области — на 9%, в Свердловской области — на 13%, в Новосибирской — почти на 15%.
Одновременно показатель существенно вырос в Севастополе — +11%, рост на 4% зафиксирован в Курганской области. РБК направил запросы властям этих регионов.
Кемеровская область, несмотря на снижение смертности, осталась в России лидером по смертям, вызванным ВИЧ-инфекцией. В 2019 году там умерли около 38 тыс. человек, из них 1552 — от вызванных ВИЧ заболеваний, это каждый 25-й из умерших. В Кузбассе, как и в некоторых других регионах Сибири, от иммунодефицита по-прежнему умирают чаще, чем в результате самоубийств, убийств, ДТП и отравлений алкоголем вместе взятых.
По данным министерства здравоохранения региона, в Кемеровской области живут более 31,5 тыс. носителей ВИЧ — это более 2% трудоспособного населения. Антиретровирусную терапию (АРВТ) получают 73% больных — в министерстве уточнили, что это все, у кого есть показания для назначения лечения. Министр здравоохранения области Михаил Малин рассказал РБК, что в 2019 году регион потратил 288,7 млн руб. на противодействие ВИЧ, в 2020 году эта сумма вырастет в 1,4 раза, причем большую часть ее составляют средства регионального бюджета.
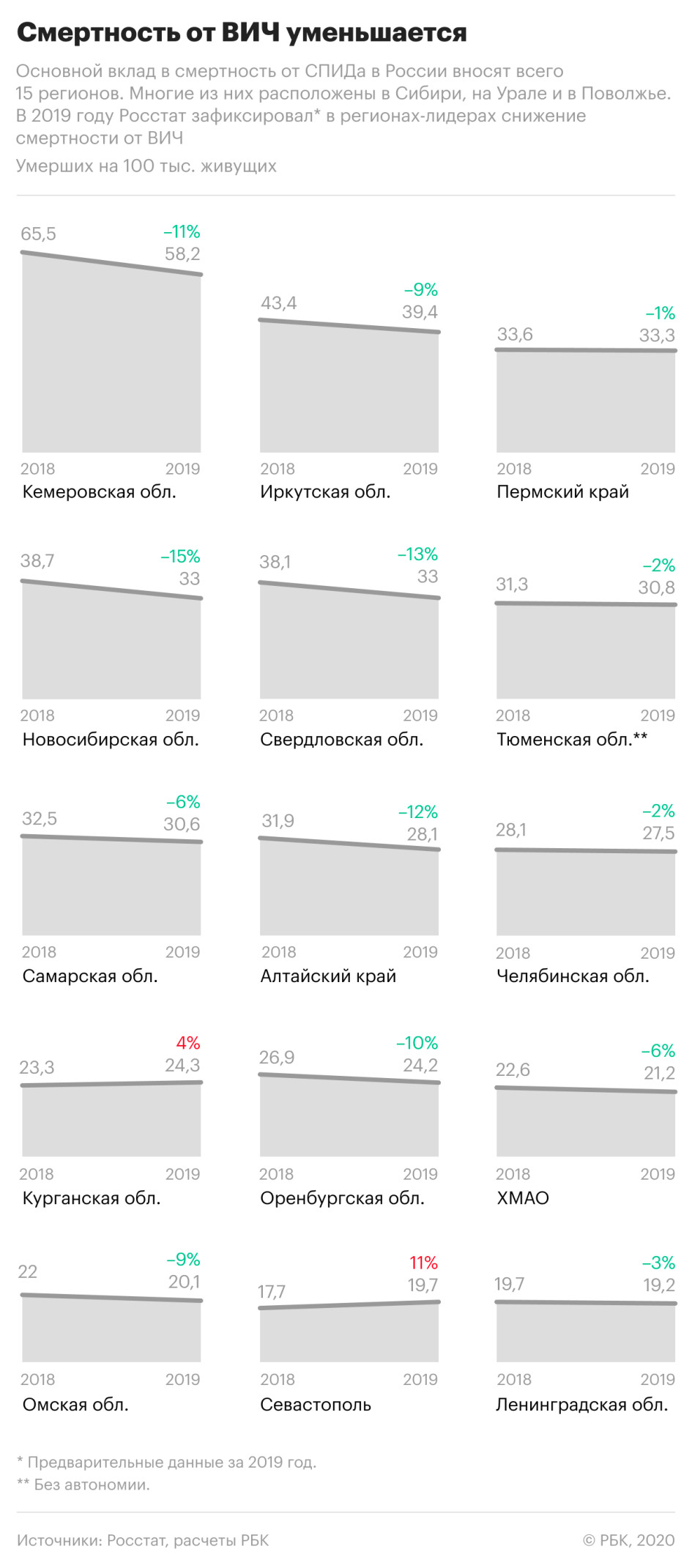
В Новосибирской области охват АРВТ составляет 75%, рассказал РБК министр здравоохранения региона Константин Хальзов. Это позволяет увеличить продолжительность жизни зараженных, уточнил он. Всего в регионе живут 31,3 тыс. носителей ВИЧ — это 2% жителей Новосибирской области трудоспособного возраста. Терапию из них получают 61%. Для борьбы с распространением инфекции в регионе действует программа равного консультирования, которая, по мнению министра, помогает социализации людей, живущих с ВИЧ, и формирует у них желание лечиться. Равные консультанты — это люди, живущие с вирусом и обученные консультировать новых пациентов.
В Иркутской области живут 30,1 тыс. больных ВИЧ, сообщила РБК замминистра здравоохранения Иркутской области Елена Голенецкая. АРВТ получают 58% из них. По словам Голенецкой, это все пациенты, которые нуждаются в терапии. Улучшение ситуации с смертностью от ВИЧ в регионе связывают с ростом числа пациентов, проходящих диспансеризацию.
Наркотрафик и другие причины эпидемии
Регионы, в которых больше всего жителей заразилось ВИЧ-инфекцией и умерло от СПИДа, во многом пересекаются с регионами, в которых популярны наркотики опийной группы. Именно в этих регионах, как показывает статистика МВД, в 2019 году правоохранительные органы изъяли большую часть опиатов.
Осторожный оптимизм и фильм Дудя
В 2019 году каждый четвертый россиянин прошел тестирование на ВИЧ, сообщили РБК в пресс-службе Минздрава. Антиретровирусную терапию получают 68,9% заболевших. Эти показатели выше плановых, указанных в Государственной стратегии по противодействию распространения ВИЧ-инфекции.


Кроме того, по словам Вадима Покровского, в некоторых регионах еще остается практика, когда вместо диагноза СПИД ставят непосредственную причину смерти пациента для улучшения отчетности.
Многие американские президенты пользуются возможностью заявить о грандиозных планах в области здравоохранения во время обращения к Конгрессу. Так, Барак Обама в 2016 году призвал совершить прорыв в лечении рака. Джордж Буш-младший в 2003 году объявил, что намерен переломить ситуацию в борьбе со СПИДом благодаря созданию PEPFAR, глобальной медицинской программы по борьбе с болезнью.
Хотя здравоохранение не относилось к особенным интересам Дональда Трампа в течение его президентского срока, во время своей речи 5 февраля он заострил внимание на обещании значительного достижения в области медицины — ликвидации эпидемии ВИЧ в Америке к 2030 году.

Сегодня более миллиона американцев живут с ВИЧ, и каждый год диагноз ставится порядка сорока тысячам человек. Группа людей, наиболее подверженных инфицированию ВИЧ в США, — это гомосексуальные и бисексуальные мужчины афроамериканского происхождения. В последние годы растет доля людей, которым был поставлен диагноз в возрасте от 25 до 35 лет. Однако предложение Трампа не так далеко от реальности, как может показаться.
Антиретровирусная терапия теперь способна подавлять вирус до такой степени, что он не определяется в крови, так что люди, получающие лечение, неспособны передать вирус другим. У нас есть также PrEP — доконтактная профилактика, которая продается под названием Truvada, позволяющая предотвратить инфицирование в случае риска. (Употребление этого препарата связывают с более рискованным сексуальным поведением). В сочетании с профилактическими мероприятиями — диагностикой, раздачей чистых игл, информированием о безопасном сексе — победа над ВИЧ действительно достижима.
Однако сегодня конкретный план администрации не вполне ясен. Все, что у нас есть, — это двухстраничная справка Министерства здравоохранения, с которой можно ознакомиться. Так что мы опросили семь экспертов в области ВИЧ и здравоохранения о том, что должен включать в себя план Трампа по борьбе с ВИЧ в США, если администрация всерьез намерена прекратить эпидемию. Вот что они нам рассказали. Ответы незначительно отредактированы для большей ясности.
Предоставить доступ к PrEP людям из групп риска
Дженнифер Кейтс, вице-президент и директор Отдела глобальной охраны здоровья и политики в области ВИЧ Фонда семьи Кайзера
Одна из самых больших проблем для США прямо сейчас — только у приблизительно половины людей, живущих с ВИЧ, вирусная нагрузка подавлена (то есть они принимают препараты, которые снижают риск передачи инфекции до нуля). Если бы она была подавлена у 90 % населения, все было бы совсем иначе. Именно в этом и заключается наша основная задача: лечить людей и подавлять вирус. Если инфекция подавлена надежно, то отсутствует риск ее передачи ВИЧ-негативному партнеру.

Вторая часть решения — это PrEP. Она рекомендуется тем, кто оказался в ситуации повышенного риска инфицирования ВИЧ. В данный момент в нашей стране не существует механизма стабильного обеспечения населения PrEP. Деньги Райана Уайта (федеральная программа, которая направляет гранты городам и штатам на обеспечение лечения ВИЧ у малоимущих пациентов) не выделяются на доконтактную профилактику, потому что это грант для людей, живущих с ВИЧ. А PrEP, по определению, нужна людям, у которых ВИЧ нет.
Медицинская страховка покрывает PrEP. Так что, если вы застрахованы, вы сможете получить PrEP, но вам может потребоваться помощь для выплаты обязательных платежей. Если же вы не застрахованы или застрахованы недостаточно, то программа Райана Уайта вам не поможет.
Таким образом, существующая в США система основывается на том, что фармацевтическая индустрия предоставляет PrEP людям через программу помощи. Так что новая инициатива должна будет решить две проблемы: обеспечить лечение большему числу людей, чтобы подавить инфекцию, и предоставить профилактику ВИЧ людям в ситуации повышенного риска.
Поддержать расширение Medicaid в штатах
Грегг Гонсалвес, профессор эпидемиологии в Йельском институте общественного здравоохранения и бывший ВИЧ/СПИД-активист
Является ли [победа над ВИЧ] достижимой целью? Да. Или, по крайней мере, что-то очень близкое к этому. Нам нужно лечить людей, потому что если вы ВИЧ-положительный человек и получаете лечение, то не сможете передать заболевание. Это значит, что необходимо расширить доступ к здравоохранению.
Medicaid оплачивает многие медицинские услуги людям с ВИЧ. Расширение Medicaid благотворно повлияло на лечение ВИЧ по всей стране, кроме зон, в которых передача ВИЧ [наиболее высока], потому что именно на эти территории расширение и не распространилось. Штаты, которые отказываются от расширения Medicaid (на Юго-востоке США), наиболее сильно затронуты эпидемией.
Обратить внимание на социальный контекст ВИЧ
Грег Миллет, вице-президент и директор направления государственной политики Американского фонда исследования СПИДа
Одна из причин нашего большого успеха в лечении и профилактике ВИЧ — это проведенные учеными невероятные исследования. Проблема в том, что мы на самом деле не знаем, как применить полученные инструменты в полевых условиях. Чтобы лечение работало в качестве профилактики, чтобы люди не распространяли инфекцию, они должны постоянно подавлять вирусную нагрузку. Центры контроля и профилактики заболеваний США опубликовала данные, согласно которым среди всех американцев, живущих с ВИЧ, только у 48 % неопределяемая вирусная нагрузка в любой произвольно выбранный момент в течение года.
Мы знаем, что активно препятствует подавлению вирусной нагрузки. Одно из таких явлений — бездомность. Если у вас нет дома или постоянного места жительства, вы, скорее всего, не сможете принимать свои лекарства вовремя. То же касается постоянного трудоустройства. [Если вы не имеете работы или трудоустроены недостаточно, менее вероятно, что ваша нагрузка будет неопределяемой]. А большая доля людей, в первую очередь живущих с ВИЧ, — это именно люди из маргинализированных сообществ с низким уровнем жизни.
В недавнем важном исследовании Алабамского университета ученые рассмотрели неблагоприятные события, которые переживают люди, живущие с ВИЧ. Чем больше с вами происходит подобных вещей: увольнение, бездомность, какие-либо иные события, нарушающие течение вашей жизни, например, развод, тем менее вероятно, что вы будете своевременно принимать лекарства и иметь неопределяемую нагрузку.
В самый разгар эпидемии опиоидного наркопотребления также становится заметно, что растет число случаев инфицирования ВИЧ среди людей, употребляющих инъекционные наркотики. Программы распространения одноразовых шприцев значительно сокращают риск передачи ВИЧ, предоставляя людям чистые шприцы, так что мы должны расширять такие услуги. К сожалению, две трети американцев живут в 10 милях и далее от центров раздачи шприцев, что осложняет их доступ к услуге.
Увеличить финансирование государственного здравоохранения
Джеффри Клойзнер, профессор отделения инфекционных заболеваний в Институте государственной медицины Филдинга при Калифорнийском университете
Мы создали феноменальные инструменты, позволяющие покончить со СПИДом. У нас есть препарат, который можно принимать по одной таблетке в день, чтобы лечить ВИЧ, и препарат, который можно принимать раз в день для профилактики. Проблемы в том, как применить эти инструменты, и помехой является недостаток финансирования.
Конгресс замечательным образом поддержал [исследование ВИЧ] Национального института здравоохранения и совершенно ужасно обошелся с Центрами контроля и профилактики заболеваний, которые и должны были внедрять созданные инструменты.
Мы знаем, где в США возникают новые очаги заражения — вплоть до индекса. Мы должны использовать данные наших наблюдений и эпидемиологические данные, чтобы находить новые случаи, предлагать людям диагностику и обеспечивать их лечение и профилактику. А чтобы сделать это, мы должны реформировать местные учреждения государственного здравоохранения.
Однако после кризиса 2008 года государственное здравоохранение было разрушено. Недостаток финансирования государственного здравоохранения лишил нас нашей сети безопасности и сделал невозможным контроль над инфекционными заболеваниями, такими как ВИЧ и другие ЗППП. Инвестиции в государственное здравоохранение на местах — это лучшее, что мы можем сделать, чтобы контролировать ВИЧ.

Дать группам риска возможность лечения и профилактики
Джеффри Кроули, профессор юриспруденции Джорджтаунского университета и бывший директор офиса Белого дома по вопросам национальной политики в области СПИДа
Половина новых случаев ВИЧ в США выявляется в 46 округах. В стране более 3000 округов. Мы также знаем, что половину новых диагнозов ставят на Юге. Так что они концентрируются по географическому признаку.
Кроме того, они концентрируются и среди определенных социальных групп — гомосексуальные и бисексуальные мужчины составляют 2 % населения страны и более 70 % людей, у которых диагностировали ВИЧ в недавний период.
Эта информация полезна, потому что, если у вас есть свободные деньги, уместно распределить их на региональном уровне: новые случаи инфицирования сосредоточены на Юге, значит, лечение и профилактика ВИЧ должны быть сосредоточены там же. Также важно обращать наше внимание и отводить наши ресурсы таким группам населения, как гомосексуальные и бисексуальные мужчины, транс-люди, латиноамериканцы и чернокожие американцы, — это группы наивысшего риска.
Защищайте и укрепляйте права человека в ЛГБТ+ сообществах
Наина Ханна, исполнительный директор Сети ВИЧ-положительных женщин США
Так как эпидемия ВИЧ в нашей стране в особенности затрагивает гомосексуальных и бисексуальных мужчин-латиноамериканцев и афроамериканцев, трансгендерных цветных женщин, чернокожих женщин и латиноамериканок — преимущественно на Юге США, то нам нужно сконцентрировать усилия по борьбе с ВИЧ в этих сообществах.
Невозможно одновременно пытаться легализовать дискриминацию людей с транс-опытом в нашем здравоохранении — пытаться вычеркнуть существование трансгендерных людей — и при этом обеспечивать качественное здравоохранение в транс-сообществе.
Мы не можем эффективно предотвращать инфицирование ВИЧ, если у нас не будет полноценного полового просвещения людей всех возрастов, независимо от их сексуальной ориентации и гендерной идентичности. Нам нужно сексуальное просвещение, которое обращается к квир и транс-молодежи, которое предоставляет точную информацию о репродукции, включая контрацепцию и аборты. Но при администрации Трампа мы наблюдаем попытки восстановить опасную концепцию полового просвещения, основанного на стыде и воздержании, в школах и клиниках семейного планирования.
Мы не можем полагаться на стратегию, которая зависит от практик слежки за гражданами, в то время как более 30 штатов все еще имеют законы, криминализирующие людей с ВИЧ из-за их статуса. Эти законы создают климат страха и усиливают стигму людей, живущих с ВИЧ, создавая препятствия на пути диагностики, лечения, задач здравоохранения, так как для людей, живущих с ВИЧ, буквально опасно раскрывать свой ВИЧ-статус.

Добиваться доверия в группах повышенного риска
Гарольд Поллок, профессор Институт управления социальными услугами Хелен Росс при Чикагском университете
ВИЧ — в основе своей интерсекциональная задача, в которой отражаются все социальные проблемы и все политическое расслоение, существующее в американском обществе.
Некоторые из наиболее серьезно подверженных эпидемии зон инфицирования ВИЧ находятся на Юго-Востоке США и охватывают цветных людей. Когда Трамп пытается обращаться к малообеспеченным цветным людям, его известная пристрастность в области расовой идентичности делает его политически токсичным для слушателей в этих сообществах.
Администрация Трампа также с враждебностью относилась к трансгендерным американцам и другим сексуальным меньшинствам [которые непропорционально сильно затронуты ВИЧ]. Будет сложно отыскать в США группу, которая была бы менее дружелюбно настроена к администрации Трампа, чем молодые цветные мужчины, занимающиеся сексом с другими мужчинами.
Таким образом, администрации придется постараться, дабы ее услышали в этих сообществах. Им придется найти посланников, чтобы убедить людей. [Но] задача снизить число новых инфицированных в США вполне достижима. Президент Трамп заслуживает право на попытку, чтобы он смог показать, что собирается сделать. Джордж Буш младший — тоже консервативный политик, однако программа PEPFAR — это наиболее достойная часть его политического наследия.

В развитых странах уже много лет сложился относительный консенсус по срокам тестирования на ВИЧ, связанным с ситуациями риска инфицирования. Ниже мы приведем as is, так, как они есть, официальные позиции ведущих экспертных сообществ мира, снабдив их лишь необходимыми пояснениями. В том числе позиции, принятые крупными развитыми государствами в качестве официальных политик органов общественного здравоохранения. Наш перечень можно легко продолжить, рассматривая консенсусы экспертов других развитых и развивающихся стран, но в этом нет смысла, так как не будет обнаружено принципиальных разночтений с теми, что будут приведены ниже. Также мы осветим позиции, принятые странами Евросоюза и Всемирной организацией здравоохранения.
Франция. Еще в 2008 году французский регулятор в сфере здравоохранения Haute Autorité de santé (HAS, Высший орган здравоохранения) весьма четко и однозначно сформулировал политику в области тестирования на ВИЧ.
«Продолжительность серологического наблюдения в случае подозрения на ВИЧ-инфекцию
Основываясь на данных об эффективности методов, имеющихся в настоящее время на рынке стран ЕС, отрицательный результат комбинированного теста ИФА (речь идет о лабораторных тестах 4 поколения, примечание hiv.plus) через 6 недель после потенциального риска будет являться показателем отсутствия ВИЧ-инфекции. Если применена постконтактная профилактика (ПКП), то данный срок составляет 3 месяца после прекращения ПКП.
Стратегия скрининга и лабораторной диагностики в случае подозрений на ВИЧ-инфекцию, возникшую менее 6 недель тому назад, и без применения ПКП
Тестирование следует провести при первом же обращении с использованием ранее названных методов и повторить через 6 недель от даты первого тестирования.
Стратегия скрининга и лабораторной диагностики в случае подозрений на ВИЧ-инфекцию, возникшую менее 6 недель тому назад, при использовании ПКП
Цитата на языке оригинала (версия документа на английском языке): Duration of serological follow-up in the case of suspected HIV exposure(стр. 32).
Based on the performance of the techniques currently available on the European market, a negative result from the combined ELISA screening test 6 weeks after suspected HIV exposure will be considered as indicating that no HIV infection is present. In the case of post-exposure prophylaxis, the period remains 3 months after discontinuing treatment.
Screening and laboratory diagnosis strategy in the case of suspected HIV infection within less than 6 weeks and without any prophylactic treatment
An initial search for the HIV infection must be carried out in the exposed patient from the very first consultation, using the methods previously defined. It will be repeated 6 weeks after the time of suspected HIV exposure.
Screening and laboratory diagnosis strategy in the case of suspected HIV infection and with prophylactic treatment
An initial search for the HIV infection must be carried out in the exposed patient from the very first consultation, using the methods previously defined. It will be repeated 1 month and 3 months after discontinuing the prophylactic treatment. A negative result from the combined ELISA screening test 3 months after discontinuation of prophylactic treatment will be considered as indicating that no HIV infection is present.
Германия. Немецкие регуляторы чрезвычайно конкретны. Они описывают не только поколение тестов, рекомендованное для скрининга – четвертое, но и технические параметры таких тестов, а именно соответствие стандарту HIV-1 P24 Antigen WHO International Standard 90/636.
Данный стандарт в том числе предполагает использование тестов 4 поколения с чувствительностью к вирусному антигену p24 равной или меньшей, чем 2 МЕ/мл. Впрочем, это общее требование для маркировки соответствующей продукции European Conformity в странах ЕС. Чувствительность 1 МЕ/мл соответствует 10 пг/мл, то есть 2 МЕ/мл = 20 пг/мл.
Для понимания данной размерности приведем заявленную производителем чувствительность распространенной в Российской Федерации коммерческой тест-системы Abbott ARCHITECT HIV Ag / Ab Combo: в версии, одобренной FDA 18 июня 2010 года: аналитическая чувствительность к антигену ВИЧ p24 составляет 18,39 пг/мл (диапазон 17,80-19,68 пг/мл).
Так как в данном документе указано полное соответствие тезисов с позициями, изложенными в европейском руководстве European Guideline on HIV testing 2014, а также в ключевом документе по тестированию на ВИЧ-инфекцию швейцарской Концепции тестирования на ВИЧ Bundesamt für Gesundheit (BAG), то два последних документа мы приводим лишь в виде ссылок, дабы не дублировать идентичную информацию.
«1.1 Отрицательный результат скринингового теста на ВИЧ-инфекцию.
Отрицательный результат скрининговых тестов на ВИЧ исключает ВИЧ-инфекцию с высоким уровнем надежности. Могут быть исключения при условии, что
-последнее потенциально рискованное событие было менее 6 недель назад (для тестов 4 поколения) или менее 12 недель назад при использование тест-систем 3 поколения или экспресс-тестов (речь идет о так называемых аптечных экспресс-тестах, но не лабораторных, примечание hiv.plus).
Примечания:
1. Аналогичная оценка содержится в определениях Европейского руководства по тестированию на ВИЧ 2014 года и швейцарской Концепции тестирования на ВИЧ 2013 года.
2. Если проводилась постконтактная профилактика ВИЧ (ПКП), то временное окно 6 или 12 недель (в зависимости от использованного типа тестов, примечание hiv.plus) следует отсчитывать от даты прекращения ПКП. Если имеются подозрения на недавнее инфицирование ВИЧ (менее 6 недель), а выработка антител не фиксируется, то следует использовать ПЦР-тест на РНК ВИЧ.
Цитата на языке оригинала: «1.1 Negatives Ergebnis im HIV-Screeningtest
Ein negatives Ergebnis im HIV-Screeningtest schließt eine HIV-Infektion mit hoher Sicherheit aus. Ausnahmen können bestehen, wenn
-die letzte potenzielle HIV-Exposition kürzer als 6 Wochen zurückliegt (bei Verwendung von Testsystemen der 4. Generation) oder kürzer als 12 Wochen bei Verwendung von Testsystemen der 3. Generation oder von Schnelltesten.
Anmerkungen:
1. Eine analoge Einschätzung ist auch definiert in „2014 European Guideline on HIV testing“ und dem schweizerischen „HIV-Testkonzept 2013“.
2. Wird eine antiretrovirale Postexpositionsprophylaxe (PEP) durchgeführt, beginnt das Zeitfenster von 6 bzw. 12 Wochen erst nach dem Absetzen der PEP (siehe auch Anlage B). Bei Verdacht auf eine erst kürzlich erworbene HIV-Infektion (Expositionszeitpunkt
«Рекомендации BHIVA/BASHH/BIS UK с 2008 года предусматривают использование тестов 4 поколения для тестирования на ВИЧ-инфекцию. Данные тесты определяют наличие антител к ВИЧ и антигена p24 ВИЧ одновременно. Подавляющее большинство людей демонстрирует позитивный результат такого теста в образцах венозной крови уже через 4 недели от момента инфицирования. Людям, планирующим тестирование на ВИЧ по поводу конкретного риска, который возник менее чем за 4 недели назад, не следует откладывать тестирование, так как можно упустить возможность диагностики ВИЧ-инфекции, в том числе в острую фазу, когда риски передачи инфекции весьма высоки. Таковым людям следует предложить тестирование при помощи тест-систем 4 поколения, а также рекомендовать повторить его через 4 недели от даты, которую человек рассматривает как дату риска.
Отрицательный результат теста 4 поколения, проведенного через 4 недели после риска инфицирования, с весьма высокой вероятностью исключает ВИЧ-инфекцию. Повторное тестирование через 8 недель от даты, рассматриваемой как время риска инфицирования, следует рассмотреть лишь при событиях с высоким риском инфицирования (тут подразумевается, что оценка риска инфицирования в данном случае производится не человеком, обратившимся за тестом, а квалифицированным специалистом, имеющим представление о понятии высокого риска, примечание hiv.plus).
Цитата на языке оригинала: HIV testing using the latest (fourth generation) tests is recommended in the BHIVA/BASHH/BIS UK guidelines for HIV testing (2008). These assays test for HIV antibodies and p24 antigen simultaneously. A fourth generation HIV test on a venous blood sample performed in a laboratory will detect the great majority of individuals who have been infected with HIV at 4 weeks after specific exposure.
Patients attending for HIV testing who identify a specific risk occurring less than 4 weeks previously should not be made to wait before HIV testing as doing so may miss an opportunity to diagnose HIV infection (and in particular acute HIV infection during which a person is highly infectious). They should be offered a fourth generation laboratory HIV test and be advised to repeat it when 4 weeks have elapsed from the time of the last exposure.
A negative result on a fourth generation test performed at 4 weeks post-exposure is highly likely to exclude HIV infection. A further test at 8 weeks post-exposure need only be considered following an event assessed as carrying a high risk of infection.
Patients at ongoing risk of HIV infection should be advised to retest at regular intervals. Patients should be advised to have tests for other sexually transmitted infections in line with advice on window periods for those infections.

Understanding the Window Period. Denver PTC. Адаптация hiv.plus. Инфографика отражет данные из исследования Delaney KP. и др, 2017 (PMID: 27737954) и относится к тест-системам одобренным FDA.
ВОЗ. В заключение приводим позицию Всемирной организации здравоохранения, изложенную в Консолидированном руководстве для служб тестирования на ВИЧ, 2015.
Цитата на языке оригинала: 3.3.1 Retesting during the window period
In many settings post-test counselling messages recommend that all people who have a non-reactive (HIV-negative) test result should return for retesting to rule out acute infection that is too early for the test to detect – in other words, in the window period. However, retesting is needed only for HIV-negative individuals who report recent or ongoing risk of exposure. For most people who test HIV-negative, additional retesting to rule out being in the window period is not necessary and may waste resources.
For most people who test HIV-negative, additional retesting to rule out being in the window period is not necessary.
The routine and widely reiterated advice to everyone with a negative test result to retest after a “three month window period” is not appropriate. This is because most people who receive HIV testing and test HIV-negative, particularly where HIV testing is offered routinely in clinical settings, will not be at risk from recent infection. For a small minority who identify a specific recent suspected exposure, retesting after four to six weeks can be advised.
Если какого-то нашего читателя приведенные данные не убедят, то вряд ли его вообще что-то способно убедить, и таковому человеку ничего не останется, как руководствоваться самостоятельно написанной картиной мира по данному вопросу.
Тестирование на антитела к ВИЧ существует с 1985 года.
С того момента технология тестирования пережила значительную эволюцию: появилось много новых и усовершенствованных тест-систем, предназначенных как для исследовательских, так и для клинических целей. Поскольку лечение ВИЧ-инфекции невозможно, если не будет определен ВИЧ-статус, очень важно понимать, какие тесты существуют, и какие у них есть ограничения.
“В 1985 году главной целью тестирования было сканирование запасов донорской крови”, – вспоминает Стив Морин, директор Университета Калифорнии, Сан-Франциско.
На тот момент еще не существовало способов лечения ВИЧ-инфекции. Также никто не знал, всегда ли у человека с ВИЧ развивается СПИД и через какое время это может произойти.
Единственными медицинскими мерами было лечение оппортунистических заболеваний, которые появлялись, когда ослабевала иммунная система. Так что у людей не было мотивации, чтобы узнавать свой ВИЧ-статус.
В то же время, многие люди, которые считали, что у них был риск, хотели узнать, есть ли у них ВИЧ. По словам Морина это привело к
“опасению, что люди, которые хотят узнать о наличии у себя инфекции, начнут сдавать кровь, чтобы им сделали тест”.
Чтобы исключить такую возможность, федеральное и региональные правительства открыли альтернативные кабинеты тестирования, где люди могли бы узнать свой ВИЧ-статус. Опять же основной целью системы здравоохранения при тестировании была “профилактика… чтобы люди не передали вирус кому-либо еще”.
Но с появлением профилактики для предотвращения оппортунистических инфекций, а позднее – антиретровирусной терапии, цели тестирования изменились. Тесты на ВИЧ стали условием для лечения, и заодно, средством профилактики.
ВИЧ-инфекция подтверждается двумя разными тестами – скрининговым тестом и подтверждающим тестом. В своей недавней статье для Университета Калифорнии в Сан-Франциско исследователь из Университета Мариленда Ниел Константин объясняет, что
“скрининговые тесты обладают очень высокой чувствительностью, в то время как подтверждающие тесты обладают высокой специфичностью. Из-за высокой чувствительности скрининговые тесты могут давать ложноположительные результаты”.
Поскольку для скрининговых тестов есть вероятность ложноположительных результатов, обычно при получении первичного положительного результата берется тот же образец крови и скрининговый тест дублируется второй раз, и если он опять положительный, только тогда проводится подтверждающий тест другого типа. Подтверждающие тесты проводятся только для образцов крови, которые неоднократно дают положительные результаты (являются “реактивными”).
Комбинация из двух разных типов тестов гарантирует, что полученные результаты обладают “высокой точностью”. Константин отмечает, что технические ошибки и редкие биологические факторы нельзя полностью исключить.
Обычно для него используют в качестве подтверждающего теста иммунный блотинг. Точно такая же технология (диагностика с помощью ИФА и иммунного блотинга) применяется для выявления огромного числа заболеваний, например, для диагностики болезни Лайма. На самом деле иммунологические методы, на которых основаны эти тесты, настолько фундаментальные, что Салли Лиска, глава городской лаборатории здравоохранения Сан-Франциско, называет их “серология 101”.
ИФА используется как первоначальный скрининговый тест по двум причинам. Во-первых, он обладает очень высокой чувствительностью. Во-вторых, он достаточно дешев и прост для применения. Лиска добавляет:
“Обрабатывать образцы с помощью ИФА намного проще. Требуется небольшой объем крови. Процесс менее трудоемкий. Он гораздо более автоматизирован”.
Только небольшая часть из них одобрена для применения в США, а некоторые из тестов одобрены только для исследовательских целей. Эти тест-системы используют искусственно созданные белки ВИЧ, которые “ловят” специфические антитела, которые организм вырабатывает в ответ на белки вируса. Как только антитела пойманы, объясняет Константин, они “могут быть определены реагентами, которые применяются вместе с индикатором, например, ферментом, который приводит к изменению цвета”. Изменения цвета считываются машиной, которая и определяет результат.
Иммунный блотинг действует по похожей схеме, но для него используется электрическое поле, которое различает различные компоненты на основе их молекулярной массы. Это позволяет определить антитела к специфическим вирусным антигенам, которые затем изображаются на бумаге как различимые “полоски”. Иммунный блотинг, по словам Лиски:
“Несколько сложнее для проведения… и гораздо более трудоемок”. Иммунный блотинг также менее чувствителен, добавляет она, поэтому он “никогда не должен применятся сам по себе”.
Иммунный блотинг – самый распространенный подтверждающий тест, но были разработаны и другие тесты для этой цели, например, анализ на непрямые флуоресцирующие антитела, или радиоиммунный анализ. “При условии правильного проведения и интерпретации, эти очень специфические тесты не дают ложноположительных результатов”, – пишет Константин.
Главный недостаток тестирования на антитела – это “период окна”, то есть период, который требуется организму, чтобы выработать антитела в ответ на инфекцию. Стандартные тесты на ВИЧ не определяют вирус сам по себе, но антитела, которые вырабатывает организм. До того, как в организме выработаются антитела, у человека может быть ВИЧ, и вирус может передаваться другим людям, но при этом тест на антитела к ВИЧ будет отрицательным.
Когда первые тесты на ВИЧ были одобрены, период окна варьировался от 6 до 12 недель, но более современные технологии позволяют определить более низкий уровень антител, и поэтому тесты могут дать положительный результат и раньше.
“Современные тест-системы могут определить ВИЧ-инфекцию через 3-5 недель у большинства людей”, – пишет Константин. – “Это верно, как для всех тест-систем ИФА, так и для экспресс-анализов. Некоторые тесты чаще показывают положительный результат через 3 недели, но в целом они все эквивалентны”. Однако он объясняет, что это “зависит от человека (у которого антитела могут вырабатываться не так быстро, как у других)”.
Ранее все тесты проводились на крови. Недавно были разработаны тест-системы для определения антител в слюне и моче. Оральный тест – OraSure, первый был одобрен для применения в США, следует протоколу скрининга/подтверждения, как и другие тесты на ВИЧ. Это не совсем тест на слюну, для него используется небольшой соскоб жидкости с десен.
Главное преимущества таких тестов – неинвазивная процедура, которая более комфортна для многих пациентов, а также такие тесты можно использовать в местах, где забор крови невозможен по санитарным или практическим соображениям. Тесты на мочу также были разработаны, но они не привлекают такого внимания как тесты на слюну, так как не было одобрено подтверждающего теста на мочу, и для подтверждения результата все равно нужно сдавать кровь.
Другой инновацией стали экспресс-тесты на ВИЧ. При использовании обычных тестов образец крови посылается в лабораторию, и в результате пациент может прождать неделю прежде чем получить результат. Экспресс-тесты делаются на месте, и результат можно получить в течение получаса. Как и в случае с ИФА, положительный результат нуждается в подтверждающем тестировании иммунным блотингом.
Преимущества экспресс-тестов в том, что они исключают ситуацию, когда пациент не возвращается за результатом. В анонимных кабинетах тестирования на ВИЧ уровень не возвращающихся пациентов довольно низок, но в таких учреждениях как клиники по лечению ИППП, около 30% пациентов не приходят, чтобы узнать результат.
Согласно Константину, экспресс-тесты
“показали такую же точность, как и ИФА, при условии, что они выполняются осторожно и квалифицированным персоналом. Возможность совершения технической ошибки для таких тестов, как ни парадоксально, выше, потому что процедура кажется слишком простой, и пользователь может стать небрежным при его проведении”.
Чтобы решить эту проблему многие экспресс-тесты обладают сейчас встроенными системами контроля, которые должны определить, соблюдена ли процедура тестирования.
Вскоре после инфицирования ВИЧ у некоторых пациентов развивается острая (или “первичная”) ВИЧ-инфекция – период заболевания с симптомами, похожими на грипп, например, лихорадкой. Аналогичные симптомы может вызвать грипп и многие другие инфекции. Многие ученые считают, что в этот период человеку нужно назначить лечение, при условии, конечно, что был поставлен верный диагноз. В то же время лечение острой ВИЧ-инфекции остается спорным вопросом.
На данный момент для подтверждения подозрений на острую ВИЧ-инфекцию рекомендуется тестирование на РНК ВИЧ (ПЦР, тест на вирусную нагрузку). Обычный тест на антитела не определит острую ВИЧ-инфекцию, так как она проходит в “период окна”, когда антитела еще не производятся.
Тесты на вирусную нагрузку могут давать ложноположительные результаты. Тем не менее, анализ данных исследований, опубликованный еще в 1999 году в журнале “American Family Physician” говорит, что вполне возможно достаточно точное определение острого периода: “Во время периода острой ВИЧ-инфекции тест на вирусную РНК показывает результат более 50 000 копий/мл. Было зарегистрировано три случая ложноположительных РНК-тестов на ВИЧ-1, но во всех случаях пациенты были бессимптомными, и вирусная нагрузка была у них менее 2 000 копий/мл. Присутствие высокого титра РНК ВИЧ-1 (более 50 000 копий/мл) в отсутствие антител к ВИЧ позволяет диагностировать острую ВИЧ-инфекцию”.
На настоящий момент ни один тест на вирусные частицы не был одобрен для постановки диагноза ВИЧ-инфекция у пациентов. Тем не менее, в США одобрен тест на вирус для скрининга больших объемов донорской крови. Если тест на вирусную нагрузку недоступен, при подозрении на острую ВИЧ-инфекцию рекомендуется тестирование на антиген p24 – вирусный белок. В любом случае, как только закончится срок для “периода окна” диагноз должен быть подтвержден стандартным тестированием на антитела.
В научных целях могут использоваться тест-системы ИФА, чья точность была намерено занижена. Такие тесты используются потому, что уровень антител после инфицирования следует определенной и предсказуемой схеме. Через 4-6 месяцев после передачи ВИЧ этот уровень резко поднимается, а затем достигает постоянного уровня – плато – который остается неизменным на протяжении многих лет.
Современные тест-системы ИФА могут определить очень низкий уровень антител. ИФА с пониженной точностью больше не используются для диагностики среди пациентов. Однако их могут применять ученые и врачи, чтобы понять, произошла ли передачи вируса недавно, или это давняя инфекция. Если инфекция недавняя, то менее чувствительный тест, который становится положительным только к 6 месяцам, сможет это показать.
Константин суммирует свой обзор, говоря, что между различными и эпидемиологическими институтами был достигнут полный консенсус в отношении тестирования на ВИЧ:
“Тесты на антитела обладают чувствительностью практически на 100%, и специфичностью примерно на 99%”.
Такой уровень точности тестирования был показан в большом количестве исследований, включая регулярные оценки достоверности коммерческих тест-систем, поступающих на рынок, которые проводит Всемирная организация здравоохранения.
Эта аннотация была написана Брюсом Миркинемом для Центра по контролю заболеваемости и профилактике США (CDC) в связи с изменениями в официальных руководствах по тестированию в этой стране. В этой статье говорится о надежности тестов и новых системах тестирования, которые не так давно начали регистрироваться в США.
Читайте также:


