При вич клетки киллеры
Иголка в стоге сена
Генетикам давно известны гены устойчивости к некоторым вирусам у мышей, например к вирусу лейкоза. Но существуют ли подобные гены у человека, и если да, то какова их роль в защите против СПИДа?
Стивен О'Брайн и Михаэль Дин со своими коллегами из Национального института рака США много лет вели поиск таких генов у человека.
В начале 80-х годов американские ученые исследовали множество людей, которые по тем или иным причинам могли заразиться вирусом иммунодефицита. Они проанализировали тысячи образцов крови и обнаружили, казалось бы, необъяснимое явление: у 10-25% обследованных вирус вообще не выявляется, а около 1% носителей ВИЧ - относительно здоровы, признаки СПИДа у них либо отсутствуют, либо выражены очень слабо, а иммунная система в полном порядке. Неужели существует какая-то устойчивость к вирусу у некоторых людей? И если да, то с чем она связана?
Опыты на лабораторных мышах, крысах, морских свинках и кроликах показали, что устойчивость к различным вирусным инфекциям часто определяется целым набором генов. Оказалось, что сходный механизм определяет и устойчивость к вирусу иммунодефицита человека.
Известно, что многие гены ответственны за выработку определенных белков. Часто бывает, что один и тот же ген существует в нескольких измененных вариантах. Такие "многоликие" гены называются полиморфными, а их варианты могут отвечать за выработку различных белков, которые по-разному ведут себя в клетке.
Сравнив восприимчивость к вирусам у мышей, несущих множество разнообразных наборов генов, и у мышей с небольшим числом генных вариантов, ученые пришли к выводу, что чем разнороднее генетически были животные, тем реже они заражались вирусом. В таком случае можно предположить, что в генетически разнообразных человеческих популяциях генные варианты, определяющие устойчивость к ВИЧ, должны встречаться достаточно часто. Анализ заболеваемости СПИДом среди американцев различных национальностей выявил еще одну особенность: более устойчивы американцы европейского происхождения, у африканцев и азиатов устойчивость близка к нулю. Чем объяснить такие различия?
Ответ на этот вопрос предложил в середине 80-х годов американский вирусолог Джей Леви из Калифорнийского университета в Сан-Франциско. Леви и его коллеги пытались выяснить, какие именно клетки в организме поражает вирус. Они обнаружили, что после того, как вирус заражает иммунные клетки, они легко узнаются иммунными клетками другого типа, так называемыми Т-киллерами (убийцами). Киллеры разрушают зараженные вирусом клетки, препятствуя дальнейшему размножению вируса. Клетки-убийцы несут на своей поверхности особую молекулу - рецептор CD8. Она, как принимающая антенна, "узнает" сигналы от клеток, зараженных вирусом, и клетки-убийцы уничтожают их. Если из крови удалить все клетки, несущие молекулу CD8, то вскоре в организме обнаруживаются многочисленные вирусные частицы, происходит быстрое размножение вируса и разрушение лимфоцитов. Не в этом ли ключ к разгадке?
В 1995 году группа американских ученых под руководством Р. Галло обнаружила вещества, которые вырабатываются в клетках-киллерах, несущих молекулы CD8, и подавляют размножение ВИЧ. Защитные вещества оказались гормоноподобными молекулами, называемыми хемокинами. Это небольшие белки, которые прикрепляются к молекулам-рецепторам на поверхности иммунных клеток, когда клетки направляются к месту воспаления или заражения. Оставалось найти "ворота", сквозь которые проникают в иммунные клетки вирусные частицы, то есть понять, с какими именно рецепторами взаимодействуют хемокины.
Ахиллесова пята иммунных клеток
Вскоре после открытия хемокинов Эдвард Бергер, биохимик из Национального института аллергических и инфекционных болезней в Бетезде, США, обнаружил в иммунных клетках, в первую очередь поражаемых вирусом (их называют клетки-мишени), сложный по строению белок. Этот белок как бы пронизывает мембраны клеток и содействует "посадке" и слиянию вирусных частиц с оболочкой иммунных клеток. Бергер назвал этот белок "фузин", от английского слова fusion - слияние. Оказалось, что фузин родствен белкам-рецепторам хемокинов. Не служит ли этот белок "входными воротами" иммунных клеток, через которые вирус проникает внутрь? В таком случае взаимодействие с фузином какого-нибудь другого вещества закроет доступ вирусным частицам в клетку: представьте, что в скважину замка вставляется ключ, и вирусная "лазейка" исчезает. Казалось бы, все встало на свои места, и взаимосвязь хемокины - фузин - ВИЧ уже не вызывала сомнений. Но верна ли эта схема для всех типов клеток, зараженных вирусом?
Пока молекулярные биологи распутывали сложный клубок событий, происходящих на поверхности клеток, генетики продолжали поиск генов устойчивости к вирусу иммунодефицита у людей. Американские исследователи из Национального института рака получили культуры клеток крови и различных тканей от сотен пациентов, зараженных ВИЧ. Из этих клеток выделили ДНК для поиска генов устойчивости.
Чтобы понять, насколько сложна эта задача, достаточно вспомнить, что в хромосомах человека содержится около 100 тысяч различных генов. Проверка хотя бы сотой доли этих генов потребовала бы нескольких лет напряженной работы. Круг генов-кандидатов заметно сузился, когда ученые сосредоточили свое внимание на клетках, которые прежде всего поражает вирус, - так называемых клетках-мишенях.
Уравнение со многими неизвестными
Одна из особенностей вируса иммунодефицита заключается в том, что его гены внедряются в наследственное вещество зараженной клетки и "затаиваются" там на время. Пока эта клетка растет и размножается, вирусные гены воспроизводятся вместе с собственными генами клетки. Затем они попадают в дочерние клетки и заражают их.
Из множества людей с высоким риском заражения ВИЧ отобрали зараженных вирусом и тех, кто не стал носителем ВИЧ, несмотря на постоянные контакты с больными. Среди зараженных выделили группы относительно здоровых и людей с быстро развивающимися признаками СПИДа, которые страдали сопутствующими заболеваниями: пневмонией, раком кожи и другими. Ученые изучили разные варианты взаимодействия вируса с организмом человека. Различный исход этого взаимодействия, по-видимому, зависел от набора генов у обследованных людей.
Выяснилось, что люди, устойчивые к СПИДу, имеют мутантные, измененные гены рецептора хемокинов - молекулы, к которой прикрепляется вирус, чтобы проникнуть в иммунную клетку. У них контакт иммунной клетки с вирусом невозможен, поскольку нет "принимающего устройства".
В это же время бельгийские ученые Михаэль Симпсон и Марк Парментье выделили ген другого рецептора. Им оказался белок, который также служит рецептором для связывания ВИЧ на поверхности иммунных клеток. Только взаимодействие этих двух молекул-рецепторов на поверхности иммунной клетки создает "посадочную площадку" для вируса.
Итак, основными "виновниками" заражения клеток вирусом иммунодефицита служат молекулы-рецепторы, названные CCR5 и CD4. Возник вопрос: что происходит с этими рецепторами при устойчивости к ВИЧ?
В июле 1996 года американская исследовательница Мэри Керингтон из Института рака сообщила, что нормальный ген рецептора ССR5 обнаруживается лишь у 1/5 обследованных ею пациентов. Дальнейший поиск вариантов этого гена среди двух тысяч больных дал удивительные результаты. Оказалось, что у 3% людей, не заразившихся вирусом, несмотря на контакты с больными, ген рецептора ССR5 измененный, мутантный. Например, при обследовании двух нью-йоркских гомосексуалистов - здоровых, несмотря на контакты с зараженными, выяснилось, что в их клетках образуется мутантный белок CCR5, не способный взаимодействовать с вирусными частицами. Подобные генетические варианты были найдены лишь у американцев европейского происхождения или у выходцев из западной Азии, у американцев же африканского и восточноазиатского происхождения не нашли "защитных" генов.
Оказалось также, что устойчивость некоторых пациентов к инфекции лишь временная, если они получили "спасительную" мутацию только от одного из своих родителей. Через несколько лет после заражения количество иммунных клеток в крови таких пациентов снижалось в 5 раз, и на этом фоне развивались сопутствующие СПИДу осложнения. Таким образом, неуязвимыми для ВИЧ были только носители сразу двух мутантных генов.
Но у обладателей одного мутантного гена признаки СПИДа все же развивались медленнее, чем у носителей двух нормальных генов, и такие больные лучше поддавались лечению.
Не так давно исследователи обнаружили разновидности чрезвычайно агрессивных вирусов. Людей, зараженных такими вирусами, не спасает даже присутствие двух мутантных генов, обеспечивающих устойчивость к ВИЧ.
Это заставляет продолжать поиск генов устойчивости к ВИЧ. Недавно американские исследователи О'Брайн и М. Дин с коллегами обнаружили ген, который, присутствуя у людей лишь в одной копии, задерживает развитие СПИДа на 2-3 года и более. Значит ли это, что появилось новое оружие в борьбе с вирусом, вызывающим СПИД? Скорее всего, ученые приоткрыли еще одну завесу над загадками ВИЧ, и это поможет медикам в поисках средств лечения "чумы ХХ века". В многочисленных популяциях американцев афро-азиатского происхождения мутантные гены так и не найдены, но тем не менее есть небольшие группы здоровых людей, контактировавших с зараженными. Это говорит о существовании других генов защиты иммунной системы от страшной инфекции. Пока можно лишь предполагать, что в различных популяциях человека сложились свои системы генетической защиты. По-видимому, и для других инфекционных заболеваний, включая вирусный гепатит, также имеются гены устойчивости к вирусам-возбудителям. Теперь уже никто из генетиков не сомневается в существовании таких генов для вируса иммунодефицита. Исследования последних лет дали надежду найти решение такой, казалось бы, неразрешимой проблемы, как борьба со СПИДом. Кто станет победителем в противоборстве ВИЧ - человек, покажет будущее.
КАК ЛЕЧИТЬ СПИД. ПОИСК СТРАТЕГИИ
Результаты исследований последних лет заставили задуматься не только ученых и практических врачей, занимающихся проблемами СПИДа, но и фармацевтов. Раньше основное внимание уделялось комбинированному лечению инфекции, направленному против вируса. Применялись препараты, препятствующие размножению вируса в клетке: невипарин и атевирдин. Это так называемая группа ингибиторов обратной транскриптазы ВИЧ, которые не дают наследственному материалу вируса внедряться в ДНК иммунных клеток. Их сочетают с аналогами нуклеозидов типа зидовудина, диданозина и ставудина, которые облегчают течение болезни. Однако эти средства токсичны и обладают побочными действиями на организм, поэтому их нельзя считать оптимальными. Им на смену все чаще приходят более совершенные средства воздействия на ВИЧ.
В последнее время появилась возможность препятствовать "посадке" вирусных частиц на поверхность клеток. Известно, что этот процесс происходит за счет связывания вирусного белка gр120 с клеточными рецепторами. Искусственное блокирование мест связывания ВИЧ с помощью хемокинов должно защищать клетки от вторжения ВИЧ. Для этого нужно разработать специальные препараты-блокаторы.
Другой путь - получение антител, которые будут связываться с рецепторами ССR5, создающими "посадочную площадку". Такие антитела будут препятствовать взаимодействию этих рецепторов с вирусом, не давая доступа ВИЧ в клетки. Кроме того, можно вводить в организм фрагменты молекул ССR5. В ответ на это иммунная система начнет вырабатывать антитела к данному белку, которые также перекроют доступ к нему вирусных частиц.
Наиболее дорогостоящий способ обезопасить вирусные частицы - ввести в иммунные клетки новые мутантные гены. В результате сборка рецептора для "посадки" вируса на поверхности "оперированных" клеток прекратится, и вирусные частицы не смогут заразить такие клетки. Подобная защищающая терапия, по-видимому, наиболее перспективна при лечении больных СПИДом, хотя и весьма дорого стоит.
При лечении сопровождающих СПИД раковых заболеваний врачи чаще всего прибегают к высоким дозам химических препаратов и к облучению опухолей, что нарушает кроветворение и требует пересадки больным здорового костного мозга. А что, если в качестве донорских кроветворных клеток пересадить больному костный мозг, взятый от людей, генетически устойчивых к инфекции ВИЧ? Можно предположить, что после такой пересадки распространение вируса в организме пациента будет остановлено: ведь донорские клетки устойчивы к инфекции, поскольку не имеют рецепторов, позволяющих вирусу проникнуть через клеточную мембрану. Однако эту привлекательную идею вряд ли удастся воплотить в практику полностью. Дело в том, что иммунологические различия между пациентом и донором, как правило, приводят к отторжению пересаженной ткани, а иногда и к более серьезным последствиям, когда донорские клетки атакуют чужеродные для них клетки реципиента, вызывая их массовую гибель.
Т-киллеры - иммунные клетки, которые уничтожают зараженные вирусом клетки.
Рецепторы клеток - особые молекулы на поверхности, которые служат "опознавательным знаком" для вирусных частиц и других клеток.
Ген рецептора - ген, ответственный за выработку соответствующего белка.
Хемокины - гормоноподобные вещества на поверхности иммунных клеток, которые подавляют размножение вируса в организме.
Культура клеток - клетки, развивающиеся вне организма, в питательной среде пробирки.
Мутантные гены - измененные гены, не способные контролировать выработку нужного белка.
Клетки-мишени - иммунные клетки, которые в первую очередь поражает вирус.
- Сегодня в мире 29 миллионов зараженных вирусом иммунодефицита. 1,5 миллиона человек уже умерли от вызванного этим заражением СПИДа.
- Самый неблагополучный по СПИДу регион - Африка. В Европе лидируют Испания, Италия, Франция, Германия. С 1997 года к этим странам присоединилась Россия. На территории бывшего СССР зараженность ВИЧ распределяется так: 70% - Украина, 18,2% - Россия, 5,4% - Беларусь, 1,9% - Молдова, 1,3% - Казахстан, остальные - менее 0,5%.
- К 1 декабря 1997 года в России официально зарегистрировано около 7000 зараженных вирусом иммунодефицита, в основном при передаче инфекции половым путем.
- В России и странах ближнего зарубежья существует более 80 центров по профилактике и борьбе со СПИДом.
Новые знания, полученные в ходе работы группы ученых из Института Рагона (США), могут послужить основой для создания эффективной вакцины против СПИДа. Специалисты вычислили ген, ответственный за формирование в организме иммунных Т-клеток, которые "распознают" большее число фрагментов белка ВИЧ. Это позволяет уничтожать вирус гораздо эффективнее.
Для человека, зараженного ВИЧ, при отсутствии медикаментозного лечения развитие СПИДа, как правило, — лишь вопрос времени. Тем не менее, у небольшого числа людей, подвергшихся воздействию вируса иммунодефицита, СПИД развивается очень медленно или не развивается вообще. Почему?
Еще в конце 1990-х годов исследования показали, что очень высокий процент людей, имеющих естественный иммунитет против ВИЧ (а их число составляет примерно 1 на 200 зараженных), является носителями гена HLA B57.
В настоящее время группа ученых из Института Рагона в Чарльстоне (США) продолжила исследования в этом направлении. В результате была выявлена способность данного гена активизировать защитные силы организма и противостоять ВИЧ-инфекции.
Тем временем исследовательская группа под руководством профессора Массачусетского технологического института (MIT) Арупа Чакраборти и профессора Гарвардского университета Брюса Уолкера продвинулась в своей работе еще дальше. Внимание ученых было сосредоточено на одном из видов иммунных клеток, а именно — Т-киллерах, отвечающих за уничтожение клеток организма, пораженных заболеванием.
Т-киллеры распознают фрагменты чужеродных белков, расположенные на поверхности клетки, и в случае, если этот фрагмент определен как "вражеский", уничтожают клетку и продуцируют гамма-интерферон, который ограничивает проникновение вируса в соседние клетки. Каждая Т-клетка "настроена" только на один специфический антиген и убивает только клетки с этим антигеном.
Однако новое исследование показало, что организм носителей гена HLA B57 вырабатывает большее число Т-киллеров, которые к тому же являются кросс-реактивными, то есть могут распознавать более чем один "вражеский" белок и благодаря этому уничтожать и мутировавшие вирусы иммунодефицита.
Профессор Чакраборти пояснил: "У людей, лишенных гена HLA B57, кросс-реактивные Т-киллеры также присутствуют, но в гораздо меньших количествах. Результаты исследования позволяют надеяться на создание вакцины, способной увеличить их число".
Чакраборти и его коллеги ранее разработали расчетную модель развития Т-киллеров в вилочковой железе (тимусе), где они проходят отбор, направленный на отсеивание как слишком "слабых" клеток, плохо распознающих угрозу, так и слишком "агрессивных", набрасывающихся на здоровые клетки организма.
Этот эффект позволяет контролировать ВИЧ-инфекцию (а также любой другой активно развивающийся вирус), но, с другой стороны, делает носителей гена более восприимчивыми к аутоиммунным заболеваниям (ревматизм, системная красная волчанка, подагра).
В тимусе (лимфоидном органе человека, в котором происходит созревание, дифференцировка и иммунологическое "обучение" T-клеток) Т-киллеры взаимодействуют с собственными пептидами человеческого организма и, в зависимости от реакции на эти пептиды, либо успешно проходят "проверку на агрессивность", либо погибают.
Тип и количество собственных пептидов, с которыми сталкиваются Т-киллеры, определяется генами HLA. Ученые показали, что HLA B57, наряду с HLA B27 (носители которого также демонстрируют наличие иммунитета против ВИЧ), обеспечивает минимальное количество собственных пептидов, в результате чего Т-киллерам проще выдержать "испытание".
В итоге тимус покидают Т-клетки, обладающие более высокой кросс-реактивностью и способностью к уничтожению большего числа форм ВИЧ, но в то же время более опасные для здоровых клеток организма. Эта модель также объясняет причину повышенного риска возникновения аутоиммунных заболеваний у носителей гена HLA B57.
Новые знания, полученные в ходе исследования, могут помочь ученым в разработке вакцин, которые вызывают такую же реакцию на ВИЧ, какую носители гена HLA B57 вырабатывают самостоятельно.
Читайте также в "Правде.Ру"
Некоторые данные указывают на то, что угнетение экспрессии МНС I класса белками ВИЧ (в частности, Tat, Vpu и Nef) защищает ВИЧ-инфицированные клетки от цитотоксического действия CD8+-клеток. Это свойство, отмеченное в линиях Т-клеток, может отсутствовать у первичных CD4+-клеток.
Однако такое угнетение экспрессии МНС является классическим механизмом, который обеспечивает распознавание и уничтожение клетки NK-клетками. Однако, несмотря на то, что экспрессия обычных молекул HLA классов А и В может уменьшаться в ВИЧ-инфицированных клетках, экспрессия HLA классов С и Е, предотвращающих уничтожение NK-клетками, может продолжаться. Присутствие HLA-C и HLA-E молекул на ВИЧ-инфицированных клетках также может предохранять ау-тологичные CD4+-клетки от антителзависимого уничтожения NK-клетками.
Однако некоторые NK-клетки, у которых отсутствуют тормозные рецепторы HLA-C и HLA-E, могут уничтожать инфицированные CD4+-клетки, экспрессирующие МНС I класса. Кроме того, было показано, что NK-клетки вырабатывают Р-хемокины и другие растворимые факторы, которые могут угнетать ВИЧ-1 инфекцию.
Количество и активность NK-клеток уменьшаются при ВИЧ-инфекции. Уменьшение количества этих клеток коррелирует с уменьшением количества CD44-клеток. Необходимо отметить, что активность NK-клеток, по-видимому, остается в норме у ВИЧ-инфицированных людей с высоким содержанием CD4-T-клеток, но уменьшается при уменьшении количества CD4+-клеток. В одном исследовании было показано, что у длительно выживающих ВИЧ-инфицированных количество NK-клеток и их цитотоксическая активность остаются в пределах нормы. Увеличение количества тормозных рецепторов и потеря рецепторов активации сочетаются с уменьшением активности NK-клеток. В некоторых исследованиях было показано, что у пациентов с выраженной вирусемией происходит уменьшение экспрессии рецепторов естественной цитотоксичности и снижение активности NK-клеток.
Кроме того, было показано, что нарушается способность NK-клеток вызывать лизис незрелых дендритных клеток.
ВИЧ-вирусемия также сопровождается усилением экспрессии тормозных рецепторов NK-клеток и может вызывать снижение активности NK-клеток, если на клетке экспрессируются какие-либо молекулы МНС I класса. У лиц с ВИЧ-вирусемией экспрессия главных активирующих NK рецепторов (за исключением NKG2D), в том числе NKG2A и CD94, на NK-клетках угнетается. NKG2A и CD94 совместно распознают HLA-E.
Кроме того, на инфицированных клетках под действием ВИЧ может происходить индукция неклассической молекулы МНС I класса, HLA-G, которая позволяет предотвратить гибель NK-клеток.
Эта молекула, например, экспрессируется на клетках плаценты и способствует угнетению реакции материнских NK-клеток. HLA-G, по-видимому, обладает устойчивостью к Nef-индуцированному угнетению экспрессии молекул на поверхности клетки преимущественно за счет меньшей длины его внутрицитоплазматического домена.
Влияние ВИЧ на функции NK-клеток:
• Уменьшение количества и функций NK-клеток
• Уменьшение количества естественных рецепторов цитотоксичности
• Нарушение способности вызывать лизис незрелых дендритных клеток
• Усиление экспрессии ингибиторных рецепторов на NK-клетках и утрата активирующих рецепторов
• Индукция МНС I класса HLA-G
• Снижение экспрессии NKG2A и CD94, которые распознают HLA-E
• Уменьшение АЗКЦ
• Выделение высоких концентраций IFN-y и TNF
• Уменьшение выработки перфорина
• Уменьшение способности отвечать на действие IFN
• Изменение соотношения субпопуляций NK-клеток
Цитокины усиливают цитотоксические реакции NK-клеток за счет активации клеток и усиления экспрессии активационных рецепторов NKp44. Недавно было показано, что NK-клетки уничтожают CD4+-клетки ВИЧ-инфицированных лиц путем распознавания NКр44-лигандов на поверхности клетки. Экспрессия NKp44 на CD4+-Т-клетках индуцируется пептидами gp41. Тем не менее неизвестно, насколько эти данные соответствуют ситуации in vivo. ВИЧ-инфицированные клетки не экспрессируют NKp44.
Некоторые исследователи сообщают, что, в отличие от вышеприведенных данных, несмотря на уменьшение количества NK-клеток у лиц с ВИЧ-вирусемией, они секретируют больше IFN-y и TNF-a, чем NK-клетки пациентов без вирусемии, или ВИЧ-отрицательных лиц. Необходимо отметить, что NK-клетки пациентов с вирусемией демонстрируют более высокий уровень экспрессии CD107а, маркера экзоцитоза лизосомальных гранул. Этот маркер может отражать цитотоксическую активность NK-клеток.
Другие исследователи показали, что, несмотря на увеличение количества NK-клеток после проведения противоретровирусной терапии, у них наблюдается сниженная выработка IFN-y и они не способны реагировать на IFN-a (4524). Существуют данные об улучшении функций NK-клеток на фоне HAART. Необходимы дальнейшие исследования этой проблемы для объяснения таких противоречивых сведений. NK-клетки также уничтожают ВИЧ-инфицированные клетки с помощью механизма АЗКЦ. В этом случае ВИЧ-инфицированные клетки уничтожаются NK-клетками после распознавания антител, связанных с белками вирусной оболочки на поверхности инфицированной клетки.
Большинство исследований АЗКЦ, в которых проводили измерение количества антител к белкам оболочки ВИЧ, не продемонстрировали корреляции этого показателя с клиническим состоянием; концентрация aнти-gp120 антител существенно не различалась у большинства ВИЧ-инфицированных пациентов с симптомами заболевания или без них.
Однако если рассматривать количество активных эффекторных клеток (например, нейтрофилов или NK-клеток) у инфицированных людей, можно показать уменьшение АЗКЦ по мере прогрессирования заболевания. Наконец, как отмечалось ранее, NK-клетки, несущие рецепторы к комплементу, могут уничтожать инфицированные, а также неинфицированные клетки через взаимодействие с комплементом на их поверхности. Важно отметить, что некоторые исследования указывают на то, что NK-клетки могут погибать в процессе осуществления АЗКЦ как напрямую, так и вследствие активации апоптоза.
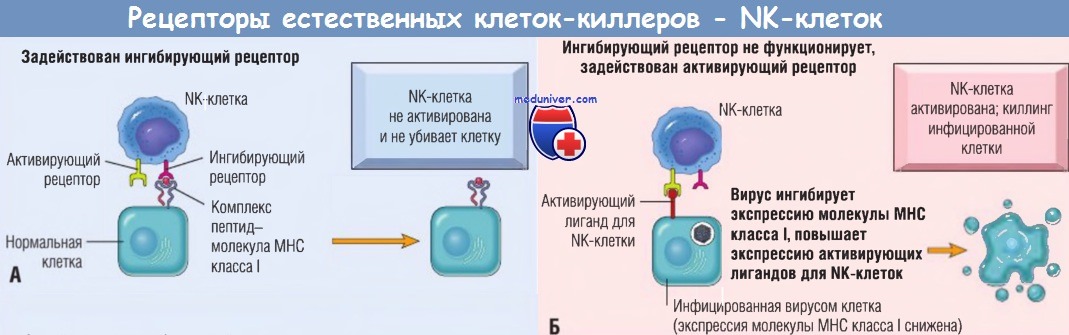
Активирующие и ингибирующие рецепторы естественных кле-ток-киллеров (NК-клеток).
(А) Нормальные клетки экспрессируют молекулы класса I собственного главного комплекса гистосовместимости (МНС), распознаваемые ингибирующими рецепторами, благодаря чему NK-клетки не атакуют собственные клетки.
Обратите внимание, что здоровые клетки могут экспрессировать лиганды для активирующих рецепторов или не экспрессировать их (как показано), однако они не активируют NK-клетки,
т.к. взаимодействуют с ингибирующими рецепторами.
(Б) У инфицированных и подвергнутых стрессу клеток экспрессия молекул МНС класса I снижена, поэтому ингибирующие рецепторы не активируются и экспрессируются лиганды для активирующих рецепторов.
В результате NK-клетки активируются и убивают инфицированные клетки. 
11 октября 2016
- 2468
- 2,1
- 2
- 11
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.
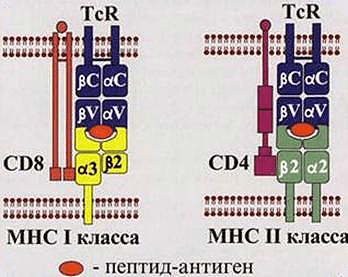
Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.
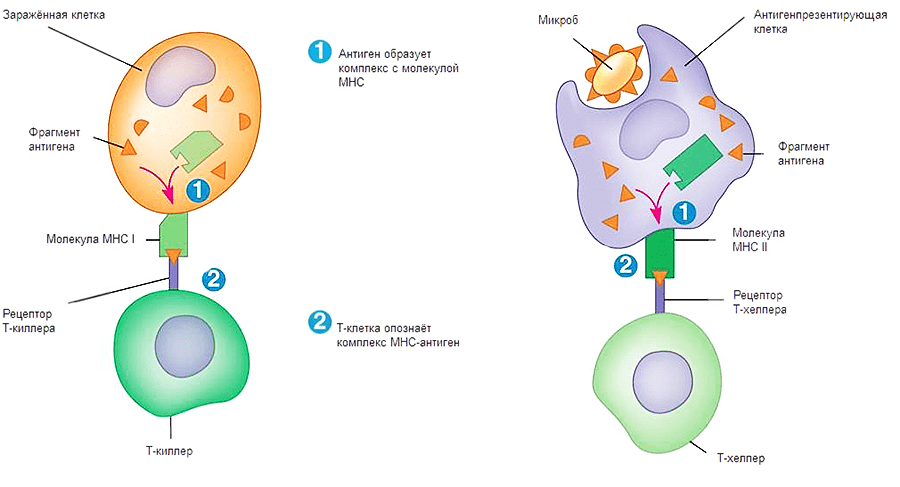
Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).
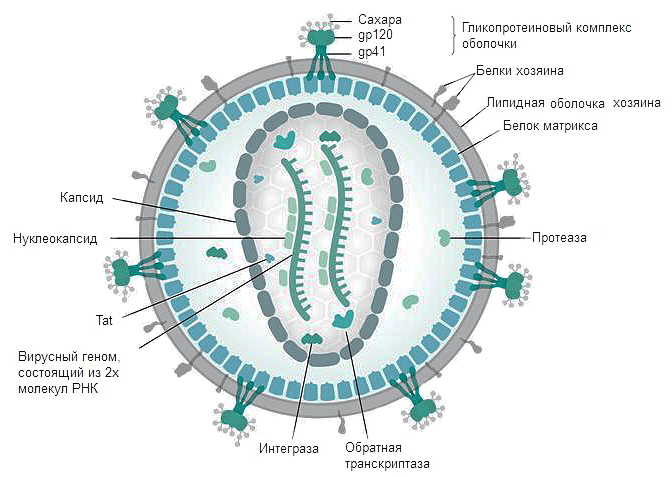
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.
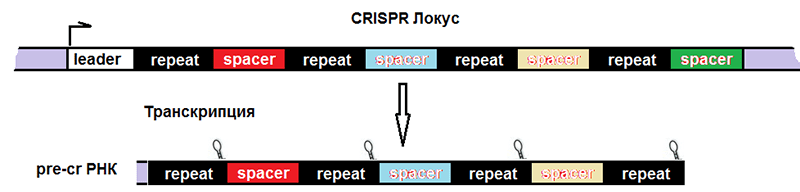
Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).
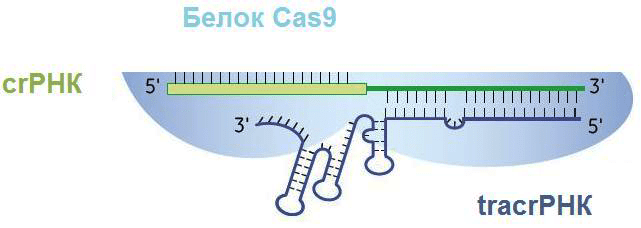
Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.
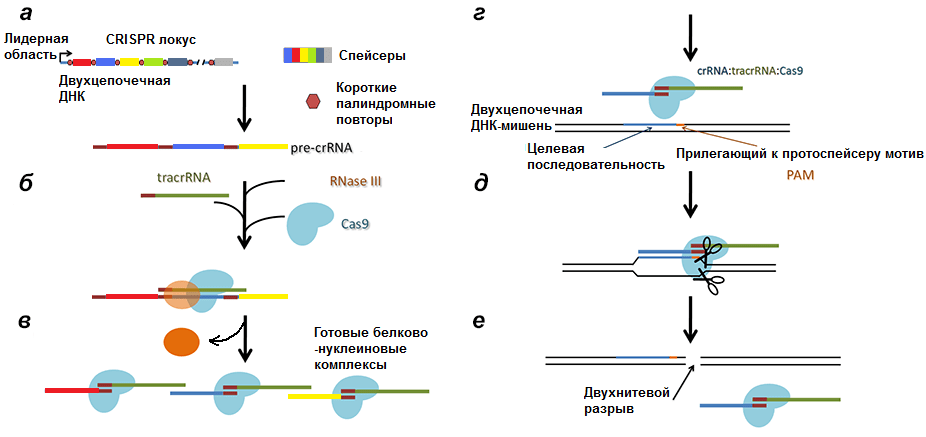
Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.
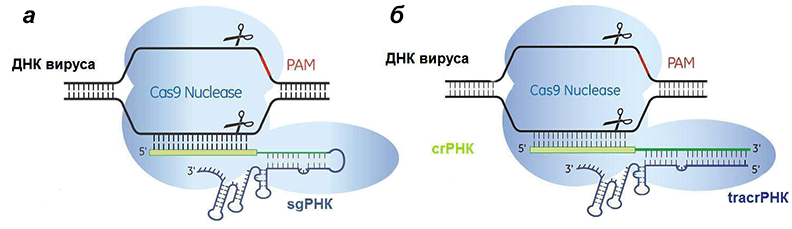
Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.
Читайте также:


