Разработана вакцина против вич
Вакцина против ВИЧ, разработанная группой ученых из Scripps Research и некоммерческой организации по изучению вакцин IAVI, продемонстрировала, что способна повлиять на выработку организмом ВИЧ-специфических антител широкого спектра действия (bNAbs).
Обнадеживающие результаты, которые были опубликованы в журнале Immunity, позволяют предположить, что исследователи стали на один шаг ближе к разработке эффективной вакцины против ВИЧ – одной из ключевых целей науки с момента идентификации вируса в 1983 году.
Как отмечают специалисты, современные противовирусные препараты способны сделать жизнь ВИЧ-позитивных людей ничем не отличающейся от жизни без вируса, а также исключить риски дальнейшего распространения инфекции. Однако даже новейшие препараты не способны устранить инфекцию и должны приниматься постоянно.
Учитывая это, исследователи уже давно признали, что человечеству необходима профилактическая вакцина, которая будет доступна по цене и позволит искоренить ВИЧ как угрозу для мирового здравоохранения.
Чрезвычайно высокая скорость мутаций ВИЧ и ряд иных механизмов уклонения от иммунной атаки сделали вирус очень трудной целью для разработчиков вакцин. Однако тест, проведенный Уайеттом и его командой, подтвердил, что вакцинация может повлиять на выработку антител, которые необходимы для обеспечения широкой защиты от ВИЧ.
Как известно, организм людей, инфицированных ВИЧ, способен самостоятельно вырабатывать bNAbs как часть иммунного ответа на вирус, однако чаще всего жто происходит уже после того, как инфекция распространится.
Ввиду этого, главная задача разработчиков вакцин против ВИЧ заключалась в том, чтобы найти способы стимулировать иммунную систему – у большинства или у всех людей – к выработке bNAbs, способных поразить множество уязвимых участков вируса.
В основу разработки вакцины Уайетт и его коллеги положили имитирующий вирус белок на основе Env ВИЧ. Обычно множество копий белков Env расположены на поверхности капсида ВИЧ. Каждый Env содержит молекулярный механизм, который позволяет ему связываться с рецептором на иммунных клетках, известных как CD4, и использовать этот рецептор в качестве портала для проникновения в клетку.
Последующие бустерные иммунизации в течение 48 недель использовали белки Env с восстановленными гликанами для отбора антител, которые нацелены на место связывания CD4, но также могли проходить через этот щит. Белки Env при этом также представляли собой составы, основанные на различных штаммах ВИЧ, чтобы стимулировать выработку антител против структур Env, которые не отличаются от штамма к штамму.
Команда привила 12 кроликов в соответствии со своей стратегией вакцинации и сравнила результаты с контрольной группой, которая получила только одну версию Env с защитой от гликанов. Они обнаружили, что их стратегия вакцинации имела намного лучший эффект: пять кроликов вырабатывали антитела, которые могли нейтрализовать несколько изолятов ВИЧ.
Исследователи проанализировали антитела кролика, которые ответили наиболее эффективно, и идентифицировали два различных типа bNAb. Один из них, названный E70, блокирует область связывания CD4, как и ожидалось, хотя и необычным способом - частично путем захвата одного из экранирующих гликанов. Другой, 1C2, попадает в иное, но также хорошо известное уязвимое место на Env, на границе раздела между двумя ключевыми сегментами сложного белка. Связывание антитела 1C2, по-видимому, дестабилизирует Env, так что оно больше не может опосредовать проникновение ВИЧ в клетки хозяина. Оказалось, что это антитело также обладает необычной широтой нейтрализации, блокируя 87% из 208 отдельных изолятов ВИЧ.
Полученные выводы являются важной демонстрацией того, что правильная вакцинация против ВИЧ может привести к достижению цели по выработке bNAbs нв нескольких областях вируса, говорит Уайетт.
В настоящее время ученые продолжают тестировать и совершенствовать свою стратегию вакцинации на небольших моделях животных и надеются в конечном итоге испытать ее на обезьянах, а затем – на людях.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Галиулина К.Ю.
В статье представлены существующие разработки и перспективные направления специфической профилактики ВИЧ-инфекции. Рассмотрены наиболее значимые факторы, осложняющие задачу создания эффективной вакцины против вируса иммунодефицита человека ( ВИЧ ).
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Галиулина К.Ю.
VACCINE AGAINST HIV: DEVELOPMENT AND CAUSES OF FAILURE
The article presents existing developments and perspective directions of specific prevention of HIV infection. The most significant factors that complicate the task of creating an effective vaccine against the human immunodeficiency virus (HIV) are considered.
УДК 612.017.1:616.002 ББК 28.707
ВАКЦИНА ПРОТИВ ВИЧ: РАЗРАБОТКИ И ПРИЧИНЫ НЕУДАЧ
ГАЛИУЛИНА К.Ю. ФГБОУВО ЮУГМУМинздрава России, г. Челябинск, Россия e-mail: karigal777@gmail.com
В статье представлены существующие разработки и перспективные направления специфической профилактики ВИЧ-инфекции. Рассмотрены наиболее значимые факторы, осложняющие задачу создания эффективной вакцины против вируса иммунодефицита человека (ВИЧ).
Ключевые слова: ВИЧ, СПИД, изменчивость, профилактика, вакцина.
Актуальность. Проблема ВИЧ / СПИДа на данный момент касается не только области локального медицинского, но и глобального социально-экономического, общественного интереса. За 35 лет, прошедших со времени начала эпидемии ВИЧ-инфекции, она стала причиной смерти 35-40 миллионов человек, что дало повод соизмерять масштабы демографического поражения с мировыми войнами. Несмотря на современные достижения диагностики ВИЧ-инфекции и ее терапии, эпидемиологическая ситуация остаётся крайне напряжённой, тенденция к нарастанию потерь сохраняется.
В 2015 г. в мире заразились ВИЧ 2,1 миллиона человек, СПИД унёс жизни 1,1 миллиона человек. На начало 2017 г. суммарное число зафиксированнных случаев ВИЧ-инфекции в структуре заболеваемости граждан Российской Федерации достигло 1 114 815 человек (в мире - 36,7 миллионов ВИЧ-инфицированных, в том числе 2,1 миллиона детей). Согласно расчётам объединённой программы организации объединённых наций по ВИЧ / СПИД (ЮНЕЙДС) (Joint United Nations Programme on HIV/AIDS (UNAIDS)), в России уже более 1 500 700 инфицированных ВИЧ, более того, по версии швейцарских и американских специалистов, неофициальное число инфицированных приближается к 2 000 000.
Стремительное распространение ВИЧ / СПИДа гарантированно снижает
продолжительность жизни населения земного шара, сокращает его численность в связи с гибелью мужчин и женщин детородного возраста, повышением уровня детской смертности. Отрицательное влияние ВИЧ на
экономическую компоненту объясняется снижением числа трудоспособного населения, увеличением доли лиц, не способных к труду и требующих социального обеспечения.
Всего за 30 лет ВИЧ удалось распространиться повсеместно, несмотря на ограниченный спектр возможного пути передачи (половой, инъекционный,
трансплацентарный, гемотрансфузионный, перинатальный), в связи в этим перед учёными всего мира стоит задача изобретения эффективной вакцины против ВИЧ. Несмотря на множественные попытки разработать эффективную вакцину против ВИЧ-инфекции, однозначный успешный результат достигнут не был [6]. В связи с этим, всё более актуальной становится проблема более тщательного изучения трудностей, связанных с разработкой результативной вакцины против ВИЧ [3].
Цель работы. Рассмотреть существующие разработки и перспективные направления специфической профилактики ВИЧ-инфекции, а также причины неудач в создании вакцин против ВИЧ-инфекции.
Материалы и методы. Анализ источников литературы, посвящённых специфической профилактике ВИЧ-инфекции, изменчивости и другим особенностям ВИЧ.
Результаты исследования. Вакцина - это препарат, содержащий антигены возбудителя инфекционного заболевания, введение которого сопровождается возникновением иммунитета (невосприимчивостью) к данному возбудителю.
Несмотря на значительные победы учёных в снижении заболеваемости населения
инфекционными заболеваниями путём своевременной вакцинации (так, в 1980 году была официально провозглашена ликвидация
натуральной оспы, достигнутая массовой вакцинацией), проблема ВИЧ-пандемии так и не решена.
За последние годы появлялось значительное количество информации о различных инновационных вакцинах против ВИЧ-инфекции, порядка 35 вакцин в настоящее время проходят доклинические и клинические испытания [11].
Со времени начала первых клинических испытаний предполагаемой действенной вакцины на людях, начатых свыше десяти лет назад, в тестировании приняли участие более 20 тысяч волонтёров. Тем не менее, огромные средства, вложенные в работы по разработке ВИЧ-вакцин и грандиозные усилия учёных, не оправдали себя, так как ни одна вакцина не доказала своей ожидаемой эффективности.
Одной из вакцин, на которую возлагались большие надежды, была ДНК-вакцина.
Для обеспечения необходимого иммунного ответа, направленного против вирусной инфекции, не нужен цельный вирус, достаточно наличия одного или нескольких белков, локализующихся на его поверхности. Данный компонент и обеспечивают ДНК-вакцины.
ДНК-вакцины (генные вакцины, вакцины на основе нуклеиновых кислот) представляют собой определённые генно-инженерные конструкции (ДНК-фрагмент), содержащие специфический ген, который при попадании в клетку инициирует продукцию нужного белка-антигена. Таким образом, производится введение не самого белка-антигена, а механизма, обеспечивающего его синтез, т.е. ДНК. Итог аналогичный: образование иммуноглобулинов, направленных на
уничтожение чужеродных организму белков.
Перспектива использования участков ДНК в целях вакцинации появилась ещё в 50-60-е годы, когда после проведения исследований подтвердился факт сохранения способности к транскрибированию генетической информации ДНК после переноса её в другую клетку. Следует отметить, что подобная вакцина, названная избирательной "генетической иммунизацией", способна обеспечивать активный гуморальный иммунитет, но и клеточный иммунный ответ.
ДНК-вакцина представляет собой
имплантированную в клетку, с помощью вектора (переносчика) последовательность нуклеотидов, кодирующую антиген/комплекс антигенов. Необходимо подобрать оптимальный вектор -вирус или бактерию. Были протестированы более 20 разных бактерий, РНК- и ДНК-содержащих вирусов. Наиболее подходящими векторами
оказались изменённый штамм
модифицированного вируса коровьей оспы ankara, а также вирусы fowlpox и сапагурох, которые обладают возможностью инфицирования клеток человека, но потеряли возможность к размножению в них.
Иной вариант ДНК-вакцинации, безвекторный, заключается в помещении ДНК в частички металла с дальнейшей их имплантацией в дендритные клетки.
Неоспоримое преимущество использования ДНК-вакцин состоит в том, что в сравнении с обычной вакцинацией, когда антиген вводится в организм в достаточно большом количестве и существует в нем относительно короткий промежуток времени, использование ДНК в качестве активного агента позволяет осуществлять регуляцию сразу нескольких параметров: дозы антигена, продолжительности и интенсивности его действия (дозированные количества белка-антигена продуцируются в организме внутриклеточно длительно).
Также применение ДНК-вакцин позволяет избежать множества нежелательных побочных эффектов старого поколения вакцин, произведённых на основе живого ослабленного возбудителя: риск развития инфекции, хроническая иммуностимуляция и др.
Принцип ДНК-вакцинации был положен в основу американской компанией VaxGen при разработке вакцины против ВИЧ AIDSVAX. Вакцина AIDSVAX создавалась на основе белка ВИЧ - gp 120, который вирус использует в сочетании с белком gp 41 для проникновения в клетку. Гипотеза действенности вышеупомянутой вакцины заключалась в выработке специфических антител к одному из белков ВИЧ - gp 120 или gp 41 или к обоим белкам, таким образом, полностью перекрывался бы доступ ВИЧ к искомой клетке. Тем не менее, несмотря на то, что вакцина AIDSVAX стала первым препаратом из серии ВИЧ-профилактики, прошедшим все этапы клинических тестов в 2002 г., AIDSVAX оказалась неэффективной.
Следующий тип вакцин очень близок к концепции ДНК-вакцин.
Так, первая вакцина IAVI, разработанная сотрудниками университетов Оксфорд (Англия) и Найроби (Кения) в сотрудничестве с Международной инициативой по разработке вакцины против СПИДа (International AIDS Vaccine Initiative (IAVI)), проект по созданию которой получил название инициатива Кенийской вакцины от СПИДа (Kenya AIDS Vaccine
Initiative), содержит РНК ВИЧ подтипа А.
Второй проект IAVI по производству вакцины в партнерстве с AlphaVax из Северной Каролины и университетом Кейптауна (ЮАР), ориентирован на разработку вакцины от ВИЧ подтипа C.
В третьем проекте IAVI-исследований планируется адаптировать инновации Балтиморского института вирусологии. Предполагаемая концепция вакцины против ВИЧ включает в себя пероральное использование. Подобное применение объясняется имплантацией активных компонентов вакцины внутрь непатогенных штаммов сальмонеллы.
Другой возможный путь инициации иммунного ответа на проникновение вируса иммунодефицита - это активация значительного пула клеток, обладающих способностями инактивировать клетки, инфицированные ВИЧ, иными словами, производится интенсификация клеточного иммунного ответа.
Вакцины, основанные на базисе стимулирования клеточного ответа, находятся в стадии клинических испытаний. Вакцина ALVAC, представленная французской фармацевтической компанией Sanofi Pasteur, включает в свой состав птичий вирус (canarypox), в котором были найдены ВИЧ-элементы. Необходимо отметить, что хотя и вакцины ALVAC первого поколения основывались на профилактике ВИЧ подтипа B, результаты исследований на американских добровольцах показали, что действие вакцины распространяется и на другие подтипы ВИЧ. Однако, после последних клинических испытаний в Уганде (Восточная Африка), новостей о препарате не появлялось.
Чем же объяснить неудачи в разработке средства вакцинации от ВИЧ?
Одна из главных проблем, возникающих при создании вакцины, связана со стремительной генетической изменчивостью вируса
иммунодефицита [8]. Данная изменчивость обуславливает как "феномен ускользания" вируса от защитных факторов иммунной системы, так и непродуктивность антиретровирусной терапии по отношению к специфическим вирусным вариантам, проходящим позитивный отбор в организме человека. Вариабельность генома ВИЧ иллюстрируется тем фактом, что на терминальной стадии СПИДа число вариантов исходной вирусной частицы (псевдовидов) сравнимо с генетическим полиморфизмом вируса гриппа (Influenza virus),
циркулировавшего в популяции в течение года
Одними из основных причин ВИЧ-изменчивости являются мутации в ходе обратной транскрипции, ключевую роль в которой играет фермент ревертаза (обратная транскриптаза), не имеющая З'-экзонуклеазной корректирующей активности. Точность работы ревертазы ВИЧ-1 в разы ниже, чем у обратных транскриптаз других известных ретровирусов, в результате чего скорость генерации ошибок оказывается высокой. Результат проявляется существованием в организме больного "популяции" разнообразных ВИЧ ("квазивидов" ВИЧ). Тенденцию обратной транскриптазы ВИЧ-1 к многочисленным ошибкам РНК-копирования позволяют подтвердить исследования in vitro (так, частота мутаций порядка 5-7х104 была выявлена при исследованиях с использованием гена протеина IacZa в качестве матрицы) [7].
Следует отметить, что обратная транскриптаза ВИЧ обладает значительным полиморфизмом, как природным, так и связанным с фармакологической
резистентностью, следовательно, присутствие определённых мутаций (например, M184V) обеспечивает повышение точности репликации, снижая частоту возникновения форм ВИЧ, крайне устойчивых к антиретровирусной терапии, наличие же мутаций, положительно влияющих на потенциал изменчивости генома ВИЧ, осложняет поиск эффективных антиретровирусных средств [9, 10].
Ферментом, играющим роль в формировании защиты организма против ВИЧ, является дезаминаза семейства APOBEC ("apolipoprotein B mRNA editing enzyme catalytic polypeptide"), выполняющая функцию дезаминирования цитозина в составе минус-цепи ДНК вируса на стадии обратной транскрипции. Несмотря на то, что гипермутагенез вируса, вызванный редактирующими ферментами, в большинстве случаев носит летальный характер, в определённых масштабах не приводит к уничтожению ВИЧ, а, напротив, способствует его эволюции. Примером тому служит выработанный ВИЧ-1 механизм ингибирования APOBEC3G (apolipoprotein B mRNA-editing enzyme, catalytic polypeptide-like 3G), обеспечивающий ВИЧ-1 устойчивость по отношению к антиретровирусной терапии и повышенную скорость приспособления к иммунной системе человека по сравнению с
ВИЧ-2. Взаимодействие белка Vif (фактор инфекционности вируса) ВИЧ-1 с APOBEC3G потенциирует разрушение дезаминаз протеасомами. В результате возникает некоторое снижение (но не тотальная отмена) интенсивности гипермутагенетических реакций. Достигнутый уровень гипермутагенеза обеспечивает возникновение новых ВИЧ-вариантов [7].
В отличие от мутаций, провоцирующих медленные, но стойкие изменения генома ретровирусов, рекомбинации имеют более радикальный характер, являясь одним из ключевых звеньев механизма изменчивости ВИЧ. Процесс рекомбинации позволяет обеспечить целостность генома, нивелировать последствия повреждений, несовместимых с продолжением жизненного цикла. Реставрация генома вируса иммунодефицита нацелена на восстановление информации РНК, накопившей большое количество мутаций, вызывающих снижение устойчивости ВИЧ.
Так, при отсутствии рекомбинантных процессов ВИЧ имеет склонность к постепенному накоплению значительного количества подобных мутаций. Рекомбинация "перемешивает" уже существующие мутации, что позволяет вирусу стремительно, а не многостадийно приобретать мутации, полезные для выживания, а также обеспечивает разрыв сцепленных мутаций (к примеру, если некий псевдовид вируса иммунодефицита обладает мутацией, ведущей к повышению фармакологической резистентности, но вместе с тем снижает его защиту от цитотоксических Т-лимфоцитов, рекомбинативные механизмы помогают сохранить полезную мутацию до того времени, пока вирус не обретёт мутацию, позволяющую избежать уязвимости для T-лимфоцитов. Устранение конкуренции между мутациями, однозначно гарантирующими выживаемость ВИЧ, в разы повышает адаптационный потенциал вируса [5, 7].
Проблему разработки вакцины против ВИЧ-инфекции осложняет и отсутствие адекватной экспериментальной модели данной инфекции на животных [4]. Так, известно, что применение потенциальной вакцины на обезьянах хоть и
обеспечивает защиту животных от инфекции, но не гарантирует воспроизведение аналогичного эффекта на людях. Ярким примером является провал проекта фармацевтической фирмы "Merck". В 2007 г., несмотря на хорошие результаты вакцинации в отношении приматов, испытания среди людей-добровольцев были прерваны в связи с тем, что процент заражённых в опытной группе заметно превысил процент заражённых в контрольной. Данный факт иллюстрирует и проблему высокой степени риска, возникающей при проведении клинических испытаний с использованием добровольцев.
Возможность оценить истинную
иммуногенность и эффективность вакцины осложняется вопросами этического и социально-экономического характера. Так, трудности, связанные со взятием добровольного информированного согласия, предоставления гарантии конфиденциальности участия в клинических испытаниях, официальным определением ВИЧ-статуса (возможность ложно отнести иммунизированного волонтёра к группе ВИЧ-инфицированным в связи с наличием антител), дороговизной исследований, статистическими особенностями, страхованием волонтёров, правовой защитой и пр. позволяют определить задачу формирования групп добровольцев как одну из самых сложных и трудоёмких [2].
Нельзя не отметить и финансовую сторону вопроса. Вложений требуют не только научные и технологические разработки, но и юридическая поддержка и страхование участников исследований. Затраты на исследования оказываются весьма
значительными, в то же время неудача может случиться на любом из этапов, поскольку заведомо гарантировать безопасность и эффективность кандидатной вакцины представляется невозможным.
Выводы. Разработка вакцины против ВИЧ-инфекции представляет неоднозначную, многоплановую проблему, осложнённую как специфическими особенностями самого вируса, так и социальными, экономическими и моральными препятствиями.
1. Антигенная и генетическая изменчивость ВИЧ-1 в Российской Федерации на современном этапе. / Ф.Ф. Москалейчик [и др.] // Физиология и патология иммунной системы. - 2015. - №7. - С. 3-12.
2. Клинические испытания анти-ВИЧ/СПИД-вакцин: современное состояние проблемы / Г.О. Гудима [и др.] // Цитокины и воспаление. - 2005. - №3. - С. 65-69.
3. Комплексный анализ профилактических мероприятий по предотвращению распространения ВИЧ-инфекции в
Челябинской области за 2011-2016 гг. / М.В. Радзиховская [и др.] // Вестн. Совета молодых ученых и специалистов Челябинской области. - 2017. - №3 (18), т. 1. - С. 61-65.
4. Нетёсов С.В. Проблемы создания вакцин против гепатита С и ВИЧ-инфекции / С.В. Нетёсов //Вестн. Рос. академии наук. - 2008. - №10. - С. 880-892.
5. Перспективы иммунотерапии ВИЧ-инфекции и СПИДА, анти-ВИЧ/СПИД-вакцины и микробоциды /И.Г. Сидорович [и др.] //Цитокины и воспаление. - 2005. - №3. - С. 82-88.
6. Современные стратегии биомедицинской профилактики ВИЧ-инфекции/СПИДА. Часть I. анти-ВИЧ/СПИД-вакцины и антиретровирусная терапия /Г.О. Гудима [и др.] //Иммунология СПИДА. - 2013. - №1. - С. 4-9.
7. Сосин Д.В. Молекулярные механизмы генетической изменчивости ВИЧ-1 /Д.В. Сосин, Н.А. Чуриков //Молекулярная биология. - 2017. - №4. - С. 547-560.
8. Харченко Е.П. ВИЧ: коллизии вакцинологии /Е.П. Харченко //Иммунология. - 2012. - №4. - C. 206-212.
9. Brander C. The challenges of host and viral diversity in HIV vaccine design / C. Brander [et al.] // Current opinion in immunology. - 2006. - №18. - P. 430-437.
10. Carr J.K. Viral diversity as a challenge to HIV-1 vaccine development / J.K. Carr // Current opinion in HIV and AIDS. -2006. - №1. - P. 294-300.
11. Nabel G. HIV-1 diversity and vaccine development / G. Nabel [et al.] // Science. - 2002. - №296. - P. 2335.
VACCINE AGAINST HIV: DEVELOPMENT AND CAUSES OF FAILURE*
GALIULINA K.Y. FSBEI HE SUSMU MOH Russia, Chelyabinsk, Russia e-mail: karigal777@gmail.com
The article presents existing developments and perspective directions of specific prevention of HIV infection. The most significant factors that complicate the task of creating an effective vaccine against the human immunodeficiency virus (HIV) are considered.
Keywords: HIV, AIDS, variability, prevention, vaccine.
* Научный руководитель: к.м.н., ст. преп. Пешикова М.В.
Вакцина против ВИЧ, разработанная группой международных исследователей, за последние годы продвинулась дальше, чем любая другая, и это вселяет надежду на борьбу с вирусом, который может привести к СПИДу.
Дэн Баруш, иммунолог из медицинского центра Beth Israel Deaconess и Гарвардской медицинской школы, возглавляет команду, которая создала вакцину, называемую Ad26.

В июле в британском медицинском журнале The Lancet была опубликована статья о первых испытаниях Ad26 на людях, проведенных в Африке, Таиланде и США. Большинство из 393 взрослых в испытаниях показали усиленный иммунный ответ, а побочные эффекты были минимальными. Исследователи утверждают, что вакцина также защитила 67% макак-резусов, подвергшихся воздействию обезьяньего вируса, похожего на ВИЧ.
В настоящее время Ad26 проходит испытание эффективности с участием 2600 человек в Африке. Исследование определит, может ли вакцина действительно защитить людей от вируса. Начальный этап применения вакцины на людях выглядит многообещающе. Только четыре предыдущие потенциальные вакцины против ВИЧ добрались до такой стадии разработки. Последняя, протестированная в 2013 году в США, была отложена из-за отсутствия результатов. Итоги испытания Ad26 ожидаются через три года. Напомню, что в 2016 году Генассамблея ООН приняла резолюцию, согласно которой к 2030 году эпидемия ВИЧ должна быть остановлена.
![]()
Создание вакцины против ВИЧ
Видео о "мозаичной" вакцине против вируса иммунодефицита человека, разработанной в Лос-Аламосской национальной лаборатории (США) с использованием машинного обучения. В настоящее время безопасность и эффективность этой вакцины проверяется в Африке на 2600 женщинах-добровольцах. Эти клинические испытания получили название Imbokodo, что на зулусском языке означает “скала” - этим словом подчёркивается сила женщин и их важная роль в жизни местных общин.
Ожидается, что результаты испытаний станут известны в 2020-21 годах.
![]()
Медики создали вакцину против ВИЧ
Об этом стало известно из публикации молекулярных биологов из США.
Иммунные клетки с модифицированной ДНК успешно прижились в организме людей, пораженных ВИЧ и стали бороться с инфекцией без побочных эффектов. Об этом стало известно из публикации молекулярных биологов из США. Материал врачей обнародовано на страницах журнала Molecular Therapy.

Как рассказали врачи, спустя 3-4 года после заражения ВИЧ иммунная система человека часто начинает синтезировать так называемые антитела широкого профиля действия (bnAbs), которые могут нейтрализовать сразу несколько разновидностей вируса. Однако это уже мало чем помогает организму, потому что к тому моменту вирус глубоко проникает во все ткани тела и переходит в хроническую стадию, а иммунная система человка необратимо слабеет.
По словам Марголиса, эту проблему можно решить, если "надрессировать" иммунные клетки создавать такие антитела намного раньше, чем произойдет истощение иммунитета, и превентивно ввести их в организм в больших количествах.
Год назад биологи из университета Пенсильвании провели первый такой опыт, модифицировав ДНК этих телец таким образом, что они стали синтезировать антитела, делающие частицы ВИЧ "видимыми" для иммунитета.
Успешное окончание экспериментов на животными открыло путь для клинических тестов на добровольцах, зараженных ВИЧ и постоянно принимающих антиретровирусные препараты. На первом этапе этих экспериментов исследователи проверили, как попадание иммунных клеток с модифицированной ДНК повлияет на их самочувствие и здоровье.
Собрав команду из семи добровольцев, медики выловили "взрослые" Т-клетки из проб крови, отобрали самые активные из них, "натравив" их на обрывки оболочек ВИЧ, после чего они модифицировали их ДНК и размножили их. Получив необходимое число телец, врачи ввели их обратно в кровь пациентов и стали следить за изменениями в их состоянии.
Как продемонстрировали эти эксперименты, клонированные Т-клетки успешно прижились в организме пациентов, не вызвав при этом тяжелых воспалений и других опасных побочных эффектов. Так как все участники эксперимпентов не прекращали приема антиретровирусных препаратов, иммуннотерапия не сильно изменила число вирусных частиц в их организме.
Однако, эксперименты на образцах их крови продемонстрировали что иммунные клетки добровольцев стали гораздо активнее бороться с вирусом, захватывая и уничтожая его частицы и убивая "зараженные" клетки, покрытые напылением из оболочек ВИЧ.
Это, полагает Марголис, дает возможность для проверки эффективности такой терапии в рамках второй фазы клинических испытаний с применением большего числа Т-клеток.
![]()
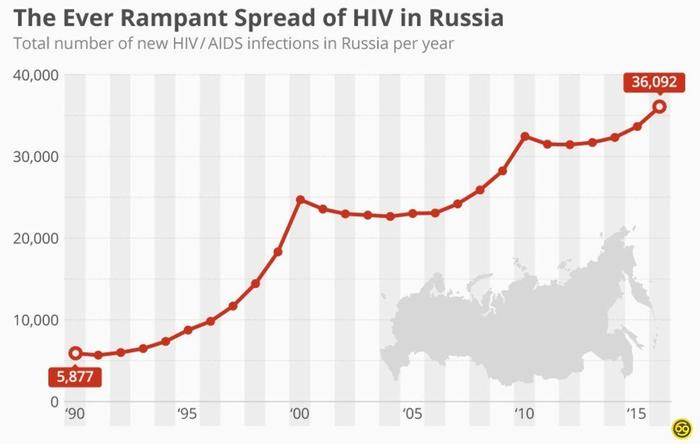
Распространение ВИЧ в России
Наткнулся в инете на график распространения ВИЧ в стране. И если на него глянуть, то обнаруживается, что во времена лихих 90-ых, когда был лозунг:"Секс, наркотики, рок- ин-ролл, количество заболевших было ниже. А сейчас, вроде век цифровых технологий, и уже дети с пеленок знают про безопасный секс, наркоманов колющихся через одну иглу, уже врятли встретишь, пропаганда ЗОЖ, а количество растёт.
Интересно, почему?

![]()
Комбинация антител защитила макак от вируса иммунодефицита на 20 недель
Несмотря на многолетние исследования, вакцины и лечения от ВИЧ пока нет. Однако у людей с ВИЧ обнаружили антитела, блокирующие широкий спектр штаммов этого вируса. Эти антитела тестируют на способность держать инфекцию под контролем и предотвращать заражение. В настоящем исследовании одна инъекция модифицированных антител защитила макак от заражения ВИЧ на срок до пяти месяцев.
![]()
ВИЧ, гепатиты В и С: риски, до- и постконтактная профилактика
Обещанный пост по рискам заражения ВИЧ и вирусными гепатитами и по их профилактики.

Ну, попробую. Да-да-да, мы все видели эти плакаты, рекламу и ТВ-сюжеты, и вынесли из них, что по проституткам не надо ходить без пачки дюрекса, а наркотики - зло. И это правда, но тут всё, оказывается, тоньше.
По ВИЧ, гепатитам В и С, как не удивительно, риски разные. Вся представленная статистика по путям передачи – европейская, так как российская отличается от любой другой на 180, поэтому, мягко говоря, вызывает недоверие. Текст сопровожден ссылками, по большей части, на хорошие и относительно свежие научные исследования.
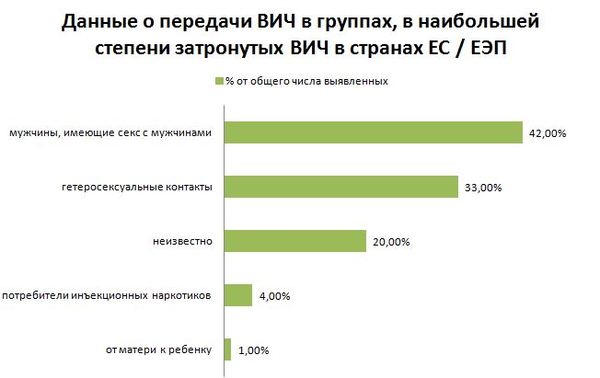
Сразу оговорюсь, в России заражение ВИЧ через потребление инъекционных наркотиков на порядок выше (сказываются неработающие программы снижения вреда и экономическая ситуация в целом), а среди мужчин, практикующих секс с мужчинами, в разы ниже.
Итак, риски по ВИЧ в режиме да/нет и с пояснениями:
1. Инъекционное потребление наркотиков
Инъекционное потребление наркотиков является рисковым поведением в отношении ВИЧ без вариантов. Если вы, или ваши близкие не можете отказаться от наркотиков, используйте одноразовые шприцы однократно, избегайте попадания в вещество чужой крови и нестерильных шприцов, участвуйте в программах снижения вреда (особенно, если вы живете в стране, где разрешена методоновая терапия).
2. Незащищенный секс
3. Медицинские инвазивные процедуры
* Есть единичные случаи заражения ВИЧ в медицинских учреждениях в России. Больше миллиона человек заразилось ВИЧ через иглу и незащищенный секс и единицы в медучреждениях. Поэтому не нужно превращаться в спидофоба – это тот риск по ВИЧ, которого, фактически, нет.
4. Косметические инвазивные процедуры
*Если не используется одна игла на несколько человек, то, однозначно, нет. Вирус вне организма живет считанные часы при самых благоприятных условиях. К тому же для заражения его нужно много – должна быть видна кровь на инструменте, причем свежая, не запекшаяся.
Какие бы фантазии не родило воображение, ответ нет, бытовым путем ВИЧ не передается. А фантазии, к слову, бывают самыми разными (есть, конечно, повеселее, но они с сексуальными подробностями)
6. Вертикальный путь (от матери к ребенку)
Да, но сегодня маловероятен*
* Все беременные в России обязательно проходят тестирование на ВИЧ. Будущим мамам с ВИЧ назначается терапия, профилактическая терапия также назначается новорожденному с первого дня. Всё это снижает риск передачи ВИЧ от матери к ребенку до 1%.
Доконтактная профилактика ВИЧ (ДКП, PrEP)
1) ежедневно по 1 таблетки на протяжении 7 дней, при условии, что рисковый половой акт произойдет на 3-4 день профилактики
2) Ipergay: 2 таблетки за 24 часа до рискового полового акта и два дня по 1 таблетки после. Как видно из названия схемы, разработана она для геев, поэтому для гетеросексуальных пар лучше использовать первую.
Эффективность доконтактной профилактики для гетеросексуальных пар, к сожалению, ниже эффективности использования презерватива, и ниже, чем для МСМ, поэтому защищенный секс в приоритете.
Постконтактная профилактика ВИЧ (ПКП, PEP)
Существуют 2-х и 3-х компонентные схемы для ПКП. Для большинства непрофессиональных рисков подойдут 2-х компонентные:
Есть и другие схемы ПКП, но привожу те 2, которые легче купить и которые не вызовут за месяц тяжелых необратимых побочных эффектов, хотя и не леденцы, конечно. Да, именно купить, бесплатно вам их никто не даст – у нас и больным лекарства бесплатно дают только при серьезном падении иммунитета, а уж здоровым их точно никто дарить не станет. Самое главное: начали пить ПКП, пьем по часам до конца, все 4 недели, никаких пропусков и перерывов – этим только навредите себе.
И, в любом случае, хорошо бы до начала ПКП нужно проконсультироваться в СПИД-центре - вдруг то, что вы сочли риском, риском не было.
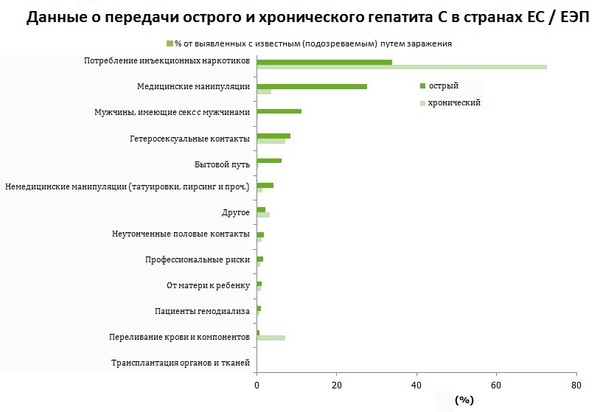
Риски по гепатиту С в режиме да/нет:
1. Инъекционное потребление наркотиков
Инъекционное потребление наркотиков является рисковым поведением и для гепатита С. Повторюсь, если отказ от наркотиков невозможен, нужно, хотя бы, снижать вред.
2. Незащищенный секс
* В достаточной для заражения концентрации вирус гепатита С содержится только в крови и в печени. В вагинальном секрете и сперме его либо нет вообще, либо крайне мало. В 2004 году итальянские исследователи представили результат наблюдения за 776 парами, в которых у одного из супругов был гепатит С (положительно определялась РНК вируса в крови), а второй был здоров. На протяжении наблюдения парам запрещалось использовать презерватив и практиковать анальный секс, а также секс во время менструации. За 10 лет наблюдения заразились лишь 4 человека, и, как выяснилось после проведения генетических тестов вируса, заразились они не от своих супругов – вирусы оказались разные. Последующие исследования с похожим дизайном дают примерно тот же результат. А у итальянцев вывод был однозначный:
Сейчас существует мнение, что, так как половой путь передачи гепатита С плохо дифференцируется с бытовым, поэтому их в статистике разумней объединить.
3. Медицинские инвазивные процедуры
* Шанс получить гепатит С в медицинских учреждениях сегодня гораздо ниже, чем ещё 10 лет назад и совсем несравнима с тем, что было 30 лет назад, когда его ещё толком не диагностировали. Меры по дезинфекции и стерилизации стали жестче, выполняются чаще, многоразовые шприцы заменены на одноразовые, как и многие инвазивные инструменты. Если раньше стоматология была рассадником гепатита, то теперь каждый пациент может проконтролировать, как и откуда доктор берет для него инструменты. Но некоторые медицинские манипуляции остаются риском и сегодня: ФГДС, колоноскопия, операции и др. Можно воспринимать этот факт как плату за все те плюшки, которые мы получаем от доступной медицины, или неизбежное маленько зло, данное нам в обмен на большое. Подчеркну: проблемы только с инструментами, которые нарушают целостность кожи и слизистых, если медицинский сотрудник, например, не поменял перчатки, прежде чем сделать вам укол или осмотреть – это не риск по гепатиту С, так им заразиться не получиться.
Риски для медицинского персонала также остаются значительными.
4. Косметические инвазивные процедуры
* Основной опасностью при косметических процедурах и татуировках всегда были иглы. Сейчас они заменены на одноразовые уже везде. Поэтому риски при каком-нибудь маникюре не выше, чем для бытового пути: не невозможные, но достаточно низкие. А если эти инструменты подержат в дезрастворе и промоют, то рисков по гепатиту С не будет вовсе. Основной проблемой тут по-прежнему остаются работающие на дому частники с одним набором инструментов и водичкой вместо нормального дезинфектора, но они тоже потихоньку уходят в прошлое.
Маловероятен, только в случае контакта с кровью*
6. Вертикальный путь (от матери к ребенку)
Доконтактная профилактика Гепатита С
Постконтактная профилактика Гепатита С
Постконтактной профилактики тоже нет и не будет, по тем же причинам. Есть определенные инструкции для медперсонала и на этом всё. Если был риск по гепатиту С, то ничего не остается, как ждать и сдавать анализ.

Риски по гепатиту В в режиме да/нет:
1. Инъекционное потребление наркотиков
То же самое, бросать, пока не бросим – снижать вред
2. Незащищенный секс
*Гепатит В обнаруживается в крови, сперме, вагинальном секрете, меньше в слюне и других жидкостях организма, поэтому риск при любом виде сексуальной активности значителен. Считается, что гепатит В в плане полового пути передачи заразнее ВИЧ будет.
3. Медицинские инвазивные процедуры
* Шанс получить гепатит В в медицинских учреждениях, хотя и в разы снизился за последние несколько десятков лет, по-прежнему высок. Это связано с тем, что при нормальных условиях, вирус гепатита В может оставаться вне организма до 30 дней. Инактивация вируса возможна только при строгом соблюдении норм СанПиНа.
Медицинскому персоналу проводят вакцинацию.
4. Косметические инвазивные процедуры
* По тем же причинам. Безобидный педикюр нестерильными инструментами – это риск по гепатиту В.
Да, но не то чтобы прям очень*
6. Вертикальный путь (от матери к ребенку)
Да, но сегодня маловероятен*
Доконтактная профилактика гепатита В
Ревакцинация, в принципе, не предусмотрена – прививка может работать и до конца жизни, но лучше сдавать анализ на Anti-HbsAg каждые 10 лет и, в случае падения защиты до 10 антител и ниже, пройти повторный курс прививок.
Если прививки у вас нет, да и сделать её было всё как-то недосуг, то, может быть, вот он, тот момент, когда можно и привиться) И себя защитите, и человечество приблизите к светлому будущему с полной победой над ещё одной болезнью.
Постконтактная (экстренная) профилактика гепатита В
Итак, суть по гепатиту В в картинке:


Это такой несамостоятельный гепатит, небольшой РНК-содержащий инфекционный агент, который является вирусом-сателлитом гепатита В, ходит только с ним под ручку. Для того, чтобы гепатит Д размножился и попал в клетку, ему нужен кусочек вируса гепатита В – его оболочка. Поэтому и опасен он только для тех, у кого есть гепатит В. Способы передачи у него примерно такие же, как и у гепатита В.
Всем больным ХВГВ необходимо регулярно проверяться на наличие этого гада. А для здоровых людей это ещё один повод сделать прививку – видите, она аж от двух гепатитов защищает, ну красота же!
Читайте также:


