Ретровирусная инфекция при вич
Осторожно: ротавирусная инфекция!
У вашего ребёнка тошнота, рвота, понос, насморк, покашливания, интоксикация и поднялась температура выше 37,5? В таком случае можно предположить, что он заразился ротавирусной инфекцией. Что делать? Как защитить от болезни себя и других членов семьи?

Ротавирусное заболевание (ротавирусный гастроэнтерит) — острая вирусная болезнь с преимущественным заболеванием детей; характеризуется симптомами общей интоксикации, поражением желудочно-кишечного тракта, дегидратацией. Заболеть ротавирусной инфекцией могут люди в любом возрасте, однако чаще всего болеют дети от 6 месяцев до года — двух.
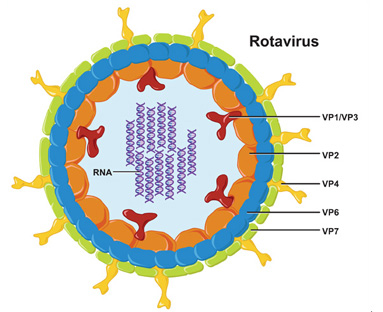
Возбудитель относится к семейству Reoviridae, роду Rotavirus. Название ротавирусы получили от латинского rota — колесо, так как вирусные частицы под электронным микроскопом выглядят как маленькие колесики с толстой втулкой, короткими спицами и тонким ободом. Ротавирусы животных для человека непатогенны. Ротавирусы устойчивы во внешней среде. Источником инфекции служит больной человек или здоровый вирусоноситель. Вирус размножается в клетках слизистой оболочки желудочно-кишечного тракта и выделяется с калом на протяжении до 3 нед (чаще 7-8 дней от начала болезни). Поражение слизистой пищеварительного тракта нарушает переваривание пищи и приводит к развитию сильной диареи и обезвоживанию организма. Основной механизм передачи ротавирусной инфекции – пищевой. Заражение происходит фекально-оральным путем. Иммунитет к ротавирусной инфекции в большинстве случаев возникает в раннем детстве после перенесенного заболевания. Иммунитет нестойкий, поэтому у взрослых с низким уровнем антител заболевание может повториться. Симптомы и течение. Инкубационный период длится от 15 ч до 7 дней (чаще 1-2 дня). Заболевание начинается остро. У большинства госпитализированных детей температура тела достигает 37,9°С и выше, а у некоторых может подниматься до 39°С и выше. При легких формах болезни как у взрослых, так и у детей выраженной лихорадки не бывает. Первые симптомы ротавируса это боли в животе (в эпигастральной области острые, схваткообразные), рвота (до 3-4 раз в сутки), недомогание, повышение температуры (до 38 С). Характерен обильный жидкий водянистый стул без примеси слизи и крови. Более тяжелое течение обычно обусловлено наслоением вторичной инфекции. У половины больных отмечается рвота. У взрослых больных на фоне умеренно выраженной интоксикации и субфебрильной температуры появляются боли в эпигастральной области, рвота и понос. Лишь у отдельных больных рвота повторяется на 2-3-й день болезни. У взрослых нередко выявляется гиперемия и зернистость слизистой оболочки мягкого неба, небных дужек, язычка, а также гиперемия склер. Признаки общей интоксикации отмечаются лишь у 10% общего числа больных, выражены слабо. К описанным симптомам инфекции очень быстро присоединяется острый понос (диарея). Понос обильный желтоватого цвета с резким неприятным, кислым запахом. При осмотре больного можно заметить покраснение конъюнктивы глаз, слизистой оболочки зева и небных дужек (воспаленное горло). Характерно громкое урчание в животе. У некоторых больных отмечается примесь слизи и крови в испражнениях, что всегда свидетельствует о сочетании ротавирусного заболевания с бактериальной инфекцией (шигеллез, эшерихиоз, кампилобактериоз). У этих больных более выражены лихорадка и общая интоксикация. Основная опасность ротавирусной инфекции связана с обезвоживанием организма из-за сильного поноса. Течение ротавирусной инфекции обычно доброкачественное. Ротавироз заканчивается через 4-7 дней полным выздоровлением. Взрослый человек может даже не заметить, что он носитель ротавирусной инфекции, болезнь, как правило, протекает со стертыми симптомами: недлительный, возможно единоразовый случай поноса, снижение аппетита, кратковременное повышение температуры. Но в этот период человек является заразным! Диагностика. Диагностические признаки ротавирусной инфекции: — характерный эпиданамнез (групповой характер заболевания в зимнее время года); — острое начало болезни; — повышение температуры тела; — синдром интоксикации; — ведущий симптом — рвота; — характерна водянистая диарея; — умеренно выраженные боли в животе; — метеоризм. Лабораторная диагностика основана на обнаружении ротавирусов в фекалиях и/или антител в сыворотке крови. Оптимальные сроки обследования — 1-4 день болезни. Лечение. Специфического лечения ротавирусной инфекции не существует. Показано симптоматическое лечение ротавируса: лечение поноса (главным образом адекватная регидратация организма), снижение температуры, легкая диета и ферментные препараты (Смекта, Креон). В диете ограничивают молоко, молочные и богатые углеводами продукты (овощи, фрукты, бобовые). Патогенетическая терапия. Цель — восстановление потерь жидкости и электролитов. Средства от ротавирусной инфекции для детей. Оральную регидратацию проводят глюкозо-солевыми растворами (ре-гидрон, цитроглюкосолан, оралит). При тяжелой форме обезвоживания показана инфузионная терапия. Широко применяют ферментные препараты (панкреатин, мезим-форте, дигестал, панзинорм), биологические препараты (лактобактерин, нутролин В и др.). Антибиотики не показаны. Антибактериальные препараты назначают только детям раннего возраста при смешанных вирусно-бактериальных инфекциях, наличии сопутствующих заболеваний микробной природы. В терапию тяжелых форм ротавирусных диарей включают специфический лактоглобулин. Профилактика. Профилактика заключается в соблюдении мер личной гигиены и изолировании больного во время болезни. Ротавирусная инфекция хорошо передается через грязные руки, поэтому уже с малых лет необходимо учить ребенка мыть руки перед едой и по возвращению с улицы.
Вирус гепатита G.
Гепатит G вызывается РНК - содержащим вирусом из группы флавивирусов. Вирус передается парентерально, способен вызывать острые и хронические гепатиты. Описано несколько генотипов HGV. У этого вируса обнаружено два структурных оболочечных белка - Е1 и Е2 и пять неструктурных белков. Маркеры гепатита G распространены среди населения даже чаще, чем - вируса гепатита С, особенно при трансплантации почки, у наркоманов, больных гемофилией, при гемодиализе и наиболее часто - у носителей вируса гепатита С.
Как метод лабораторной диагностики чаще используют ПЦР - определение РНК вируса (при остром гепатите G в первые шесть месяцев можно определить только вРНК), антитела к оболочечному белку Е2 выявляют не ранее 5 - 6 месяцев с момента инфицирования.
Острый гепатит G переходит в хронический реже, чем гепатит С. С хроническими гепатитами G связана персистенция вируса, возникновение циррозов печени. Гепатит G к настоящему времени изучен еще недостаточно.
Современные представления о вирусных гепатитах изменяются быстро, список вирусов расширяется. К новым гепатотропным вирусам, действие которых уточняется, следует отнести TTV (ДНК- вирусы нового семейства Circinoviridae) и SEN- вирусы.
TTV- вирус- спутник, сопутствующий известным вирусным парентеральным гепатитам. Это- вирус - оппортунист, активирующийся при иммунодефицитах (в т.ч. ВИЧ- инфекции). SEN- вирусы- это ДНК -вирусы, близкие к семейству TTV, связаны с переливаниями крови, реплицируются в гепатоцитах, чаще встречаются у больных с парентеральными вирусными гепатитами В и С, генетически высоко изменчивы.
Вирус иммунодефицита человека (ВИЧ или HIV) относится к семейству ретровирусов, подсемейству лентивирусов (медленных вирусов). Геном ретровирусов уникален - он представлен двумя идентичными молекулами позитивной РНК, т.е. это РНК - вирусы с диплоидным геномом. Свое название ретровирусы получили за отличительные особенности репродукции (РНК à ДНК à иРНК à геномная РНК). Особенности репродукции связаны с функциями фермента обратной транскриптазы (ревертазы или РНК - зависимой ДНК - полимеразы), обладающей тремя видами активности - обратной транскриптазы, РНК - азы и ДНК - полимеразы.
Семейство Retroviridae включает три подсемейства.
1. Lentivirinae - возбудители медленных вирусных инфекций, в т.ч. ВИЧ.
2. Oncovirinae - онкогенные вирусы, с которыми связано превращение клеток в опухолевые. Раньше не знали, как РНК - вирусы могут встраиваться в геном клетки и способствовать опухолевому росту (не были известна возможность обратной транскрипции у вирусов), что тормозило научную разработку вирусологии опухолевого роста.
3. Spumavirinae - “пенящие” вирусы, название которых связано с характерным “вспененным” видом инфицированных ими клеточных культур как результатом интенсивного симпластообразования.
Первыми открытыми в конце 70- х годов ретровирусами были HTLV-1 и HTLV-2 (от “human T- lymphotropic virus) - возбудители Т - клеточных лейкозов и лимфом. Наиболее известны обладающие лимфотропным и цитопатическим действием вирусы ВИЧ-1 (HIV-1 в английском варианте) и ВИЧ-2, вирус иммунодефицита обезьян (ВИО или SIV), к которому по ряду свойств ближе (чем к ВИЧ-1) ВИЧ-2. К настоящему времени имеется информация уже о нескольких сотнях ретровирусов, интегрированных с геномом человека и практически очень мало об их роли в патологии.
История изучения и происхождения ВИЧ.
Синдром приобретенного иммунодефицита (СПИД) впервые выделен как самостоятельное заболевание в США в 1981г. Возбудитель (ВИЧ-1) был описан почти одновременно в 1983г. французом Л.Монтанье и американцем Р.Галло. Эпидемиология нового вида патологии поражала своей необычностью. Почти 100% больных были мужчинами в возрасте 25-49 лет, 94% - гомо- или бисексуалами, отмечалась высокая летальность. У больных были выявлены дефекты клеточного иммунитета, развитие пневмоцистозной пневмонии, кандидоза и саркомы Капоши у них было расценено как оппортунистические заболевания. СПИД окрестили болезнью четырех “H”- по первым буквам английских вариантов слов гомосексуалы, гемофилия, гаитяне и героин. В 1986г. был идентифицирован еще один вирус - ВИЧ-2.
Окончательного ответа на вопрос о месте, времени и условиях возникновения ВИЧ нет. Ретроспективные исследования показали циркуляцию этого вируса по крайней мере с конца 50-х - начала 60-х годов. Прародительницей ВИЧ считают тропическую Африку, где широко распространен ВИО (близкородственный ВИЧ-2) среди обезьян. Первые известные серологические находки ВИЧ отмечены в Африке, здесь же - наибольшая интенсивность передачи ВИЧ наиболее естественным гетеросексуальным путем. Однако эпидемическое распространение ВИЧ - инфекция получила с конца 70-х - начала 80-х годов. В 1987г. выявлен первый случай в России, в настоящее время счет идет на десятки тысяч инфицированных в год. В мире регистрируют десятки миллионов инфицированных ВИЧ в год, ежегодно число вновь инфицированных увеличивается, т.е. налицо пандемия ВИЧ - инфекции.
Структура вириона ВИЧ.
ВИЧ имеет сферическую форму и размеры 100-120 нм в диаметре. Наружная оболочка образована двойным липидным слоем с гликопротеиновыми “шипами”, состоящими из трансмембранного белка gp41 (пронизывает липидный слой) и наружного белка gp120. Эти оболочечные белки кодируются геном env и участвуют в прикреплении вириона к мембранам клеток хозяина. С внутренней стороны липидной оболочки находится матричный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона - нуклеокапсид или сердцевину (англ. - core). Собственная оболочка сердцевины образована “коровским” белком р24. Внутри нуклеокапсида находится геном вируса в виде двух цепочек, связанных белками р7 и р9, полимеразный комплекс ревертазы, протеаза, интеграза (эндонуклеаза), затравочная т - РНК. Наиболее распространен ВИЧ-1, который в зависимости от строения гена env имеет субтипы. Субтипы A-H составляют доминирующую группу M (major), наиболее распространены субтипы С и Е.
Жизненный цикл ВИЧ.
Инфекционный процесс при заражении ВИЧ носит последовательный фазовый характер и начинается с проникновения вируса через слизистую оболочку половых путей или с непосредственного поступления в кровоток. Проникнув в организм, вирус в первую очередь атакует клетки, имеющие специфичный для него рецептор CD4. Этот рецептор имеют в большом количестве Т - хелперы, в меньшем - макрофаги и моноциты, нейроны, клетки нейроглии и некоторые другие клетки (см. лекции по общей иммунологии). Вирус распознает CD4 - рецепторы с помощью своего белка gp120. Процесс инфицирования клетки вирусом осуществляется в два этапа : прикрепления и слияния. Прикрепленный через белок gp120 к рецептору CD4 клетки - мишени вирус белком оболочки gp41 сливается с мембраной клетки. Белок gp41 обеспечивает не только слияние вирусной и клеточной мембран, но и слияние мембран клеток с образованием синцития (многоядерных клеток), обреченного на гибель. Нуклеокапсид, освобожденный от суперкапсида при слиянии мембран, попадает в цитоплазму. На пути к ядру освобождается геномная РНК и ассоциированные с ней компоненты сердцевины. Обратная транскриптаза синтезирует на вирионной РНК минус - цепь ДНК, РНК-аза разрушает вирионную РНК, а вирусная ДНК - полимераза синтезирует на минус - цепи плюс - цепь ДНК.
Двунитевая ДНК транспортируется в ядро клетки, где приобретает кольцевую форму и интегрируется под действием эндонуклеазы (интегразы) с ядром клетки, превращаясь в ДНК - провирус.Последующие этапы жизненного цикла ВИЧ - латентная фаза, фаза активации транскрипции с ДНК- провируса и последующая трансляция белков вируса, наработка компонентов вируса и формирование новых вирионов, их выход из клетки, сопровождающийся цитопатическим эффектом для клетки - мишени.
ДНК - провирус может длительно находиться в неактивном состоянии (персистентное инфицирование). В этот период вирус можно выявить только с помощью ПЦР. Активация транскрипции особым ядерным фактором в результате действия иммунокомпетентных клеток или микробных антигенов приводит к продуктивной фазе - активному размножению ВИЧ. Факторы экспрессии генов ВИЧ - специфические антигены (прежде всего - герпес - вирусы), неспецифические митогены (фитогемагглютинин), цитокины (фактор некроза опухолей, интерфероны, гамма - интерферон), бактериальные иммуномодуляторы (фосфолипиды сальмонелл), глюкокортикостероиды.
Антигенные свойства ВИЧ.
Функция обратной транскриптазы не подвергается контролю, что обусловливает высокую частоту генетических ошибок при репликации и мутации структурных белков вируса. С учетом частоты изменчивости ни один ВИЧ не производит при репликации вирион, в точности соответствующий родительскому. Высокая генетическая изменчивость реализуется в вариабельности антигенных и биологических свойств ВИЧ. Высокой изменчивостью характеризуется продукт гена env - оболочечный белок gp120, особенно петлеобразный V3 - домен (из 35 аминокислот), к которому образуется до 90-95% всех вируснейтрализующих антител.
ВИЧ-1 и ВИЧ-2 имеют существенные отличия в строении, гомология первичной структуры геномов составляет только около 42%, перекрестного иммунитета между этими вирусами нет. Антигенными свойствами обладают все основные структурные элементы вириона, прежде всего - белки. Исключительная генетическая и антигенная изменчивость позволяет вирусу выживать в инфицированном организме.
Наряду с генетическими особенностями, ВИЧ-1 имеет фенотипические различия по ряду свойств - эффективности репликации, характеру цитопатического действия и способности образовывать синцитий (этот признак связан с вирулентностью), преимущественному тропизму к клеткам - моноцитотропные изоляты (начальные этапы болезни) и лимфотропные изоляты (разгар болезни).
Рецептором для ВИЧ является дифференцировочный антиген CD4, имеющий гомологичные участки с иммуноглобулинами и белком gp120 ВИЧ. Расположенный на мембранах Т- хелперов и Т- индукторов, рецептор CD4 в комплексе с белками HLA II класса выполняет функцию распознавания антигенов. Фиксация вируса через gp120 ВИЧ-1 (или gp105 ВИЧ-2) с мембранным рецептором CD4 блокирует основную функцию этих иммунокомпетентных клеток - восприятие сигналов от антиген- представляющих клеток. Последующая репликация вируса ведет к гибели этих клеток и выпадению их функций, т.е. к развитию иммунодефицита. Чем активнее CD4+ клетки, тем активнее процесс репродукции вируса. ВИЧ угнетает преимущественно Т- хелперы -1 (связанные с многими цитокинами клеточного иммунитета), что способствует развитию вирусных инфекций и опухолей.
Сродство вирусного gp120 (gp105 в случае ВИЧ-2) к этому рецептору определяет высокую избирательность поражения клеток. В патологический процесс вовлекаются в первую очередь и в наибольшей степени CD4+ лимфоциты, моноциты крови и макрофаги тканей, дендритные клетки крови, лимфоузлов, селезенки, кожи, альвеолярные и интерстициальные макрофаги легких, микроглия и другие клетки нервной системы, имеющие CD4+ рецепторы. Поражаются также В- и 0- лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника. Большое значение в распространении ВИЧ и длительному сохранению в организме придают клеткам Лангерганса.
В патогенезе ВИЧ - инфекции большое значение имеют механизмы иммунного повреждения. Наличие сходных участков в структуре белков gp120, HLA класса II и CD4 - рецепторов определяет перекрестное реагирование антител к ВИЧ с этими структурами с рядом патологических эффектов (блокада кооперации CD4+ лимфоцитов и HLA класса II, неадекватная стимуляция CD4+ клеток и др.).
Поражение иммунной системы при ВИЧ - инфекции носит системный характер, проявляясь глубокой супрессией Т- и В- звеньев иммунитета. Происходят изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность CD8+ лимфоцитов, NK клеток, нейтрофилов. Нарушение иммунного статуса проявляется рядом синдромов - инфекционным, аллергическим, аутоиммунным, лимфопролиферативным.
Манифестный синдром приобретенного иммунодефицита (СПИД) проявляется в трех основных клинических формах: нейроСПИД, онкоСПИД, инфектоСПИД (оппортунистические инфекции). Это зависит от путей внедрения ВИЧ, его преимущественного тропизма к CD4 Т- лимфоцитам или макрофагам, наличия кофакторов (цитомегаловирус, вирус Эпштейна- Барр), дозы инфекта, иммунного статуса организма и др.
В динамике ВИЧ- инфекции можно выделить следующие основные стадии: заражение, латентный период, появление лабораторных признаков инфекции, первичная клиника острой вирусной (ретровирусной) инфекции (эта стадия может отсутствовать), клинический СПИД (иммунодефицит плюс индикаторные болезни). Особое значение имеет выявление лабораторных признаков ВИЧ- инфекции.
Можно выделить три типа инкубации:
- вирусологическую ( от инфицирования до определения в крови вируса или его антигенов) - в среднем 2 - 4 недели;
- серологическую (от заражения до сероконверсии - появления положительных серологических результатов) - в среднем 8 - 12 недель;
- СПИД - инкубацию (равно или более 10 лет). Безусловный иммунологический критерий СПИДа - снижение CD4+ лимфоцитов до 200 клеток в микролитре.
Лабораторная диагностика ВИЧ - инфекции методически базируется на ИФА, иммуноблоте и ПЦР. Основными ее направлениями являются:
- выявление антител к ВИЧ;
- выявление ВИЧ или его антигенов;
- определение изменений в иммунном статусе.
Для выявления антител применяют ИФА с различными тест - системами (лизатными, рекомбинантными, пептидными антигенами ВИЧ-1 и ВИЧ-2). Основная проблема - ложноположительные результаты (перекрестная реактивность gp120, CD4+ рецепторов, белков HLA II класса и др.). Поэтому исследования в ИФА проводят как правило с использованием параллельно нескольких различных тест - систем.
Иммуноблот чаще применяют как подтверждающий тест для выявления антител к отдельным белкам ВИЧ. Антитела к основным внутренним белкам (р17, р24) обнаруживают у 70% инфицированных и примерно у половины больных СПИДом. В иммуноблоте чаще всего выявляются антитела к gp41 (до 85%) и gp160 (до 100%).
В ранние сроки используют выявление в ИФА антигена р24. Наиболее чувствительным методом выявления ВИЧ является ПЦР - диагностика.
Основным клинико - лабораторным показателем диагностики СПИДа у ВИЧ - инфицированных является определение количества CD4+ лимфоцитов. Уровень ниже 200 клеток/мкл является основным критерием СПИДа.
Лечение является одним из наиболее актуальных и до настоящего времени не решенных проблем ВИЧ - инфекции. Теоретически наиболее оправдано применение препаратов, ингибирующих обратную транскрипцию - зидовудин, азидотимидин, диданозин, ставудин и др. Вакцины против ВИЧ находятся в стадии разработки. С учетом высокой изменчивости вируса это очень сложная задача.
Ротавирусная инфекция (ротавирусный гастроэнтерит) — острая инфекционная болезнь, вызываемая ротавирусами, характеризующаяся симптомами общей интоксикации и поражением ЖКТ с развитием гастроэнтерита.
Код по МКБ -10
A08.0. Ротавирусный энтерит.
Этиология (причины) ротавирусной инфекции
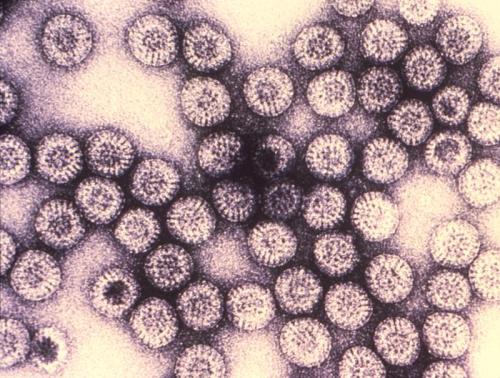
Ротавирусная инфекция, вид в электронный микроскоп
В составе ротавирусов обнаружено четыре основных антигена; главный из них — групповой антиген — белок внутреннего капсида. С учётом всех группоспецифических антигенов ротавирусы делят на семь групп: A, B, C, D, E, F, G. Большинство ротавирусов человека и животных относят к группе A, внутри которой выделяют подгруппы (I и II) и серотипы. Подгруппа II включает до 70–80% штаммов, выделяемых от больных. Существуют данные о возможной корреляционной связи определённых серотипов с тяжестью диареи.
Ротавирусы устойчивы к воздействию факторов окружающей среды: в питьевой воде, открытых водоёмах и сточных водах они сохраняются до нескольких месяцев, на овощах — 25–30 дней, на хлопке, шерсти — до 15–45 дней. Ротавирусы не разрушаются при многократном замораживании, под действием дезинфицирующих растворов, эфира, хлороформа, ультразвука, но погибают при кипячении, обработке растворами с рН больше 10 либо меньше 2. Оптимальные условия существования вирусов: температура 4 °С и высокая (>90%) или низкая ( Эпидемиология ротавирусной инфекции
Основной источник заражения и резервуар ротавирусной инфекции — больной человек, выделяющий с фекалиями значительное количество вирусных частиц (до 1010 КОЕ в 1 г) в конце инкубационного периода и в первые дни болезни. После 4–5-го дня болезни количество вируса в испражнениях значительно снижается, однако общая продолжительность выделения ротавируса составляет 2–3 недели. Длительно выделяют вирусные частицы больные с нарушенной иммунологической реактивностью, при хронической сопутствующей патологии, лактазной недостаточности.
Источником возбудителя инфекции могут быть также здоровые вирусоносители (дети из организованных коллективов и стационаров, взрослые: прежде всего, медицинский персонал родильных домов, соматических и инфекционных отделений), из фекалий которых ротавирус можно выделить на протяжении нескольких месяцев.
Механизм передачи возбудителя — фекально-оральный. Пути передачи:
– контактно-бытовой (через грязные руки и предметы обихода);
– водный (при употреблении инфицированной вирусами воды, в том числе бутилированной);
– алиментарный (чаще всего при употреблении молока, молочных продуктов).
Не исключена возможность воздушно-капельного пути передачи ротавирусной инфекции.
Ротавирусная инфекция высококонтагиозна, о чём свидетельствует быстрое распространение заболевания в окружении больных. Во время вспышек заболевает до 70% неиммунного населения. При сероэпидемиологическом исследовании в крови 90% детей старших возрастных групп обнаруживают антитела к различным ротавирусам.
После перенесённой инфекции в большинстве случаев формируется непродолжительный типоспецифический иммунитет. Возможны повторные заболевания, особенно в старших возрастных группах.
Ротавирусная инфекция встречается повсеместно и выявляется во всех возрастных группах. В структуре острых кишечных инфекций доля ротавирусного гастроэнтерита колеблется от 9 до 73%, в зависимости от возраста, региона, уровня жизни и сезона. Особенно часто болеют дети первых лет жизни (преимущественно от 6 мес до 2 лет). Ротавирусы — одна из причин диареи, сопровождающейся тяжёлой дегидратацией у детей в возрасте до 3 лет, этой инфекцией обусловлено до 30–50% всех случаев диареи, требующих госпитализации или проведения интенсивной регидратации. По данным ВОЗ, от этого заболевания в мире ежегодно умирают от 1 до 3 млн детей. На ротавирусную инфекцию приходится около 25% случаев так называемой диареи путешественников. В России частота ротавирусного гастроэнтерита в структуре других острых кишечных инфекций колеблется от 7 до 35%, а среди детей до 3 лет — превышает 60%.
Ротавирусы — одна из наиболее частых причин внутрибольничной инфекции, особенно среди недоношенных новорождённых и детей раннего возраста. В структуре внутрибольничных острых кишечных инфекций на долю ротавирусов приходится от 9 до 49%. Внутрибольничному инфицированию способствует длительное пребывание детей в стационаре. Существенную роль в передаче ротавирусов играет медицинский персонал: у 20% сотрудников даже при отсутствии кишечных расстройств в сыворотке крови обнаруживают антитела IgM к ротавирусу, а в копрофильтратах выявляют ротавирусный антиген.
На территориях с умеренным климатом ротавирусная инфекция носит сезонный характер, преобладая в холодные зимние месяцы, что связывают с лучшей выживаемостью вируса в окружающей среде при низких температурах. В тропических странах заболевание встречается круглый год с некоторым повышением заболеваемости в прохладный дождливый сезон.
Профилактика ротавирусной инфекции включает комплекс противоэпидемических мероприятий, принятых в отношении всей группы острых кишечных инфекций с фекально-оральным механизмом инфицирования. Это, в первую очередь, рациональное питание, строгое соблюдение санитарных норм водоснабжения, канализирования, повышение уровня санитарно-гигиенического воспитания населения.
Для специфической профилактики ротавирусной инфекции у человека предлагают использование нескольких вакцин, в настоящее время проходящих заключительные фазы клинических исследований в отношении эффективности и безопасности. Это вакцина Rotarix (компания GlaxoSmithKline), основанная на человеческом типе вируса, и вакцина на базе человеческого и коровьего штаммов ротавирусов, созданная в лаборатории компании Merck & Co.
Патогенез
С другой стороны, уже в первые сутки заболевания ротавирус обнаруживают в эпителии слизистой оболочки двенадцатиперстной кишки и верхних отделах тощей кишки, где происходит его размножение и накопление. Проникновение ротавируса в клетку — многоэтапный процесс. Для внедрения в клетку некоторые серотипы ротавируса нуждаются в специфических рецепторах, содержащих сиаловую кислоту. Установлена важная роль белков: α2β1-интегрина, интегрина-αVβ3 и hsc70 на начальных этапах взаимодействия вируса и клетки, при этом весь процесс контролируется вирусным белком VP4. Проникнув внутрь клетки, ротавирусы вызывают гибель зрелых эпителиоцитов тонкой кишки и отторжение их от ворсинок. Клетки, замещающие ворсинчатый эпителий, функционально неполноценны и не способны адекватно абсорбировать углеводы и простые сахара.
Возникновение дисахаридазной (главным образом, лактазной) недостаточности ведёт к накоплению в кишечнике нерасщеплённых дисахаридов с высокой осмотической активностью, что вызывает нарушение реабсорбции воды, электролитов и развитие водянистой диареи, нередко приводящей к дегидратации. Поступая в толстую кишку, эти вещества становятся субстратами для ферментации кишечной микрофлорой с образованием большого количества органических кислот, углекислого газа, метана и воды. Внутриклеточный метаболизм циклического аденозинмонофосфата и гуанозинмонофосфата в эпителиоцитах при данной инфекции практически не изменяется.
Таким образом, в настоящее время в развитии диарейного синдрома выделяют два основных компонента: осмотический и секреторный.
Клиническая картина (симптомы) ротавирусной инфекции
Инкубационный период составляет от 14–16 ч до 7 дней (в среднем — 1–4 дня).
Различают типичную и атипичную ротавирусную инфекцию. Типичную ротавирусную инфекцию, в зависимости от степени тяжести ведущих синдромов, подразделяют на лёгкую, среднетяжёлую и тяжёлую формы. К атипичным относят стёртую (клинические проявления выражены слабо и кратковременны) и бессимптомную формы (полное отсутствие клинических проявлений, но лабораторно обнаруживают ротавирус и специфический иммунный ответ). Диагноз вирусоносительства устанавливают при обнаружении ротавируса у здорового человека, не имевшего при обследовании изменений специфического иммунитета в динамике.
Заболевание чаще всего начинается остро, с повышения температуры тела, появления симптомов интоксикации, диареи и повторной рвоты, что позволило зарубежным исследователям охарактеризовать ротавирусную инфекцию как DFV-синдром (диарея, лихорадка, рвота). Указанные симптомы отмечают у 90% пациентов; они возникают почти одновременно в первый день болезни, достигая максимальной выраженности в течение 12–24 ч. В 10% случаев рвота и диарея появляются на 2–3-й день болезни.
Возможно также постепенное начало заболевания, с медленным нарастанием тяжести процесса и развитием обезвоживания, что нередко обусловливает позднюю госпитализацию.
Рвота — не только один из первых, но нередко и ведущий признак ротавирусной инфекции. Обычно она предшествует диарее или появляется одновременно с ней, может быть повторной (до 2–6 раз) или многократной (до 10–12 раз и более), продолжается в течение 1–3 дней.
Повышение температуры тела умеренное: от субфебрильных до фебрильных значений. Длительность лихорадки колеблется в пределах 2–4 дней, нередко лихорадка сопровождается симптомами интоксикации (вялость, слабость, снижение аппетита, вплоть до анорексии).
Кишечная дисфункция протекает преимущественно по типу гастроэнтерита или энтерита, характеризуясь жидким, водянистым, пенистым стулом жёлтого цвета без патологических примесей. Кратность дефекаций чаще соответствует тяжести болезни. При обильном жидком стуле может развиться обезвоживание, обычно I–II степени. Лишь в отдельных случаях наблюдают тяжёлую дегидратацию с декомпенсированным метаболическим ацидозом, при этом возможна ОПН и гемодинамические расстройства.
С самого начала заболевания могут наблюдаться боли в животе. Чаще они умеренные, постоянные, локализованы в верхней половине живота; в отдельных случаях — схваткообразные, сильные. При пальпации живота отмечают болезненность в эпигастральной и пупочной областях, грубое урчание в правой подвздошной области. Печень и селезёнка не увеличены. Признаки поражения органов пищеварения сохраняются в течение 3–6 дней.
У части больных, преимущественно у детей младшего возраста, развиваются катаральные явления: покашливание, насморк или заложенность носа, редко — конъюнктивит, катаральный отит. При осмотре обращают на себя внимание гиперемия и зернистость мягкого нёба, нёбных дужек, язычка.
Количество мочи в острый период болезни уменьшено, у отдельных пациентов наблюдается незначительная протеинурия, лейкоцитурия, эритроцитурия, а также повышение содержания креатинина и мочевины в сыворотке крови. В начале болезни может быть лейкоцитоз с нейтрофилёзом, в период разгара сменяющийся лейкопенией с лимфоцитозом; СОЭ не изменена. Для копроцитограммы характерно отсутствие признаков выраженного воспалительного процесса, в то же время обнаруживаются зёрна крахмала, непереваренная клетчатка, нейтральный жир.
У большинства больных ротавирусной инфекцией отмечают нарушение состава микрофлоры фекалий, в первую очередь, снижение содержания бифидобактерий, а также рост числа условно-патогенных микробных ассоциаций. Выявляют признаки лактазной недостаточности, в том числе кислые значения pH кала.
Симптомы, характерные для лёгких форм ротавирусной инфекции:
– субфебрильная температура тела;
– умеренная интоксикация в течение 1–2 дней;
– нечастая рвота;
– стул жидкой кашицей до 5–10 раз в сутки.
При среднетяжёлых формах заболевания отмечается:
– фебрильная лихорадка;
– выраженная интоксикация (слабость, вялость, головная боль, бледность кожных покровов);
– повторная рвота в течение 1,5–2 дней;
– обильный водянистый стул от 10 до 20 раз в сутки;
– обезвоживание I–II степени.
Тяжёлые формы ротавирусного гастроэнтерита характеризуются бурным началом с нарастанием тяжести состояния ко 2–4-му дню болезни в связи со значительными потерями жидкости (обезвоживание II–III степени), многократной рвотой и бессчётным водянистым стулом (более 20 раз в сутки). Возможны гемодинамические нарушения.
Осложнения ротавирусной инфекции:
– циркуляторные расстройства;
– острая сердечно-сосудистая недостаточность;
– острая экстраренальная почечная недостаточность;
– вторичная дисахаридазная недостаточность;
– дисбактериоз кишечника.
Необходимо учитывать возможность наслоения вторичной бактериальной инфекции, что приводит к изменениям клинической картины болезни и требует коррекции терапевтического подхода. В связи с возможностью развития осложнений при ротавирусном гастроэнтерите выделяют группы больных повышенного риска, куда включают новорождённых, детей младшего возраста, пожилых лиц, а также больных с тяжёлыми сопутствующими заболеваниями. Недостаточно изучены особенности течения ротавирусной инфекции у лиц с иммунодефицитами (например, ВИЧ-инфицированные), у которых может наблюдаться некротический энтероколит и геморрагический гастроэнтерит.
Летальные исходы чаще встречаются у детей раннего возраста, имеющих выраженный иммунологический дефицит и гипотрофию, а также среди пожилых пациентов с тяжёлой сопутствующей патологией (такой, как атеросклероз, хронический гепатит), в некоторых случаях — со смешанной инфекцией.
Диагностика ротавирусной инфекции
Основные клинико-диагностические признаки ротавирусной инфекции:
* характерный эпидемиологический анамнез — групповой характер заболевания в зимнее время года;
* острое начало болезни;
* повышение температуры тела и синдром интоксикации;
* рвота как ведущий симптом;
* водянистая диарея;
* умеренно выраженные боли в животе;
* метеоризм.
Для лабораторного подтверждения ротавирусной природы заболевания используют три группы методов:
* методы, основанные на обнаружении ротавируса и его антигенов в фекалиях:
– электронная и иммуноэлектронная микроскопия;
– РЛА;
– ИФА;
* методы обнаружения вирусной РНК в копрофильтратах:
– метод молекулярных зондов — ПЦР и гибридизации;
– электрофорез РНК в полиакриламидном геле или агарозе;
* методы обнаружения специфических антител (иммуноглобулины различных классов и/или нарастания титра антител) к ротавирусам в сыворотке крови (ИФА, РСК, РТГА, РНГА).
На практике диагностика ротавирусной инфекции чаще всего основана на обнаружении вирусного антигена в копрофильтратах с помощью РЛА, ИФА в 1–4-е сутки болезни.
Ротавирусную инфекцию дифференцируют с холерой, дизентерией, эшерихиозом, гастроинтестинальными формами сальмонеллёза, кишечным иерсиниозом (табл. 18-22).
Консультации других специалистов рекомендуют при тяжёлой сопутствующей патологии, развитии осложнений.
A08.0 Ротавирусная инфекция, синдром гастроэнтерита, среднетяжёлая форма, дегидратация I степени.
Лечение ротавирусной инфекции
Госпитализации подлежат больные со среднетяжёлой и тяжёлой формами ротавирусной инфекции, а также пациенты, представляющие высокую эпидемиологическую опасность (декретированные контингенты).
Комплексное лечение ротавирусной инфекции включает лечебное питание, этиотропную, патогенетическую и симптоматическую терапию.
Из диеты исключают молоко и молочные продукты, ограничивают употребление углеводов (овощи, фрукты и соки, бобовые). Пища должна быть физиологически полноценной, механически и химически щадящей, с достаточным содержанием белка, жира, минеральных солей и витаминов. Необходимо увеличение кратности приёмов пищи.
Один из перспективных методов лечения ротавирусной инфекции — применение препаратов, обладающих противовирусной и интерфероногенной активностью, в частности, меглумина акридонацетата (циклоферона). Меглумина акридонацетат в таблетированной форме принимают в 1–2–4–6–8-й день в возрастной дозировке: до 3 лет — по 150 мг; 4–7 лет — 300 мг; 8–12 лет — 450 г; взрослые — 600 мг однократно. Использование меглумина акридонацетата приводит к более эффективной элиминации ротавируса и сокращению длительности заболевания.
Кроме того, в качестве лечебных средств можно применять иммуноглобулины для энтерального введения: иммуноглобулин человека нормальный (IgG+IgA+IgM) — 1–2 дозы 2 раза в день. Антибактериальные средства не показаны.
Патогенетическое лечение, направленное на борьбу с дегидратацией и интоксикацией, осуществляют путём введения полиионных кристаллоидных растворов, внутривенно или внутрь, с учётом степени обезвоживания и массы тела больного.
Оральную регидратацию проводят подогретыми до 37–40 °С растворами: глюкосолан, цитраглюкосолан, регидрон. Для инфузионной терапии используют полиионные растворы.
Эффективный метод лечения диареи ротавирусной этиологии — энтеросорбция: смектит диоктаэдрический по 1 порошку 3 раза в сутки; полиметилсилоксана полигидрат по 1 столовой ложке 3 раза в сутки; лигнин гидролизный по 2 таблетки 3–4 раза в сутки.
Учитывая ферментативную недостаточность, рекомендуют применение полиферментных средств (таких, как панкреатин) по 1–2 драже 3 раза в сутки во время еды.
Кроме того, при лечении ротавирусной инфекции целесообразно включение биопрепаратов, содержащих бифидобактерии (бифиформ по 2 капсулы 2 раза в сутки).
Таблица 18-22. Основные дифференциально-диагностические признаки острых кишечных инфекций
Прогноз выздоровления
Прогноз обычно благоприятный. Переболевших выписывают при полном клиническом выздоровлении, наступающем в большинстве случаев к 5–7-му дню от начала болезни.
Диспансерного наблюдения не проводят.
После перенесённого заболевания пациенту рекомендуют в течение 2–3 нед соблюдать диету с ограничением молока и молочных продуктов, углеводов.
Читайте также:


