Трихомониаз в окрашенных мазках
Возбудителя обнаруживают по его характерному движению среди клеточных элементов в препарате, приготовленном сразу после взятия материала.
Влагалищная трихомонада имеет грушевидную, округлую или овальную форму тела, величину немного больше лейкоцита, обладает характерным толчкообразным движением ундулирующей мембраны и жгутиков. К ошибкам может привести наличие в препарате подвижных бактерий, которые, прикрепляясь к лейкоцитам, создают впечатление подвижных трихомонад. При длительном пребывании при комнатной температуре трихомонады довольно быстро теряют свою подвижность, поэтому метод исследования окрашенных препаратов является более точным и удобным.
Препараты можно окрашивать по Романовскому—Гимзе, раствором метиленового синего (10 г/л) и по Граму.
В препарате, окрашенном метиленовым синим, трихомонады имеют округлую, овальную, полигональную форму, расположены в слизи, между клеточными элементами; четко просматривается оболочка, ядро расположено эксцентрично, интенсивно окрашено в синий цвет; цитоплазма нежная, сетчатая светло-синяя; вакуоли бесцветны
В мазках, окрашенных по Граму, влагалищные трихомонады окрашиваются бледно: оболочка в виде тонкой полоски окружает сетча тую цитоплазму оранжево-красного цвета, ядро сиреневого или фиолетового цвета, жгутики и ундулирующая мембрана не просматриваются.
Более четко трихомонады выявляются в мазках, окрашенных по Романовскому—Гимзе. Они имеют грушевидную, овальную, круглую или неправильную форму, с хорошо выраженными контурами клетки. Ядро овальное, круглое, в форме сливовой косточки или лисьего глаза, окрашено в фиолетовый цвет. Цитоплазма ячеистая, пенистая, вакуолизированная, окрашена в синий или голубовато-серый цвет. В цитоплазме может выявляться фагоцитированная микробная флора.
Урогенитальный хламидиоз
Урогенитальный хламидиоз — одна из самых распространенных инфекций. У мужчин чаще поражается уретра, у женщин — цервикальный канал, покрытый цилиндрическим эпителием. Вагинитов хламидии не вызывают, так как вагина покрыта плоским эпителием.
Хламидиоз часто протекает бессимптомно. Выделения слизистого характера в небольшом количестве. Хламидии могут вызывать послеродовый эндометрит, сальпингит, конъюнктивит у новорожденных, пневмонии, бесплодие и др.
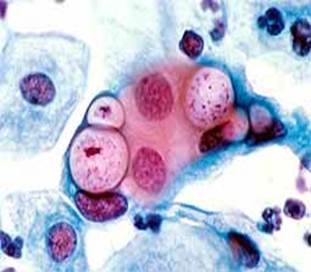 | Хламидии — облигатные внутриклеточные паразиты с уникальным циклом развития, включающим две формы существования. 1)Элементарное тельце — инфекционная форма возбудителя, поражающая клетки (окрашивается в красно-фиолетовый цвет). |
2)Ретикулярное тельце является неинфекционной (вегетативной) формой хламидии, образуется в процессе их размножения в клетке (окрашивается в синий цвет).
Хламидии растут, размножаются и созревают в виде микроколоний в цитоплазматическом пузырьке (вакуоли). В цитоплазме клеток образуются мембраноограниченные включения — вакуоли (тельца Провачека). Хламидийное тельце оттесняет ядро к периферии и может занимать значительную часть цитоплазмы. В цитоплазме одной клетки может быть несколько микроколоний хламидийных включений.
Исследование препаратов, окрашенных по Романовскому-Гимзе, позволяет получить только ориентировочные результаты. Морфологический метод очень трудоемкий и субъективный, выявляемость до 15—20%. Метод позволяет обнаружить в окрашенном цилиндрическом эпителии, полученном из цервикального канала, уретры или в соскобах из конъюнктивы глаз, цитоплазматические включении хламидий.
У мужчин соскоб из уретры берут сразу после мочеиспускания на расстоянии 2—4 см от головки члена.
У женщин материал берут из цервикального канала ежиком, предварительно удалив пробирку из цервикса. В исследуемом материале должен быть цилиндрический эпителий, так как многослойный плоский эпителий хламидиями не поражается.
В препарате, окрашенном по Романовскому—Гимзе, хламидийпые включения следует дифференцировать с зернистыми структурами травмированных ядер (кариорексис), с розовато-синими зернами муцина, диффузной зернистостью цитоплазмы, пигментными зернистыми массами, эозинофильными зернами разрушенных клеток.
Урогенитальный кандидоз
В развитии воспалительных процессов половых органов большую роль играет поражение дрожжеподобными грибами рода Candida. Они подавляют не только патогенные бактерии, но и палочки молочнокислого брожения, являющиеся физиологическими антагонистами дрожжеподобных грибов. В результате рН влагалища изменяется в щелочную сторону, процесс самоочищения нарушается.
При кандидомикозе слизистой оболочки исследованию подлежит беловатый или желтоватый налет (пленка). Пленка состоит из псевдомицелия гриба, дрожжеподобных клеток, опущенного эпителии и небольшого числа лейкоцитов.
Мазки окрашивают раствором метиленового синего (10 г/л), по Романовскому—Гимзе, Граму.
Характерным для микроскопической картины кандидомикоза является наличие клеток овальной или грушевидной формы, в 1,5 раза больших усредненного поперечника нитей псевдомицелия гриба.
В препаратах женских и очень редко мужских выделений встречается микроорганизм типа Leptothrix, который, как и дрожжеподобный гриб рода Candida, является условно патогенным.
| Палочки Leptothrix встречаются в виде тонких длинных прямых и изогнутых нитей разной длины, иногда располагающихся цепочками и симулирующих нити мицелия. Часто эти элементы видны в виде ветвящихся причудливых нитей, образующих сплетение в виде войлока. |  |
Клинически картина напоминает молочницу слизистой оболочки.
Поражение влагалища грибами наблюдается при: диабете, лечении антибиотиками широкого спектра действия, на фоне иммунодепрессивной терапии, при использовании пероральных контрацептивов, внутриматочных спиралей, гормональных препаратов. Источником инфекции может быть и сам организм, в котором постоянно находятся возбудители некоторых микозов.
На вирусную природу воспаления (вирус простого герпеса, папилламавирус и др.) может указывать присутствие гигантских многоядерных клеток. Ядра гипертрофированные, гипохромные, контуры хроматина размыты, ядерная оболочка уплотнена, контурирует четко за счет краевого (маргинального) расположения хроматина. Ядрышки гипертрофированные, могут подвергаться лизису и фрагментизации.
Признаком цитомегаловирусной инфекции считают наличие крупных клеток, обычно округлой формы, с увеличенными ядрами. В ядре обнаруживаются гомогенные включения округлой формы, окруженные светлым ободком. Эти включения занимают почти все ядро и напоминают птичий глаз.
Для подтверждения вирусной природы заболевания необходимо применение серологических, иммунофлюоресцентных, электронно-микроскопических и других методов исследования.
Сифилис
Материалом для исследования служит тканевая жидкость из сифилитических элементов, а также пунктат лимфатических узлов. Ввиду опасности заражения при работе с этим материалом работать необходимо в резиновых перчатках. Для получения тканевой жидкости очаг поражения тщательно очищают тампоном.
· Язву или папулу сдавливают с боков пальцами. Петлей производят осторожные (чтобы не вызвать кровотечение) поглаживающие движения по поверхности эрозии или язвы. Вскоре поверхность эрозии становится блестящей в результате просачивания тканевой жидкости.
· На предметное стекло наносят каплю изотонического раствора хлорида натрия, прибавляют к ней каплю тканевой жидкости
· накрывают покровным стеклом
· исследуют в темном поле при боковом освещении
В темном поле зрения бледные трепонемы имеют вид подвижных серебристых спиралей или пунктира в связи с более ярким освещением выпуклой части завитков. Завитки равномерные, количество их колеблется от 8 до 14.
Для бледных трепонем характерно:
· весьма активное поступательное движение;
· движение вокруг своей оси;
 | Спирохеты сапрофиты, довольно часто встречающиеся на половых органах, имеют не более 6 неравномерных завитков, более грубые, обладают более резкими беспорядочными движениями. Для обнаружения бледной трепонемы используют методы окраски Романовского и Бурри. |
Препарат окрашивают разведенной по титру краской Романовского в течении 14—15 мин. Бледная трепонема окрашивается в розовый цвет, а другие спирохеты — в синий.

Трихомонады – типичные простейшие, часть из которых способна вызывать поражения урогенитального тракта у людей обоего пола.
Трихомонас вагиналис обычно проживает и размножается у женщин, для которых более типично хроническое течение инфекции.
Женщины являются и резервуаром-носителем, от которого чаще заражаются мужчины.
Актуальны все виды половых контактов, кроме орального.
Трихомонада – единственный возбудитель половых инфекций, которым нельзя заразиться при оральном сексе.
Особенности возбудителя — наличие множества ферментов-протеаз.
Это позволяет ему закрепляться на клетках эпителия половых органов, внедряться в них и ускользать от защитных механизмов иммунитета человека.
В ответ на вагинальную трихомонаду слизистая отвечает воспалением, эрозированием, метаплазией, а в подслизистом слое образуются инфильтраты.
Помимо яркой клинической картины при вульвовагините или цервиците у женщин и уретрите у мужчин нередки и случаи носительства простейших, без явной клинической картины.
Проблема диагностики инфекции актуальна не только при заболеваниях урогенитального тракта, но и при носительстве.
Трихомонада не только ослабляет местную иммунную защиту и меняет общую реактивность организм своего хозяина.
Но и открывает ворота для сопутствующих венерических инфекций (гонококков, хламидий).

Нередко можно обнаружить у носителя трихомонад или больного трихомониазом ассоциации с другими возбудителями инфекций, передаваемых половым путем.
- Классическая диагностика трихомониаза
- Как делают микроскопию мазка на трихомониаз
- Сравнительные характеристики микроскопий на трихомониаз
- Другие варианты исследования мазков на трихомониаз
- Диагностика микробных содружеств при трихомониазе
- Как подготовиться к мазку на трихомониаз
- Когда после заражения сдают мазок трихомониаз
- Серологическая диагностика трихомониаза
- Результаты мазка на трихомониаз
Классическая диагностика трихомониаза
Традиционно постановка диагноза трихомониаза связывается с микроскопией мазков.
Подобный диагностический поиск более полувека велся урологами, венерологами и гинекологами.
Ранее он был актуален для лиц обоего пола.
И сегодня взятие мазков на гонорею и трихомониаз – обязательная часть рутинного гинекологического обследования.
Однако, актуальность метода сегодня ставится под сомнение.
У женщин образцы для микроскопического анализа забираются при гинекологическом осмотре.
Источниками служат слизистая влагалища, мочеиспускательного и шеечного каналов.
Для здоровой женщины методики остаются безболезненными.
При наличии воспалительных изменений или эрозирования слизистых возможны небольшой дискомфорт и незначительные контактные кровотечения.
Они не требуют никаких мероприятий и проходят самостоятельно за несколько часов или суток.
Как делают микроскопию мазка на трихомониаз
Для забора материала соблюдается определенная последовательность: из мочеиспускательного канала, вагины, шейки матки.
- Цервикальный материал забирается тампоном-щеточкой (для иммунофлюоресцентных микроскопий) или стандартным ватным тампоном, с которого пробу переносят на предметное стекло.
- Из уретры забор предусмотрен тампоном или бактериологической петлей из пластика. Они вводятся на пару сантиметра и вынимаются с легким нажимом на стенки уретры. Полученный образец перемещают на предметное стекло, перекатывая по нему тампон, а петлю передвигают, слегка прижимая.
- Когда подозревается трихомониаз, мазок из влагалища берется с использованием стерильного ватного тампона. При выборе участков забора мазка предпочтение отдается измененной слизистой или заднему своду влагалища. Для микроскопии пробу переносят с тампона на предметное стекло. С этой целью по стеклу тампон равномерно перекатывают. Затем мазок сушат и фиксируют, используя этиловый спирт. Стекло маркируется и направляется в лабораторию для микроскопии.
Мазок на трихомониаз у мужчин берется из мочеиспускательного канала с помощью урологического зонда, вводимого на 3-4 сантиметра.

При обратном движении зонд прижимается к стенкам уретры с целью собрать материал для микроскопии.
Для микроскопии используются обезжиренные предметные стекла, маркируемые по месту забора исследуемого материала.
Их после нанесения материала высушивают на воздухе и фиксируют с помощью 96% этилового спирта (1-2 капли на мазок).
В дальнейшем чаще всего применяется окраска по Грамму.
Позволяет отделять грамположительные микробы, окрашивающиеся в темно-фиолетовый цвет от грамотрицательных, принимающих малиновый цвет.
Микроскопию проводят в световом микроскопе.
Применяют метод иммерсии (вводя между объективом и предметным стеклом масляный раствор).
Это позволяет расширять видимую область и увеличивать яркость объекта.
- При окраске по Грамму трихомонады окрашиваются неоднородно. Ядро их приобретает фиолетовую, а протоплазма — оранжевую окраску.
- В случае использования в качестве красителя метиленового-синего прокрашивает ядра в синий цвет.
- Сочетание метиленового синего и эозина дает синие ядра и голубую цитоплазму.
- Окраска по Папаниколау – более дорогой тест, который привычно используется для обнаружения новообразований цервикального канала. Для трихомонад методика обладает примерно 60% чувствительностью и 95% специфичностью.
Сравнительные характеристики микроскопий на трихомониаз
Желательно микроскопировать свежие неокрашенные мазки.
Так как трихомонады быстро теряют подвижность, через полчаса от забора материала достоверность микроскопического поиска снижается на треть.
Недостатком микроскопии становится погрешность визуального восприятия.

За трихомонады нередко принимаются клетки эпителия в состоянии вакуольной дегенерации.
Лучше поддаются верификации живые трихомонады.
Поэтому чем ранее материал попадает под микроскоп, тем выше процент удачных диагностических поисков.
Порядка 90% микроскопий материала в течение первых двух часов от его забора верны.
Чем позже от момента выполнения мазка проведено микроскопирование, тем ниже вероятность застать возбудителя в живых.
И достоверно сказать, имеет ли место инфицированность трихомонадой.
Играет роль и количество простейших в образце.
Поэтому у мужчин ПЦР всегда предпочтительнее микроскопии.
Так как в их уретре концентрация трихомонад обычно значительно меньше, чем в половых путях женщины.
Окрашивание мазков позволяет более детально изучить строение возбудителя, однако снижает чувствительность методики.
После применения анилиновых красителей успешное обнаружение трихомонады возможно лишь в 30-60 процентах случаев.

Нередко это связано с тем, что красители меняют привычную грушевидную форму инфекционного агента и затрудняют верификацию.
Предпочтительнее применение метиленового синего.
Это простая окраска, которая достаточно ярко прокрашивает ядра возбудителей и создает достаточную наглядность.
Другие варианты исследования мазков на трихомониаз
- Фазово-контрастное микроскопирование даже без подкрашивания образцов позволяет выявить присутствие трихомонад.
- Люминисцентная микроскопия основана на способности ультрафиолетовых лучей вызывать свечение предварительно обработанный люминофором (акридиновым оранжевым) клеток. Для обнаружения трихомониаза используется редко, так как методика трудозатратная и дорогая.
- Сегодня появилась возможность более детально проводить анализ генетического материала возбудителя, с высокой точностью верифицируя именно данный вид инфекционного агента. Среди методик амплификации нуклеиновых кислот чаще всего пользуются полимеразной цепной реакцией. Материал для данного вида исследования забирают аналогично тому, как это делается для микроскопии. Но тканевые образцы помещаются не на предметные стекла, а в пробирки с жидкой средой, предназначенной для транспортировки. Методика позволяет выявлять целые цепочки или их обломки генома трихомонад, верифицировать их. И для мужчин, и для женщин, анализ показывает максимальную, стопроцентную специфичность и чувствительность.
- Культуральные методики показывают высокую специфичность (100%) и чувствительность. Они предполагают транспортировку забранных образцов в пробирках со средами, перенос их на питательные среды и помещение в термостаты на период роста колоний. Для трихомонад актуальны агаровые среды. Разброс чувствительности методики довольно большой: от 40 до 96%. Играют роль качество транспортных и питательных сред, сроки и условия транспортировки образцов. Иногда требуется пересадка культуры микробов с одной среды на другую в связи с возможной задержкой роста трихомонад на сутки или более. В целом методика дорога, даже после внедрения систем типа пластикового конверта или InPouch TV.
Таким образом, посев мазка трихомониаз выявляют хуже, чем ПЦР и более информативны у женщин, чем у мужчин.
Диагностика микробных содружеств при трихомониазе
Довольно редко трихомонады становятся изолированной половой инфекцией.
Эти микроорганизмы способны захватывать и фагоцитировать клетки других возбудителей половых инфекций.
Способствуя развитию смешанного поражения урогенитального тракта.
Гибель лактобацилл в результате их растворения трихомонадами обеспечивает падение местной иммунной защиты в половых путях у женщин.
Нередко наряду с трихомонас вагиналис в мазках обнаруживаются гонококки, хламидии.
Они могут вызывать инфекционно-воспалительные процессы, устойчивые к антибактериальной терапии одним препаратом.
Удлиняют и усложняют диагностический поиск и лечение, а также делают их более дорогостоящими.
Мазок на гонорею и трихомониаз берется одновременно.
При этом методики амплификации нуклеиновых кислот (РНК и ДНК) забранных образцов предпочтительнее микроскопии.
Это связано также с тем, что входящие в бактериальное содружество спутники трихомонады могут не выявляться при микроскопическом исследовании.
Сегодня существуют методики определения чувствительности трихомонад к различным противопротозойным препаратам.
Так как возбудитель – факультативный анаэроб, то лекарственные средства тестируются как в присутствии воздуха, так и без него.
Такие диагностические пробы дороги и практического применения в обычных клиниках не имеют.
Как подготовиться к мазку на трихомониаз
Не так уж важно, какой врач назначает мазок.
Трихомониаз может быть успешно диагностирован по направлению уролога, венеролога или гинеколога.
Главное, не ошибиться с выбором диагностической методики и не допустить ошибок в подготовке к исследованию.
Можно обратиться в частную лабораторию, где делают большой спектр исследований на половые инфекции.
Можно обратиться и в клинику в системе ОМС, где сделать бесплатно можно мазки и цитологию.
Однако, посев мазка на трихомониаз – это не всегда стопроцентно достоверный анализ.
Нередко сомнительные результаты приходится перепроверять с помощью полимеразной цепной реакции.
Сроки ее выполнения занимают не более трех суток и могут быть сокращены до нескольких часов.
Цена избавления от трихомониаза в сжатые сроки, разумеется, перекрывает риски неточной диагностики бесплатными методиками.
Когда после заражения сдают мазок трихомониаз
Так как микроскопия выявляет живые подвижные клетки простейших, необходимо, чтобы они успели внедриться в клетки урогенитального эндотелия, в соскобе которых их и ищут.
Чаще всего положительные ответы микроскопии могут быть получены уже спустя семь-десять дней от заражения.
Подготовка, которую требует мазок на трихомониаз, предполагает:
- Отказ от противомикробных средств на десять дней.
- Отказ от местных антисептиков на двое суток.
- Воздержание от мочеиспускания в течение двух часов до забора материал из уретры.
![]()
Серологическая диагностика трихомониаза
Сравнение мазка и крови на трихомониаз конечно перевешивает чашу весов на сторону серологических вариантов поиска.
Почему, например, нет симптомов, а в мазке обнаружено большое число трихомонад?
Не всегда дело в носительстве инфекции.
Нередко за трихомонады при визуальной оценке принимаются клетки эпителия.
Поиск же иммуноглобулинов в венозной крови, определение их титров в парных сыворотках дает количественное представление об иммунном ответе организма на присутствие трихомонад.
Это дает преимущество в установлении давности инфекционного процесса, предполагаемых сроках заражения.
Кровь для анализа забирается натощак из вены в лаборатории или процедурном кабинете.
Однако серология не является ведущей методикой в верификации диагноза трихомониаза.
Результаты мазка на трихомониаз
Когда проводится расшифровка, мазок трихомониаз описывается следующим образом: обнаружено или нет.
В случае, когда мазок показал трихомониаз, результат желательно перепроверить посредством ПЦР.
Что делать, если обнаружено инфицирование или имеется клиника трихомониаза, определяет врач.
Обычно ведется терапия с применением противопротозойных препаратов (метронидазола или тинидазола).
Мазок трихомониаз контрольный после лечения также целесообразно заменять ПЦР.
На сегодня выбор противотрихомонадных препаратов для системного и местного лечения не так уж широк.
Простейшее часто проявляет достаточную лекарственную устойчивость и способно выживать после курса терапии.
Связано это в первую очередь с нарушением проницаемости мембраны простейшего и его способностью захватывать из соседних клеток нитрогруппы, мешающие работе метронидазола.
Поэтому, проявляя устойчивость к лекарствам, микроорганизм может модифицироваться внешне, ограничивая удачную микроскопию.
Однако генетический материал (ДНК и РНК) возбудителя остаются прежним.
Это позволяет удачно верифицировать недолеченную инфекцию методами амплификации нуклеиновых кислот.
И назначать повторное или альтернативное лечение до полной стабилизации микрофлоры урогенитального тракта.

В целом, в задачи человека, заподозрившего у себя трихомониаз или другую половую инфекцию, входит незамедлительное обращение к профильному врачу.
Такая тактика позволит своевременно установить природу и характер патологических изменений мочевыводящих или половых путей.
И начать адекватное лечение инфекции.
Ни в коем случае недопустимо самолечение или использование народных методов.
Ценой несвоевременного или неадекватного лечения может стать не только хронизация инфекции, но и осложнения, включая бесплодие и половую несостоятельность.
Если вам необходимо сделать мазок на трихомониаз, обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
- ВИЧ
- Гарднереллез
- Кондиломатоз
- Молочница
- Сифилис
- Трихомониаз
- Баланопостит
- Герпес
- Гонорея
- Микоплазмоз
- Уреаплазмоз
- Уретрит
- Хламидиоз
- ЗППП
Принципы лабораторной диагностики мочеполового трихомониаза
1. Лабораторные методы исследований
Материалом для паразитологических исследований у женщин служит отделяемое из цервикального канала, смыв из влагалища и осадок мочи; у мужчин — отделяемое из уретры, центрифугат свежевыпущенной мочи, секрет предстательной железы и эякулят.
Накануне обследования женщинам в течение суток не рекомендуется делать спринцеваний. Материал для анализа берется у них со слизистой заднего свода влагалища. В некоторых случаях исследуется отделяемое из цервикального канала.
Мужчинам перед обследованием предлагается в течение 3-4 ч воздерживаться от мочеиспусканий. Материал из уретры у них забирается с глубины 5-7 см специальным зондом или ложкой Фолькмана. Исследуется также секрет предстательной железы и эякулят. Если речь идет о хронической трихомонаднои инвазии, накануне исследования рекомендуется сделать провокацию гоновакциной, пирогеналом или неспецифическую (алкогольную).
1.1. Диагностика мочеполового трихомониаза
Диагностика мочеполового трихомониаза проводится путем микроскопии нативных препаратов, а также мазков, окрашенных метиленовым синим, по Романовскому-Гимзе и по модифицированному способу Грама. Для обнаружения трихомонад в нативных препаратах исследуется эякулят, секрет предстательной железы и осадок мочи у мужчин и смыв из влагалища у женщин.
Исследование нативных препаратов
Нативные препараты готовятся и исследуются сразу же после взятия материала. Если это невозможно, материал помещается в питательную среду, обеспечивающую кратковременное сохранение трихомонад, из расчета 1 мл исследуемого материала на 5 мл среды. Материал должен быть доставлен в лабораторию в теплом виде, сроки доставки материала не должны превышать 2 часов.
Для приготовления препарата на предметное стекло наносится капля теплого изотонического раствора хлорида натрия или раствора Рингера-Локка, с которой смешивается исследуемый материал. Взвесь накрывается покровным стеклом и микроскопируется при увеличении объектива 40 и окуляра 7 или 10.
При изучении нативного препарата особое внимание обращается на размеры и форму трихомонад, характер их движения, внутреннее содержимое клеток. В типичных случаях трихомонады обнаруживаются в виде подвижных образований грушевидной, реже овальной формы, размером в среднем от 13 до 17мкм. Характер их движений толчкообразный. Иногда удается заметить движение свободных жгутиков. Ядра трихомонад чаще не обнаруживаются или плохо различимы. Цитоплазма трихомонад обычно зернистая, чаще вакуолизирована.
Размеры лейкоцитов, имеющих округлую, реже овальную форму, как правило, не превышают 10 мкм. Цитоплазма лейкоцитов прозрачна, зернистость обычно не отмечается или слабо выражена. Сегментоядерные нейтрофилы обычно содержат хорошо различимое сегментированное ядро.
Голые ядра эпителиоцитов отличаются от трихомонад относительно толстой оболочкой (кариолеммой) и иным характером зернистости (отдельные глыбки хроматина). В клетках молодого эпителия, даже если они по размерам соответствуют трихомонадам и обладают зернистостью, всегда прослеживается четко различимое округлое или овальное ядро.
В некоторых случаях обнаруживаются амебоидные формы Т. vaginalis, длина тела которых достигала 30 мкм, а также атипично делящиеся (почкующиеся) клетки. Основными дифференциально-диагностическими критериями, отличающими атипичных трихомонад от клеток эпителия и лейкоцитов, служат наличие в цитоплазме этих простейших выраженной зернистости и вакуолей, а также отсутствие хорошо различимого ядра. Кроме того, они значительно крупнее, чем наиболее часто встречающиеся форменные элементы — сегментоядерные нейтрофилы. По размеру такие трихомонады могут быть сопоставимы с моноцитами, которые, в отличие от них, имеют четко выраженное ядро и никогда не встречаются в значительных концентрациях (несколько клеток в каждом поле зрения). При отсутствии типичных форм клеток трихомонад диагноз трихомониаза может считаться лишь предположительным и должен подтверждаться другими методами.
Окраска метиленовым синим
Готовится 1% водный раствор метиленового синего. Высушенный на воздухе мазок фиксируется в течение 3 мин 96% этиловым спиртом, высушивается, после чего на него наносили на 1 мин раствор метиленового синего. Оставшийся краситель осторожно смывается слабой струей холодной воды и мазок высушивается.
Трихомонады в препарате имеют округлую или овальную форму, с интенсивно окрашенными в синий цвет ядрами; цитоплазма клеток светло-синяя, с нежной сетчатой структурой, вакуоли — бесцветны.
Окраска по Романовскому-Гимзе
Высушенный на воздухе мазок фиксируется смесью Никифорова (абсолютный этиловый спирт и эфир в соотношении 1:1). Раствор краски Романовского (азур-эозин) перед употреблением разводится дистиллированной водой в соотношении 0,3 мл на 10 мл воды и пипеткой наносится на горизонтально расположенные препараты на 30-40 минут. Затем они быстро промываются водой и высушиваются.
В окрашенных препаратах трихомонады имеют эксцентрично расположенное овальное пурпурно-фиолетовое ядро. Цитоплазма клеток окрашивается в светло-синий цвет, вакуоли остаются бесцветными, оболочка клеток четко заметна.
Окраска по модифицированному способу Грама
Для окраски используются следующие реактивы:
- 1% раствор генцианвиолета (1 г генцианвиолета растворяется в 100 мл кипящей дистиллированной воды, полученный раствор пропускается в горячем виде через бумажный фильтр).
- Водный раствор Люголя (2 г калия йодида растворяется в 300 мл дистиллированной воды, к полученному раствору добавляется 1 г чистого йода, после чего раствор фильтруется через бумажный фильтр).
- 3,96% этиловый спирт.
- 1% водный раствор нейтрального красного (1 г нейтрального красного растворяется в 100 мл дистиллированной воды и пропускается через бумажный фильтр).
Препарат накрывается полоской фильтровальной бумаги и заливается раствором генцианвиолета на 1-2 мин, после чего бумага снимается, препарат осторожно промывается водопроводной водой и на несколько секунд заливается раствором Люголя (до почернения мазка). Остаток раствора смывается, препарат обесцвечивается в 96% этиловом спирте до тех пор, пока с тонких участков препарата перестают стекать фиолетовые струйки. После смывания спирта водой препарат сразу же докрашивается в течение 3 мин раствором нейтрального красного, затем тщательно промывается и высушивается.
При микроскопии окрашенных мазков ядра клеток Т. vaginalis окрашиваются в фиолетовый цвет, цитоплазма — в красно-оранжевый цвет разной интенсивности. Метод окраски по Граму позволяет также диагностировать гонорею. В некоторых случаях для подтверждения диагноза трихомониаза используется ПЦР и культуральный метод.
Культуральный метод
Нами Т. vaginalis выращивается на питательной среде СДС-199 М (Захаркив Ю. Ф. и др., 1998), которая имеет следующий состав:
- 100 мл солевого раствора (натрия хлорида 6,5 г, калия хлорида 0,14 г, кальция хлорида 0,12 г, натрия бикарбоната 0,2 г, 0,5 мл 0,2% раствора метиленового синего, дистиллированной воды до 1 л);
- 20 мл среды 199;
- 450 мг солянокислого цистеина;
- 30 мл сыворотки крови эмбрионов телят (без консерванта);
- 10 мл 20% раствора мальтозы;
- тиамина хлорида 5% и пиридоксина гидрохлорида 5% по 0,25 мл и аскорбиновой кислоты 5% — 0,5 мл на 100 мл среды;
- ампициллина натриевой соли 125 000 ЕД и гентамицина 40 000 ЕД на 100 мл среды.
Солевой раствор автоклавируется при 120°С в течение 30 минут, остальные ингредиенты добавляются стерильно после охлаждения среды. Антибиотики и витамины добавляются в питательную среду непосредственно перед использованием. Среда должна быть светло-зеленого цвета, прозрачной; показатель рН среды должен составлять 5,5-6,0.
Питательная среда объемом 4,5 мл помещается в стерильные пробирки и заливается слоем стерильного вазелинового масла толщиной 5 мм для создания анаэробных условий культивирования трихомонад. Посев производится пастеровской пипеткой путем помещения 0,5-1,0 мл исследуемого материала на дно пробирок.
Микроскопическое исследование производится через 48 и 96 часов после посева. При положительных результатах трихомонады дают придонный рост в виде плотного беловатого осадка, из которого пастеровской пипеткой берется материал для микроскопического исследования.
2. Определение чувствительности Trichomonas vaginalis к метронидазолу
В 1962 году S. Squires and J. A. Fadzean для определения чувствительности Т. vaginalis предложили метод серийных разведений метронидазола в жидкой питательной среде в анаэробных условиях. В качестве критерия оценки чувствительности они использовали минимальную ингибирующую концентрацию (MIC), под которой понимали наименьшую концентрацию препарата, вызывающую иммобилизацию у 100% клеток трихомонад. С помощью указанной методики авторам удалось показать, что все изученные ими штаммы Т. vaginalis, выделенные от больных трихомониазом, были чувствительны к метронидазолу в диапазоне концентраций препарата от 0,25 до 1 мкг/мл.
В 90-х гг. появились работы, свидетельствующие о возникновении и распространении штаммов Т. vaginalis, устойчивых к значительно более высоким концентрациям метронидазола: 50 мкг/мл (Borchardt К. А. et al, 1995), 32 мкг/мл (Debbia E. A. et al., 1996) и даже 250 мкг/мл (Таги Meri I. Т. et al., 1999). Тогда же было обосновано положение о том, что чувствительными к действию метронидазола в анаэробных условиях штаммами Т. vaginalis следует считать лишь те, для которых паразитоцидный эффект препарата наблюдается в концентрации более чем 15 мкг/мл (Muller M. et al., 1986, 1988; Тага Meri I. Т. et al., 1999). Процент резистентных к метронидазолу штаммов Т. vaginalis, выделенных в эти годы от больных трихомониазом, колебался от 5% (Narcisi Е. М., Secor W. Е., 1996) до 20% (Du Bouchet L. et al., 1997).
2.1. Определение чувствительности Trichomonas vaginalis к антипротозойным препаратам in vitro при использовании критерия иммобилизации трихомонад
Чувствительность штаммов Т. vaginalis к метронидазолу определяется с помощью метода серийных разведений препарата в питательной среде СДС-199 М. При использовании критерия оценки чувствительности штаммы Т. vaginalis, используемые для исследования, должны содержать не менее 90% подвижных клеток.
Среда заливается по 4,0 мл в стерильные пробирки, затем в них вносится 0,5 мл раствора, содержащего разные концентрации метронидазола (или другого антипротозойного препарата): от 0,25 до 1000 мкг/мл (1 мг/мл).
После этого в пробирки вносится 0,5 мл культуры возбудителя с заранее определенной концентрацией клеток (кл./мл). Контролем служит среда без препарата. Затем для создания анаэробных условий, необходимых для культивирования Т. vaginalis, в пробирки со средой вносится вазелиновое масло (толщина слоя — 0,5 мм). Пробирки с исследуемым материалом инкубируются в термостате при t = 37°С. Учет результатов производится через 48 и 96 часов после посева.
Чувствительность трихомонад к метронидазолу оценивается путем определения минимальной ингибирующей концентрации (MIC), вызывающей иммобилизацию всех клеток Т. vaginalis. К лекарственно-устойчивым относятся штаммы, у которых иммобилизация обнаруживается при концентрациях метронидазола (или другого антипротозойного препарата), превышающих 15 мкг/мл.
2.2. Определение чувствительности Trichomonas vaginalis к антипротозойным средствам in vitro при использовании критерия лизиса трихомонад при терапевтически эффективных концентрациях препаратов
В связи с широким распространением штаммов Т. vaginalis, устойчивых к метронидазолу, особенно среди больных хроническим мочеполовым трихомониазом, а также высокой частотой встречаемости амастиготных клеток, мы предлагаем оценивать чувствительность трихомонад к широкому спектру антипротозойных препаратов (производным 5-нитроимидазола пролонгированного типа действия (тинидазол, ниморазол, орнидазол и секнидазол), 4-аминохинолина (хлорохин, син. делагил) и нитрофурана (нифуратель, син. макмирор)) на основе оценки лизиса клеток трихомонад.
К высокоустойчивым (RIII) относятся штаммы, концентрация клеток которых в опытных пробирках с антипротозойным препаратом составляла не менее 50% по сравнению с контролем; к умеренно устойчивым (RII) — от 25 до 50%, к низкоустойчивым (RI) — менее 25%. Воздействие препарата считается оптимальным при лизисе всех клеток трихомонад; в этом случае штамм относится к чувствительным (S). По нашему мнению, именно такой подход позволяет подобрать препарат или комбинацию препаратов для назначения рациональной схемы этиотропной терапии.
2.3. Определение чувствительности Trichomonas vaginalis к метронидазолу in vivo и текущий контроль эффективности этиотропной терапии
Определение чувствительности Т. vaginalis к метронидазолу in vivo проводится с помощью метода, основанного на установлении сроков исчезновения паразитов из исследуемого материала у больных трихомониазом на фоне этиотропной терапии. Паразитологические исследования материала проводят на 1,3, 5 и 7-й дни с момента начала лечения. Лекарственно-чувствительными считаются штаммы, которые перестают выделяться от больных на 2-5-е сутки с момента начала этиотропной терапии.
Читайте также:



