Culture salmonella and shigella
Семейство Enterobacteriaceae. Род Salmonella.
Helicobacter pylori
Род Campylobacter
Род Vibrio
Род Shigella.
Род Escherichia.
Семейство Enterobacteriaceae. Род Salmonella
Формирование новых знаний. Лекционный блок.
План изучения темы:
Общая характеристика семейства энтеробактерий.
Бактерии этого семейства являются наиболее частыми возбудителями кишечных инфекций. Их объединяет ряд общих признаков. Это короткие, не образующие спор, палочки с закругленными концами, подвижные (перитрихи) или неподвижные, некоторые имеют капсулы. Аэробы или факультативные анаэробы. Характерна отрицательная окраска по Граму. Хорошо растут на обычных питательных средах с мясном экстрактом. На большинстве плотных сред энтеробактерии образуют круглые выпуклые блестящие S- (гладкие) колонии, а также часто обусловленные потерей капсулы плоские, неровные и зернистые R- (шероховатые) формы. Для них характерна ферментация глюкозы (и других углеводов) с образованием кислоты и газа. По отношению к лактозе их делят на лактоза- ферментирующие и лактоза - неферментирующие. Каталаза - положительны, восстанавливают нитраты в нитриты.
Семейство энтеробактерий включает более 20 родов, объединяющих более 100 видов бактерий, обитающих в почве, на растениях, входящих в состав микробных биоценозов кишечников животных и человека. Наибольшее значение для человека имеют рода Escherichia, Salmonella, Shigella, Yersinia, Proteus, Klebsiella и др. Для дифференциации родов используют в основном биохимические признаки, для классификации внутри родов и видов - изучение антигенной структуры (О-, Н- и К- антигенов).
О- антиген представлен липополисахаридами (ЛПС) наружной мембраны. Штаммы, лишенные О- антигена, образуют R- колонии и обычно авирулентны.
Н- антиген - термолабильные белки, имеются только у подвижных (имеющих жгутики) видов.
К- антиген - термостабильные полисахариды капсулы и наружной оболочки.
В патогенезе поражений, вызываемых энтеробактериями, имеют значение ЛПС (эндотоксин, освобождающийся при разрушении бактерий), различные энтеротоксины, факторы инвазивности и адгезии (жгутики и др.), ферменты патогенности.
Сальмонеллы - большая группа энтеробактерий, среди которых различные серотипы - возбудители брюшного тифа, паратифов А, В и С и наиболее распространенных пищевых токсикоинфекций - сальмонеллезов. По признаку патогенности для человека сальмонеллы разделяют на патогенные для человека- антропонозы (вызывают брюшной тиф и паратифы А и В) и патогенные для человека и животных - зоонозы (вызывают сальмонеллезы). Несмотря на значительные различия сальмонелл по антигенным характеристикам, биохимическим свойствам, вызываемым ими заболеваниям, по современной, но недостаточно удобной и совершенной классификации выделяют два вида - S.bongori и S.enteritica. Последний разделен на подвиды, из которых наибольшее значение имеют подвиды choleraesuis и salamae. Подвид choleraesuis включает наибольшую часть известных сероваров сальмонелл (около 1400 из примерно 2400).
Морфология. Прямые грамотрицательные палочки размером 2-4 x 0,5 мкм. Подвижны благодаря наличию перитрихиально расположенных жгутиков.
Культуральные и биохимические свойства. Факультативные анаэробы, хорошо растут на простых питательных средах. Оптимум рН- 7,2-7,4, температуры - +37. Метаболизм - окислительный и бродильный. Сальмонеллы ферментируют глюкозу и другие углеводы с образованием кислоты и газа (серотип Salmonella typhi газообразования не вызывает). Обычно не ферментируют лактозу (на средах с этим углеводом - безцветные колонии), сахарозу. Оксидаза- отрицательны, каталаза - положительны. Реакция Фогеса - Проскауэра отрицательна.
На основании биохимических (ферментативных) свойств сальмонеллы разделены на четыре группы. Характерные признаки сальмонелл - образование сероводорода, отсутствие продукции индола и аэробность. Для выделения используют дифференциально - диагностические среды (висмут - сульфит агар, среды Эндо, Плоскирева, SS агар) и среды обогащения (селенитовый бульон, желчный бульон, среда Раппопорта). S- формы образуют мелкие (от 1 до 4 мм) прозрачные колонии (на среде Эндо - розоватые, на среде Плоскирева - безцветные, на висмут - сульфит агаре - черные, с металлическим блеском). На жидких средах S- формы дают равномерное помутнение, R- формы - осадок.
Антигенная структура. Выделяют О-, Н- и К- антигены. К группе К- антигенов относят Vi- антигены (антигены вирулентности). Благодаря более поверхностному расположению (чем О- антигены) Vi- антиген может препятствовать агглютинации культур сальмонелл О- специфической сывороткой (экранирование). Для дифференциации сальмонелл применяют схему (серологическую классификацию) Кауфманна - Уайта.
В соответствии со структурой О- антигенов сальмонеллы подразделяют на О- группы (67 серогрупп), в каждую из которых входят серологические типы, отличающиеся строением Н- антигенов. Принадлежность сальмонелл к определенному серовару устанавливают при изучении антигенной структуры в соответствии со схемой Кауфманна - Уайта. Примеры: серотип S.paratyphi A относится к серогруппе А, S.paratyphi В - к серогруппе В, S.paratyphi С - к группе С, S.typhi - к серогруппе D.
1.Факторы адгезии и колонизации.
2. Способность к внутриклеточному паразитированию, препятствовать фагоцитозу, размножаться в клетках лимфоидной ткани выражены у возбудителей брюшного тифа, паратифов А и В, способствуя хроническому носительству.
4. Термолабильные и термостабильные энтеротоксины.
6. Существенное значение имеют плазмиды вирулентности и R- плазмиды.
7. Vi - антиген ингибирует действие сывороточных и фагоцитарных бактериоцидных факторов.
Основными факторами патогенности сальмонелл является их способность проникать в макрофаги и размножаться в лимфоидных образованиях собственно слизистого слоя тонкого кишечника (пейеровы бляшки, солитарные фолликулы), а также продукция эндотоксина.
Патогенез поражений. Различия клинических форм заболеваний, вызываемых сальмонеллами, зависит от вирулентности и дозы возбудителя и состояния иммунной системы организма. Обычная доза, вызывающая клинические проявления - 106 - 109 бактерий, меньшая доза достаточна при иммунодефицитах, гипохлоргидрии и других заболеваниях желудочно - кишечного тракта.
Выделяют следующие основные формы сальмонеллезной инфекции:
- генерализованную (тифоподобный и септикопиемический варианты);
- бактерионосительство (острое, хроническое, транзиторное).
Существенные патогенетические особенности инфекционного процесса, вызываемого серотипами S.typhi, S.paratyphi A,B, являются основанием для выделения тифо- паратифозных заболеваний в самостоятельную нозологическую группу. Каждой фазе патогенеза соответствует клинический период заболевания и своя тактика лабораторного обследования. Основные фазы - внедрения возбудителя (соответствует инкубационному периоду), первичной локализации возбудителя (продромальный период), бактеремии (первая неделя заболевания), вторичной локализации сальмонелл (разгар заболевания - 2-3 недели), выделительно- аллергическая (реконвалесценция - 4 неделя заболевания).
Проникшие через рот сальмонеллы попадают в эпителиальные клетки двенадцатиперсной и тонкой кишки посредством эндоцитоза. Они легко проникают в эпителиальные клетки, но не размножаются здесь, а проходят и размножаются в лимфатическом аппарате тонкого кишечника. Сальмонеллы размножаются преимущественно в lamina propria (первичная локализация), что сопровождается местной воспалительной реакцией слизистой оболочки, притоком жидкости в очаг поражения и развитием диарейного синдрома (гастроэнтерит). Энтеротоксины повышают уровень циклического аденомонофосфата (цАМФ), происходит повышение уровня гистамина и других биологически активных веществ, проницаемости сосудов. Наблюдаются водно - электролитные нарушения, развиваются гипоксия и ацидоз, которые усугубляют патологический процесс с преобладанием сосудистых растройств. Происходит разрушение части сальмонелл с выделением эндотоксина, сенсибилизация (ГЗТ) лимфатического аппарата тонкого кишечника.
Из слизистой оболочки сальмонеллы могут попадать в лимфо- и далее в кровоток, вызывая бактеремию. В большинстве случаев она носит транзиторный характер, т.к. сальмонеллы элиминируются фагоцитами.
В отличие от других сальмонелл, возбудители брюшного тифа и паратифов, проникнув в кровоток, способны выживать и размножаться в фагоцитах. Они могут размножаться в мезентериальных лимфоузлах, печени и селезенке и вызывать генерализацию процесса. После гибели фагоцитов сальмонеллы вновь поступают в кровь. При этом Vi- антиген ингибирует бактерицидные факторы.
При гибели сальмонелл освобождается эндотоксин, угнетающий деятельность центральной нервной системы (тиф - от греч. typhos - туман, спутанное сознание) и вызывающий длительную лихорадку. Действие эндотоксина может вызвать миокардит, миокардиодистрофию, инфекционно - токсический шок.
В результате бактеремии происходит генерализованное инфицирование желчного пузыря, почек, печени, костного мозга, твердых мозговых оболочек (вторичная локализация сальмонелл). Происходит вторичная инвазия эпителия кишечника, особенно пейеровых бляшек. В сенсибилизированной сальмонеллами стенке развивается аллергическое воспаление с образованием основного грозного осложнения - брюшнотифозных язв. Наблюдается длительное носительство сальмонелл в желчном пузыре с выделением возбудителя с испражнениями, пиелонефриты, кровотечения и перфорации кишечника при поражении пейеровых бляшек. Затем происходит формирование постинфекционного иммунитета, элиминация возбудителя и заживление язв или формирование бактерионосительства (в Западной Сибири часто на фоне хронического описторхоза).
Возбудителями сальмонеллезов являются другие серотипы сальмонелл, патогенные для человека и животных (S.typhimurium, S.enteritidis, S.heldelberg, S. newport и другие). В основе патогенеза сальмонеллезов - действие самого возбудителя (его взаимодействия с организмом хозяина) и эндотоксина, накапливающегося в пищевых продуктах, инфицированных сальмонеллами. В классическом варианте сальмонеллезная токсикоинфекция - гастроэнтерит. Однако при прорыве лимфатического барьера кишечника могут развиваться генерализованные и внекишечные формы сальмонеллезов (менингит, плеврит, эндокардит, артрит, абсцессы печени и селезенки, пиелонефрит и др.). Увеличение генерализованных и внекишечных форм сальмонеллезов связано с увеличением количества иммунодефицитных состояний, что имеет особое значение при ВИЧ- инфекции.
Отдельную проблему представляют госпитальные штаммы сальмонелл (чаще отдельные фаговары S.typhimurium), вызывающие вспышки внутрибольничных инфекций преимущественно среди новорожденных и ослабленных детей. Они передаются преимущественно контактно- бытовым путем от больных детей и бактерионосителей, обладают высокой инвазивной активностью, часто вызывая бактеремию и сепсис. Эпидемические штаммы характеризуются множественной лекарственной устойчивостью (R- плазмиды), высокой резистентностью, в том числе к действию высоких температур.
Эпидемиологические особенности. Характерно повсеместное распространение. Основные резервуары сальмонелл - человек (возбудители брюшного тифа и паратифа А) и различные животные (остальные серотипы сальмонелл). Основные возбудители отличаются полипатогенностью. Основные источники заражения - мясные и молочные продукты, яйца, птице- и рыбопродукты. Основные пути передачи - пищевой и водный, реже - контактный. Характерна чрезвычайная множественность резервуаров и возможных источников инфекции. Основное значение имеют сельскохозяйственные животные и птицы.
Лабораторная диагностика. Основной метод - бактериологический. Исходя из патогенеза оптимальными сроками бактериологических исследований при гастроинтестинальных формах являются первые дни, при генерализованных формах - конец второй - начало третьей недели заболевания. При исследовании различных материалов (испражнения, кровь, моча, желчь, рвотные массы, пищевые остатки) наибольшая частота положительных результатов отмечается при исследовании испражнений, для возбудителя брюшного тифа и паратифов - крови (гемокультура).
Исследования проводят по стандартной схеме. Исследуемый материал засевают на плотные дифференциально - диагностические среды - высокоселективные (висмут- сульфит агар, агар с бриллиантовым зеленым), среднеселективные (среда Плоскирева, слабощелочной агар), низкоселективные (агары Эндо и Левина) и в среды обогащения. Для посева крови используют среду Рапопорт. На висмут- сульфит агаре колонии сальмонелл приобретают черный (реже- зеленоватый) цвет.Выросшие колонии пересевают на среды для первичной (среды Ресселя) и биохимической (сероводород, мочевина, глюкоза, лактоза) идентификации. Для предварительной идентификации используют О1- сальмонеллезный фаг, к которому чувствительно до 98% сальмонелл.
Для идентификации культур в РА используют поливалентные и моновалентные О-, Н- и Vi- антисыворотки. Сначала используют поливалентные адсорбированные О- и Н- сыворотки, а затем- соответствующие моновалентные О- и Н- сыворотки. Для идентификации возбудителей брюшного тифа и паратифов используют антитела к антигену О2 (S.paratyphi A), O4 (S.paratyphi B), O9 (S.typhi). Если культура не агглютинируется О- сывороткой, ее нужно исследовать с Vi- сывороткой. Для быстрого выявления сальмонелл используют поливалентные люминесцентные сыворотки.
Серологические исследования проводят для диагностики, а также выявления и дифференциации различных форм носительства. Применяют РА (реакцию Видаля) с О- и Н- диагностикумами и РПГА с применением поливалентных эритроцитарных диагностикумов, содержащих полисахаридные антигены серогрупп А,В,С,Д и Е и Vi- антиген.
Лечение - антибиотики (левомицетин и др.). Часто выявляют резистентные к антибиотикам штаммы. Необходимо определять антибиотикорезистентность выделенных культур.
Специфическая профилактика может применяться преимущественно в отношении брюшного тифа. Применяют химическую сорбированную брюшнотифозную моновакцину. Вакцинацию в настоящее время применяют преимущественно по эпидемическим показаниям.
Не нашли то, что искали? Воспользуйтесь поиском:

Salmonella-Shigella (SS) agar is a selective and differential medium . It is used for the isolation, cultivation and differentiation of gram-negative enteric microorganisms isolated from both clinical and non-clinical specimens such as from feces, urine, and suspected food items (fresh and canned foods). This medium is not recommended for the primary isolation of Shigella as some of Shigella strains may not grow on SS agar due to relatively high level of selectivity.
Other less inhibitory media used for the isolation, cultivation and differentiation of gram-negative enteric microorganisms are:
- Desoxycholate Agar,
- MacConkey Agar,
- Eosin Methylene Blue (EMB) Agar,
- Xylose Lysine Deoxycholate (XLD Agar), and
- Hektoen Enteric Agar
Despite its name, Salmonella-Shigella (SS) agar is not suitable for isolating shigellae as it is inhibitory to most strains.
Composition of Salmonella-Shigella (SS) Agar and their function:
- Lactose: fermentable carbohydrate
- Beef extract, proteose peptone: provides the nitrogen, vitamins, and amino acids in SS Agar
- Ferric citrate: Sodium Thiosulfate is also a sulfur source, and acts with Ferric Citrate as an indicator to detect hydrogen sulfide production.
- Sodium thiosulphate &Sodium citrate: selective agents, providing an alkaline pH to inhibit Gram-positive organisms and suppress coliforms
- Bile salts : The bile salts inhibit growth of gram-positive microorganisms
- Brilliant Green/Neutral Red: pH indicator.
- Agar: Solidifying agent.
Final pH: 7.0 +/- 0.2 at 25ºC
Principle
The presence of bile salts mixture and dyes (brilliant green) inhibits the growth of gram-positive species to a varying degree. Differentiation of enteric organisms is achieved by the incorporation of lactose in the medium. Organisms which ferment lactose produce acid which, in the presence of the neutral red indicator, results in the formation of red/pink colonies. Lactose non-fermenters form colorless colonies. The latter group contains the majority of the intestinal pathogens, including Salmonella and Shigella.
The sodium thiosulfate and ferric citrate enable the detection of hydrogen sulfide production as evidenced by colonies with black centers.
Preparation of the media
- Suspend 60 g of the medium in one liter of deionized or distilled water.
- Mix well.
- Heat with frequent agitation and boil for one minute.
- Sterilization in autoclave is not necessary.
- Pour into plates
- Let the agar solidify and store in the refrigerator (avoid freezing). Prepared culture media can be kept for at least a week in refrigeration.
Note: Various commercial suppliers now supplies ready to use culture plates.
Culturing the sample -->
- Allow the plates to warm to room temperature and the agar surface to dry before inoculating.
- Heavily inoculate and streak the specimen as soon as possible after collection.
- If the specimen to be cultured is on a swab, roll the swab over a small area of the agar surface.
- Streak for isolation with a sterile loop.
- Incubate plates aerobically at 35-37°C 18-24 hours.
- Examine colonial morphology.
Results
- Lactose fermenter: If lactose fermentation occurs, the medium will turn red due to the acidic pH. e.g. Escherichia coli, Klebsiella pneumoniae gives red colonies.
- Non-Lactose fermenter: Salmonella, Shigella, and other non-lactose fermenters appear as transparent or translucent colorless colonies. Colonies of Salmonella spp. may appear with or without black centers (depending on the species isolated).
Typical colonial morphology on Salmonella-Shigella Agar is as follows:
- E.coli ……….……………………………..Slight growth, pink or red
- Enterobacter/Klebsiella …..………..Slight growth, pink
- Proteus .…………………………………..Colorless, usually with black center
- Salmonella……………………………….Colorless, usually with black center
- Shigella .…………………………………..Colorless
- Pseudomonas .………………………….Irregular, slight growth
- Gram-positive bacteria………………No growth
Precautions:
As SS Agar media contains components of animal origin (absence of transmissible pathogenic agents cannot be ruled out) so treat it as potentially infectious, and handle observing the usual universal blood precautions. Do not ingest, inhale, or allow the media to come into contact with skin.
References
- Image source: Collin college
MORPHOLOGY OF SHIGELLA DYSENTERIAE (Sh. dysenteriae)
Shape – Shigella dysenteriae is a short, rod shape (bacillus) bacterium.
Size – The size of Shigella dysenteriae is about 1–3 µm × 0.5 µm (micrometer).
Arrangement Of Cells – Shigella dysenteriae is arranged singly or in pairs.
Motility – Shigella dysenteriae is a non-motile bacterium. Some strains of E. coli are non-motile.
Flagella – Shigella dysenteriae is a non-flagellated bacterium.
Spores – The Shigella dysenteriae is a non–sporing bacterium.
Capsule – Sh. dysenteriae is a Non-capsulated bacterium.
Gram Staining Reaction – Shigella dysenteriae is a Gram -ve (Negative) bacterium.

MORPHOLOGY OF SHIGELLA DYSENTERIAE
CULTURE REQUIREMENTS OF SHIGELLA DYSENTERIAE (Sh. dysenteriae)
⇒ Special requirements – Shigella dysenteriae have no complex nutritional requirements and readily grow in ordinary media like Nutrient Agar medium (NAM). Commonly the MacConkey Agar medium & XLD medium is used for the cultivation of Shigella dysenteriae in the Laboratory.
⇒ Optimum temperature – Shigella dysenteriae ranges from 10–40°C but the optimum temperature for most of the strains is 37°C and usually cultivated at this temperature in laboratories.
⇒ Optimum pH – Sh. dysenteriae cannot survive at acidic pH below 4.5, the maximum growth observed at 7.0 i.e. neutral pH. Also, the pH requirement varies as per the strain of Escherichia col.
⇒ Oxygen requirements – Shigella dysenteriae (Sh. dysenteriae) is an aerobic bacterium i.e. grow best in the presence of oxygen and it is also a Facultative anaerobic organism i.e. can grow in a low oxygen environment.
⇒ There are various culture media used for the cultivation of Shigella dysenteriae (Sh. dysenteriae) in the laboratory and most commonly the MacConkey Agar medium, XLD medium and Selenite F broth medium is used which may vary as per the SOPs of the laboratory, the other media are as follows –
- Columbia Horse Blood Agar medium.
- Sheep Blood Agar medium.
- Eosin Methylene blue Agar (EMB) medium
- Deoxycholate Citrate Agar (DCA) medium (Selective medium for Salmonella & Shigella).
- Salmonella – Shigella Agar medium (Selective medium for Salmonella & Shigella).
- Xylose Lysine Deoxycholate (XLD) medium (Selective medium for Salmonella & Shigella).
- Selenite F Broth (Selective medium for Salmonella & Shigella).
- The Liquid medium (Trypticase Soy Broth, Nutrient broth, etc.)
⇒ The Deoxycholate Citrate Agar (DCA) medium is the Selective medium for Shigella dysenteriae & other Shigella Species as well as Salmonella Spp. contains Deoxycholate and Citrate salts in a concentration that inhibits the growth of many gram-positive bacteria & most of the intestinal flora and supports the growth of Shigella dysenteriae.
⇒ Similarly, the Salmonella – Shigella Agar medium is also a selective medium for Shigella dysenteriae & other species of Shigella as well as Salmonella spp. contains 4 key components that make it selective for Salmonella & Shigella i.e. Bile salts, Brilliant green dye, Sodium citrate & Sodium thiosulfate which selectively inhibit the growth of many gram-positive bacteria & coliform bacteria and supports the growth of Salmonella & Shigella sp.
CULTURE CHARACTERISTICS OF SHIGELLA DYSENTERIAE (Sh. dysenteriae)
| Cultural Characteristics | Nutrient Agar Medium (NAM) | MacConkey Agar medium | Blood Agar Medium | Xylose Lysine Deoxycholate Agar (XLD) Medium |
|---|---|---|---|---|
| Shape | Circular | Circular | Circular | Circular |
| Size | 1-2 mm | 1-2 mm | 1-3 mm | 2-3 mm |
| Elevation | Convex | Convex | Convex | Convex |
| Surface | Smooth | Smooth | Smooth | Smooth |
| Color | Greyish white | Colorless | Greyish white | Red without black center |
| Structure | Translucent | Transparent | Translucent | Translucent –Opaque |
| Hemolysis | ----- | ----- | γ-Hemolysis (Non - Hemolytic) | ----- |
In liquid culture media like Trypticase soy broth or Nutrient broth, the growth of the bacterium occurs as turbidity in the broth medium but the chances of contamination are high especially when the isolation is carried out from Feces specimen, commonly the Selenite F broth and Tetrathionate broth is used for the isolation of Shigella dysenteriae.
In Blood Agar medium, the Shigella dysenteriae shows gamma hemolysis i.e. no hemolysis occurs on blood agar medium, the colonies are grayish-white and grows well.
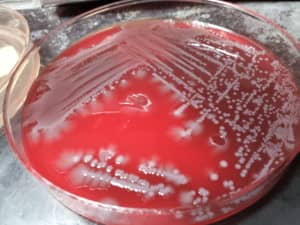
CULTURE OF SHIGELLA DYSENTERIAE ON BLOOD AGAR MEDIUM
In MacConkey Agar medium, the colonies of Shigella dysenteriae are colorless due to the lack of lactose fermentation which is of great importance in differentiating Sh. dysenteriae from other Bacteria present in the specimen, especially from Gram-positive bacteria and Escherichia coli which is lactose fermentor and gives Pink color colonies on MacConkey agar medium.
In Eosin Methylene Blue Agar (EMB) medium, the colonies of Shigella dysenteriae are colorless due to lack of lactose fermentation.
In the Deoxycholate Citrate Agar medium, the colonies of Shigella dysenteriae are colorless due to Non-Lactose Fermentation (NLF).
In Salmonella Shigella Agar medium, the colonies of Shigella dysenteriae are Colorless. Hydrogen sulfide is not produced by Shigella dysenteriae.
CULTURE OF SHIGELLA DYSENTERIAE ON SALMONELLA SHIGELLA AGAR MEDIUM (COLORLESS COLONIES)
Selenite F broth, the enrichment medium for Shigella & Salmonella species, commonly used for the isolation of the organism from the fecal sample where the density of Shigella dysenteriae may be too low in early stages of infection. The fecal specimen inoculated in Selenite F broth are incubated for 6-12 hours generally (not more than 24 hours) and then subcultured on XLD medium or any other selective medium.
CULTURE OF SHIGELLA DYSENTERIAE ON XLD MEDIUM
That’s all about the Morphology and Culture Characteristics of Shigella dysenteriae
Further Reading:
Salmonella and Shigella
Some Salmonella infections can bring dizziness to your elderly person. Dizziness is another plague of the elderly, keeping them from going shopping, getting to church and even from getting around their own homes. Drugs such as Antivert™ are given but only take the edge off the problem. Feeling dizzy can make your loved one home bound and stuck to a walker for every move.
Salmonellas, along with Shigellas, produce very toxic substances that cause dizziness. There are three common Salmonella varieties: Salmonella enteriditis, Salmonella paratyphi, and Salmonella typhimurium (386, 380, 354 KHz). Kill Salmonellas daily for a month by taking Lugol’s iodine (6 drops in a half cup water, after meals and bedtime, see Recipes). Unfortunately, this will not kill Shigellas; follow the Bowel Program (page 546) to get them.
During this time set up a system of sterilizing all dairy products (see Milk, page 425) since this is the source of reinfection. Set up a system of rinsing fingers (and fingernails) in 10% grain alcohol in the bathroom. Deli food and restaurant salads carry Salmonellas and Shigellas, too. Kill them, routinely, after eating such food due to necessity. A warm stomach full of food at a neutral pH is just the right culture condition for these bacteria. It’s like putting yeast into a bowl of warm water, flour and sugar. In half an hour it is overflowing with growth.
once Salmonella is entrenched in an organ it is difficult to eliminate. Only an electric zapper can kill them all (in an organ, not the bowel). If your body has the right conditions (like a low acid stomach) to let them grow you dare not swallow another one! Shigellas arrive with dairy foods, too, but prefer the lower intestine as their headquarters. Indigestion that starts right after eating is probably due to Salmonellas. If your indigestion comes in the night, this suggests Shigellas, since they’ve had time to reach their favorite place further down.
Campylobacter and E. coli, other digestive bacteria, are sometimes the culprits. The Bowel Program is effective against these also. Besides getting digestive improvement you get mental improvement, less depression, less dizziness, less irritability after clearing these up. Remember that eating bacteria and killing them later will not solve the problem. Stopping eating them will.
Digestion problems that remain after eliminating bacteria can be diagnosed in a rational way. Ask these questions:
• Is the stool orangish-yellow, or very pale, instead of greenish brown? If so, bile isn’t getting delivered to the small intestine from the liver.
• Is there abdominal pain? (More about this on page 97). It may be due to Ascaris, flukes, or other parasites.
• Is there constipation? This will let wastes accumulate, all the longer for bacteria to thrive on them.
• Is there bloating? This is due to gas made by bacteria.
• Does the stool float? If so, it must be lighter than water and contain fat or a great deal of undigested material.
Bile is necessary for digestion. Absorption of fat and calcium depends on bile mixing with the food. When fat isn’t absorbed, it stays in the intestine. Fat is lighter than water; it makes the stool float. Feces should not float. When the stool floats you can assume that calcium isn’t being absorbed either, leaving the blood in a deficit which will be taken from the bones.
If the stool floats or is orangish in color prepare your elderly person for a liver cleanse (page 552) to clear a bile duct of obstruction. They get quite fond of these cleanses and will ask to have one. Liver cleanses are completely safe, even for persons in their 80’s. One of the stones pictured on page 554 came from a woman age 97. The general rules apply to the extremely elderly: kill all parasites first by zapper if possible, otherwise by herbal parasite killing. Do a kidney cleanse (page 549) first, using half a dose instead of the regular dose, for three to six weeks. Attend your loved one in person for the liver cleanse, have a commode at bedside, protect bedding from accident: use paper underwear if necessary. share the joy of getting gallstones out painlessly with your loved one; let them see and count them if they wish before you flush them (use a flashlight).
Be extra careful with the skin cleansing. Hot water soothes and heals. Use starch skin soother to dispense onto the wet paper towel, besides borax solution and alcohol. Don’t use ordinary soap. The starch skin softener gives the smoothness of soap, and prevents the pain of friction. An elderly person may have no diarrhea at all with the Epsom salts! Evidently the body absorbs all the magnesium so eagerly, none is left in the intestine to absorb water and create diarrhea. It is especially important though to rehydrate your elderly person after a diarrhea. This time they do not balk at water consumption. The liver cleanse, it seems, gives them new thirst as well as new appetite. But it doesn’t last long. As the stones from the far corners of the liver move forward, they compact into larger stones and plug the ducts again. Their previous symptoms return. Try to give a cleanse once a month until the dark color of the stool returns and it no longer floats.
The benefits of a liver cleanse will last longer if valerian herb is taken the day after the cleanse and from then forward. It may be preventing spasm of the bile ducts. Use 2 oz. of the herb (cut) in 3 cups water. Simmer for 5-10 minutes, let settle or strain. Add honey to sweeten. Give a few tbs. every 4 hours (or 6 capsules) for several days followed by a daily dose at bedtime.
If constipation is a problem, use an herbal product rather than a drug until you have removed the cause. Cascara sagrada (half dosage) or prunes work for many people. Adding roughage to the diet is a good solution but often doesn’t work. If you try bran, you should add vitamin С and boil it, first, because it is very moldy. But even eating tree branches for supper won’t move a bowel that has the wrong bacteria in it.
Bacteria are part of the cause; and part of the result! Constipation increases the bacteria level which causes further constipation! You may solve the constipation problem immediately by zapping. Even though this kills some “good” with some “bad” bacteria, no harm is done. The stool is recolonized in one to two days.
Читайте также:


