Исследование воздуха на стафилококки
Микробиологическое исследование воздуха проводят в целях определения общего количества микроорганизмов (микробного числа) и количества санитарно-показательных стрептококков (иногда и патогенных стафилококков). На предприятиях мясной и молочной промышленности в отдельных производственных помещениях исследуют воздух на содержание в нем спор плесневых грибов и дрожжей. Для этого используют различные питательные среды. Так, общее количество микроорганизмов в воздухе определяют при посеве на МПА; санитарно-показательных микробов -- на кровяной агар, среды Гарро и Туржецкого; патогенных стафилококков -- на желточно-солевой или кровяно-солевой агар; спор плесеней и дрожжей -- на сусло-агар или среду Сабуро; протеолитических бактерий -- на МПЖ или молочный агар.
Воздух является средой, в которой микроорганизмы не способны размножаться, что обусловлено отсутствием в воздухе питательных веществ, недостатком влаги, губительным действием солнечных лучей. Жизнеспособность микроорганизмов в воздухе обеспечивается нахождением их в частицах воды, слизи, пыли, кусочках почвы.
Микрофлору воздуха условно разделяют на постоянную, или резидентную (автохтонную), и транзиторную, или временную (аллохтонную).
К представителям резидентной (автохтонной) микрофлоры, которая в основном формируется за счет микроорганизмов почвы, относятся пигментообразующие кокки (М. roseus, М. flavus‚ S. flava, S. alba), спорообразующие бациллы (В. subtilis, В. micoides, B. mesentericus), актиномиценты (Actinomyces spp.), грибы (Penicillium spp.,Aspergillus). дрожжеподобные грибы рода Candida.
Транзиторная (аллохтонная) микрофлора воздуха формируется преимущественно за счет микроорганизмов почвы, а также за счет видов, поступающих с поверхности водоемов и из организма людей и животных. При этом каждый человек или животное при обычном дыхании, разговоре, кашле, выделяют так называемый аэрозоль, который представляет собой коллоидную систему, состоящую из воздуха, капелек жидкости или частиц твердого вещества, включающих большое количество микроорганизмов.
Воздух не является благоприятной средой для развития аллохтонных микроорганизмов, они могут сохранять в воздухе жизнеспособность лишь временно (одни виды более, другие менее продолжительно). Многие виды отмирают сравнительно быстро под влиянием высушивания и солнечной радиации.
Возможно также попадание микробов в воздух со слущивающимся эпидермисом кожных покровов, с пылью загрязненного постельного белья и зараженной почвы.
Контаминация воздуха закрытых помещений патогенными микроорганизмами происходит в основном воздушно-капельным путем -- при разговоре, кашле, чихании от больных людей или носителей возбудителей инфекционных болезней, поражающих верхние дыхательные пути.
Микрофлора воздуха меняется в зависимости от климата, времени года, экологического состояния местности (наличие промышленных предприятий, уровня развития промышленного и сельскохозяйственного производства, транспортной инфраструктуры и т. д.). Большое значение для очистки воздуха имеют зеленые насаждения.
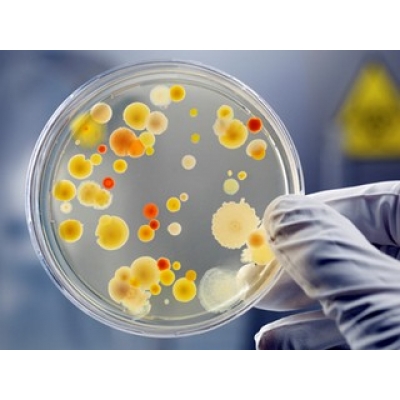
В составе микрофлоры воздуха преобладают различные виды кокков, споры бацилл, грибов, дрожжи. Могут встречаться патогенные и токсигенные микроорганизмы (стафилококки, стрептококки, туберкулезные палочки и т. д.).
Их количество в воздухе рабочих и жилых помещений зависит от экологического состояния. Скопление людей, плохая вентиляция, недостаточная уборка способствуют увеличению количества микроорганизмов в воздухе.
Экологическая оценка воздуха помещений осуществляется по двум показателям: общему количеству микроорганизмов и количеству санитарно-показательных микроорганизмов в 1 м3 воздуха.
Санитарно-показательными микроорганизмами служат гемолитические стрептококки и стафилококки. Они являются постоянными обитателями верхних дыхательных путей, слизистой носа и ротовой полости человека. Ориентировочно воздух производственных помещений должен содержать от 100 до 500 бактерий в 1 м3. В жилых помещениях -- до 1500 шт., и гемолитических стрептококков -- до 16 шт. в 1 м3. Загрязненным воздух жилых помещений считается при наличии (в 1 м3) 2500 всех бактерий и 38 стрептококков. Воздух холодильных камер исследуется также на загрязненность плесенями.
При оценке экологического состояния воздуха закрытых помещений в зависимости от задач исследования определяется:
- -- общее микробное число (ОМЧ) (КОЕ/м3);
- -- количество золотистого стафилококка (Staphylococcus aureus) (КОЕ/м3);
- -- количество плесневых и дрожжевых грибов (КОЕ/дм3).
Воздушная среда, как объект санитарно-микробиологического исследования имеет целый ряд специфических особенностей. Как правило, среди них в первую очередь выделяют: отсутствие питательных веществ и, как следствие, невозможность размножения микроорганизмов;
- - кратковременное нахождение микроорганизмов в воздушной фазе и их самопроизвольная седиментация;
- - невысокие концентрации микроорганизмов в воздухе
- - относительно небольшое число видов микроорганизмов, обнаруживаемых в воздухе.
- · скорость оседания (седиментации) - для частиц размером от 10 до 100 мкм составляет 0,03 - 0,3 м/сек. Частицы указанного размера оседают на поверхности за 5-20 минут. Частицы с размером 5 мкм и менее формируют практически не седиментирующий аэрозоль постоянно взвешенных в воздухе частиц;
- · проникающая способность частиц - наиболее опасны частицы с размером от 0,05 до 5 мкм, так как они задерживаются в бронхиолах и альвеолах. Именно эта фракция пылевых частиц принимается во внимание в современной классификации чистых помещений согласно ГОСТ Р 50766 - 95. Частицы с размером от 10 мкм и более задерживаются в верхних отделах дыхательных путей и выводятся из них.[2]
Опасность микробного аэрозоля для здоровья людей обусловлено не только существованием аэрозольного механизма передачи при ряде инфекционных заболеваний. Микробный аэрозоль может также явиться причиной развития аллергии, а также интоксикаций (отравлений), связанных с ингаляцией эндотоксинов грамотрицательных бактерий, грамположительных бактерий и микотоксинов плесневых грибов. Кроме того, присутствие в воздухе микробных аэрозолей нежелательно при осуществлении ряда технологических процессов. [3]

Бесплатная горячая линия юридической помощи

- Главная
- ПРИКАЗ Минздрава СССР от 31.07.78 N 720 "ОБ УЛУЧШЕНИИ МЕДИЦИНСКОЙ ПОМОЩИ БОЛЬНЫМ С ГНОЙНЫМИ ХИРУРГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ И УСИЛЕНИИ МЕРОПРИЯТИЙ ПО БОРЬБЕ С ВНУТРИБОЛЬНИЧНОЙ ИНФЕКЦИЕЙ"

5. Схема бактериологического исследования на стафилококк
5.1. Первый день. Посев на элективные среды (желточно-солевой, молочно-солевой или молочно-желточно-солевой агар). Засеянные среды выдерживают в термостате при 37 град.С в течение 2 суток, либо одни сутки в термостате и дополнительно 24 часа на свету при комнатной температуре.
5.2. Второй-третий день. Просмотр чашек, фиксация в журнале характера и массивности роста. На вышеуказанных средах стафилококк растет в виде круглых, блестящих, маслянистых, выпуклых, пигментированных колоний. На средах, содержащих желток St.aureus выделенный от человека, в 60-70% случаев образует радужный венчик вокруг колонии (положительная лецитовителлазная реакция). Стафилококки животного происхождения дают положительную лецитовителлазную реакцию в 5-10% случаев.
5.3. Отвивка на скошенный агар для дальнейшего исследования не менее 2-х колоний, подозрительных на стафилококк. Для исследования отвиваются прежде всего колонии, дающие положительную лецитовителлазную реакцию. При отсутствии на чашках таких колоний дальнейшему исследованию подвергают пигментированные колонии, схожие по морфологии со стафилококком. При одновременном наличии на чашах колоний стафилококка, отличающихся по пигменту, следует отвивать не менее двух колоний различного вида; пробирки с посевом помещают в термостат при 37 град.С на 18-20 часов.
5.4. Четвертый день. После суточной инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие плазмокоагулирующей активности. Следует отметить, что характер роста культуры на скошенном агаре в ряде случаев дает возможность "предвидеть" принадлежность ее к виду St.aureus или St.epidermidis. Первые, как правило, дают обильный равномерный, сочный рост, вторые - очень скудный и неравномерный рост по ходу посева. Окраска по Граму проводится общепринятым методом. Под микроскопом окрашенные по Граму стафилококки имеют вид фиолетово - синих кокков, располагающихся гроздьями или небольшими кучками ("кружево"). Плазмокоагулирующая активность проверяется в реакции коагуляции плазмы (РКП).
5.5. С учетом результатов РКП и лецитовителлазной активности в 70-75% случаев, на четвертый день исследования может быть подтверждена принадлежность выделенного штамма к виду St.aureus и выдан соответствующий ответ. Возможные варианты сочетаний результатов определения плазмокоагулирующей и лецитовителлазной активности представлены на схеме 1.
5.6. Если культура обладает плазмокоагулирующей и лецитовителлазной активностью, выдается ответ о выделении St. aureus без проведения дополнительных исследований. Если культура обладает только плазмокоагулирующей или только лецитовителлазной активностью, то для окончательного ответа требуется определение других признаков патогенности (ферментация маннита в анаэробных условиях - АФМ или ДНКавной активности). В этих случаях ответ выдается в зависимости от результатов полученных при определении названных признаков.
5.7. Если культура не обладает ни плазмокоагулирующей, ни лецитовителлазной активностью и выделяется из слизи верхних дыхательных путей практически здоровых лиц, то может быть выдан ответ о выделении St. epidermidis без проведения дополнительных исследований. Однако, следует помнить, что в 1-2% случаев речь может идти о выделении культуры St. aureus, лишенной основного видового признака - способности коагулировать плазму.
5.8. Определение антибиограммы проводится только после выделения чистой культуры по показаниям (выбор способа лечения и т.д.). Выделенные культуры St. aureus подлежат фаготипированию. В случае необходимости на 4-й день исследования может быть поставлена реакция определения ДНКазной активности или анаэробной ферментации маннита.
5.9. Пятый день. Учет результатов фаготипирования, определения чувствительности к антибиотикам, ДНКазной активности. Окончательная выдача ответа.
Санитарно-микробиологическое исследование воздуха можно разделить на 4 этапа:
- отбор проб;
- обработка, транспортировка, хранение проб, получение концентрата микроорганизмов (если необходимо);
- бактериологический посев, культивирование микроорганизмов;
- идентификация выделенной культуры.
Отбор проб, как и при исследовании любого объекта, является наиболее ответственным. Правильное взятие проб гарантирует точность исследования. В закрытых помещениях точки отбора проб устанавливаются из расчета на каждые 20 м2 площади - одна проба воздуха, по типу конверта: 4 точки по углам комнаты (на расстоянии 0,5 м от стен) и 5-я точка - в центре. Пробы воздуха забираются на высоте 1,6—1,8 м от пола - на уровне дыхания в жилых помещениях. Пробы необходимо отбирать днем (в период активной деятельности человека), после влажной уборки и проветривания помещения. Атмосферный воздух исследуют в жилой зоне на уровне 0,5—2 м от земли вблизи источников загрязнения, а также в зеленых зонах (парки, сады и т.д.) для оценки их влияния на микрофлору воздуха. Для отбора воздуха на уровне 0,5-2м от земли используют специальные штативы.
Следует обратить внимание на то, что при отборе проб воздуха во многих случаях происходит посев его на питательную среду.
Седиментационный - наиболее старый метод, широко распространен благодаря простоте и доступности, однако является неточным. Метод предложен Р. Кохом и заключается в способности микроорганизмов под действием силы тяжести и под влиянием движения воздуха (вместе с частицами пыли и капельками аэрозоля) оседать на поверхность питательной среды в открытые чашки Петри. Чашки устанавливаются в точках отбора на горизонтальной поверхности. При определении общей микробной обсемененности чашки с мясопептонным агаром оставляют открытыми на 5—10 мин или дольше в зависимости от степени предполагаемого бактериального загрязнения. Для выявления санитарно-показательных микробов применяют среду Гарро или Туржецкого (для обнаружения стрептококков), молочно-солевой или желточно-солевой агар (для определения стафилококков), суслоагар или среду Сабуро (для выявления дрожжей и грибов). При определении санитарно- показательных микроорганизмов чашки оставляют открытыми в течение 40—60 мин.
По окончании экспозиции все чашки закрывают, помещают в анаэростат или термостат для культивирования в оптимальной для развития выделяемого микроорганизма среде, затем (если этого требуют исследования) на 48 ч оставляют при комнатной температуре для образования пигмента пигментообразующими микроорганизмами.
Седиментационный метод имеет ряд недостатков: на поверхность среды оседают только грубодисперсные фракции аэрозоля; нередко колонии образуются не из единичной клетки, а из скопления микробов; на применяемых питательных средах вырастает только часть воздушной микрофлоры. К тому же этот метод совершенно непригоден при исследовании бактериальной загрязненности атмосферного воздуха.
Более совершенными методами являются аспирационные, основанные на принудительном осаждении микроорганизмов из воздуха на поверхность плотной питательной среды или в улавливающую жидкость (мясо-пептонный бульон, буферный раствор, изотонический раствор хлорида натрия и др.). В практике санитарной службы при аспирационном взятии проб используются аппарат Кротова, пробоотборное устройство ПУ-1Б, бактериоуловитель Речменского, прибор для отбора проб воздуха (ПОВ-1), пробоотборник аэрозольный бактериологический (ПАБ-1), бактериально-вирусный электропреципитатор (БВЭП-1), прибор Киктенко, приборы Андерсена, Дьяконова, МБ и др. Для исследования атмосферы могут быть использованы и мембранные фильтры № 4, через которые воздух просасывается с помощью аппарата Зейтца. Большое разнообразие приборов свидетельствует об отсутствии универсального аппарата и о большей или меньшей степени их несовершенства.
Пробоотборное устройство ПУ-1Б. В настоящее время этот прибор широко применяется при исследовании воздуха закрытых помещений и имеется в лабораториях СЭС.
Принцип работы ПУ-1Б основан на том, что воздух, просасываемый через отверстия в крышке аппарата, ударяется о поверхность питательной среды, при этом частицы пыли и аэрозоля прилипают к среде, а вместе с ними и микроорганизмы, находящиеся в воздухе. Чашку Петри с тонким слоем среды укрепляют на вращающемся столике аппарата, что обеспечивает равномерное распределение бактерий на ее поверхности. Работает аппарат от электросети. После отбора пробы с определенной экспозицией чашку вынимают, закрывают крышкой и помещают на 48 ч в термостат. Обычно отбор проб проводят со скоростью 200 л/мин в течение 0,5-5 мин. Таким образом, определяется флора в 100-1000 л воздуха.
Приемник перед забором пробы воздуха заполняется 3—5 мл улавливающей жидкости (водой, мясопептонным бульоном, изотоническим раствором хлорида натрия).
Пробоотборник аэрозольный бактериологический (ПАБ-1) (в настоящее время снят с производства). Механизм действия ПАБ-1 основан на принципе электростатического осаждения частиц аэрозоля (а следовательно, и микроорганизмов) из воздуха при прохождении его через прибор, в котором эти частицы получают электрический заряд и осаждаются на электродах с противоположным знаком. На электродах для улавливания аэрозолей помещают в горизонтальном положении металлические поддоны с твердыми средами в чашках Петри или жидкой питательной средой (15—20 мл). Прибор переносной с большой производительностью 150-250 л/мин, т.е. за 1 ч можно отобрать 5—6 м3 воздуха. Его рекомендуют применять для исследования больших объемов воздуха при обнаружении условно-патогенных и патогенных микроорганизмов, например, при выявлении в воздухе палат больниц возбудителей внутрибольничных инфекций (Pseudomonas aeruginosa. Staph, aureus и др.), определении сальмонелл и эшерихий в атмосферном воздухе в местах дождевания при орошении земледельческих полей сточными водами.
При использовании любого из перечисленных приборов получаемые результаты являются приблизительными, однако они дают более правильную оценку обсемененности воздуха в сравнении с седиментационным методом. Поскольку и отбор и санитарно-микробиологические исследования воздуха не регламентированы ГОСТ, то можно использовать любой прибор для оценки бактериальной загрязненности воздуха. Во многих случаях отбор проб совмещен с этапом посева.
Для снижения численности микроорганизмов в воздухе закрытых помещений применяют следующие средства:
- химические - обработка озоном, двуокисью азота, распыление молочной кислоты,
- механические - пропускание воздуха через специальные фильтры,
- физические - ультрафиолетовое облучение.
Определение общей численности сапрофитных бактерий
Общая бактериальная обсемененность воздуха или микробное число - это суммарное количество микроорганизмов, содержащихся в 1 м3 воздуха. Для определения общего количества бактерий в воздухе закрытых помещений забирают две пробы (объемом по 100 л каждая) на чашки Петри с МПА при помощи Пу-1Б, либо седиментационным методом, расставляя чашки с питательной средой по принципу конверта. Чашки с посевом помещают в термостат на сутки, а затем на 48 ч оставляют при комнатной температуре. Экспозиция чашек с посевами на свету дает возможность подсчитать раздельно количество пигментных колоний (желтых, белых, розовых, черных, оранжевых и др.), количество спорообразующих бацилл, грибов и актиномицетов.
Подсчитывают количество колоний на обеих чашках, вычисляют среднее арифметическое и делают перерасчет на количество микроорганизмов в 1 м3 воздуха. Бациллы образуют колонии, как правило, крупные, круглые, с неровными краями, сухие, морщинистые. Колонии грибов с пушистым налетом (Мисог и Aspergillus) и плотные - зеленоватые или сероватые (Penicillium). Актиномицеты образуют беловатые колонии, вросшие в агар. Количество каждой группы колоний (пигментных, беспигментных, плесеней, бацилл, актиномицетов) выражают в процентах по отношению к общему числу.
При определении микробного числа методом седиментации по Коху подсчитываются колонии, выросшие на МПА в чашках Петри, и расчет ведется по B.Л. Омелянскому. Если придерживаться этой методики, на чашку площадью 100 см2 за 5 мин оседает такое количество микробов, которое содержится в 10 л воздуха.
Стафилококки являются одним из наиболее распространенных микроорганизмов в воздухе закрытых помещений, что обусловливается значительной устойчивостью их к различным факторам окружающей среды. Обнаружение патогенных стафилококков в воздухе закрытых помещений имеет санитарно-показательное значение и свидетельствует об эпидемическом неблагополучии. Отбор проб воздуха проводится в количестве 250 л на 2—3 чашки с молочно-желточно-солевым агаром (или молочно- солевым, желточно-солевым) и на чашку с кровяным агаром. Чашки инкубируют при температуре 37°С в течение 48 ч. Изучают культуральные признаки всех видов колоний, из подозрительных готовят мазки и окрашивают по Граму.
Помимо качественной характеристики отдельных колоний, подсчитывают количество выросших колоний стафилококков в 1 м3 воздуха.
Стрептококки также являются санитарно-показательными микроорганизмами воздуха, в который они попадают от больных скарлатиной, тонзиллитами, ангиной и носителей стрептококков. Отбор проб воздуха при исследовании на наличие а- и р-гемолитических стрептококков производят на чашки с кровяным агаром, средами Гарро и Туржецкого. Забирают 200—250 л воздуха, чашки с посевами выдерживают в термостате 18—24 ч и затем еще 48 ч при комнатной температуре (после предварительного просмотра и учета). Идентификацию проводят по общепринятой методике.
Определение патогенных микроорганизмов в воздухе
Ввиду малой концентрации патогенных микроорганизмов в воздухе закрытых помещений, их выделение является достаточно трудной задачей.
При расшифровке внутрибольничных инфекций определяют в воздухе присутствие стафилококков, стрептококков, синегнойной палочки, сальмонелл, протеев и др. Отбор проб воздуха производят в объеме не менее 1000 л. Посев производят на соответствующие элективные среды. Если используется жидкая среда как улавливающая жидкость, то пробирку с жидкостью помещают в термостат на сутки для подращивания (получение накопительной культуры), а затем высевают на элективную среду.
При исследовании воздуха на наличие микобактерий туберкулеза отбор проб производят в объеме 250—500 л воздуха. В качестве улавливающей жидкости берут среду Школьниковой, которую затем обрабатывают 3% раствором серной кислоты (для подавления сопутствующей микрофлоры) и центрифугируют. Осадок засевают в пробирки на одну из яичных сред, чаще среду Левенштейна - Иенсена. Инкубируют при 37°С до 3 мес. Отсутствие роста в течение 3 мес дает возможность выдать отрицательный ответ. Пробирки первый раз просматривают через 3 нед, затем каждые 10 дней. Выделенную культуру идентифицируют, определяют ее вирулентность (заражением морских свинок - биопроба) и при необходимости определяют устойчивость к лекарственным препаратам.
При определении в воздухе коринебактерий дифтерии для посева воздуха используют чашки со средой Клауберга.
В последние годы определяют в атмосферном воздухе в районах дождевания земледельческих полей, при орошении их сточными водами, сальмонеллы в случае появления заболевания среди персонала станций орошения или населения. Отбор проб производят с помощью аспиратора ПУ-1Б на чашки с висмут-сульфитным агаром. Исследуют не менее 200 л воздуха. Выделенная культура идентифицируется по обычной схеме определения сальмонелл.
В связи с развитием микробиологической промышленности возникла необходимость исследования воздуха с целью обнаружения грибов-продуцентов при производстве антибиотиков, ферментных препаратов, при изготовлении кормовых дрожжей и др. Для исследования воздуха на плесневые грибы рода Candida отбор проб производят в объеме от 100 до 1000 л на чашки со средой Чапека, суслоагаром (для обнаружения плесневых грибов) и с метабисульфит-натрий- агаром (МБС-агар) с добавлением антибиотиков (для обнаружения дрожжеподобных грибов рода Candida). Чашки инкубируют в термостате при температуре 26—27°С в течение 3—4 сут (для плесневых грибов) и при 35—37°С в течение 2—3 сут (для грибов - продуцентов и дрожжеподобных рода Candida). Идентификация проводится с учетом особенностей плодоносящих гиф и характера мицелия. Считают, что концентрация дрожжеподобных грибов в количестве 500—600 клеток в 1 м3 воздуха рабочего помещения является предельной, превышение ее ведет к развитию аллергических реакций у рабочих.
1.1. Настоящие методические указания предназначены для специалистов органов, осуществляющих функции по контролю и надзору в сфере обеспечения санитарно-эпидемиологического благополучия населения, организаций и учреждений Роспотребнадзора, лечебно-профилактических и других организаций независимо от организационно-правовой формы и формы собственности.
1.2. Методические указания устанавливают методы санитарно-бактериологических исследований в учреждениях здравоохранения, других организациях лечебного профиля. Объектами санитарно-бактериологических исследований, на которые распространяются настоящие методические указания, являются:
· объекты окружающей среды, в т.ч. изделия медицинского назначения, зонды, катетеры, бужи, резиновые перчатки и другие изделия из резин и металлов, шовный материал, подготовленный к использованию, и прочее, спецодежда;
1.3. Номенклатура, кратность и объем санитарно-бактериологических исследований устанавливается действующими нормативно-методическими документами с учетом санитарно-эпидемиологической обстановки.
1.4. Для санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности изделий медицинского назначения в учреждениях здравоохранения и других организациях лечебного профиля могут быть использованы питательные среды лабораторного и промышленного приготовления, расходные материалы, биологические препараты, указанные в настоящих методических указаниях. Применение других коммерческих питательных сред (расходных материалов, биологических препаратов) допускается при наличии методик исследования, утвержденных и разрешенных к применению в установленном порядке.
3.1. Исследования бактериальной обсемененности воздушной среды
3.1.1. Исследования бактериальной обсемененности воздушной среды проводят в помещениях лечебных организаций в зависимости от их функционального назначения на санитарно-микробиологические показатели:
общее количество микроорганизмов в 1 м 3 воздуха (КОЕ/м 3 );
количество колоний S . aureus в 1 м 3 воздуха (КОЕ/м 3 );
количество плесневых и дрожжевых грибов в 1 м 3 воздуха.
3.1.2. Пробы воздуха отбирают аспирационным методом с помощью аппаратов и устройств, разрешенных к применению в установленном порядке.
Количество пропущенного воздуха должно составлять 100 дм 3 для определения общего количества микроорганизмов, дрожжевых и плесневых грибов и 250 дм 3 для определения S. aureus . Исследование воздуха седиментационным методом не допускается.
3.1.3. Для определения общего количества микроорганизмов в 1 м 3 воздуха забор проб проводят на питательный агар типа МПА, СПА, ГРМ-агар и другие, приготовленные согласно инструкций по применению. Посевы инкубируют при температуре 37 °С в течение (48 ± 2) ч, подсчитывают количество выросших колоний и производят перерасчет на 1 м 3 воздуха. При наличии роста колоний дрожжевых и плесневых грибов, их подсчитывают и делают пересчет на 1 м 3 воздуха. В протоколе количество дрожжевых и плесневых грибов указывают отдельно.
Примечание : При переносе аппаратов и устройств для отбора проб воздуха из одного помещения в другое их поверхность обрабатывают раствором дезинфицирующего средства. Столик, внутренние стыки, крышку и прочие части прибора с внутренней и внешней стороны протирают спиртом (70 %).
Для определения наличия S. aureus забор проб проводят на желточно-солевые среды на основе сред: элективно-солевой агар, стафилококк-агар, маннитолагар или среда № 10 по ГФ XII, агар Байд-Паркер. Чашки с посевами инкубируют в термостате при 37 °С (48 ± 2) ч.
2. Второй-третий день.
На вышеуказанных средах стафилококк растет в виде круглых, блестящих, маслянистых, выпуклых, пигментированных колоний. Следует учитывать, что стафилококки, выделенные от человека, дают положительную лецитовителлазную реакцию в 60 - 70 % случаев. Отвивка на скошенный агар для дальнейшего исследования не менее 2 колоний, подозрительных на стафилококк. Для исследования отвивают прежде всего колонии, дающие положительную лецитовителлазную реакцию (образование радужного венчика). При отсутствии на чашках таких колоний дальнейшему исследованию подвергаются пигментированные колонии, схожие по морфологии со стафилококком. При одновременном наличии на чашках колоний стафилококка, отличающихся по пигменту, следует отвивать не менее двух колоний различного вида. Пробирки с посевом помещают в термостат при 37 °С на (24 ± 2) ч.
3. Четвертый день.
После инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие плазмокоагулирующей активности в реакции плазмокоагуляции (РПК).
Если культура обладает только плазмокоагулирующей или только лецитовителлазной активностью, то для окончательного ответа требуется учитывать другие признаки, позволяющие определить принадлежность штамма к виду S. aureus (ферментация маннита, гемолитическая активность).
При необходимости, после выделения чистой культуры, проводят определение чувствительности/устойчивости к антибиотикам, дезинфицирующим средствам, бактериофагам.
Учет результатов дополнительных тестов. Окончательная выдача ответа.
3.2. Исследования микробной обсемененности объектов внешней среды
3.2.1. Бактериологическое исследование микробной обсемененности объектов внешней среды предусматривает определение стафилококков, бактерий группы кишечных палочек, сальмонелл, синегнойной палочки. Отбор проб с поверхностей различных объектов осуществляют методом смывов. По эпидемиологическим показаниям номенклатура исследований микробной обсемененности объектов внешней среды может быть расширена.
3.2.2. Взятие смывов производят стерильными ватными тампонами, вмонтированными в пробирки. Для увлажнения тампонов в пробирки наливают по 2,0 мл стерильной 0,1 % пептонной воды с добавлением нейтрализаторов дезинфицирующих средств.
3.2.3. При контроле мелких предметов смывы забирают с поверхности всего предмета. При контроле предметов с большой поверхностью смывы проводят в нескольких местах исследуемого предмета общей площадью примерно 100 см 2 .
3.2.4. Для обнаружения стафилококков делают высев 0,2 - 0,3 мл смывной жидкости в пробирку с 5,0 мл 6,5 % солевого бульона. Засеянные пробирки инкубируют при 37 °С в течение (24 ± 2) ч, после чего делают высев на желточно-солевые среды на основе сред: элективно-солевой агар, стафилококкагар, манитолагар или среда № 10 по ГФ XII, агар Байд-Паркер. Дальнейшие исследования выделенных культур стафилококков проводят по п. 3.1.4.
3.2.5. Для обнаружения бактерий группы кишечных палочек делают высев 0,2 - 0,3 мл смывной жидкости в пробирку с 5,0 мл среды Кесслера. Засеянные пробирки инкубируют при 37 °С в течение (24 ± 2) ч и делают пересев на среду Эндо. Выросшие колонии на среде Эндо подвергают дальнейшему изучению для установления их возможной принадлежности к патогенным энтеробактериям.
3.2.6. Для обнаружения сальмонелл делают высев 0,2 - 0,3 мл смывной жидкости в пробирку с 5,0 мл одной из сред обогащения (магниевая, селенитовая или среда Раппапорта-Вассилиадиса). Засеянные пробирки инкубируют при 37 °С в течение 18 - 20 ч, делают пересев на среду Эндо и висмут-сульфит агар с последующим отбором подозрительных колоний и их идентификацией.
3.2.7. Для обнаружения синегнойной палочки делают высев на среду № 8 (бульон для накопления стафилококков и синегнойной палочки) и среду № 9 (для определения синегнойной палочки по наличию пигмента пиоцианина) или питательные среды в соответствии с ГФ XII. Колонии, подозрительные на синегнойную палочку (колонии с ровными или слегка волнистыми краями, гладкой блестящей поверхностью с характерным запахом и пигментом, однако, следует учесть, что запах и пигмент могут сильно варьировать или вообще отсутствовать), пересевают на скошенный агар.
P. aeruginosa - грамотрицательная, подвижная, оксидазоположительная палочка, окисляющая, но не ферментирующая глюкозу, дающая рост при 42 °С.
3.2.8. Ориентировочный перечень объектов, подлежащих санитарно-бактериологическому контролю методом смывов:
А. Операционный блок:
· маска наркозного аппарата;
· тройник наркозного аппарата;
· емкости и приспособления для мытья и обработки рук;
· фартуки (клеенчатые или полиэтиленовые);
· шланг вакуум-отсоса, внутренняя часть емкости;
· шланг кислородной подводки;
· стоики для введения лекарственных средств и вспомогательные приспособления;
· ручка бестеневой лампы;
· руки персонала, участвующего в операции;
· медицинские изделия многократного применения;
Б. Послеоперационные палаты, отделения, палаты реанимации и интенсивной терапии:
· кровать и постельное белье, подготовленные для больного;
· полотенца и приспособления для обработки рук персонала;
· шланг кислородной подводки;
· запасная наркозная аппаратура (набор реанимационной укладки);
· шланг вакуум-отсоса, внутренняя часть емкости;
· внутренняя поверхность шкафов и холодильников (для хранения лекарственных средств, градусников);
· медицинские изделия многоразового использования;
В. Перевязочные, процедурные:
· кушетка и приспособления для перевязок;
· полотенца и приспособления для обработки рук персонала;
· мебель (медицинские столы, тумбочки);
· оборудование для химической стерилизации (стойки, чехлы для хранения стерильных эндоскопов, емкости с крышкой для химической стерилизации);
· гибкая часть эндоскопов и оптика;
· внутренняя поверхность шкафов и холодильников для хранения лекарственных препаратов и изделий медицинского назначения;
· внутренняя и наружная поверхности бактерицидных камер для хранения простерилизованных изделий медицинского назначения.
4.1. Отбор проб на стерильность производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа.
4.2. Все изделия медицинского назначения, подлежащие контролю, направляют в микробиологическую лабораторию в упаковке, в которой осуществляли их стерилизацию, дополнительно заворачивают в стерильную простыню или помещают в стерильную наволочку.
При стерилизации изделий в неупакованном виде в отделении отбор проб проводят в стерильные емкости, соблюдая правила асептики.
Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды. При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконе и т.д.) должно быть достаточным для полного погружения изделия или его части.
При проверке стерильности более крупных изделий проводят отбор проб методом смывов с различных участков поверхности изделий: с помощью стерильного пинцета (корнцанга) каждый участок тщательно протирают марлевой салфеткой (размер салфетки 5 ´ 5 см), увлажненной стерильной питьевой водой. Каждую салфетку помещают в отдельную пробирку (колбу, флакон) с питательной средой.
У изделий, имеющих функциональные каналы, рабочий конец опускают в пробирку с питательной средой и с помощью стерильного шприца или пипетки 1 - 2 раза промывают канал этой средой.
Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды.
4.3. Для контроля стерильности используют следующие питательные среды: тиогликолевую, бульон Сабуро (с ингибитором посторонней микрофлоры - теллурит калия или левомицетин).
При контроле изделий каждого наименования обязателен одновременный посев на обе указанные питательные среды.
На каждый вид исследуемого материала используют по две пробирки каждой среды.
При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконе и т.д.) должно быть достаточным для полного погружения изделия или его части.
4.4. Посевы в тиогликолевой среде выдерживают в термостате при температуре 32 °С. Посевы в бульоне Сабуро - при температуре 20 - 22 °С в течение 14 суток при контроле изделий, простерилизованных растворами химических средств и газовым методом, в течение 7 суток - простерилизованных физическими методами (паровой, воздушный).
4.5. Учет результатов исследования на стерильность.
При отсутствии роста микроорганизмов во всех пробирках (колбах, флаконах) делают заключение о стерильности изделий. Материал не стерилен при росте микрофлоры.
5.1. Смывы с рук персонала производят стерильными марлевыми салфетками размером 5 ´ 5 см, смоченной в нейтрализаторе. Марлевой салфеткой тщательно протирают ладони, околоногтевые и межпальцевые пространства обеих рук. После отбора проб марлевую салфетку помещают в широкогорлые пробирки или колбы с физиологическим раствором и стеклянными бусами, встряхивают в течение 10 мин. Жидкость засевают глубинным способом на 2 чашки Петри с мясопептонным агаром (по 0,5 мл) и в 2 пробирки с 0,5 %-м сахарным бульоном (по 1 мл). Посевы инкубируют при температуре 37 °С в течение 48 ч.
5.2. Учет результатов.
Отсутствие роста патогенных и условно патогенных бактерий.
6.1. Требования к помещению для посева на стерильность
6.1.1. Контроль стерильности изделий проводят с соблюдением асептических условий, исключающих возможность вторичной контаминации изделий микроорганизмами.
Контроль стерильности изделий проводят в боксах с ламинарным потоком воздуха. При отсутствии боксов с ламинарным потоком воздуха контроль стерильности проводят в боксированных помещениях (бокс с предбоксником).
6.1.2. В боксированном помещении поверхность пола, стен, потолка, мебели должна быть гладкой, без щелей, устойчивой к многократному действию моющих и дезинфицирующих средств. Полы должны быть нескользкими, иметь гидроизоляцию. Поверхность столов не должна иметь швов и трещин.
6.1.3. Боксы оборудуют приточно-вытяжной вентиляцией (с преобладанием притока над вытяжкой) с подачей в них воздуха через бактериальные фильтры. В боксе и предбокснике устанавливают бактерицидные облучатели в соответствии с нормами, предусмотренными действующими нормативно-методическими документами.
6.2. Подготовка бокса, инструментов и персонала к работе
6.2.1. Перед проведением работы поверхности в помещениях бокса и предбоксника (стены, пол, оборудование и др.), а также внутренние поверхности бокса с ламинарным потоком воздуха обрабатывают раствором дезинфицирующего средства, разрешенного к применению в установленном порядке.
6.2.2. Через 45 - 60 мин после обработки в бокс вносят все необходимые для работы материалы и инструменты, кроме образцов изделий.
6.2.3. Перед началом работ бокс с ламинарным потоком воздуха включают на время, достаточное для обеспечения полного обмена воздуха, а затем помещают в него необходимый для работы материал.
6.2.4. В боксе и предбокснике перед работой включают бактерицидные облучатели.
6.2.5. Инструменты, посуду и спецодежду, используемые в работе, предварительно стерилизуют при следующем режиме: температура 32 °С, время стерилизационной выдержки - 90 мин; изделия из резин (перчатки и т.д.) - при температуре 120 °С в течение 60 мин.
6.2.6. Перед посевом исследуемый материал вносят в предбоксник, предварительно снимая наружную мягкую упаковку. В предбокснике пакеты, биксы протирают снаружи с помощью стерильного пинцета (корнцанга) стерильной салфеткой (ватным тампоном), обильно смоченной раствором дезинфицирующего средства, обладающего спороцидными свойствами, разрешенного к применению в установленном порядке, и оставляют на 30 мин. При поступлении изделий, упакованных в два слоя (бумага, перманганаты, ткани), первый слой снимают в предбокснике и изделия во внутренней упаковке сразу переносят в бокс.
6.2.7. Перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом, вытирают их стерильным полотенцем (салфеткой), надевают в предбокснике бахилы, стерильные халаты, 4-слойные маски, шапочки и стерильные перчатки.
6.2.8. В процессе посева в боксе проверяют обсемененность воздуха. Для этого на рабочий стол ставят 2 чашки с мясопептонным агаром (МПА), открывая их на 15 мин, затем чашки помещают в термостат при температуре 37 °С на (48 ± 2) ч. Допускается рост не более трех колоний неспорообразующих сапрофитов.
Для контроля стерильности питательные среды после изготовления и стерилизации помещают в термостат при температуре 37 °С на (48 ± 2) ч.
Бульон Сабуро контролируют полностью (всю приготовленную серию пробирок или колб).
Для тиогликолевой среды термостатируют 1 % от общего числа приготовленных пробирок или колб каждой серии. Для проведения исследований материала на стерильность эту часть сред не используют.
Читайте также:


