Метронидазол можно при стафилококке
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
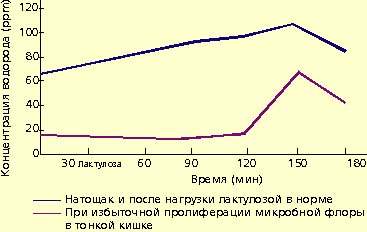 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
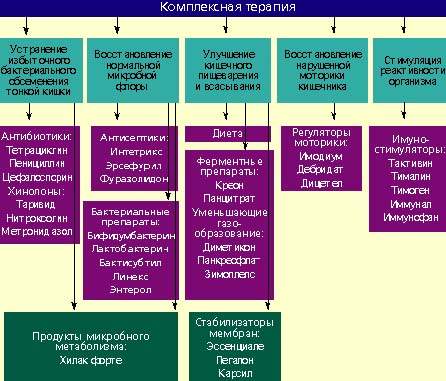 |
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.

Метронидазол (трихопол, флагил, клеон и др.) — одно из производных нитроимидазола.
Белый или с желтовато-зеленоватым оттенком кристаллический порошок, мало растворимый в воде и спирте.
С 1962 г. он известен как противопротозойное средство, а с 1972 г. широко применяется и как бактерицидно действующий препарат против анаэробных бактерий.
Фармакокинетика трихопола
Применяют чаще внутрь, хотя можно назначать и ректально, а также местно и парентерально (стерильные препараты).
В пищевом канале легко всасывается, быстро образуя высокие концентрации в крови (с максимумом через 1 ч, сохраняясь в терапевтических концентрациях не менее 6 ч), затем в различных органах и тканях, включая печень, центральную нервную систему, костную ткань, предстательную железу. Препарат хорошо проникает в полость абсцессов мозга, легких, а также в плод.
Выделяется преимущественно в активном, неизмененном, но частично инактивированном состоянии, главным образом с мочой, в которой за сутки обнаруживается до 50 % воспринятой дозы (по другим данным — всего 10—20 %, причем частично в неактивном состоянии).
Часть препарата выделяется с желчью (до 7 %), а также с молоком. До половины метронидазола разрушается в печени.
Его высокая лечебная активность объясняется легкой проходимостью через биологические барьеры.
Действие (показания) метронидазола
Его довольно широкий спектр действия охватывает многие простейшие, в частности:
- трихомонады;
- лямблии;
- амебы;
- балантидии и др.
Высокоактивен также в отношении большинства анаэробных бактерий:
- бактероидов;
- анаэробных кокков;
- фузобактерий;
- клостридий.
Но на аэробные бактерии (стафилококк, кишечную палочку и другие энтеробактерии, синегнойную палочку и др.) антимикробного действия практически не оказывает.
Избирательное действие метронидазола на анаэробные бактерии связано с тем, что в их клетках имеются условия для взаимодействия препарата с РНК, что приводит к гибели клетки. 
Может наблюдаться синергизм с рифампицином и налидиксовой кислотой. Метронидазол устойчив к ферментам гнойного экссудата. Поэтому показан для местного применения в гнойных ранах и в полостях абсцессов, сохраняя активность в анаэробных условиях.
Обладает противоотечным действием, стимулирует процессы регенерации слизистой оболочки кишок, что важно при язвенном и псевдомембранозном колите.
Метронидазол широко применяют при:
- трихомониазе у женщин и мужчин;
- амебной дизентерии;
- лямблиозе;
- балантидиазе;
- некоторых других протозойных инфекциях.
В настоящее время рассматривается как наилучшее средство для лечения при амебной дизентерии и амебных поражениях печени. Данные о его эффективности при лейшманиозе противоречивы.
В последние годы метронидазол начали широко применять для лечения и профилактики при различных анаэробных заболеваниях, особенно вызываемых грамотрицательными их представителями:
- различными видами бактероидов (устойчивыми ко многим химиотерапевтическим препаратам),
- фузобактериями;
- анаэробными кокками.
При этих инфекциях метронидазол является одним из лучших лечебных средств. Эффективен при инфекциях, вызываемых различными клостридиями: возбудителями газовой гангрены и другими. Может успешно назначаться при смешанных, анаэробноаэробных заболеваниях, но совместно с другими показанными химиотерапевтическими препаратами.
Метронидазол является одним из лучших средств для лечения при инфекциях, вызываемых бактероидами, но может успешно назначаться и при остальных анаэробных инфекциях. Он эффективен для профилактики анаэробных инфекций, в частности для предупреждения осложнений после операций на кишках, в первую очередь толстых, особенно при гнойном и гангренозном аппендиците.
В настоящее время рассматривается как эффективное средство лечения при псевдомембранозном энтороколите, иногда развивающемся в результате длительного применения антибиотиков, особенно линкомицина гидрохлорида и его производного — клиндамицина, а также тетрациклинов и левомицетина.
Эффективен при заболеваниях, вызываемых клостридиями, в частности при газовой гангрене. Видимо, он может быть эффективным и при язвенном колите. При смешанных анаэробно-аэробных инфекциях (и даже при подозрении на это) метронидазол можно назначать совместно с другими показанными данному больному химиотерапевтическими препаратами из числа более активно действующих.
Метронидазол поэтому применяется:
- при хроническом отите;
- при гайморите;
- при некротических процессах в полости рта;
- при воспалениях женских внутренних половых органов, слабо поддающихся обычной химиотерапии;
- при подозрении на анаэробную или аэробно-анаэробную их этиологию;
- при плохо заживающих абсцессах;
- при некоторых формах менингита и др.
Метронидазол также способствует заживлению язв при язвенной болезни желудка и двенадцатиперстной кишки.
Эффективен при инфекционном мононуклеозе (активнее препаратов пенициллина). Вызывает отвращение к спиртным напиткам, поэтому может применяться и для лечения при алкоголизме.
Побочные эффекты трихопола
Побочное действие метронидазола при приеме в терапевтических дозах отмечается нечасто.
Он малотоксичен и поэтому сравнительно редко вызывает токсические явления.
При значительной дозировке могут наблюдаться диспепсические явления:
- обложенность языка;
- сухость во рту;
- неприятный или горький вкус во рту;
- тошнота;
- понос.
Часто это связано с явлениями дисбактериоза, вызываемого препаратом в связи с уничтожением анаэробной флоры в организме.
Может способствовать развитию кандидоза, особенно в полости рта и кишках.
- головная боль;
- возбуждение;
- аллергические явления:
- сыпь;
- отеки;
- кожный зуд;
- повышение температуры тела.
Известны случаи появления умеренной нейтропении, связанной с содержанием нитрогруппы в молекуле метронидазола. Все эти побочные явления после прекращения приема препарата обычно быстро проходят.
У новорожденных детей он может вызвать:
- анорексию;
- дискразии со стороны крови.
Дозировка метронидазола
Метронидазол применяют внутрь (через рот или ректально), а при возможности вводят непосредственно в пораженные органы или гнойные очаги (например, в полости абсцессов или путем аппликаций в полости рта при стоматите, гингивите). Известно его назначение внутривенно в виде 0,5 % раствора.
При трихомониазе метронидазол обычно назначают взрослым:
- 1-й день — 0,5 г через каждые 12 ч во время или после приема пищи;
- 2-й день — по 0,25 г 3 раза в день, затем по 0,25 г 2 раза в день.
Общая доза на курс — 3,75 г.
По другой схеме: по 0,25 г 2 раза в день (утром и вечером) в течение 10 дней, а женщинам одновременно вводят во влагалище по 1 вагинальной свече (или таблетке), содержащей 0,5 г препарата, 1 раз в день (на ночь).
Для устранения возможности реинфекции в семье обязательно проводят одновременное лечение и жены и мужа независимо от наличия клинических симптомов трихомониаза.
Курс лечения при необходимости повторяют через 4 — 5 недель.
При амебиазе взрослым назначают по 0,25 г 3 раза в день, обычно в течение 10 дней, а при лямблиозе — по 0,25 г 2 раза в день в течение 5 дней (эффективнее тритромицин с фуразолидоном).
При анаэробных инфекциях обычно принимают в тех же дозах, т. е. по 0,2 — 0,5 г 2 — 4 раза в сутки, до 1,2 — 1,5 г, в зависимости от тяжести заболевания. Детям — по 0,2 г 3 раза в день.
Курс лечения 10 — 15 дней.
При анаэробном сепсисе его рекомендуют по 0,8 г внутрь или ректально по 1 г 3 раза в сутки.
Профилактически перед операциями на кишках его можно назначать ректально за 1 ч до операции в дозе 1 г, а после операции— по 0,6—0,8 г на прием.
Противопоказания метронидазола
Повышенная индивидуальная чувствительность к метронидазолу и заболевания центральной нервной системы.
Форма выпуска трихопола
В таблетках по 0,25 г и 0,5 г, покрытых оболочкой желтого цвета, а также в виде ректальных свечей и вагинальных таблеток по 0,5 г.
Хранение флагила
В защищенном от света месте при комнатной температуре.

Человеческий организм может служить домом для тысяч микробов и бактерий, причем, такое соседство вовсе не обязательно заканчивается болезнью. Иммунитет надежно защищает нас, сдерживая активность непрошеных гостей и заставляя их следовать правилам хорошего тона. Стафилококк – не исключение; он в норме обнаруживается примерно у трети населения Земли, но ничем себя не проявляет до поры до времени.
Ослабление иммунитета, банальное переохлаждение или наличие в организме другой инфекции, против которой применялись антибиотики, - вот причины, по которым стафилококк может перейти в наступление. Поэтому важно понимать две вещи: нельзя лечиться антибиотиками в случае малейшего недомогания или простуды, и просто бессмысленно использовать их против стафилококка для упреждения. От носительства вы все равно не избавитесь, зато познакомите свой стафилококк с антибактериальными препаратами и сведете на нет их эффективность в будущем, когда они действительно могут понадобиться.
Единственная разумная мера по упреждению стафилококковых инфекций – это местная санация кожи, слизистых оболочек и верхних дыхательных путей в холодный период года, а также приём препаратов, укрепляющих иммунитет. Назначение антибиотиков оправдано лишь в случае тяжелых, опасных для жизни заболеваний: пневмонии, эндокардита, остеомиелита, множественных гнойных абсцессов на коже и в мягких тканях, чирьев на лице и голове (в непосредственной близости к головному мозгу). Но прежде чем выбрать антибиотик против стафилококка, квалифицированный врач всегда производит бактериальный посев.
В санэпидстанции, кожно-венерологическом диспансере или медицинском кабинете профильного специалиста (ЛОРа, дерматовенеролога, гинеколога, уролога, пульмонолога, гастроэнтеролога, инфекциониста) производится забор бактериальной культуры из места локализации стафилококковой инфекции. Это может быть мазок из зева, гнойного абсцесса на коже, влагалища или уретры, а также образец крови, мокроты, мочи, слюны, желудочного сока, спермы и прочих физиологических жидкостей.
Полученный материал помещается в питательную среду, через некоторое время колония стафилококков размножается, и лаборант может определить, к какому типу относится возбудитель, и к каким антибиотикам он чувствителен.
Результат посева выглядит как список, в котором напротив названий всех актуальных противомикробных препаратов стоит одно из буквенных обозначений:
S (susceptible) — чувствителен;
I (intermediate) — умеренно чувствителен;
R (resistant) — устойчив.
Антибиотики и стафилококк
По сути, есть только одна объективная причина для применения антибиотиков против такого устойчивого и гибкого возбудителя, как стафилококк – ожидаемая польза превысит неизбежный вред. Лишь в случае, когда инфекция охватила весь организм, попала в кровь, вызвала лихорадку, а естественных защитных сил не хватает для победы над болезнью, приходится прибегать к антибактериальной терапии.
Зато есть целых три веских причины, чтобы отказаться от антибиотиков при лечении стафилококка:
Справиться с некоторыми типами возбудителя, например, с золотистым стафилококком, могут лишь цефалоспорины второго-третьего поколения, полусинтетические пенициллины (оксациллин, метициллин), да мощнейшие современные антибиотики (ванкомицин, тейкопланин, фузидин, линезолид). Прибегать к крайним средствам приходится все чаще, потому что за последние 5-10 лет стафилококки мутировали и обзавелись ферментом бета-лактамаза, с помощью которого они успешно разрушают цефалоспорины и метициллин. Для таких возбудителей существует термин MRSA (methicillin-resistant Staphylococcus aureus), и уничтожать их приходится комбинациями препаратов, например, фузидина с бисептолом. А если пациент до возникновения обширной стафилококковой инфекции бесконтрольно употреблял антибиотики, возбудитель может оказаться нечувствительным;
Антибиотики не выбирают жертв – помимо тех бактерий, против которых вы их применяете, они уничтожают и другие микроорганизмы, в том числе, полезные. Длительное лечение антибактериальными препаратами почти всегда провоцирует дисбактериоз в органах ЖКТ и мочеполовой сфере, а также усугубляет опасность активизации других инфекций, присутствующих в организме в форме носительства.
Можно ли полностью избавиться от стафилококка?

Почему иммунитет здорового ребенка или взрослого человека не избавляется от этой опасной бактерии? Потому что на то нет объективных причин, пока носительство не переходит в заболевание. Скромно сидящий в уголочке стафилококк не вызывает никакого интереса у иммунной системы, лейкоциты и макрофаги не объявляют на него охоту, и в крови не вырабатываются нужные антитела. Но что же делать, если, например, ребенок каждую осень-зиму болеет стафилококковой ангиной, или девушка, знающая о присутствии зловредной бактерии в своем организме, планирует беременность?
В этих случаях необходимо прибегнуть к иммуностимулирующей терапии и санации доступных проблемных зон: зева, носоглотки, кожи, влагалища. Такие меры не позволят вам избавиться от стафилококка навсегда, но существенно сократят численность его колоний и снизят риск перехода носительства в опасную болезнь.
Чем производится санация стафилококка?
Профилактическая санация – очень действенная мера, к которой рекомендуется регулярно прибегать всем носителям стафилококка. Сотрудники детских образовательных и лечебных учреждений дважды в год сдают мазки из носа, и если результат положительный, проводится санация, а затем анализ берут повторно, стремясь добиться полного отсутствия стафилококка в верхних дыхательных путях. Это очень важно, ведь только так можно застраховаться от распространения возбудителя воздушно-капельным путем.
Если у вас или вашего ребенка ежегодно наблюдаются рецидивы ангины, фурункулеза и прочих гнойно-воспалительных заболеваний, причиной которых (согласно результатам анализов, а не исходя из ваших догадок) служит именно стафилококк, стоит пополнить домашнюю аптечку средствами для местной санации. С помощью этих препаратов производится полоскание горла, закапывание носа, закладывание ватных тампонов в носовые ходы, орошение или спринцевание половых путей, протирание и смазывание кожи или слизистых оболочек, в зависимости от локализации носителя. Для каждого случая нужно подбирать подходящий вариант препарата и строго придерживаться инструкции.
Вот список всех эффективных растворов и мазей против стафилококка:
Масляный раствор ретинола ацетата (витамина A);
Читайте также:


