Определение бактерий рода salmonella в пищевых продуктах
Сальмонеллы представляют собой один из 12 родов большого семейства бактерий Enterobacteriacae. К настоящему времени по серологической типизации систематизировано около 2000 сероваров сальмонелл. Они встречаются (обитают) в кишечном канале животных и человека, а также во внешней среде. Морфологически представляют собой мелкие палочки с закругленными концами, иногда овальной формы. Все они, кроме S. pul lorum и S . gallinarum хорошо подвижны, по Граму окрашиваются отрицательно, спор и капсул не образуют. Являются аэробами или факультативными анаэробами. Оптимальная реакция среды для роста слабощелочная (рН — 7,2-7,5), оптимальная температура роста 37°С, хотя сальмонеллы хорошо растут и при комнатной температуре, не исключается их рост при низких плюсовых температурах (5. 8°С).
Сальмонеллы довольно устойчивы. Они длительное время могут жить в пыли, высушенном кале и навозе, в почве, воде и животных кормах, сохраняя вирулентность. Установлено, что при биометрическом обезвреживании навоза сальмонеллы инактивируются только в течение 3 недель. Для полного обезвреживания мяса, обсемененного сальмонеллами, необходимо довести температуру внутри кусков до 80 0 С и поддерживать ее на этом уровне не менее 10 минут. В мороженом мясе бактерии сохраняют жизнеспособность в течение 2-3 лет, а при хранении мяса в условиях низких плюсовых температур (5…8 0 С) могут даже размножаться. В соленом мясе они сохраняют жизнеспособность 5-6 месяцев, а при содержании в продукте 6-7% поваренной соли также могут размножаться.
Сальмонеллы обладают свойством продуцировать эндотоксины. Последние представляют собой глюцидо-липоидо-полипептидные комплексы, тождественные с соматическим антигеном бактерий, и являются термостабильными. Многочисленными опытами было установлено, что при парентеральном введении они обладают высокой токсичностью. Так, доза 0,3 мл профильтрованной 7-дневной жидкой культуры при подкожном введении вызывает быструю гибель мышей. В то же время 10-30-кратные дозы при энтеральном введении, не вызывали заболевания животных. То же самое было подтверждено в опытах на обезьянах. Наконец, люди добровольно в порядке самоэксперимента выпивали до приема пищи от 20 до 350 мл токсинов сальмонелл (фильтрат убитой культуры), и заболевание у них не наступало. На основании этих опытов был сделан вывод о том, что энтерально действующих токсинов у сальмонелл нет, а пищевые токсикоинфекции у людей вызывают только живые бактерии.
Существуют два метода типизации (т. е. установления вида) бактерий рода сальмонелла: серологический и биохимический. Для серологической типизации применяют реакцию агглютинации (РА) с поливалентными и монорецепторными сальмонеллезными сыворотками.
Биохимическая типизация основана на различии у сальмонелл состава ферментов. В силу ферментных (биохимических) различий одни бактерии способны разлагать те или иные углеводы или спирты, а другие такой способностью не обладают. Для биохимической типизации применяют различные элективные среды (Эндо, Смирнова, Левина, Плоскирева и др.). Одной из наиболее употребительных является элективная среда Эндо. Ингредиентом в среде Эндо является сахар-лактоза, а индикатором — фуксин, обесцвеченный сернисто-кислым натрием. Бактерии кишечной группы разлагают лактозу, а сальмонеллезные бактерии лактозу не разлагают. При росте бактерий рода Е. coli на среде Эндо вследствие разложения лактозы и образования молочной кислоты восстанавливается красный цвет фуксина, чего не происходит при росте сальмонелл. В связи с этим колонии бактерий кишечной группы на среде Эндо будут красно-фиолетового цвета с металлическим отблеском, и среда вокруг колоний окрашивается в красный цвет; сальмонеллы растут на этой среде в виде полупрозрачных колоний светло-розового цвета с голубоватым оттенком.
Для дальнейшей биохимической типизации сальмонелл применяют малый или большой пестрый ряд сред. В состав пестрого ряда входят среды Гисса с различными сахарами и многоатомными спиртами, а также бульон с глицерином (по Штерну), среда с рамнозой (по Биттеру), молоко, лакмусовое молоко и мясо-пептонный бульон с индикаторной бумажкой (на сероводород). При биохимической типизации помимо изменения цвета сред изучают способность бактерий образовывать сероводород, индол и т. д.
Принадлежность культуры к определенному виду бактерий по изменению сред пестрого ряда устанавливают по таблицам или определителям, которые имеются в учебных пособиях по практическим занятиям по ветсанэкспертизе. Следовательно, типизация бактерий рода сальмонелла и определение их вида возможны только в результате бактериологического исследования.
При исследовании соленого мяса, находящегося в бочечной таре, берут образцы мяса и имеющиеся лимфатические узлы сверху, из середины и со дна бочки, а также, при наличии, трубчатую кость. Пробы заворачивают в вощаную или пергаментную бумагу, наклеивают этикетки, нумеруют, заворачивают в общий пакет, перевязывают шпагатом, пломбируют или опечатывают сургучной печатью.
Из присланного в лабораторию материала готовят мазки-отпечатки по общепринятой методике, окрашивают по Граму и микроскопируют их, а также проводят посев на мясопептонный агар и вышеуказанные элективные среды. Для идентификации и выделения чистой культуры сальмонелл в лабораториях широко используют среды накопления (селенитовая и магниевая среды). При проведении бактериологического исследования используют в комплексе методы серологической и биохимической типизации.
ПАТОГЕННОСТЬ БАКТЕРИЙ
РОДА САЛЬМОНЕЛЛА
ДЛЯ ЖИВОТНЫХ
Патогенное действие сальмонелл на животных проявляется при нарушении сложных механизмов между микро- и макроорганизмами. Степень патогенности штаммов зависит от вида сальмонелл, инфицирующей дозы, биологических особенностей возбудителя, а также возраста макроорганизма, его резистентности и других моментов. В литературе к настоящему времени накопилось достаточное количество данных, свидетельствующих о несостоятельности разграничения сальмонелл на патогенных только для человека, животных или птиц.
У животных и птиц в естественных условиях сальмонеллы являются возбудителями инфекционных болезней, именуемых сальмонеллезами. В соответствии с патогенезом и эпизоотологическими особенностями эти болезни подразделяют на первичные и вторичные сальмонеллезы.
Первичные сальмонеллезы – типичные инфекционные заболевания, которые вызываются специфическими возбудителями, при течении имеют определенную клиническую картину и ярко выраженные патологоанатомические изменения. К первичным сальмонеллезам относят: сальмонеллез телят, сальмонеллез поросят, сальмонеллез овец и коз и др.
Вторичные сальмонеллезы не являются самостоятельными заболеваниями, а возникают у животных или птиц-сальмонеллоносителей при инфекционных, инвазионных и незаразных болезнях, отравлениях и септикопиемических процессах, длительном голодании, переутомлении и других факторах, снижающих резистентность организма. При указанных факторах вирулентность сальмонелл усиливается, они интенсивно размножаются и проникают из мест первоначальной локализации (кишечник, печень, брыжеечные лимфатические узлы) в различные органы и мышцы. В связи с этим патологоанатомические изменения могут быть самые разнообразные и во многом определяются тем, на какой первичный патологический процесс произошло наслоение вторичных сальмонеллезов. Кровоизлияния в различных органах, особенно в печени, почках и лимфатических узлах, кровоизлияния на серозных оболочках, плохое обескровливание туш, абсцессы в печени, артриты, жировое перерождение печени дают повод подозревать вторичные сальмонеллезы. Вторичные сальмонеллезные заболевания животных нередко встречаются в практике ветеринарно-санитарного эксперта и играют большую роль в возникновении пищевых токсикоинфекций у людей.
Вторичное обсеменение сальмонеллами может быть при роже свиней, пастереллезе, европейской чуме, лейкозе, инфекционном ринотрахеите, стабхиботриотоксикозе, онхоцеркозе, пироплазмидозах, беломышечной болезни, кетозах и других заболеваниях инфекционной, инвазионной и незаразной этиологии. В этих случаях обязательно проводится бактериологическое исследование продуктов убоя.
ПАТОГЕННОСТЬ БАКТЕРИЙ
РОДА САЛЬМОНЕЛЛА
ДЛЯ ЧЕЛОВЕКА
У человека сальмонеллы вызывают пищевые токсикоинфекции. Вспышки и случаи возникновения токсикоинфекций характеризуются общностью признаков, внезапностью их появления, массовостью и одновременным заболеванием употреблявших одинаковую пищу людей, территориальной ограниченностью и отсутствием эпидемиологического хвоста, т. е. отсутствием выделения больных в последующие дни. Существует многообразие форм клинического проявления. Накопленные в медицинской практике данные о пищевых токсикоинфекциях сальмонеллезной этиологии позволяют с известной условностью утверждать, что заболевание может иметь гастроэнтеритическую, тифо- или холероподобную, гриппоподобную, септическую и нозопаразитическую формы клинического проявления, а также субклиническую (латентное бактерионосительство).
Инкубационный период в среднем 12-24 часа, но иногда затягивается до 2-3 суток.
Гастроэнтеритическая форма проявляется повышением температуры тела, ознобом, тошнотой, рвотой, жидким стулом, иногда с примесью крови и слизи, болью в животе, повышенной жаждой и головными болями. Особенно тяжело с явлениями неудержимой рвоты и даже поражением нервной системы протекает заболевание при попадании с пищевыми продуктами в организм человека S. typhimurium.
Тифоподобная форма может начинаться с обычного гастроэнтерита и после кажущегося временного выздоровления через несколько суток проявляется признаками, характерными для обычного брюшного тифа.
Гриппоподобная форма, довольно часто встречающаяся при заболевании людей, характеризуется болями в суставах и мышцах, ринитом, конъюнктивитом, катаром верхних дыхательных путей и возможными расстройствами желудочно-кишечного тракта.
Септическая форма протекает в виде септицемии или септикопиемии. При этой форме наблюдаются обусловленные сальмонеллами местные септические процессы с локализацией очагов во внутренних органах и тканях: эндокардиты, перикардиты, пневмонии, холециститы, остеомиелиты, артриты, абсцессы и т. д.
Нозопаразитическая форма представляет собой вторичное заболевание, наслаивающееся на какой-либо первичный патологический процесс и возникающее в результате эндогенного (из кишечника у бактерионосителей) или экзогенного проникновения сальмонелл в организм, ослабленный первичным заболеванием. Клиническая картина и патогенез этой формы сальмонеллезной токсикоинфекции у человека еще недостаточно изучены.
Смертность при пищевых токсикоинфекциях в среднем составляет 1-2%, но в зависимости от тяжести вспышек, возрастного состава людей (заболевание среди детей) и других обстоятельств может доходить до 5%.

Кишечные инфекции являются одними из распространенных заболеваний по критерию смертности среди населения планеты. По международным оценкам во всем мире ежегодно выявляют более 3 млн. случаев заражения со смертельным исходом, связанных с грамотрицательными кишечными патогенами из-за диареи и кишечной лихорадки.
Производство мясной продукции в РФ за 17 лет выросло в 6 раз. По данным МСХ РФ в 2017 г производство скота и птицы на убой (в живом весе) в хозяйствах всех категорий составило 14,6 млн. т, т.е. по сравнению с 2016 г увеличилось на 4,7 %, что благоприятно сказалось на работе перерабатывающих предприятий [3].
В счет увеличения потребления и производства мяса птицы повышается потенциальный риск загрязнения продовольственных товаров сальмонеллами. По статистическим данным Роспотребнадзора, за январь-апрель 2016 г в РФ было зарегистрировано 10347 случаев сальмонеллезных инфекций, 2246 случаев в шигеллеза, 180534 случая острых кишечных инфекций, вызванных неопределенными инфекционными возбудителями.
Сальмонеллёз – это пищевая токсикоинфекция, которая ассоциируется с потребление контаминированных пищевых продуктов, свежего или обработанного мяса и птицы, а также яиц. По итогам 2017 г душевое потребление мяса птицы в РФ составило 34,3 кг. Для сравнения, в 2012 г ― 29,0 кг, в 2007 г ― 22,5 кг, 2002 г ― 16,1 кг, т.е. потребление мяса за 15 лет увеличилось более чем в 2 раза. Чтобы недопустить контаминацию и распространение возбудителя необходимо проводить контроль качества выпускаемой продукции [5, с. 13 - 14].
Род Salmonella входит в семейство Enterobacteriaceae и включает в себя вид S. enteritica и серовары: S. typhimurium, S. choleraesuis и S. enteritidis. Современная серологическая классификация сальмонелл насчитывает свыше 2500 сероваров и бактерий видов S. enterica и S. bongori. Вид S. bongori включает в себя только 22 серовара,. а вид S. enterica 2557 сероваров, которые подразделяются на 6 основных подвидов: enterica, salamae, arizonae, diarizonae, houtenae, indica. В состав клеток сальмонелл входят O-, H-, Vi-, M- и K- антигены, на основе общности соматических антигенов обозначают – 1, 2, 3…15. Дифференциацию внутри группы осуществляют по H-антигенам (a, b, c, d) [6, с. 60 - 63].
За последние 25 лет были приняты попытки разработать усовершенствованные методы обнаружения и идентификации сальмонелл в продуктах животного происхождения. В данной работе рассмотрим методы, используемые для идентификации сальмонелл.
На сегодняшний день выявление в пищевых продуктах сальмонелл проводят с использованием ПЦР-диагностики. ПЦР используется в качестве основного метода идентификации для ускоренного обнаружения сальмонелл в сфере молекулярной биологии. Мишенью для амплификации ДНК бактерий служат части нуклеиновых кислот патогена. Важной особенностью метода ПЦР-Real time является возможность распознавания и идентификации продуктов амплификации ДНК бактерии при непосредственном проведении реакции. Процедура ПЦР анализа продуктов питания по выявлению сальмонелл регламентируется ГОСТ Р ИСО/МЭК-17025.
На первом этапе постановки реакции ПЦР необходимо увеличить численность сальмонелл, с этой целью проводят обогащение образцов. Однако в ходе обогащения клетки сальмонелл могут вытесняться другими микроорганизмами или ингибироваться специализированными метаболитами, например антибиотиками. Кроме того необходимо исключить и ложноположительные результаты при распознавании ДНК нежизнеспособных клеток. Для этого существуют специальные методы отделения популяции сальмонелл от фона других микроорганизмов. Например, иммуномагнитная сепарация клеток (ИСК) которая основывается на взаимодействии очищенных антител, ковалентно связанных на поверхности парамагнитных частиц, с колониями сальмонелл. Однако чувствительность данного метода ограничена связывающей специфичностью антител к клеткам бактерий, что имеет решающее значение для предотвращения ложноотрицательных результатов. Очевидными преимуществами ПЦР диагностики являются быстрота выполнения анализа, чувствительность и специфичность обнаружения, но высокая стоимость оборудования и другие затраты останавливают производителей в пользу более простых и классических методов [2].
Кроме ПЦР существует ИФА-тест, разработанный для идентификации бактерий рода Salmonella. Этот тест содержит ряд специальных компонентов, позволяющих быстро подтвердить наличие или отсутствие в пищевых продуктах патогенных микроорганизмов. Патогены обнаруживаются через уникальную комбинацию ELISA метода иммунохроматографии и появления окрашенного сигнала. Используются тесты Singlepath или Duopath, в состав которых входят коллоидные, меченные золотом антитела к патогенным антигенам. Комплекс антиген-антитело перемещается на мембрану к реакционной зоне, где образуется красная полоса. Тест содержит зону контроля, и если его работа верна, образуется вторая красная линия. Преимуществами данного метода является значительное сокращение времени исследований (на 48 ч), высокая специфичность и надежность определения. Метод не предусматривает сложных процедур пробоподготовки и использования каких-либо дополнительных приборов или устройств [4].
К ускоренным методам выявления бактерий рода Salmonella относится использование специализированной среды Salmosyst, где изначально микроорганизмы проходят стадию неселективного обогащения. Обогащение проводят на среде Salmosyst® Broth Base, с добавлением таблетки Salmosyst® Selective Supplement, которая увеличивает рост сальмонелл и подавляет сопутствующую микрофлору. Для идентификации сальмонелл культуру высевают на одну из дифференциально-диагностических сред. Преимуществом данного метода является сокращение времени исследования на 24-48 ч, а также высокая чувствительность (выявляются поврежденные клетки сальмонелл), простота выполнения анализа и экономичность. Этот метод одобрен Центром Гигиены и Эпидемиологии Роспотребнадзора (МР №24ФЦ/976) и разрешен к применению в лабораториях санитарно-эпидемиологической службы, осуществляющих государственный и ведомственный контроль, а также в производственных лабораториях.
Кроме вышеперечисленных методик существует еще метод выявления бактерий рода Salmonella с использованием специализированной полужидкой среды Раппопорта-Вассилиадиса (среда MSRV) с новобиоцином. На этой среде сальмонеллы образуют светлую непрозрачную зону роста. Рост сопутствующих бактерий ингибируется введением новобиоцина, наличием хлорида магния, малахитового зеленого и культивированием при повышенной температуре – 41,5 °С. Преимуществом метода является время исследования, которое составляет 24-48 ч (за счет совмещения этапа селективного обогащения с этапом высева на агаризованную среду) и высокая чувствительность, обеспечивающая выявление даже единичных клеток сальмонелл, а также экономичность метода [1].
На российском рынке широко представлена экспресс-система для определения сальмонелл Petrifilm ® SALX. Данный тест предназначен для быстрого выявления и биохимического подтверждения сальмонелл в обогащенных образцах пищевых продуктов и производственных объектов. Учет результатов проводят через 44-52 ч. Дополнительный анализ на наличие сальмонелл и других патогенных микроорганизмов проводят по системе молекулярного анализа 3М ™ . В основе разработанной системы лежит комплекс изотермической амплификации ДНК и биолюминесцентной детекции. Использование данного сочетания обеспечивает высокую чувствительность и точность результатов, которые учитывают через 24-27 ч [4].
Метод идентификации сальмонелл с помощью масс-спектрометрии обеспечивает прямое обнаружение присутствия выраженных бактериальных рибосомальных белков, где каждый воспроизводимый результат видоспецифичен. Преимуществом масс-спектрометрии является отсутствие необходимости в пробирном отборе материала. Масс-спектральные отпечатки содержат достаточно наблюдаемых белков, что делает его достаточно мультиплексным анализом [2].
Альтернативой MALDI-ToF MS является обнаружение бактериальных белков с помощью высокоэффективной жидкостной хроматографии ― метод разделения и анализа сложных смесей веществ, в котором подвижной фазой является жидкость. Данный метод показал большие перспективы для дифференциации близкородственных видов с пределах семейства Enterobacteriaceae и выявления белков-биомаркеров для разработки зондов ПЦР [2].
Заключение
Таким образом, методов применяемых для индикации и идентификации бактерий рода Salmonella в пищевых продуктах достаточно много. Однако не все методы будут рекомендоваться или даже использоваться для определенного случая диагностики при исследовании сырья и продуктов животного и растительного происхождения. Производительность самого метода будет зависеть от общей чувствительности, его специфики, а также технической сложности. Влияют также и внешние факторы, включая набор навыков специалиста и техническое мастерство, стоимость оборудования и материалов. Но в итоге, при систематической проверке методов установится их полезность и эффективность.
Главной целью новых разработок является сокращение времени и автоматизация лабораторной диагностики. Важно отметить, что результаты применения одного метода будут способствовать улучшению характеристик другого, даже если они непосредственно не будут связаны между собой.
Список литературы:
- ГОСТ Р 53665-2009. Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Метод выявления сальмонелл.
- МУ 4.2.2723-10 Лабораторная диагностика сальмонеллезов, обнаружение сальмонелл в пищевых продуктах и объектах окружающей среды.
- Абдуллаева А.М., Серегин И.Г., Удавлиев Д.И., Соколова Н.А., Лощинин М.Н., Мамедбердыева М.Д. Микробиологическая безопасность полуфабрикатов из мяса птицы /// Проблемы ветеринарной санитарии, гигиены и экологии. – 2017. – № 2 (22). – С.11-15.
- Абдуллаева А.М., Смирнова И.Р., Трохимец Е.В., Губанкова А.А. Микробиологический контроль полуфабрикатов из мяса индеек при холодильном хранении // Ветеринария. – 2017. – № 8. – С. 49-53.
- Серегин И.Г., Дюльгер Г.П., Кульмакова Н.И., Абдуллаева А.М. Ветеринарно-санитарная экспертиза при переработке птицы. Учебное пособие. – Санкт-Петербург: Квадро. – 2017. – 200 с.
- Соколова Н.А., Абдуллаева А.М., Лощинин М.Н. Возбудители зооантропонозов, пищевых отравлений, порчи сырья и продуктов животного происхождения. Учебное пособие. – М.: ДеЛи плюс, – 2015. – 170 с.
Метод предназначен для выявления в определенной навеске продукта бактерий рода Salmonella. Для этого определенное количество продукта высевают в жидкую неселективную среду, после инкубирования которой производят посев в жидкие селективные среды. Затем полученные культуры пересевают на плотные дифференциально-диагностические среды. Выросшие на этих средах характерные колонии исследуют, выявляя характерные для сальмонелл биохимические и серологические признаки.
а) Неселективное предварительное обогащение. Необходимую навеску продукта высевают в забуференную пептонную воду. Соотношение массы (объема) продукта и забуференной пептонной воды при этом должно составлять 1:9. Посевы инкубируют при 36(±1)°С в течение 18-20 ч.
Доводят pH до 7,0(±0,2) жидких высококислотных продуктов — перед посевом, а твердых высококислотных продуктов — в посевах. Для этого используют стерильные растворы гидроокиси натрия и соляной кислоты.
В ряде случаев предварительное неселективное обогащение можно не производить (при анализе колбасных изделий и продуктов из мяса, яичных продуктов, мяса).
б) Селективное обогащение. По 10 см 3 полученных в результате предварительного обогащения культуры пересевают в две среды для селективного обогащения. Для этого используют по 100 см 3 магниевой и тетратионатной сред или по 100 см 3 селенитовой и тетратионатной среды. В ряде случаев помимо перечисленных сред допускается использование среды Мюллера (при анализе яичных продуктов). Посевы культивируют в течение 24-48 ч при 36(±1)°С (магниевая и селенитовая среда) и 43(+1)°С (тетратионатная среда).
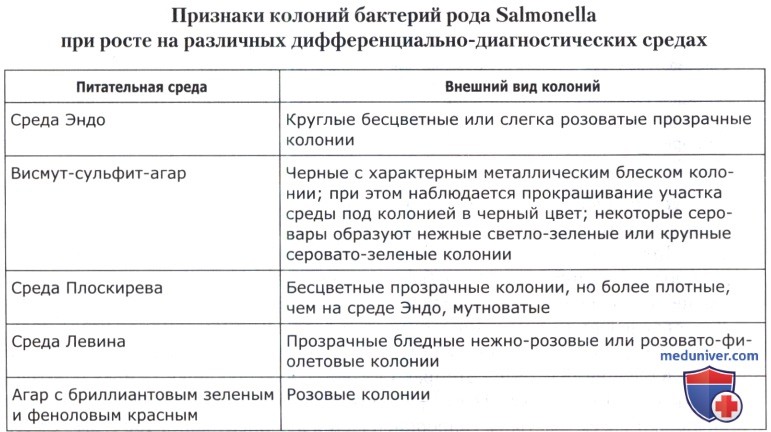
в) Выделение культур на плотных дифференциально-диагностических средах. Через 24 и 48 ч инкубирования микроорганизмы из селективных сред пересевают методом истощающего штриха на три агаризованные дифференциально-диагностические среды—висмут-сульфит агар, среду Плоскирева и среду Эндо (или Левина). В ряде случаев помимо перечисленных сред допускается использование агара с бриллиантовым зеленым и феноловым красным (при анализе мяса птицы, субпродуктов и полуфабрикатов птичьих). Посевы культивируют при 36(±1)°С в течение 24-48 ч. Предварительный учет производят через 24 ч, окончательный—через 48 ч.
На дифференциально-диагностических средах отмечают наличие колоний, характерных для сальмонелл. При отсутствии в посевах характерных колоний дают заключение об отсутствии бактерий рода Salmonella в анализируемой навеске продукта.
Если хотя бы на одной дифференциально-диагностической среде обнаружены колонии, характерные для Salmonella, проводят их дальнейшее изучение.
г) Биохимическое подтверждение принадлежности к Salmonella. Не менее трех характерных колоний с каждой дифференциально-диагностической среды пересевают на поверхность скошенного МГ1А и параллельно на трехсахарный агар (штрихом по поверхности и уколом в столбик). Посевы культивируют при 36(±1) °С в течение 24 ч.
После того как произведен посев, из материала отобранных колоний готовят мазки и окрашивают их по Граму. Бактерии рода Salmonella являются не образующими спор грамотрицательными палочками с закругленными концами.
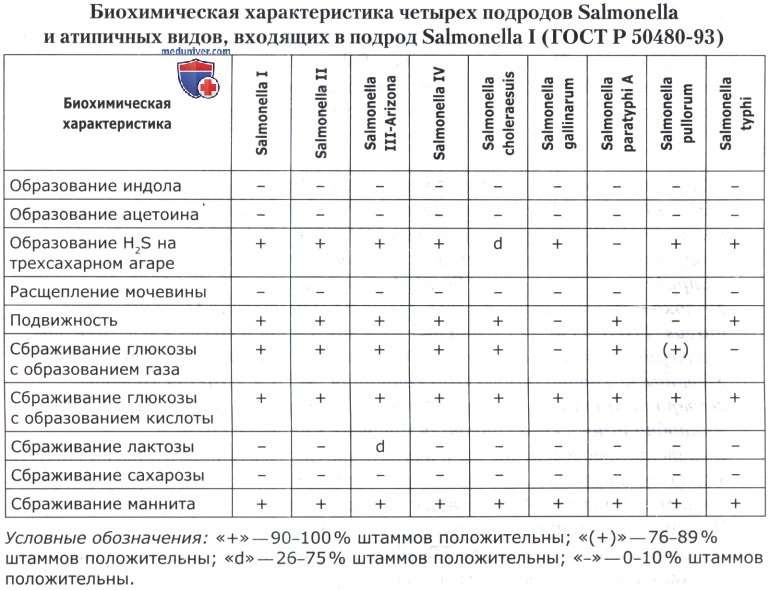
Учет результатов культивирования на трехсахарном агаре позволяет установить способность бактерий к ферментации лактозы, сахарозы и глюкозы, а также способность к образованию сероводорода. В ряде случаев допускается использование сред Ресселя, Клиглера (при анализе яичных продуктов, мяса птицы, субпродуктов и полуфабрикатов птичьих), Крумвиде-Олькеницкого (при анализе яичных продуктов, мяса, колбасных изделий и продуктов из мяса). Типичные культуры Salmonella ферментируют глюкозу (с образованием или без образования газа), не ферментируют лактозу и сахарозу, образуют сероводород.
Дальнейшим исследованиям подвергают бактерии, удовлетворяющие этим требованиям, а также лактозоположительные бактерии или бактерии, не образующие сероводород, но обязательно ферментирующие глюкозу (с образованием или без образования газа). Эти культуры пересевают на поверхность скошенного МПА и инкубируют при 36(±1)°С в течение 24 ч. Выросшие бактерии используют для определения способности к расщеплению мочевины, образованию индола и ацетоина, ферментации сахарозы и маннита, подвижности.

Для установления способности расщеплять мочевину культуру высевают штрихом на среду Кристенсена с мочевиной и культивируют при 36(± 1) °С в течение 24 ч. При росте уреазоположительных бактерий среда достаточно быстро (часто даже после 2 ч инкубации) приобретает цвет от розового до темно-вишневого. Сальмонеллы мочевину не расщепляют.
Для определения образования ацетоина (реакция Фогес-Проскауера) культуры пересевают в мясопептонный бульон с глюкозой. Посевы инкубируют при 36(±1) °С в течение 48 ч. Затем отбирают в стерильную пробирку 1 см 3 культуральной жидкости, прибавляют 0,6 см 3 раствора α-нафтола. Пробирку встряхивают и прибавляют 0,2 см 3 раствора гидроокиси калия в концентрации 400 г/дм 3 . Смесь хорошо встряхивают. Появление розового окрашивания через 15 мин указывает на положительную реакцию. Учет результатов реакции можно проводить не ранее чем через 15 мин и не позднее чем через 2 ч. Сальмонеллы не образуют ацетоина (реакция отрицательная).
Для определения образования индола культуры пересевают в мясопептонный бульон с триптофаном. Посевы инкубируют при 36(±1)°С в течение 24 ч. Затем к посевам прибавляют по 1 см 3 реактива Эрлиха или Ковача. При наличии индола (положительная реакция) в пограничном слое в течение 5 мин появляется красное окрашивание. Сальмонеллы индол не образуют.
Для установления способности к ферментации маннита и сахарозы культуры пересевают в среды Гисса с маннитом или сахарозой. Посевы культивируют при 36(±1)°С в течение 24 ч. При сбраживании указанных субстратов изменяется цвет среды, образуется или не образуется газ. Сальмонеллы не сбраживают маннит и сахарозу.
Для определения подвижности культуры пересевают уколом в полужидкий МПА. Посевы инкубируют при 36(±1)°С в течение 24 ч. При росте подвижных бактерий наблюдается диффузный рост по всему столбику агара, при росте неподвижных бактерий—только вдоль места укола. Большинство сальмонелл подвижно.
Полученные результаты оценивают пользуясь таблицей.
В ряде случаев (например, при анализе мяса птицы, субпродуктов и полуфабрикатов птичьих) дополнительно выявляют способность выделенных культур к дезаминированию фенилаланина. Сальмонеллы дают отрицательную реакцию.
д) Серологическое подтверждение принадлежности к Salmonella. Культуры, проявившие типичные биохимические свойства, пересевают на поверхность скошенного МПА и инкубируют при 36(±1) °С в течение 24 ч.
Определение самоагглютинирующих штаммов. Каплю физраствора помещают на предметное стекло и диспергируют в ней часть исследуемой культуры так, чтобы получилась густая гомогенная суспензия. Стекло осторожно покачивают 30-60 с. Затем отмечают результаты на темном фоне (лучше при помощи увеличительного стекла). Если наблюдается в разной степени склеивание бактерий, т. е. образование осадка, то считают, что тестируемые штаммы обладают самоагглютинацией. Эти штаммы не подвергают дальнейшей серологической идентификации.
Определение О-антигенов проводят в реакциях с поливалентными сальмонеллезными сыворотками основных групп А, Б, С, Д, Е, а затем, если не выявлено О-антигенов с сыворотками основных групп, ставят реакцию с сыворотками редких групп. Ход определения указан в прилагаемых к сывороткам инструкциях.
е) Оценка результатов. К Salmonella относят культуры, показавшие типичные биохимические и серологические реакции. Предположительно к Salmonella относят культуры с типичными биохимическими реакциями, но не имеющих самоагглютинации и О-антигенов, а также культуры с типичными биохимическими реакциями и самоагглютинацией.
Редактор: Искандер Милевски. Дата публикации: 14.10.2019
Обнаружение бактерий рожи свиней, листериоза и пастереллеза
Эти микроорганизмы выявляют по специфическому росту на мясопептонном шаре и дифференцируют по морфологическим, культуральным и биологическим свойствам.
На мясопептонном агаре они растут в виде мелких прозрачных колоний. Из этих колоний готовят мазки с окраской по Граму, исследуют на подвижность и проводят посев на МПА и МПБ.
При необходимости проводят дополнительную дифференциацию листерий от возбудителя рожи свиней с применением желатина. Листерии на нем, не разжижая, дают медленный рост в виде узловатой нити с неровными краями и пушистыми отростками; они ферментируют салицин; вызывают гемолиз на агаре с кровью, на мясопептонном печеночной агаре с добавлением 0,5% глюкозы, 3% глицерина, 0,01°о теллурита калия растут в виде мелких черных колоний. При биопробе на морских свинках вызывают кератокон ью1 исгивит.
Для проведения пробы на каталазу к суточной культуре добавляют 1 мл 10%-ного раствора перекиси водорода. Л истерии, выделяя каталазу, расщепляет перекись водорода с образованием пузырьков газа.
Б результате бактериологического исследования мяса и мясопродуктов часто выявляются бактерии, вызывающие пищевые токсикоинфекции. К ним относятся бактерии семейства Enterabacteriaceae, родов: Escherichia, Salmonella, Proteus. Наиболее опасен из них род Salmonella. Бактерии различных видов этого рода по морфологическим и культуральным свойствам друг от друга не отличаются. Они имеют общие признаки с бактериями рода Escherichia а рода Proteus.
Выявление сальмонелл проводят в четыре последовательных этапа: микроскопия и первичный посев, обогащение, посев со среды обогащения и подтверждение.
На первом этапе проводят микроскопию мазков с окраской по Грану, делают посев на плотные элективные среды. Посевы 18-24 часа выдерживают в термостате (37°С) и определяют наличие типичных колоний. На среде Эндо - это Круглые, бесцветные или слегка розоватые, прозрачные (полупрозрачные) мелкие колонии, на среде Левина - прозрачные, бледные, нежно-розовые или розовато-фиолетовые колонии.
На втором этапе (обогащение) С целью накопления сальмонелл проводят посев на жидкие селективные среды (среды Мюллера, Киллиана, Кауфмана, селенитовый Ф-бульон, хлористомапшевая среда). Их выдерживают в термостате при температуре 37°С (на селенитовом Ф-бульоне при+43'С).
На третьем этапе, после обогащения, проводят пересев с жидких сред на плотные селективные диагностические среды, которые после термостатной выдержки (37°С) исследуют на присутствие типичных колоний.
На четвертом этапе проводят подтверждение наличия бактерий из рода сальмонелл путем определения морфологических, биохимических и серологических свойств.
По серологической типизации систематизированы около 2000 серотипов сальмонелл. Они встречаются (обитают) в кишечнике животных и человека и во внешней среде. Морфологически эта палочка с закругленными концами, иногда овальной формы, длина их 2-4 и ширина - 0,5 ммк. Все они (кроме S. pullorum u S. gallinarum) хорошо подвижны, по Граму - отрицательны, спор и капсул не образуют, являются аэробами или факультативными анаэробами. Оптимальная среда для роста слабощелочная (рН- 7,2-7,5), оптимальная температура роста-37"С (не исключается их рост при низких плюсовых температурах 5-8°С). По росту на простом агаре и обычных жидких питательных средах сальмонеллы почти неразличимы на мясопептонном агаре гладкие формы, S-формы этих бактерии образуют круглые, полупрозрачные, выпуклые, иногда со слегка вдавленным центром влажные колонии с легким металлическим блеском. Шероховатые (R-формы) растут в виде неровно округленных, шероховатых, тусклых и сухих колоний. На скошенном агаре растут пышно, образуя в конденсационной воде сильную муть, на М11Б они вызывают равномерное помутнение среды, желатину не разжижают, индол не образуют, молоко не ферментируют.
На плотных селективных средах сальмонеллы растут в виде характерных колоний: на бактоагаре Плоскирева - бесцветные мелкие колонии; на висмут-сульфитном агаре - черные или коричневые колонии с характерным металлическим блеском с прокрашиванием в черный цвет участка среды под колонией. Лишь некоторые серологические типы сальмонелл из группы С растут на висмут-сульфитном агаре в виде нежных светло-зеленых и крупных колоний.
Несмотря на общность морфологических и культуральных характеристик, а также токсинообразоания, бактерии рода сальмонелла отличаются друг от друга по биохимическим и антигенным (серологическим) свойствам. Эти различия положены и основу научно разработанных методов типизации.
Существуют два основных метода типизации (т. е. установления видов) бактерий рода сальмонелла: серологический и биохимический. Для серологической типизации используют реакцию агглютинации с салъмонеллезными сыворотками.
За немногими исключениями сальмонеллы имеют два ряда антигенов: термостабпльный О-антиген (соматический, связанный с телом бактерий) и термолабильный Н-антиген (жгутиковый, связанный с двигательным аппаратом бактерий). Каждый из этих антигенов состоит из двух и более компонентов или фракций (рецепторов).
По различию в строении О- и Н-антигенов у отдельных видов сальмонелл Кауфман и Уайт систематизировали бактерии этого рода на несколько серологических групп - А, В, С, Д, Е и т. д. Основой для подобной систематики группы является общность их соматического антигена. Каждый вид бактерий, входящих в определенную серологическую группу, будет агглютинироваться с сывороткой, приготовленной путем иммунизации животного культурой любой бактерии, входящей в данную группу. Такие сыворотки называют групповыми, а реакцию агглютинашш с ними - групповой.
Кроме групповых наши биофабрики готовят специфические мопорецепторные сыворотки. Они агглютинируют только определенный вид сальмонелл.
Однако для практики ветсанэкспертизы, при определении ветеринарно-санитарной оценки мяса и мясопродуктов, видовая диагностика сальмонелл значения не имеет. Она необходима для эпидемиологов, эпизоотологов, гигиенистов для лечения людей или животных, больных сальмонеллезом.
Для ветсанэкспертизы необходимо определить род сальмонелл, так как санитарная оценка при сальмонеллезе одинаковая и не зависит от видовой принадлежности возбудителя. Поэтому r практике ветсанэкспертизы пользуются в основном групповыми агглютинирующими сыворотками.
Для биохимической типизации сальмонелл применяют различные элективные среды: Эндо, Смирнова, Падлевского, Левина, Плоскирева и др. Более употребляемая из них среда Эндо. Ингредиентом ее является сахар-лактоза, а индикатором - фуксин, обесцвеченный сернистокислым натрием. Бактерии кишечной группы разлагают лактозу, а сальмонеллезные бактерии - не разлагают. При росте бактерий рода Е. coli на среде Эндо вследствие разложения лактозы и образования молочной кислоты восстанавливается красный цвет фуксина, чего не происходит при росте сальмонелл. В связи с этим колонии бактерий кишечной группы на среде Эндо будут красно-фиолетовыми с металлическим блеском, и среда вокруг колоний окрасится в красный цвет; сальмонеллы растут на этой среде в виде полупрозрачных колонии светло-розового цвета с голубоватым оттенком.
Для дальнейшей биохимической типизации сальмонелл применяют малый или большой пестрый ряд сред. В состав большого пестрого ряда входят: среды Гисса с различными сахарами и многоатомными спиртами, а также бульон с глицерином (по Штерну), среда с рамнозой (лакмусовое молоко и МПБ).
Бактериологическая диагностика сальмонеллеза основывается на обнаружении подвижных (кроме S. pullorum, S. gallinarum), грамотрицателъных палочек, не ферментирующих лактозу и сахарозу, по ферментирующих глюкозу и маннит с образованием кислоты и газа (S. typhinmurium маннит не ферментирует), а также характерном росте па элективных средах, дающих положительную реакцию агглютинации с О- и Н-сальмонеллезпыми сыворотками).
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


