Перивентрикулярная и субкортикальная лейкоэнцефалопатия у новорожденных

В процессе родовой деятельности будущего малыша поджидает множество опасных моментов. Одним из них является перивентрикулярная лейкомаляция – патологический очаг в головном мозге новорожденного, обусловленный недостатком поступления кислорода к его клеткам.
Преимущественное расположение перивентрикулярной зоны поражения – вдоль наружно-верхних отделов боковых желудочков органа. В дальнейшем они могут преобразоваться в кисты или полости, ведущие к тяжелым нарушениям центральной нервной системы малыша. Поэтому профилактике этой патологии уделяется большое внимание врачами во всем мире.
Причины и факторы риска
О важности первых 2–3 месяцев внутриутробного развития ребёнка знают большинство будущим мам. Однако последний триместр беременности также таит в себе множество опасностей для полноценного роста и формирования головного мозга человека.
Снижение поступления кислорода к мозговым клеткам обусловлено метеорологическими условиями, провоцирующими спазмы сосудов.

Другие факторы неврологического заболевания:
- эндокринные нарушения у будущей матери – к примеру, диабет;
- анемия беременных;
- авитаминозы;
- внутриутробное инфицирование плода;
- обильные кровотечения в момент родовой деятельности;
- резкие колебания кровяного давления у малыша;
- ранняя острая дыхательная недостаточность у новорожденного.
Тем не менее, главной причиной лейкомаляций головного мозга остается глубокая недоношенность. Поэтому основной упор акушеры-гинекологи делают на своевременную профилактику преждевременных родов и внутриутробной кислородной недостаточности.

Процесс формирования патологии
Для того чтобы понять, что такое ПВЛ и как с нею бороться, необходимо разобраться в механизме ее формирования. На фоне провоцирующих факторов в нервных клетках появляется патологический очаг – из-за кислородного голодания белое вещество органа отмирает. Полноценные нейроциты заменяются иными элементами, которые не способны выполнять те же функции.
Позже – через 7-14 суток на этом участке возникают перивентрикулярные кисты – полые или заполненные особой жидкостью. На завершающем этапе могут появляться рубцы на нервной ткани. Реже в боковых желудочках органа могут наблюдаться вторичные геморрагические инфаркты. В последующем пораженные участки полностью атрофируются.


Как правило, перивентриулярная лейкомаляция развивается в первые часы появления малыша на свет. Однако встречаются случаи, когда перивентрикулярный вариант патологии возникают позднее – до 5-7 суток от момента родов.
Поражение боковых желудочков головного мозга может происходить и внутриутробно – при беременности, сопровождающейся обострением пиелонефрита, гепатита. Для того чтобы этого избежать, женщине необходимо обращаться к наблюдающему за течением беременности врачу при первых же признаках ухудшения самочувствия.
Симптомы и признаки болезни
Заподозрить, что лейкомаляция головного мозга у новорожденных появилась, затруднительно – признаки перивентрикулярной патологии разнообразны и крайне неспецифичны. Тем не менее, недостаток поступления кислорода к нервным клеткам не протекает вовсе бессимптомно. Основные клинические признаки перивентрикулярной лейкомаляции:
- чрезмерная возбудимость новорожденного – крикливость, избыточная хаотичность движений;
- склонность к судорожным состояниям;
- вялость мышечных рефлексов.

У глубоко недоношенных детей симптоматика намного грубее:
- колебание температуры тела;
- вялость;
- повышенная сонливость;
- снижение аппетита;
- нарушение сна;
- парезы/параличи конечностей;
- дыхательные расстройства;
- зрительные нарушения – косоглазие.

Специалисты подчеркивают – проявления перивентрикулярной формы заболевания после острого периода могут стихать. Этот период мнимого благополучия длится до 8-9 месяцев. И только к году лейкомаляция головного мозга дает о себе знать дефицитом нервной деятельности. О течение патологического процесса свидетельствуют:
- недостаточная прибавка в весе;
- медленный рост;
- отставание в освоении навыков;
- несоответствие интеллекта возрасту;
- задержка психоречевого развития;
- выраженная эмоциональная лабильность.
Прогнозы и степень тяжести ПВЛ
Если женщине не удается доносить малыша до положенного срока – дети появляются на свет недоношенными. Родителям следует заранее подготовиться к правильному уходу за новорожденным.
Относительно благоприятным прогноз будет при легкой степени лейкомаляции головного мозга. В перивентрикулярной клинике преобладает дефицит внимания, а также гиперактивность – хаотичность движений конечностей. Тогда как моторное развитие – своевременность ползанья, ходьбы, переворотов сохраняется.

Специальные коррекционные мероприятия позволяют добиться компенсации расстройства, улучшить физическое и интеллектуальное развитие.
При среднетяжелом и тяжелом характере перивентрикулярной лейкомаляции малыш не будет соответствовать усредненным возрастным нормам – родителям следует быть к этому готовыми. Он позже начнет переворачиваться, присаживаться, ходить.
Затруднено и речевое развитие – слоги появятся позднее, предложения же будут практически недоступны. Иные проявления перивентрикулярной патологии:

- отсутствие естественного детского любопытства;
- болезненность и напряженность мышц конечностей;
- беспокойность, чрезмерная плаксивость;
- нарушение сна – прерывистость, частая путаность дня с ночью;
- грудное вскармливание затруднено – плохо выражен сосательный, а также глотательный рефлекс;
- отклонения в дательной системе – потребность в применении аппарата искусственного дыхания.
Тактика лечения
Поскольку очаги лейкомаляции подразумевают необратимую гибель нервных клеток, то каких-либо четких схем устранения подобных перивентрикулярных состояний не разработано. Специалисты придерживаются симптоматического подхода – лечение направлено на уменьшение выраженности негативных проявлений.

Перивентрикулярная лейкомаляция у недоношенных детей требует незамедлительного принятия мер по улучшению снабжения клеток кислородом. Для этого следует восстановить полноценный кровоток. Эффективные группы медикаментов:
- ноотропы – усиливают приток крови к нервным клеткам: Пирацетам;
- противосудорожные средства – Карбамазепин;
- витаминные комплексы;
- при высоком внутричерепном давлении – Диакарб;
- при повышенной плаксивости, нарушении сна – успокоительные лекарства на растительной основе, к примеру, Валериана, Мелисса.
Помимо медикаментозной терапии, врачи рекомендуют курсы лечебного массажа и физиотерапии. Обязательно проводятся коррекционные занятия с психологом, педагогами – для стимулирования памяти, мышления, внимания, а также речи.
При тяжелой степени перивентрикулярной болезни лечебные мероприятия будут проводиться в стационарных условиях – восстановление дыхательной, сердечнососудистой деятельности, компенсация внутричерепной гипертензии. В этом случае о благоприятном прогнозе речи уже вестись не будет.

Профилактика
Крепкое здоровье детей – это результат усилий их мам с первых дней, когда они узнали о своей беременности. Для того чтобы перивентрикулярная лейкомаляция не возникала, рекомендуется заранее принимать меры профилактики:
- соблюдать принципы здоровой жизни еще на этапе планирования беременности;
- придерживаться сбалансированного питания, с присутствием в рационе различных овощей и фруктов;
- отказаться от всех вредных привычек, особенно употребления табачной и алкогольной продукции;
- заранее пройти консультацию врача, сдать анализы на присутствие в организме скрытых инфекций;
- избегать тяжелых физических, психоэмоциональных нагрузок;
- укреплять защитные барьеры – принимать витаминные комплексы;
- хорошо высыпаться;
- свести к минимуму контакты с людьми, страдающими от заболеваний инфекционного характера.

Узнавшей о своей беременности женщине следует незамедлительно встать на учет к врачу, который будет ее наблюдать на всех этапах внутриутробного развития малыша. Профилактике различных патологий, в том числе и периветрикулярной лейкомаляции у новорожденных, специалистами системы здравоохранения уделяется огромное внимание – разработаны стандарты профилактических исследований у беременных.
Клиника, диагностика, прогноз, осложнения перивентрикулярной лейкомаляции
Таким образом, основные клинические симптомы ПЛ в раннем периоде — это: 1) снижение тонуса нижних конечностей, 2) возрастание тонуса в шейных разгибателях, 3) приступы апноэ и брадикардии, 4) гипервозбудимость, 5) псевдобульбарный паралич с бледностью конечностей и 6) судороги.
При электроэнцефалографическом (ЭЭГ) исследовании в начальной стадии у многих детей обнаруживается пароксизмальная активность и депрессия ЭЭГ. Данные ЭЭГ используются для прогноза последствий ПЛ. В то же время специфичность проявлений ПЛ на ЭЭГ низкая (в том числе на амплитудной интегрированной ЭЭГ).
Имеется классификация степеней тяжести ПЛ, основанная на данных нейросонографии (см. выше). Особую трудность представляет диагностика ПЛ в острой фазе, поскольку ореол повышенной перивентрнкулярной эхоплотности в норме присутствует у недоношенных новорожденных. Эти изменения могут исчезать в течение 2—3 недель после рождения и свидетельствовать о каких-либо нарушениях кровообращения в перивентрикулярных областях мозга.
Для диагностики и прогноза формирования ПЛ в настоящее время рекомендуют исследование в сыворотке крови мозгового нейротрофического фактора (BDNF) и специфического белка астроцитарной глии S-100. Повышение концентрации S-100 с высокой достоверностью позволяет прогнозировать развитие тяжелых структурных повреждений мозга, особенно при сочетании ПЛ с ВЖК, когда наблюдалось превышение показателей нормы в 10—12 раз. У новорожденных с ПЛ уровень сывороточной концентрации BDNF низкий.
Прогноз ПЛ. По моим и литературным данным, при ПЛ поражаются прежде всего кортико-спинальный тракт, зрительная и слуховая лучистости. Следствием ПЛ являются 1) ДЦП (чаще спастическая диплегия, при тяжелых поражениях квадриплегия), 2) задержка психомоторного развития, и 3) нарушения зрения (нарушения фиксации, нистагм, страбизм и др.). Могут нарушаться функции слуха. По данным О. Н. Малиновской и соавт. (2005), исходом ПЛ являются: 1) выздоровление (19,5 %), 2) детский церебральный паралич (ДЦП) (80,5 %), 3) судорожный синдром и эпилепсия (37,5 %) и 4) задержка психоречевого развития (66 %). Все дети с задержкой развития страдали ДЦП, причем чем значительнее двигательные нарушения, тем грубее нарушения психоречевого развития. У всех детей с 3 и 4 степенями тяжести по данным
НСГ развивался ДЦП. Такой исход как выздоровление может вызвать возражения, так как самое минимальное повреждение головного мозга при ПЛ сопровождается разрушением нервных волокон, их ретроградной дегенерацией, астроглиозом и др. Надо полагать, что не все случаи ПЛ по данным НСГ-исследования представляют случаи истинной ПЛ. В то же время такие последствия, как эпилепсия, вероятно, связаны с поражениями корковых структур и су- бикулюма гиппокампа, которые весьма чувствительны к гипоксии. Надо дифференцировать между собой последствия ПЛ и последствия других сопутствующих поражений головного мозга, что представляет трудную задачу.
По данным J. Volpe (2003), 10 % выживших глубоко недоношенных детей (массой до 1500 г) с ПЛ страдают ДЦП, а 50 % в дальнейшем имеют психомоторные нарушения.
При ДЦП по данным НСГ определяют 5 основных типов нарушений: ПЛ (33,1 %), постгеморрагическую порэнцефалию, аномалии развития, кортикальную и субкортикальную атрофию, повреждения базальных ганглиев (Гайнетдинова Д. Д., 2001). ПЛ и ДЦП — это разные нозологические единицы. По моим данным, после перенесенной ПЛ формируются кисты в белом веществе мозга с характерным преобладанием в определенных отделах мозга (см. топографию), в той или иной степени атрофируется белое вещество, а при тяжелой степени поражения гипоплазируются мозолистое тело, кора больших полушарий и расширяются боковые желудочки (возникает вентрикуломегалия).
Считают, что ДЦП формируется у всех детей с ПЛ, не удерживающих голову к 6 мес. скорригированного возраста. Причем от степени тяжести ПЛ зависит прогноз неврологических нарушений. При ПЛ 1 степени все дети самостоятельно передвигались, при ПЛ 2-й степени передвигались самостоятельно или с поддержкой 80 % детей, а при 3-й степени — только 15 % детей передвигались самостоятельно, а 45 % больных не передвигались и не могли сидеть самостоятельно.
Для профилактики ПЛ рекомендуется антенатальная диагностика хориоамнионитов с последующим введением матери на 24-31 неделях беременности бетаметазона, положительно влияющего на защитную реакцию плода при воспалении. Важно предупреждать преждевременные роды, не употреблять наркотики (кокаин), диагностировать внутриутробные инфекции, предупреждать пролонгированную гипокарбию при искусственной вентиляции легких и т. д.
Многие исследовали указывают на роль фактора некроза опухоли (ФНО) в развитии ПЛ (вызывает артериальную гипотензию, усиливает интраваскулярную коагуляцию, способствует гибели олигодендроцитов и т. д.). В то же время кортикостероиды блокируют продукцию ФНО астроцитами и снижают его активность, что позволяет считать обоснованным их применение при лечении и профилактике ПЛ. Однако имеются данные, что раннее введение дексаметазона у недоношенных детей при СДР коррелирует с развитием ПЛ. При ранней терапии дексаметазоном в первые три дня жизни возрастает частота неврологических осложнений и ДЦП. Поэтому рекомендуется использовать этот препарат после 2-й недели жизни или применять альтернативные препараты (будесонид, пулимикорт) и ингаляционные стероиды (флутиказон, беклометазон).
В терапии ПЛ важно использовать препараты, улучшающие мозговое кровообращение (винпоцетин, стугерон, ницерголин) и ноотропы (пирацетам). При респираторном дистресс-синдроме целесообразно назначение препаратов сурфактанта, уменьшающих тяжесть дыхательных расстройств и уменьшающих потребность в ИВЛ, а тем самым снижающих риск возникновения новых очагов ПЛ. В терапии ДЦП, возникших вследствие ПЛ, рекомендуется использование церебролизина (Гайнетдинова Д Д., 2001), обладающего антикласто- генной и антиоксидантной активностью. Все разработки по лечению церебральной ишемии и гипоксически-ишемической энцефалопатии 3-й степени целесообразно применять и при лечении ПЛ.
Лейкоэнцефалопатия – это такое заболевание, которое приводит к повреждению белого вещества, составляющего основу головного мозга, что провоцирует многочисленные неврологические синдромы. Характеризуется быстрым прогрессированием и развитием демиелинизирующих патологических процессов.
Определение патологии
Лейкоэнцефалопатия всегда сопровождается поражением белого мозгового вещества, которое возникает вследствие разных причин: сосудистых патологий, инфицирования полиомавирусом, генных мутаций. Инфекционная форма развивается из-за реактивации полиомавируса JC, который в латентном состоянии находится в организме многих людей.
Наследственная форма заболевания аутосомно-рецессивного генеза возникает на фоне генной мутации (преимущественно гена EIF2B5). Мелкоочаговая лейкоэнцефалопатия сосудистого генеза – это такое заболевание, которое развивается вследствие поражения небольших элементов кровеносной системы мозга, что провоцирует характерные для гипоксически-ишемического поражения тканей симптомы.
Классификация заболевания
Различают формы патологии в зависимости от причин возникновения. Сосудистая форма лейкоэнцефалопатии, известная как болезнь Бинсвангера – это такое заболевание головного мозга, которое носит прогрессирующий характер, развивается на фоне гипертонической болезни, что указывает на ведущую роль в патогенезе атеросклероза и других патологий сосудов.
Клиническая картина напоминает проявления субкортикальной (подкорковой) энцефалопатии артериосклеротической этиологии. Патогенез связан с поражением белого вещества на фоне атеросклероза мелких артерий и артериол, вследствие чего происходит утолщение сосудистых стенок и сужение просвета, развивается гиалиноз – белковая дистрофия с замещением нормальной ткани более плотной, малоэластичной структурой.
Типичные осложнения: ТИА (преходящие нарушения мозгового кровообращения), инсульты. Третья часть всех клинических случаев сосудистой деменции обусловлена мультифокальной лейкоэнцефалопатией. В 80% случаев возраст пациентов составляет 50-70 лет. Очаговое поражение белого вещества инфекционного генеза возникает вследствие реактивации вируса JC.
Перивентрикулярная лейкоэнцефалопатия, известная как перивентрикулярная лейкомаляция, характеризуется возникновением очагов поражения белого вещества чаще возле желудочковой системы. При масштабном поражении очаги распространяются в центральные отделы белого вещества.
Демиелинизирующий процесс агрессивного, длительного течения приводит к образованию некротических полостей в мозговых структурах. Лейкоэнцефалопатия (лейкомаляция) головного мозга, обнаруженная у детей, часто является причиной развития в детском возрасте церебрального паралича (ДЦП).
Причины возникновения
Основная причина развития формы инфекционного генеза – реактивация полиомавируса. Это безоболочечный вирус JC, который обнаруживается у 80% населения. Обычно не вызывает развитие заболеваний. В этом случае инфицированные люди являются носителями. Активация происходит на фоне подавления деятельности иммунной системы, часто у пациентов с диагнозом ВИЧ.
Инфицирование ВИЧ часто сопровождается типичным симптомом – развитием многоочаговой лейкоэнцефалопатии с прогрессирующим течением патологии. Заболевание возникает как результат терапии иммуномодуляторами (после имплантации органов), иммуносупрессорами или моноклональными антителами, из-за чего происходит угнетение иммунной системы.
Терапия при помощи моноклональных антител проводится в отношении рассеянного склероза, аутоиммунных заболеваний крови, неходжкинской лимфомы, артрита ревматоидной формы. Вирус JC попадает в организм через органы желудочно-кишечного тракта с зараженной водой и пищей или воздушно-капельным путем. Процесс инфицирования протекает бессимптомно.
Вирус пребывает в организме латентно до появления факторов, провоцирующих активацию. Провоцирующие факторы ассоциируются с пересадкой стволовых клеток и лечением препаратами – аналогами пурина (Фопурин, Меркаптопурин, Пуринетол). Мелкоочаговая лейкоэнцефалопатия, которая развилась на фоне сосудистых патологий, обычно спровоцирована факторами:
- Артериальная гипертензия, длительно протекающая, устойчивая.
- Артериальная гипотензия.
- Патологическое изменение циркадного (биологического) ритма артериального давления – резкое повышение или понижение показателей давления в ночное время.
Патологические изменения в мозговых структурах происходят в результате хронической гипоксии – кислородного голодания. Вероятные причины включают врожденные аномалии развития элементов сосудистой системы, возрастные деформации, посттравматические дефекты и другие нарушения, провоцирующие ухудшение церебрального кровотока.
Симптоматика
Мелкоочаговая энцефалопатия инфекционного генеза характеризуется отсутствием признаков воспалительного процесса в мозговом веществе. Проникая в ЦНС вирус вызывает лизис (растворение) олигодендроцитов, что приводит к масштабной демиелинизации – повреждению миелиновых оболочек.
Инфицированные олигодендроциты располагаются по краям очага демиелинизации. Постепенно патологический процесс охватывает обширные участки мозга, что провоцирует нарастающее развитие неврологической симптоматики:
- Гемипарезы (парезы в одной стороне тела).
- Гемисоматосенсорные расстройства (нарушение чувствительности – онемение, покалывание, изменение восприятия температуры, изменение реакции на болевые раздражители, искажение пространственного представления о положении отдельных частей тела относительно друг друга).
- Эпилептические припадки. Наблюдаются у 20% больных, что указывает на близость очага к коре.
В зависимости от локализации очага поражения появляются такие симптомы, как атаксия (нарушение согласованности при сокращении группы мышц), афазия (речевая дисфункция), зрительные расстройства, апраксия (нарушение целенаправленных движений), дисметрия (избыточность или недостаточность при выполнении произвольных движений). Для патологии типичны когнитивные расстройства, нередко перерастающие в деменцию.
Поражение тканей полушарий с соответствующей симптоматикой в клинической практике встречается в 10 раз чаще, чем стволовых структур. В ходе исследования МРТ обнаруживаются крупные субкортикальные (подкорковые) очаги – гиперинтенсивные (режим Т2) и гипоинтенсивные (режим Т1). С увеличением диаметра очага неврологический дефицит нарастает. Сосудистая лейкоэнцефалопатия сопровождается симптомами:
- Когнитивные расстройства (ухудшение памяти и умственной деятлеьности) с тенденцией к прогрессированию.
- Атаксия, моторная дисфункция.
- Нарушение двигательной координации.
- Недержание мочи, непроизвольная дефекация.
Для поздних стадий течения заболевания свойственно развитие слабоумия. Больные теряют способность к самообслуживанию, круглосуточно нуждаются в медицинской помощи. У больных отсутствует интерес к речевой, двигательной, познавательной, психической деятельности. Периодически возникает чувство эйфории. У некоторых пациентов происходят эпилептические припадки.
Для болезни Бинсвангера типична тенденция к прогрессированию. Нередко наблюдаются длительные периоды стабильного состояния. Слабоумие развивается из-за нарушения корково-подкорковых связей, которые возникают вследствие повреждения белого вещества. Не последнюю роль в патогенезе играет дисфункция таламуса и базальных ганглиев.
Очаговая лейкоэнцефалопатия – это такое заболевание, для которого характерно изменение походки, что указывает на поражение сосудистого генеза экстрапирамидной системы. Походка больного становится медленной, семенящей, шаги укорачиваются, наблюдается постуральная дисфункция – затруднение движения на поворотах. Пациенту сложно инициировать (начать) движение. Иногда двигательные расстройства проявляются по типу паркинсонизма (ригидность, скованность мышц, тремор).
Симптоматика дополняется гемипарезами (парез в одной половине тела) и псевдобульбарным синдромом (дизартрия – нарушение произношения, дисфония – ослабление силы голоса, дисфагия – затруднения при глотании, непроизвольный плач или смех). Для постановки диагноза многоочаговая лейкоэнцефалопатия сосудистой этиологии необходимо наличие признаков:
- Деменция.
- Факторы риска развития сосудистых заболеваний или признаки сосудистой патологии, затронувшей кровеносную систему мозга.
- Неврологические синдромы, характерные для поражения субкортикальных (подкорковых) структур мозга (изменение походки, недержание мочи, паратония – непроизвольное сопротивление пассивным движениям).
Исследование КТ показывает двухсторонний лейкоареоз – малую ишемию сосудов, повреждения элементов сосудистой системы белого вещества. При перивентрикулярной лейкоэнцефалопатии на МР-томограмме различается диффузно-очаговое поражение белого вещества преимущественно симметричное.
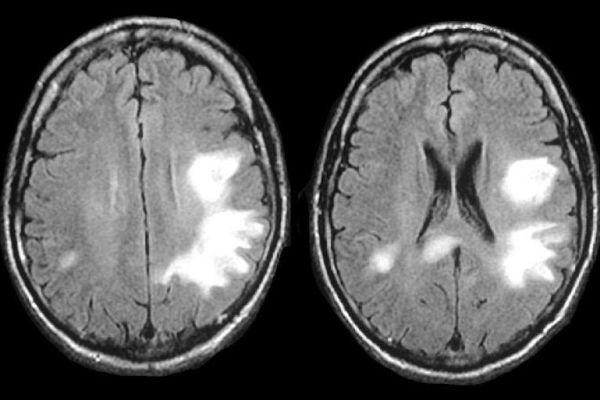
Для сравнения при вирусном поражении очаги расположены преимущественно ассиметрично. Единичный неспецифический очаг лейкоэнцефалопатии может быть ошибочно расценен, как проявление инсульта.
Методы диагностики
Ранняя диагностика JС-ассоциированной инфекции позволяет своевременно начать лечение. Нейровизуализация остается приоритетным способом обнаружения участков патологически измененной ткани. Основные методы инструментальной диагностики:
- МРТ, КТ.
- Допплерография сосудов мозга.
- Электроэнцефалография.
- Биопсия. Исследование мозгового биоптата. Чувствительность метода оценивается в 64-90%.
Исследование типа ПЦР помогает обнаружить ДНК вируса. Чувствительность метода оценивается в 72-92%.
Способы лечения
Лечение патологии сосудистого генеза предполагает устранение причин, спровоцировавших развитие заболевания. Чаще назначают лекарства и другие методы терапии, направленные на стабилизацию повышенного или пониженного артериального давления. Показаны препараты:
- Улучшающие микроциркуляцию крови в мозговых структурах.
- Стимулирующие метаболические процессы в клетках мозга.
- Устраняющие неврологическую симптоматику.
Параллельно проводится терапия атеросклероза и сопутствующих соматических болезней. Специфического лечения при вирусной форме не существует. Эффективными мерами считаются:
- Прекращение приема иммуносупрессоров (кортикостероиды, цитостатики). Или уменьшение их дозировки.
- Отмена Натализумаба – препарата на основе моноклональных антител, если реактивация вируса произошла вследствие его применения. Параллельно рекомендуется проведение плазмафереза до 5 сеансов ежедневно для выведения препарата.
- Назначение Мефлоцина (антималярийный препарат). Некоторые исследования показывают эффективность лекарства, которое замедляет репликацию (размножение) вируса JС.
Антидепрессант Миртазапин ингибирует обратный захват серотонина, препятствует распространению вируса JС. Механизм действия основан на блокировании рецепторов 5-НТ2, которые являются мишенью для полиомавируса.
Прогноз
Сколько живут при диагнозе лейкоэнцефалопатия головного мозга, зависит от причин развития и характера течения патологии. Прогноз продолжительности жизни составляется индивидуально лечащим врачом с учетом возраста и физического состояния пациента. Прогноз заболевания сосудистого генеза условно благоприятный. Своевременная коррекция сосудистых нарушений позволяет отсрочить масштабное повреждение белого вещества.

При диагнозе ВИЧ лейкоэнцефалопатия, обусловленная вирусом, занимает второе место среди причин смертности, уступая только неходжкинской лимфоме. Многочисленные результаты аутопсии показали отсутствие прямой связи между смертностью и морфологическими особенностями строения очагов (размеры, локализация, степень атрофии тканей, гидроцефалия) при вирусной форме болезни.
Профилактические мероприятия
Для профилактики патологии больным рассеянным склерозом, которым проводится терапия Натализумабом, назначают превентивное обследование на наличие вируса JС. Профилактические меры включают общие рекомендации по укреплению иммунитета:
- Закаливающие процедуры.
- Отказ от вредных привычек.
- Организация здорового, полноценного питания.
- Активный образ жизни, дозированные физические нагрузки.
Предотвращение родовых травм в перинатальный период и повреждений в области головы во взрослом возрасте, систематический контроль и коррекция значений артериального давления помогут избежать осложнений и быстрого прогрессирования заболевания.
Лейкоэнцефалопатия – прогрессирующий процесс разрушения белого вещества. Ранняя диагностика и корректная терапия патологии сосудистого генеза способствует значительному улучшению состояния больного.
Читайте также:


