Резистентность к метронидазолу трихомонады
Из числа инфекций, передающихся преимущественно половым путем, ведущее место занимает мочеполовой трихомониаз. По данным Ивановой М.А., Виноградовой С.А. с соавторами за период с 1997 по 2008 гг. наибольшую долю в структуре заболеваемости ИППП занимал трихомониаз. Пик заболеваемости трихомониазом был отмечен в1995 г. (344,3 на 100 тыс. населения). С2000 г. вновь началось снижение показателей с 319,7 (в2000 г.) до 167,4 на 100 000 населения в2008 г.
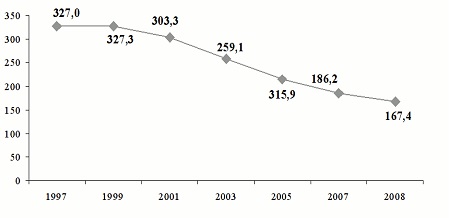
Рис. 3. Динамика заболеваемости урогенитальным трихомониазом в Российской Федерации за 1997-2008 гг. (на 100 000 соотв. населения)
Превышение среднероссийского показателя сегодня отмечается в Сибирском (293,7 на 100 000 населения) и Уральском (181,4 на 100 000 населения) федеральных округах.
Распространенность трихомониаза велика и до конца не учтена. Еще в1962 г. И.И. Ировец сообщал, что трихомониазом поражено до 10% населения Земли.
По суммарным данным ВОЗ, в мире ежегодно заболевают 180-200 млн человек. Среди проституток, а также женщин с белями процент больных МТ достигает 70-80%; при скрининговом обследовании различных контингентов выявлялось до 5—30% женщин, больных трихомониазом, и до 6-15% мужчин — носителей трихомонад.
Значимость трихомонадной инфекции обусловлена не только ее широкой распространенностью, но и способностью вызывать ряд тяжелых осложнений.
- бесплодие;
- воспалительные заболевания органов малого таза у женщин;
- простатиты, эпидидимиты, стриктуры уретры у мужчин;
- преждевременный разрыв околоплодных оболочек;
- рождение детей с пониженной массой тела;
- риск возникновения рака шейки матки и передачи ВИЧ- инфекции.
- сексуальные расстройства.
Необходимо также учитывать тот факт, что трихомонады могут фагоцитировать и резервировать различные патогенные и условно-патогенные микроорганизмы, способствуя распространению других ИППП).
Клиническая картина мочеполового трихомониаза, по мнению ряда авторов, претерпевает патоморфоз, характеризуясь, обилием стертых и малосимптомных форм.
В ходе практической работы и при обзоре литературных данных нами отмечены возможные основные причины неудачного лечения трихомониаза и увеличение количества рецидивов заболевания:
- возникновение резистентных к антипротозойным препаратам штаммов T. vaginalis, несомненно связанно с чрезмерно широким, нередко необоснованным применением препарата в общей медицинской практике;
- снижение активности метронидазола за счет захвата активных нитрорадикалов микроорганизмами, входящими в состав микробиоциноза урогенитального тракта;
- низкая концентрации протистоцидных средств, попадающих в очаги хронического воспаления, в связи с нарушением васкуляризации и развитием рубцовых изменений;
- патология желудочно-кишечного тракта,
- низкая эффекторная функция иммунной системы;
- недостаточно высокая комплаентность пациентов.
- у пациентов с хроническим урогенитальным трихомониазом развивается дисбиоз уретры, проявляющийся изменением видового и количественного состава условно-патогенной микрофлоры. После успешной эрадикации трихомонад воспалительный процесс может сохраняться, поддерживаясь сопутствующей микрофлорой и создавая у врача ложное представление о неэффективности лечения.
- нельзя исключать возможность реинфекции, если оба партнера начали лечение неодновременно или появился новый половой партнер;
- К сожалению, проблема фальсификации лекарственных средств, а также появлением большого количества дженериков.
- вероятность ложноположительных результатов лабораторных тестов, использованных для постановки диагноза заболевания (некорректная трактовка результатов ИФА).
Вот уже 50 лет метронидазол используется в лечении трихомониаза и анаэробных инфекций. По литературным данным, неэффективность лечения трихомониаза метронидазолом составляет до 44%.
Некоторые авторы приводят более впечатляющие результаты; так, по данным дерматовенерологической клиники Новосибирского мединститута, в 1995-1996 гг. рецидивы после полноценного лечения нитроимидазолами достигали 47%.
Уже опубликованы сообщения о более чем 100 резистентных к метронидазолу штаммах из США, порядка 20 устойчивых штаммов описаны европейскими учеными, в том числе российскими.
Описывается также перекрестная устойчивость к тинидазолу и орнидазолу, что свидетельствует о формировании устойчивости ко всей группе 5-нитроимидазолов. В то же время за неимением альтернативных схем лечения предпринимаются попытки лечить трихомониаз, вызванный устойчивыми к метронидазолу штаммами, увеличивая дозировки применяемых схем метронидазола, однако такие попытки редко оказываются успешными.
Известно, что устойчивость – это результат мутации и формирования новых резистентных штаммов. Все чаще появляются публикации, связывающие устойчивость T. vaginalis с ее инфицированием РНК-вирусами. Инфицированные изоляты близки друг к другу при оценке молекулярного строения. Эти изоляты чаще всех остальных оказываются резистентными к группе препаратов 5-нитроимидазолов.
Наиболее сложным вопросом терапии современного трихомониаза является выбор эффективного этиотропного средства. Несмотря на многочисленные публикации результатов изучения эффективности противотрихомонадной терапии, выбор конкретных препаратов на отечественном рынке остается весьма ограниченным.
Таким образом, несмотря на рекомендации, приведенные в отдельных публикациях, отсутствие доказательных данных об эффективности и безопасности препаратов, не принадлежащих к группе 5-НИ, в терапии трихомонадной инфекции, в т. ч. ее рефрактерных форм, не позволяет рекомендовать их использование у пациентов с данной патологией, за исключением случаев, когда другие терапевтические альтернативы исчерпаны.
Обобщение собственного опыта, отечественных и зарубежных дерматовенерологов показывает, что для более успешного лечения трихомониаза необходимо соблюдать следующие положения:
- лечить следует одновременно всех половых партнеров, даже при отсутствии клинических и лабораторных признаков заболевания;
- употребление алкоголя и половая жизнь в период лечения исключаются;
- схема лечения определяются с учетом сопутствующих соматических заболеваний, возраста и веса больного;
- тактика лечения зависит от формы течения заболевания (острый или хронический процесс), локализации воспалительного процесса и наличия смешанной инфекции, а также данных клинико-лабораторного обследования больных..
В Европейском руководстве по заболеваниям, передаваемым половым путем, отмечено, что при персистирующих и рецидивирующих симптомах, связанных с урогенитальным трихомониазом, часто у пациенток, у которых первый курс не дает эффекта, эффективным бывает второй курс стандартного лечения метронидазолом. Перед повторным курсом метронидазола необходимо провести эмпирическое лечение эритромицином или амоксициллином для снижения уровня b-гемолитических стрептококков, поскольку некоторые микроорганизмы, присутствующие во влагалище, могут снижать эффективность метронидазола, захватывая активную нитрогруппу. Это и есть так называемая относительная резистентность к терапии, когда излечение наступает после повторного назначения того же метронидазола после устранения, с помощью антибиотиков, кокковой флоры, являющейся истинной причиной неэффективности первого курса терапии.
Если повторно проведенное лечение вновь оказывается неэффективным, то согласно Европейскому руководству по заболеваниям, передаваемым половым путем, эффективного лечения не существует.
необходимости в местном лечении, так как достаточно общего лечения для ликвидации воспалительных явлений и эрадикации возбудителя
Что касается иммунокоррекции при трихомониазе, то следует отметить, что недостаточно изучен иммунопатогенез, роль клеточных, цитокиновых факторов иммунитета и интерферонового статуса.
А в тоже время назначаемые довольно часто иммунотропные и иммуномодулирующие препараты из разных фармокологических групп имеют как ни странно одинаковые показания в терапии хронических форм трихомониаза. Анализ практических и литературных данных позволил нам выделить следующие основные принципы применения иммуномодуляторов:
Перед назначением ИМ целесообразно выявить у больного клинические и лабораторные признаки нарушений иммунитета;
- Установить причину формирования иммунодефицита и степень его влияния на иммунную систему.
- Препараты не применяются самостоятельно, а лишь дополняют традиционную терапию.
- Перед назначением ИМ обязательна оценка характера иммунологических нарушений у больного.
- Принимать во внимание зависимость изменений иммунологических показателей от возраста, биологических ритмов больного и других причин.
- Учитывать иммунотропные эффекты традиционных лекарственных средств.
- Выраженность эффекта коррекции в остром периоде выше, чем в стадии ремиссии.
- Продолжительность устранения иммунологических нарушений составляет от 30 дней до 6-9 месяцев и зависит от свойств препарата, маркерного показателя и характера заболевания.
- При многократном введении ИМ спектр их действия сохраняется, а выраженность эффекта возрастает.
- Препараты полностью реализуют свои эффекты только при использовании в оптимальных дозах.
Таким образом, в решении задач излеченности и уменьшения количества рецидивов трихомониаза, мы видим в своевременном выявлении и профилактике вышеназванных причин неудачного лечения и в необходимости применения комплексной терапии, включая оптимальное этиотропное, патогенетическое, физиотерапевтическое, адекватное иммунотропное и местное лечение.

Длительное применение (начиная с 1959 года) метронидазола в качестве противопротозойного препарата при лечении урогенитального трихомониаза привело к формированию устойчивых форм Trichomonas vaginalis. Опубликованы сообщения о более чем 100 резистентных к метронидазолу штаммах из США, порядка 20 - описаны европейскими учёными [6, 13]. До сих пор неясны механизмы развития резистентности простейшего к метронидазолу. Согласно мнению некоторых авторов [1, 10, 11, 12], лекарственная устойчивость Tr. vaginalis может быть обусловлена в первую очередь снижением активности пируват-ферродоксин-оксиредуктазы микробной клетки, что приводит к снижению накопления цитотоксических нитро-радикальных ионных интермедиатов. Другие исследователи этого феномена утверждают, что резистентность может быть связана с нарушением транспортных систем клетки, включая феномен выброса, либо с тем, что в состав микробиоценоза половых органов могут входить микроорганизмы, способные захватывать нитрогруппы и тем самым снижать активность метронидазола и его аналогов [5, 6, 8, 9].
Наши экспериментальные исследования позволяют предположить о существенной роли цитоплазматической мембраны (ЦПМ) простейшего в формировании популяции резистентных штаммов Trichomonas vaginalis. Адаптивные изменения ЦПМ являются проявлениями наследуемой модификационной изменчивости [2, 3, 4, 7].
Целью наших исследований было изучение формирования резистентности Trichomonas vaginalis к метронидазолу.
Поставленная цель требовала решения следующих задач:
1. Выделение и изучение in vitro предположительно резистентных форм Trichomonas vaginalis в клинических изолятах, полученных от неизлеченных больных.
2. Получение устойчивых к метронидазолу штаммов Trichomonas vaginalis при длительном проточном культивировании.
3. Изучение роли цитоплазматической мембраны простейшего в формировании лекарственной устойчивости.
4. Выявление модификационного характера резистентности урогенитальной трихомонады к метронидазолу.
Материалы и методы исследования
Исходя из поставленной цели и соответствующих задач, нами были проведены две серии опытов на проточной культуре урогенитальной трихомонады в период с 2009 по 2011 г. главным образом на базе ЛКЦ г. Саратова. Проточное культивирование осуществлялось на ферментёре собственной конструкции, проходящей в настоящее время процедуру патентования.
В ходе данной серии опытов нами было осуществлено длительное культивирование паразита, результатом которого стало получение чистых культур Tr.vaginalis. Впоследствии каждая из 32 культур была подвержена действию трихомонацидных концентраций метронидазола и тинидазола. Используемые концентрации (метронидазол 2,0 мкг/мл; тинидазол 1,0 мкг/мл) были получены методом серийных разведений. Исходная концентрация препаратов составляла 1:1000, а каждая последующая в 2 раза ниже, чем предыдущая. Длительность культивирования в первой серии опытов зависела от группы пациентов и составляла от 7 до 21 суток.
Результаты исследования и их обсуждение
В ходе проведения первой серии опытов мы наблюдали элиминацию паразита при воздействии на него противопротозойными препаратами, согласно схемам лечения рекомендаций СDC от 2006 г. Полученные результаты отображены в диаграмме.
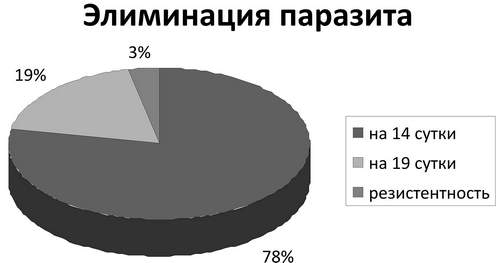
При концентрации метронидазола 2,0 мкг/мл гибель Tr.vaginalis происходила на 14 сутки в изолятах от двадцати одного пациента 1-й группы и четырёх пациентов 2-й группы, что составило 78 % от всех культур. В оставшихся изолятах наблюдали умеренный рост простейшего. Эти штаммы были подвергнуты действию тинидазола в концентрации, равной 1,0 мкг/мл в течение 5 суток, после чего наблюдали элиминацию паразита на 19 день опыта в изолятах, взятых у пяти больных из 1-й группы и одного больного из 2-й группы соответственно, составляющих в целом 19 % от всех культур. В одном изоляте (3 % от всех культур) от одного пациента 2-й группы наблюдали продолжение роста и жизнедеятельности, несмотря на проводимую противопротозойную терапию, что может свидетельствовать о развитии резистентности простейшего в данной культуре. Эксперимент был завершён на 30 сутки.
Во второй серии опытов при воздействии только метронидазолом на изоляты, полученные от половины пациентов, наблюдалось экспотенциальное снижение количества клеток простейшего на выходе из ферментёра с дальнейшей тотальной элиминацией на 14-17 сутки культивации. При комплексном воздействии метронидазола и ЭМИ на оставшиеся изоляты наблюдались следующие явления. На 7-е сутки культивирования в условиях комплексной обработки происходило значительное увеличение клеток простейшего в отделяемой из ферментёра культуральной жидкости (до 2,6 млн/мл, при контроле - 430-600 тыс. клеток/мл). На 14-17 сутки непрерывного культивирования наблюдалось снижение количества клеток трихомонад до 150-210 тыс. в мл. На 21 сутки в отделяемом из ферментёра клетки простейшего не определялись, но выявлялись паразиты из субстратов носителей ферментёра в количестве 300-380 клеток на мл. Они имели округлую форму и размеры 8-10 мкм. Пересев этих штаммов на стационарную среду давал рост трихомонад, устойчивых к метронидазолу. Дальнейшая культивация данных штаммов Tr.vaginalis в условиях проточного культивирования при отсутствии экзогенных лекарственных и ЭМИ воздействий на 40-60 сутки приводила к возвращению чувствительности паразита к 5-НИ.
В опытах на полученных нами резистентных штаммах трихомонад по измерению утечки УФ-поглощающего вещества (Fe2O3) было установлено, что в супернатанте концентрация этого соединения была выше, чем в культурах с нерезистентными штаммами, что свидетельствовало об усилении барьерной функции мембран клеток простейшего и уменьшении диффузии оксида железа в цитоплазму. Общеизвестно, что ЭМИ изменяют вязкость липидной компоненты мембран, энергетическую активность мембран, которые принимают активное участие во всех функциях организма. Под действием лазерного и КВЧ излучений изменяется форма билипидного слоя клеточных мембран, что приводит к переориентации головок липидов и, как следствие, уменьшению диффузной проницаемости. Перечисленные процессы могут лежать в основе феномена наследуемой модификационной изменчивости, приводящей к временной резистентности трихомонад к 5-НИ [2, 4].
1. Низкая комплаентность пациентов и хронические формы трихомониаза не являются достоверной причиной формирования резистентности урогенитальной трихомонады к 5-НИ.
3. Комплексное воздействие 5-НИ и ЭМИ при длительном проточном культивировании позволяет создать условия для формирования устойчивых к 5-НИ форм Trichomonas vaginalis.
4. У резистеных штаммов наблюдали увеличение барьерных функций цитоплазматических мембран, что говорило о роли ЦПМ в формировании резистентности к 5-НИ.
5. Выявленная резистенность носила временный характер, что говорит о принадлежности её к наследуемой модификационной изменчивости, характерной для простейших.

Начиная с 1959 года, основным эффективным оружием в борьбе с возбудителем трихомониаза Trichomonas vaginalis, был метронидазол и многочисленные дженерики, производные 5-нитроимидазола [11, 13, 14].
Вполне естественно, что это привело к микроэволюционным процессам в популяции Простейшего, отличающегося, сложным мобильным геномом и появлению устойчивых форм Trichomonas vaginalis. [6, 9, 12, 15, 19, 20, 21]. Этот факт стал известен довольно давно, но, тем не менее, до сих пор не признаётся как практикующими врачами (в первую очередь) так и учёными специалистами в области венерических болезней.
Между тем было выяснено, что устойчивость урогенитальной трихомонады к 5-НИ препаратам может быть обусловлена извращением активности пируват-ферродоксин-оксиредуктазы простейшего паразита, что приводит к снижению накопления цитотоксических нитро-радикальных ионных интермедиатов [1, 8, 9, 12].
Исследования Barrientes показали, что в основе механизмов резистентности может быть нарушение транспортных систем клетки, включая феномен выброса [18].
Не исключено, что в состав микрофлоры мочеполовых трактов мужчин и женщин при определённых условиях появляются микроорганизмы, блокирующие нитрогруппы метронидазола и других препаратов этого ряда [11, 12, 18, 20, 21].
Начиная с 2011 года нами проводились оригинальные экспериментальные исследования по изучению формирования резистентности простейшего при проточном культивировании in vitro, в условиях максимально приближенных к естественным, in vivo [3, 4, 5].
Кроме того, был выявлен ещё один вполне вероятный механизм возникновения резистентности микропаразита – изменение проницаемости клеточной мембраны [4, 7].
К сожалению публикации не получили должного резонанса, тем более что эти эксперименты подтверждали выводы профессора С.Г. Инге-Вечтомова о наличие у простейших неканонической изменчивости, играющую громадную роль в их адаптации к воздействиям внешней среды [10].
В связи с отсутствием на сегодня альтернативных метронидазолу препаратов, возможно, полезно обратиться к истории отечественной венерологии и вспомнить как лечили социально значимое заболевание трихомониаз до появления препаратов 5-НИ ряда [6, 7, 16, 19, 20].
В 1836 году французский врач Альфред Донне описал простейшего, жгутиконосца, которого обнаружил в соскобах из женских половых путей при остром воспалении последних, изначально полагая, что оно вызвано гонореей [11].
Приблизительно в 1845 году немецкий натуралист-зоолог Эренберг дал таксономическое название этому простейшему – Trichomonas vaginalis – влагалищная трихомонада. Существенную роль в формировании этиологических представлений о трихомониазе и механизмах его развития и лечения сыграли исследования отечественных учёных медиков – И.П. Лазаревича и К.Ф. Славянского [7, 19].
В 1927 г., чешский венеролог Capek сообщил о двух случаях трихомонадного уретрита у мужчин, возникшего вследствие полового общения с женщинами, страдавшими трихомонадным кольпитом. Ему также принадлежит мысль о необходимости лечения при этой инфекции обоих супругов [7, 11].
Следует отметить, что, несмотря на выявление влагалищных трихоманад в мочеполовой системе, как у мужчин, так и женщин, эти организмы длительное время не считали этиологическим фактором развития воспалительных заболеваний. Лишь в начале XX века признана патогенность урогенитальных трихомонад и возможность их передачи половым путем.
В тоже время среди практикующих врачей стало бытовать убеждение в том, что трихомониаз не является моноэтиологической патологией и что хронически персистирующая трихомонада не нуждается в удалении. Такое мнение есть не что иное, как возврат к далекому прошлому.
До 1927 года на трихомониаз мужчин уже существовал взгляд как на сапрофитное носительство [11].
У мужчин трихомонады поражают уретру, семенные пузырьки, предстательную железу, купферовы железы, мочевой пузырь и почечные лоханки [11].
У женщин наружные половые органы, слизистую влагалища, цервикальный канал, уретру, бартолиновые железы, мочевой пузырь, яичники [11].
Как у женщин, так и у мужчин возможна хронизация инвазии, причём у мужчин чаще отмечается хроническое течение трихомонадной инвазии, приводящей к бесплодию [7, 11].
Так или иначе, с начала 20-го века дерматовенерологии, урологи и гинекологи стали понимать, что влагалищная трихомонада, хоть и относится к Простейшим, далеко не проста, и способна доставлять серьёзные неприятности заболевшим людям [7, 11, 16].
Как же лечили трихомониаз на протяжении более 50 лет до внедрения в практику метронидазола?
Трихомониаз рассматривали как одно из упорных и трудноизлечимых заболеваний мочеполового тракта человека. Это объяснялось как отсутствием специфических противопротозойных препаратов, так и слабой системой борьбы с инфекциями передаваемыми половым путем [15, 16].
Пероральные и парентеральные методы лечения в дометронидазольный период были малоэффективны. Лечение трихомониаза проводили практически только местно.
В этих целях использовали более 300 лекарственных препаратов, главным образом мышьяка (осарсол, аминарсол) и нитрофуранов. Хорошие результаты давал отечественный противотрихомонадный препарат нитазол, который назначался как местно, так и перорально. Женский трихомониаз довольно успешно излечивали растительным алкалоидом лютенурином [7, 11].
Фитотерапия широко использовалась в лечении инфекций передаваемых половым путем. При трихомониазе значительную эффективность проявляли настои хвоща полевого, чистотела большого, чеснока полевого, черёмухи обыкновенной. При остром процессе использовали спринцевания, и ванночки с настоем цветков ромашки, травы шалфея, масло гвоздики [7].
Новый этап в терапии мочеполового трихомониаза начался с открытия антибиотиков и синтетических бактерицидных препаратов. В 1952 г. были выделены трихомицин и аминитразол, применявшиеся в терапии трихомониаза и дававшие неплохой терапевтический эффект, особенно у мужчин [11].
С конца 30-х годов прошлого столетия в практическую медицину пришло увлечение физиотерапевтическими методами лечения практически всех заболеваний. Это электромагнитные излучения (ЭМИ), электрический ток различной мощности, ультра и инфразвук, искусственный сон и проч. Делались попытки излечения этими методами и урогенитального трихомониаза. Доходило до абсурда – больных погружали в искусственный сон на несколько дней. Состояние нервной системы этим пациентам до известной степени оздоравливали, а вот микроскопический паразит спать не хотел и продолжал свою разрушительную деятельность.
Современные исследования показали, что некоторые виды ЭМИ напротив, стимулируют жизнедеятельность трихомонады [7, 15].
Неудачами закончились также попытки лечить трихомониаз гомеопатическими средствами.
И, тем не менее, учитывая способность Trichomonas vaginalis активно адаптироваться к современным противопротозойным препаратам на основе 5-НИ? может быть, полезно заглянуть в историю лечения этой протоинвазии?
Трихомониаз относится к социально значимым заболеваниям и в борьбе с ним новое может оказаться хорошо забытым старым, но верным средством.
В.М. Kрасовский
Институт урологии АМН Украины (Kиев)
Изучена сравнительная эффективность использования препаратов Метронидазола, Тинидазола, Ниморазола, Тенонитрозола, Орнидазола в лечении 126 больных урогенитальным трихомониазом. Эффективность Метронидазола составила 40,4%, Тинидазола – 44,1%, Ниморазола – 85,7%, Тенонитрозола – 89,7%, Орнидазола – 93,3%, Орнидазола + Тенонитрозола – 97,7%. Препараты отличаются различной переносимостью и количеством побочных эффектов: Метронидазол – 23,3%, Тинидазол – 25%, Нимора-зол – 12,5%, Тенонитрозол – 12%, Орнидазол – 9,1%, Орнидазол + Тенонитрозол – 9,1%. Лучшие результаты получены в группах пациентов, которые получали: Орнидазол (93,3%), Тенонитрозол (89,7%), а также комбинация их последовательного применения Орнидазол + Тенонитрозол (97,7%). Результаты исследования можно использовать в клинической практике.
Kлючевые слова: хронический урогенитальный трихомониаз, лечение, Метронидазол, Тинидазол, Ниморазол, Тенонитрозол, Орнидазол.
The comparative is studied efficiency of the use of preparations of Metronidazolum, Tinidazolum, Nimorazolum, Tenonitrazolum, Ornidazolum in treatment of patients with chronic urogenital trichmoniasis for 126 patients. Efficiency of Metronidazolum was 40,4%, Tinidazolum – 44,1%, Nimorazolum - 85,7%, Tenonitrazolum - 89,7%, Ornidazolum - 93,3%, Ornidazolum + Tenonitrazolum - 97,7%. Preparations differ different bearableness and amount of side effects: Metronidazolum - 23,3%, Tinidazolum - 25%, Nimorazolum - 12,5%, Tenonitrazolum - 12%, Ornidazolum - 9,1%, Ornidazolum + Tenonitrazolum - 9,1%. The best results are got in groups which got: Ornidazolum (93,3%), Tenonitrazolum (89,7%), and also combi nation of their successive application of Ornidazolum + Tenonitrazolum (97,7%). Research results can be recommended for the use in clinical practice.
Keywords: chronic urogenital trichmoniasis, treatment, Metronidazolum, Tinidazolum, Nimorazolum, Tenonitrazolum, Ornidazolum.
В последние десятилетия трихомониаз получил широкое распространение. Чаще всего это заболевание диагностируют у мужчин и женщин молодого возраста – от 16 до 35 лет, из которых большой процент больных составляют лица с другими венерическими заболеваниями и те, кто часто меняют половых партнеров [1, 34].
Заражение трихомониазом происходит в основном половым путем, бытовым путем (плавая в бассейне или реке, в душе, в сауне) заразиться практически невозможно. Однако в сперме, моче и воде возбудитель остается жизнеспособным в течение 24 ч. У больных или у тех, кто перенес эту инфекцию, вырабатываются сывороточные и секреторные антитела, которые указывают на возбудителя, но иммунитет в отношении трихомонадной инфекции не развивается [1–5, 8, 11].
К главным особенностям заболевания следует отнести то, что возбудитель очень легко передается человеку, имевшему половую связь с инфицированным; наличие на поверхности микроорганизмов гиалуронидазы, каталазы, амилазы; способность повторять рельеф эпителиальной клетки и проникать в клетку хозяина; способность защититься от разрушительного действия организма с помощью фиксации на своей поверхности антитрипсина; наличие прямой зависимости вирулентности урогенитальных трихомонад от их гемолитической активности; способность прикрепляться к лейкоцитам, эритроцитам, эпителиальным клеткам за счет гликопротеида.
Выделяют несколько форм трихомониаза: свежая острая, подострая, торпидная; хроническая; трихомонадоносительство. Хроническая форма заболевания характеризуется малосимптомным течением, когда с момента заражения прошло более 2 мес. Периодические обострения могут быть спровоцированы снижением сопротивляемости организма, чрезмерным употреблением алкоголя, изменением рН содержимого мочеиспускательного канала. Трихомонадоносительство – форма заболевания, при которой отсутствуют какие-либо симптомы [2, 4, 5–10, 13].
Трихомониаз – многоочаговое заболевание. По данным Всемирной организации здравоохранения (1995), только у 10,5% больных трихомониаз протекает как моноинфекция, в 89,5% случаев выявляются смешанные трихомонадные инфекции в различных комбинациях: с микоплазмами – 47,3%; с гонококками – 29,1%; с гарднереллой – 31,4%; с уреаплазмой – 20,9%; с хламидиями – 20%; с грибами – 15%.
Диагностика трихомониаза осуществляется на основании клинических признаков и результатов лабораторных исследований. Для получения более точного результата используют сразу несколько методов, а материал для изучения берут из различных очагов воспаления. Применяют следующие лабораторные методы: латекс-агглютинация (используют для выявления трихомонадоносительства); культуральные (используют для диагностики атипичных форм); иммунологические; микроскопия нативного препарата (позволяет по грушевидной или овальной форме, а также характерным движениям микроорганизма определить наличие трихомонады); микроскопия окрашенного препарата (дает возможность проводить исследования, когда материал взят достаточно давно); люминесцентная микроскопия (основан на свечении микроорганизма в ультрафиолетовых лучах). Самый точный и современный метод – ДНK (ПЦР)-диагностика. Для ее проведения из биологического материала извлекают генетически уникальный кусочек ДНK микроорганизма. Все возможные ошибки данного метода составляют 5%. Этот метод отличается не только точностью, но и скоростью выполнения (1–2 дня) [2, 3, 5, 8–10, 12].
Лечение трихомониаза назначают обязательно после осмотра и лабораторного обследования с учетом количества очагов инфекции, тяжести заболевания и индивидуальных особенностей пациента. Кроме того, лечение трихомониаза по требованиям ВОЗ проводят всем половым партнерам, если у одного из них обнаружена инфекция (трихомонада). Особенностью заболевания является наличие множества очагов инфекции. Учитывая этот факт, больным назначают комплексную терапию, включающую: прротивопротозойные препараты; антибактериальные препараты; местное лечение; этиотропные методы; витамины; биостимуляторы; иммунокоррегирующие методы; симптоматическое лечение; гепатопротекторы; противогрибковые препараты. На фоне лечения половая жизнь и прием алкоголя не рекомендуются [2, 6–10,12, 13]. Выбор тактики лечения следует осуществлять индивидуально, с учетом клинико-анамнестических данных.
Лечение острой формы: этиотропная терапия; антибактериальные препараты по индивидуальным показаниям; ферменты, улучшающие пищеварение; витаминотерапия; противотрихомонадные препараты для местного применения в очагах воспаления. По окончании этиотропной терапии рекомендуется провести курс антиоксидантной терапии (перорально и местно) в сочетании с гепатопротекторными средствами.
Лечение хронической формы:
- Подготовительный этап: лекарственные средства, повышающие общий и/или местный иммунитет (по показаниям); витаминотерапия; антиоксиданты; местное лечение очагов поражения.
- Базисная терапия: противотрихомонадные препараты; антибактериальные препараты по показаниям; иммуномодулирующие препараты по показаниям; ферменты, улучшающие пищеварение; протеолитические ферменты; гормонзаместительные препараты (внутрь или местно) по показаниям; антиоксиданты.
- Восстановительная терапия: гепатопротекторы; антиоксиданты — местно; физиотерапевтические процедуры; витаминотерапия.
Первое контрольное обследование у мужчин проводят на 7–10-й день после окончания лечения трихомониаза: пальпаторное обследование предстательной железы и семенных пузырьков, микроскопическое исследование их секрета. Через 1 нед назначают провокацию. Если после провокации трихомонадная инфекция не обнаружена, то на последнее контрольное обследование пациент приходит через 1 мес.
Kритерии излеченности
Различают этиологическое и клиническое выздоровление от трихомониаза. Этиологическое выздоровление: при контрольных обследованиях после курса лечения трихомонады не обнаружены в течение 1–2 мес. у мужчин. Для контрольных обследований применяют культуральные и бактериоскопические лабораторные методы. Kлиническое выздоровление: исчезновение симптомов болезни. Нередко у мужчин после наступления этиологического выздоровления симптомы трихомониаза сохраняются. Посттрихомонадные воспалительные процессы бывают у пациентов с осложненными или хроническими формами болезни [9–13].
Этиотропную терапию трихомониаза проводят несколькими препаратами: это метронидазол, тинидазол, ниморазол, тенонитрозол, орнидазол, секнидазол, флюнидазол, карнидазол. Первых пять препаратов зарегистрированы и их применяют в Украине.
Лекарственная резистентность, ее механизмы и клиническое значение
В последние годы у микроорганизмов все чаще вырабатывается лекарственная резистентность к различными препаратам в связи с неконтролируемым, недостаточно интенсивным или длительным лечением, самолечением. Частота развития резистентности и уровень устойчивости существенно различаются в зависимости от вида микроорганизма, химического состава препарата, эффективности применяемых доз и схем лечения.
Развитие устойчивости связано в первую очередь со снижением активности нитроредуктаз микробной клетки и соответственно со снижением внутриклеточной биотрансформации препаратов. В результате уменьшается образование комплексов с ДНK, снижаются процессы образования свободных радикалов и концентрация цитотоксических продуктов метаболизма. Развитие устойчивости может быть обусловлено также нарушением транспортных систем клетки (снижение проницаемости клеточной стенки у анаэробов и микроаэрофилов и клеточной оболочки у простейших), включая феномен выброса.
Kроме того, главной проблемой в лечении трихомониаза сегодня выступает всевозрастающая резистентность трихомонады к антипротозойным препаратам. Так, согласно исследованиям, проведенным авторами в 1999 г., всего 35% штаммов трихомонад чувствительны к метронидазолу [4]. Согласно другим исследованиям, всего 55% трихомонад чувствительны к тинидазолу [5]. Соответственно изучение изменяющейся чувствительности трихомонад к современным антипротозойным препаратам является актуальной проблемой лечения трихомониаза и микст-инфекций половых путей.
В связи с этим была сделана попытка провести исследование сравнительной эффективности различных противотрихомонадных препаратов.
МАТЕРИАЛЫ И МЕТОДЫ
В отделении сексопатологии и андрологии Института урологии АМН Украины изучали клиническую эффективность различных противотрихомонадных препаратов: Метронидазола, Тинидазола, Ниморазола, Тенонитрозола, Орнидазола у больных хроническим урогенитальным трихомониазом. Кроме того, проводили ретроспективный анализ чувствительности влагалищной трихомонады к различным противопротозойным препаратам и оценивали их эффективность и безопасность.
Под наблюдением находились 370 пациентов с хроническим урогенитальным трихомониазом в возрасте от 21 до 48 лет и длительностью заболевания от 3 мес. до 8 лет. Диагноз урогенитального трихомониаза устанавливали на основании общепринятых принципов с выявлением трихомонад, что подтверждено микроскопией окрашенных мазков, исследованием нативного препарата, культуральным методом, а также методом ПЦР.
Все больные были разделены на группы:
1-я группа (52 пациента) получала в качестве противотрихомонадного препарата Метронидазол в стандартной дозе на протяжении 10 дней.
2-я группа (43 пациента) – Тинидазол по 0,5 г 4 раза в день с интервалом 15 мин 2 дня.
3-я группа (49 мужчин) – Орнидазол по 0,5 г 2 раза в день на протяжении 10 дней.
4-я группа (56 мужчин) – Ниморазол по 0,5 г 2 раза в день на протяжении 6 дней.
5-я группа (126 мужчин) – Тенонитрозол по 0,25 г 2 раза в день на протяжении 8 дней.
6-я группа (44 мужчин) – Орнидазол по 0,5 г 2 раза в день на протяжении 10 дней и Тенонитрозол по 0,25 г 2 раза в день на протяжении 8 дней.
С целью коррекции иммунного статуса назначали индуктор интерферона растительного происхождения кагоцел; как гепатопротектор использовали препарат легалон – 140 мг в день стандартных доз на курс лечения. Для получения антибактериального эффекта (ввиду наличия TANK-функции у трихомонады) назначали препарат группы макролидов кларитромицин в дозе по 500 мг 2 раза в сутки на протяжении 10 дней; пациенты также получали симптоматическое и физиотерапевтическое лечение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Таблица 1. Эффективность этиотропной терапии урогенитального трихомониаза различными препаратами
| Клиническая группа | Препарат | Количество больных | Клиническое выздоровление (абс. число) | Клиническое выздоровление, % |
| 1-я | Метронидазол | 52 | 21 | 40,4 |
| 2-я | Тинидазол | 43 | 19 | 44,1 |
| 3-я | Орнидазол | 49 | 45 | 93,3 |
| 4-я | Ниморазол | 56 | 48 | 85,7 |
| 5-я | Тенонитрозол | 126 | 113 | 89,7 |
| 6-я | Орнидазол + Тенонитрозол | 44 | 43 | 97,7 |
Результаты микроскопии секрета предстательной железы и молекулярно-генетического исследования соскоба слизистой оболочки мочеиспускательного канала мужчин в динамике приведено в табл. 3.
Таблица 3. Результаты микроскопии секрета предстательной железы при этиотропной терапии урогенитального трихомониаза различными препаратами
| Клиническая группа | Препарат | Количество больных | Микроскопия секрета ПЖ | ПЦР |
| 1-я | Метронидазол | 52 | 18 (34,6%) | 21 (40,4%) |
| 2-я | Тинидазол | 43 | 16 (37,2%) | 19 (44,1%) |
| 3-я | Орнидазол | 49 | 44 (89,8) | 45 (93,3%) |
| 4-я | Ниморазол | 56 | 44 (78,5%) | 48 (85,7%) |
| 5-я | Тенонитрозол | 126 | 121 (88,0%) | 113 (89,7%) |
| 6-я | Орнидазол + Тенонитрозол | 44 | 43 (97,7%) | 43 (97,7%) |
Kак видно из приведенных данных, лучшие результаты получены при использовании метода ПЦР в группах пациентов, которые получали: Орнидазол (93,3%), Тенонитрозол (89,7%), а также их комбинацию последовательного применения Орнидазол + Тенонитрозол (97,7%). Метод микроскопии показал несколько худшие результаты по всем группам пациентов, что обусловлено субъективностью самого метода и свойством мимикрии трихомонады. Но эффективность лечения в тех же группах была выше.
При проведении ретроспективного анализа чувствительности влагалищной трихомонады к различным противопротозойным препаратам оценивали их эффективность. Был проведен анализ культуральных посевов трихомонад с подбором чувствительности к антипротозойным средствам у 243 пациентов, которую определяли по проценту выявления высокой чувствительности к препарату (чистая зона 20 мм и более вокруг диска или отсутствие возбудителя в чашке с препаратом). Высокой чувствительностью обладал препарат в случае наличия этих показателей в более чем 75% культуральных посевах, средний - от 50 до 75%, низкий - менее 50%. Результаты представлены на рис. 1.
Рис 1. Процент высокой чувствительности трихомонады к различным препаратам
Кроме того, нами была оценена эффективность лечения различными препаратами больных, основываясь на полной эрадикации возбудителя, на что указывает молекулярно-генетический метод. Данные приведены на рис. 2.
Рис. 2. Эффективность терапии трихомониаза различными препаратами
При определении количества побочных явлений при использовании различных противопротозойных препаратов выявлены результаты, которые приведены на рис. 3.
Рис. 3. Количество побочных явлений при использовании различных противопротозойных препаратов
ВЫВОДЫ
1. При изучении клинической эффективности различных противотрихомонадных препаратов у больных хроническим урогенитальным трихомониазом выявлено, что эффективность (по критерию эрадикации трихомонады) Метронидазола составила 40,4%, Тинидазола - 44,1%, Ниморазола -85,7%, Тенонитрозола - 89,7%, Орнидазола - 93,3%, Орнидазола + Тенонитрозола - 97,7%.
2. Препараты отличаются различной переносимостью количеством побочных эффектов: Метронидазол - 23,3%, Тинидазол - 25%, Ниморазол - 12,5%, Тенонитрозол - 12%, Орнидазол - 9,1%, Орнидазол + Тенонитрозол - 9,1%.
3. Наиболее высокую чувствительность трихомонады выявили к препаратам Орнидазол (73,6%) и Атрикан (84,4%).
4. Лучшие результаты получены в группах пациентов, которые получали: Орнидазол (93,3%), Тенонитрозол (89,7%), а также комбинация их последовательного применения Орнидазол + Тенонитрозол (97,7%). Результаты исследования можно использовать в клинической практике.
Читайте также:


