Сальмонеллез окраска по граму
Для посмертной диагностики в лабораторию направляют свежий труп мелких животных, в том числе и птиц, целиком, от трупов крупных животных — трубчатую кость, долю печени с желчным пузырем, почку, селезенку, брыжеечные лимфоузлы, пораженные участки легких, слепую кишку с содержимым; в случае аборта — свежий плод.
Для прижизненной диагностики в лабораторию направляют фекалии, носовую слизь, истечения из родовых путей.
Для получения гемокультуры на 1-4-й день болезни (не позже, т.к. период бактериемии при сальмонеллезах короткий) от животных может быть взята кровь, а для серологического исследования по РА — сыворотка крови. От птиц берут кровь для постановки кровекапельной реакции агглютинации или кровекапельной реакции непрямой гемагглютинации для диагностики пуллороза-тифа.
Микроскопическое исследование исходного материала. Изпоступившего материала готовят мазки, окрашивают по Граму. Сальмонеллы являются грамотрицательными, мелкими палочками с закругленными концами, от 1 до 4 мкм длиной и 0,5-0,8 мкм шириной. Не образуют спор и капсул.
Выделение и идентификация культур сальмонелл. Сальмонеллы — факультативные анаэробы. Хемоорганотрофы; обладают и дыхательным и бродильным типами метаболизма. Оптимальная температура культивирования 37° С, рН среды 7,2-7,4, хорошо растут на обычных питательных средах.
Исследуемый материал высевают на обычные МПА и МПБ, на плотные селективные среды, а в ряде случаев (главным образом при исследовании фекалий и при получении гемокультуры) в среды накопления. Из селективных наиболее часто используют среды Плоскирева, Эндо, Левина, висмут-сульфит агар, а из сред накопления — Мюллера, Кауфмана, Киллиана.
Для получения гемокультуры кровь засевают в пробирку с 20%-ным желчным МПБ. Засеянные чашки Петри и пробирки инкубируют 18-
20 часов при 37° С. После этого просматривают посевы на плотных средах в чашках Петри и отбирают подозрительные колонии, наряду с этим делают высевы с жидких сред накопления на плотные селективные среды, которые инкубируют при 37° С в течение 18-24 часов.
Характер роста сальмонелл на питательных средах. В МПБсальмонеллы дают рост в виде равномерного помутнения среды, на МПА образуют небольшие, диаметром 2-4 мм, гладкие выпуклые прозрачные или серо-голубоватые колонии с ровными краями. Некоторые серовары
(S. abortus equi, S. abortus ovis, S. typhisuis) образуют более мелкие колонии диаметром около 1 мм. На среде Эндо колонии сальмонелл слегка розовые, прозрачные, на средах Плоскирева и Мак-Конки — бесцветные, но выглядят более плотными и мутноватыми, чем на МПА. На агаре Левина сальмонеллы растут в виде прозрачных колоний, иногда с фиолетовым оттенком. На висмут-сульфит агаре почти все сальмонеллы образуют черные колонии с характерным металлическим блеском, при этом наблюдается прокрашивание участка среды под колонией в черный цвет. Отдельные немногочисленные серовары составляют исключение, и на висмут-сульфит агаре образуют светлые или светло-зеленоватые колонии.
Морфология клеток сальмонелл в культуре. В мазках, приготовленных с питательных сред, сальмонеллы обнаруживают в виде грамотрицательных, мелких палочек с закругленными концами, от 1 до 4 мкм длиной и 0,5-0,8 мкм шириной. В мазках располагаются одиночно, беспорядочно, иногда попарно. Не образуют спор и капсул. Обладают, как правило, выраженной подвижностью за счет перитрихиально расположенных жгутиков. Некоторые серовары (S. gallinarum-pullorum) всегда неподвижны, могут встречаться неподвижные мутанты и среди других сероваров.
Идентификация сальмонелл по ферментативным признакам. Чистые культуры бактерий с характерными для сальмонелл культуральными свойствами с целью установления родовой принадлежности засевают в дифференциально-диагностические среды для определения ферментативных свойств.
К роду Salmonella относят бактерии: оксидазоотрицательные; катала-зоположительные; не образующие индол; дающие отрицательную реакцию Фогес-Проскауэра (желтое окрашивание среды); положительную пробу с метиловым красным (среда окрашивается в розово-красный цвет); способные расти на среде Симмонса с цитратом; лизин- и орнитиндекарбоксилазо-положительные; образующие H2S; не сбраживающие лактозу, сахарозу; не расщепляющие мочевину; не разжижающие желатину. По аргининдегидрогеназе, способности расти в присутствии KCN и использованию малона-та сальмонеллы различаются. Как правило, сбраживаемые ими углеводы включают L-арабинозу, D-ксилозу, мальтозу,
D-маннитол, D-маннозу, L-рамнозу, D-сорбитол, трегалозу и глюкозу.
Частота выявления позитивных реакций при изучении некоторых биохимических характеристик сальмонелл представлена в таблице 24.
Не нашли то, что искали? Воспользуйтесь поиском:
Общая характеристика семейства энтеробактерий.
Бактерии этого семейства являются наиболее частыми возбудителями кишечных инфекций. Их объединяет ряд общих признаков. Это короткие, не образующие спор, палочки с закругленными концами, подвижные (перитрихи) или неподвижные, некоторые имеют капсулы. Аэробы или факультативные анаэробы. Характерна отрицательная окраска по Граму. Хорошо растут на обычных питательных средах с мясном экстрактом. На большинстве плотных сред энтеробактерии образуют круглые выпуклые блестящие S- (гладкие) колонии, а также часто обусловленные потерей капсулы плоские, неровные и зернистые R- (шероховатые) формы. Для них характерна ферментация глюкозы (и других углеводов) с образованием кислоты и газа. По отношению к лактозе их делят на лактоза- ферментирующие и лактоза - неферментирующие. Каталаза - положительны, восстанавливают нитраты в нитриты.
Семейство энтеробактерий включает более 20 родов, объединяющих более 100 видов бактерий, обитающих в почве, на растениях, входящих в состав микробных биоценозов кишечников животных и человека. Наибольшее значение для человека имеют рода Escherichia, Salmonella, Shigella, Yersinia, Proteus, Klebsiella и др. Для дифференциации родов используют в основном биохимические признаки, для классификации внутри родов и видов - изучение антигенной структуры (О-, Н- и К- антигенов).
О- антиген представлен липополисахаридами (ЛПС) наружной мембраны. Штаммы, лишенные О- антигена, образуют R- колонии и обычно авирулентны.
Н- антиген - термолабильные белки, имеются только у подвижных (имеющих жгутики) видов.
К- антиген - термостабильные полисахариды капсулы и наружной оболочки.
В патогенезе поражений, вызываемых энтеробактериями, имеют значение ЛПС (эндотоксин, освобождающийся при разрушении бактерий), различные энтеротоксины, факторы инвазивности и адгезии (жгутики и др.), ферменты патогенности.
Сальмонеллы - большая группа энтеробактерий, среди которых различные серотипы - возбудители брюшного тифа, паратифов А, В и С и наиболее распространенных пищевых токсикоинфекций - сальмонеллезов. По признаку патогенности для человека сальмонеллы разделяют на патогенные для человека- антропонозы (вызывают брюшной тиф и паратифы А и В) и патогенные для человека и животных - зоонозы (вызывают сальмонеллезы). Несмотря на значительные различия сальмонелл по антигенным характеристикам, биохимическим свойствам, вызываемым ими заболеваниям, по современной, но недостаточно удобной и совершенной классификации выделяют два вида - S.bongori и S.enteritica. Последний разделен на подвиды, из которых наибольшее значение имеют подвиды choleraesuis и salamae. Подвид choleraesuis включает наибольшую часть известных сероваров сальмонелл (около 1400 из примерно 2400).
Морфология. Прямые грамотрицательные палочки размером 2-4 x 0,5 мкм. Подвижны благодаря наличию перитрихиально расположенных жгутиков.
Культуральные и биохимические свойства. Факультативные анаэробы, хорошо растут на простых питательных средах. Оптимум рН- 7,2-7,4, температуры - +37. Метаболизм - окислительный и бродильный. Сальмонеллы ферментируют глюкозу и другие углеводы с образованием кислоты и газа (серотип Salmonella typhi газообразования не вызывает). Обычно не ферментируют лактозу (на средах с этим углеводом - безцветные колонии), сахарозу. Оксидаза- отрицательны, каталаза - положительны. Реакция Фогеса - Проскауэра отрицательна.
На основании биохимических (ферментативных) свойств сальмонеллы разделены на четыре группы. Характерные признаки сальмонелл - образование сероводорода, отсутствие продукции индола и аэробность. Для выделения используют дифференциально - диагностические среды (висмут - сульфит агар, среды Эндо, Плоскирева, SS агар) и среды обогащения (селенитовый бульон, желчный бульон, среда Раппопорта). S- формы образуют мелкие (от 1 до 4 мм) прозрачные колонии (на среде Эндо - розоватые, на среде Плоскирева - безцветные, на висмут - сульфит агаре - черные, с металлическим блеском). На жидких средах S- формы дают равномерное помутнение, R- формы - осадок.
Антигенная структура. Выделяют О-, Н- и К- антигены. К группе К- антигенов относят Vi- антигены (антигены вирулентности). Благодаря более поверхностному расположению (чем О- антигены) Vi- антиген может препятствовать агглютинации культур сальмонелл О- специфической сывороткой (экранирование). Для дифференциации сальмонелл применяют схему (серологическую классификацию) Кауфманна - Уайта.
В соответствии со структурой О- антигенов сальмонеллы подразделяют на О- группы (67 серогрупп), в каждую из которых входят серологические типы, отличающиеся строением Н- антигенов. Принадлежность сальмонелл к определенному серовару устанавливают при изучении антигенной структуры в соответствии со схемой Кауфманна - Уайта. Примеры: серотип S.paratyphi A относится к серогруппе А, S.paratyphi В - к серогруппе В, S.paratyphi С - к группе С, S.typhi - к серогруппе D.
1.Факторы адгезии и колонизации.
2. Способность к внутриклеточному паразитированию, препятствовать фагоцитозу, размножаться в клетках лимфоидной ткани выражены у возбудителей брюшного тифа, паратифов А и В, способствуя хроническому носительству.
4. Термолабильные и термостабильные энтеротоксины.
6. Существенное значение имеют плазмиды вирулентности и R- плазмиды.
7. Vi - антиген ингибирует действие сывороточных и фагоцитарных бактериоцидных факторов.
Основными факторами патогенности сальмонелл является их способность проникать в макрофаги и размножаться в лимфоидных образованиях собственно слизистого слоя тонкого кишечника (пейеровы бляшки, солитарные фолликулы), а также продукция эндотоксина.
Патогенез поражений. Различия клинических форм заболеваний, вызываемых сальмонеллами, зависит от вирулентности и дозы возбудителя и состояния иммунной системы организма. Обычная доза, вызывающая клинические проявления - 10 6 - 10 9 бактерий, меньшая доза достаточна при иммунодефицитах, гипохлоргидрии и других заболеваниях желудочно - кишечного тракта.
Выделяют следующие основные формы сальмонеллезной инфекции:
- генерализованную (тифоподобный и септикопиемический варианты);
- бактерионосительство (острое, хроническое, транзиторное).
Существенные патогенетические особенности инфекционного процесса, вызываемого серотипами S.typhi, S.paratyphi A,B, являются основанием для выделения тифо- паратифозных заболеваний в самостоятельную нозологическую группу. Каждой фазе патогенеза соответствует клинический период заболевания и своя тактика лабораторного обследования. Основные фазы - внедрения возбудителя (соответствует инкубационному периоду), первичной локализации возбудителя (продромальный период), бактеремии (первая неделя заболевания), вторичной локализации сальмонелл (разгар заболевания - 2-3 недели), выделительно- аллергическая (реконвалесценция - 4 неделя заболевания).
Проникшие через рот сальмонеллы попадают в эпителиальные клетки двенадцатиперсной и тонкой кишки посредством эндоцитоза. Они легко проникают в эпителиальные клетки, но не размножаются здесь, а проходят и размножаются в лимфатическом аппарате тонкого кишечника. Сальмонеллы размножаются преимущественно в lamina propria (первичная локализация), что сопровождается местной воспалительной реакцией слизистой оболочки, притоком жидкости в очаг поражения и развитием диарейного синдрома (гастроэнтерит). Энтеротоксины повышают уровень циклического аденомонофосфата (цАМФ), происходит повышение уровня гистамина и других биологически активных веществ, проницаемости сосудов. Наблюдаются водно - электролитные нарушения, развиваются гипоксия и ацидоз, которые усугубляют патологический процесс с преобладанием сосудистых растройств. Происходит разрушение части сальмонелл с выделением эндотоксина, сенсибилизация (ГЗТ) лимфатического аппарата тонкого кишечника.
Из слизистой оболочки сальмонеллы могут попадать в лимфо- и далее в кровоток, вызывая бактеремию. В большинстве случаев она носит транзиторный характер, т.к. сальмонеллы элиминируются фагоцитами.
В отличие от других сальмонелл, возбудители брюшного тифа и паратифов, проникнув в кровоток, способны выживать и размножаться в фагоцитах. Они могут размножаться в мезентериальных лимфоузлах, печени и селезенке и вызывать генерализацию процесса. После гибели фагоцитов сальмонеллы вновь поступают в кровь. При этом Vi- антиген ингибирует бактерицидные факторы.
При гибели сальмонелл освобождается эндотоксин, угнетающий деятельность центральной нервной системы (тиф - от греч. typhos - туман, спутанное сознание) и вызывающий длительную лихорадку. Действие эндотоксина может вызвать миокардит, миокардиодистрофию, инфекционно - токсический шок.
В результате бактеремии происходит генерализованное инфицирование желчного пузыря, почек, печени, костного мозга, твердых мозговых оболочек (вторичная локализация сальмонелл). Происходит вторичная инвазия эпителия кишечника, особенно пейеровых бляшек. В сенсибилизированной сальмонеллами стенке развивается аллергическое воспаление с образованием основного грозного осложнения - брюшнотифозных язв. Наблюдается длительное носительство сальмонелл в желчном пузыре с выделением возбудителя с испражнениями, пиелонефриты, кровотечения и перфорации кишечника при поражении пейеровых бляшек. Затем происходит формирование постинфекционного иммунитета, элиминация возбудителя и заживление язв или формирование бактерионосительства (в Западной Сибири часто на фоне хронического описторхоза).
Возбудителями сальмонеллезов являются другие серотипы сальмонелл, патогенные для человека и животных (S.typhimurium, S.enteritidis, S.heldelberg, S. newport и другие). В основе патогенеза сальмонеллезов - действие самого возбудителя (его взаимодействия с организмом хозяина) и эндотоксина, накапливающегося в пищевых продуктах, инфицированных сальмонеллами. В классическом варианте сальмонеллезная токсикоинфекция - гастроэнтерит. Однако при прорыве лимфатического барьера кишечника могут развиваться генерализованные и внекишечные формы сальмонеллезов (менингит, плеврит, эндокардит, артрит, абсцессы печени и селезенки, пиелонефрит и др.). Увеличение генерализованных и внекишечных форм сальмонеллезов связано с увеличением количества иммунодефицитных состояний, что имеет особое значение при ВИЧ- инфекции.
Отдельную проблему представляют госпитальные штаммы сальмонелл (чаще отдельные фаговары S.typhimurium), вызывающие вспышки внутрибольничных инфекций преимущественно среди новорожденных и ослабленных детей. Они передаются преимущественно контактно- бытовым путем от больных детей и бактерионосителей, обладают высокой инвазивной активностью, часто вызывая бактеремию и сепсис. Эпидемические штаммы характеризуются множественной лекарственной устойчивостью (R- плазмиды), высокой резистентностью, в том числе к действию высоких температур.
Эпидемиологические особенности. Характерно повсеместное распространение. Основные резервуары сальмонелл - человек (возбудители брюшного тифа и паратифа А) и различные животные (остальные серотипы сальмонелл). Основные возбудители отличаются полипатогенностью. Основные источники заражения - мясные и молочные продукты, яйца, птице- и рыбопродукты. Основные пути передачи - пищевой и водный, реже - контактный. Характерна чрезвычайная множественность резервуаров и возможных источников инфекции. Основное значение имеют сельскохозяйственные животные и птицы.
Лабораторная диагностика. Основной метод - бактериологический. Исходя из патогенеза оптимальными сроками бактериологических исследований при гастроинтестинальных формах являются первые дни, при генерализованных формах - конец второй - начало третьей недели заболевания. При исследовании различных материалов (испражнения, кровь, моча, желчь, рвотные массы, пищевые остатки) наибольшая частота положительных результатов отмечается при исследовании испражнений, для возбудителя брюшного тифа и паратифов - крови (гемокультура).
Исследования проводят по стандартной схеме. Исследуемый материал засевают на плотные дифференциально - диагностические среды - высокоселективные (висмут- сульфит агар, агар с бриллиантовым зеленым), среднеселективные (среда Плоскирева, слабощелочной агар), низкоселективные (агары Эндо и Левина) и в среды обогащения. Для посева крови используют среду Рапопорт. На висмут- сульфит агаре колонии сальмонелл приобретают черный (реже- зеленоватый) цвет.Выросшие колонии пересевают на среды для первичной (среды Ресселя) и биохимической (сероводород, мочевина, глюкоза, лактоза) идентификации. Для предварительной идентификации используют О1- сальмонеллезный фаг, к которому чувствительно до 98% сальмонелл.
Для идентификации культур в РА используют поливалентные и моновалентные О-, Н- и Vi- антисыворотки. Сначала используют поливалентные адсорбированные О- и Н- сыворотки, а затем- соответствующие моновалентные О- и Н- сыворотки. Для идентификации возбудителей брюшного тифа и паратифов используют антитела к антигену О2 (S.paratyphi A), O4 (S.paratyphi B), O9 (S.typhi). Если культура не агглютинируется О- сывороткой, ее нужно исследовать с Vi- сывороткой. Для быстрого выявления сальмонелл используют поливалентные люминесцентные сыворотки.
Серологические исследования проводят для диагностики, а также выявления и дифференциации различных форм носительства. Применяют РА (реакцию Видаля) с О- и Н- диагностикумами и РПГА с применением поливалентных эритроцитарных диагностикумов, содержащих полисахаридные антигены серогрупп А,В,С,Д и Е и Vi- антиген.
Лечение - антибиотики (левомицетин и др.). Часто выявляют резистентные к антибиотикам штаммы. Необходимо определять антибиотикорезистентность выделенных культур.
Специфическая профилактика может применяться преимущественно в отношении брюшного тифа. Применяют химическую сорбированную брюшнотифозную моновакцину. Вакцинацию в настоящее время применяют преимущественно по эпидемическим показаниям.
Сальмонелла в продуктах животного происхождения является предметом пристального внимания на протяжении многих лет. Эта инфекция вызывает диарею, лихорадку, а в случае если человек ослаблен или стар – даже смерть. Каждый год огромное число людей страдает от сальмонеллеза, что приносит убытки в миллионы рублей.
Сальмонеллы представляют собой один из 12 родов большого семейства бактерии Enterobacteriaceae. К настоящему времени по серологической типизации систематизировано более 2000 серотипов сальмонелл [1, с. 126].
Вместе с большой общностью морфологических и культуральных характеристик сальмонелла отличается друг от друга по биохимическим и антигенным свойствам. Эти различия и положены в типизации [1, с. 128].
Обсеменение мяса сальмонеллами может происходить двумя путями: прижизненно и после убоя. Прижизненно сальмонеллы проникают в мышцы у клинически больных животных. Послеубойное обсеменение мяса сальмонеллами происходит при обработке туш больных и здоровых животных одними и теми же не продезинфицированными инструментами, при неправильной разделке туш [2, с. 155]. Инфицирование мяса сальмонеллами может произойти при перевозке на одном и том же транспорте туш или внутренних органов больных и здоровых животных. Обсеменить сальмонеллами мясо и мясопродукты может также и человек (больной или бактерионоситель) [4, с.98].
Мясо и особенно субпродукты являются хорошей средой для размножения и накопления в нем сальмонелл. Характерно, что при развитии сальмонелл в мясе или других продуктах органолептические показатели его обычно не изменяются [2, с 148].
Люди заражаются сальмонеллезом при употреблении продуктов питания, обсемененных сальмонеллами в процессе их получения, переработки, транспортировки и реализации прошедших недостаточную кулинарную обработку или хранившихся с нарушением установленных режимов. Возможно заражение через предметы бытовой и производственной обстановки, а также через воду [3, с. 129].
А так как, у крупного рогатого скота сальмонеллез вызывают Salmonella dublin, реже — S. typhimurium, у свиней — S. choleraesuis, S. typhisuis, реже — S. typhimurium, у овец — S. abortus ovis, у лошадей — S. abortusn equi, у птиц — S. gallinarum-pullorum, S. typhimurium реже — S. enteritidis, мы можем предположить первоначальную проблему инфицирования продуктов питания сальмонеллами [1, с. 127].
Актуальность данной работы состоит в том, что морфологические, культуральные, биохимические свойства и главным образом серотипирование имеют основное значение при идентификации сальмонелл, для выявления источника пищевых токсикотнфекции.
Целью нашей работы явился анализ литературных данных по изучению проблем возникновения сальмонеллеза, идентификация бактерий рода Salmonella, выделенных из пищевых продуктов животного происхождения, по биологическим свойствам.
Материалы и методы.
В работе были использованы 12 изолятов бактерий рода Salmonella, выделенные из продуктов животного происхождения.
Для определения морфологии используемых в работе бактерий применяли набор для окраски по Граму.
Для изучение культуральных свойств проводили посевы на следующие питательные среды: мясопептонный агар (МПА), мясопептонный бульон (МПБ), ксилозо-лизин-деоксихолатный агар (XLD); висмут-сульфит агар (ВСА), среду Эндо, скошенный агар. Чашки с посевами инкубировали при 370С в течение 20 часов. Подвижность микроорганизмов определяли при посеве уколом в полужидкий агар (ПЖА) через 24 часа при температуре 370С.
Биохимические свойства определяли в соответствии с наставлениями по применению систем индикаторных бумажных для идентификации микроорганизмов (СИБ), путем высева на среды Гисса и на бактериологическом анализаторе Vitek2 Compact с использованием идентификационных карт GN (для идентификации грамотрицательных микроорганизмов, не требовательных к составу среды).
Определение принадлежности к серотипам выявляли в РА на стекле с наборами сальмонеллезных поливалентных ABCDE и монорецепторных О- и Н-агглютинирующих сывороток. При агглютинации с О-сыворотками следует брать верхнюю часть выросшей культуры на скошенном агаре, а для агглютинации с Н-сыворотками – из конденсата или из самой нижней части (наиболее подвижные особи).
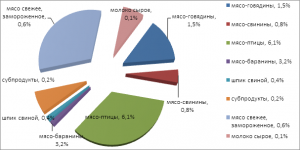
Рисунок 1. Диаграмма выделения сальмонелл из продуктов питания за исследуемый период
Как представлено на рисунке 1, наибольшее количество сальмонелл, 20 изолятов, было выделено из мяса – птицы (27,4%).
При использовании микробиологического метода, производили посев исследуемого материала на несколько питательных сред, чтобы обеспечить возможность роста максимально большему числу возможных возбудителей. Засеянные среды инкубировали в термостате в течение 20 часов при температуре 370С, после чего делали мазки и окрашивали по Граму. И в соответствии с данными бактериоскопии делали высевы на дифференциально-диагностические среды и проводили идентификацию выделенных бактерий.
а б
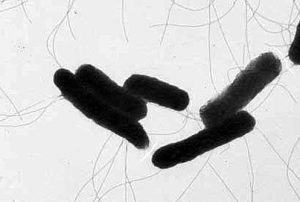
Рисунок 2. Морфология клеток сальмонелл: а – с МПБ, б – с МПА (электронная микроскопия, увеличение х25000)
Хорошо растут при температуре 370С. На МПА образуют гладкие, круглые, полупрозрачные, выпуклые, влажные колонии. На МПБ вызывают равномерное помутнение среды, на скошенном агаре растут обильно, образуя в конденсационной воде сильную муть. На XLD – черные, блестящие колонии. На ВСА – небольшие черные колонии с металлическим блеском, на Эндо – прозрачные, бесцветные, гладкие колонии (рисунок 3).
Рисунок 3. Рост бактерий рода Salmonella, на твердых питательных средах: а — XLD-arap, б – ВСА
По биохимическим свойствам все изоляты ферментировали глюкозу с образование газа, не обладали уреазной активностью, не образовывали индол и не ферментировали сахарозу и лактозу.
Ферментировали орнитиндекарбоксилазу, β-галактозидазау, маннит. Изоляты 10, 11 и 12 не утилизировали цитрат Симмонса. Арабинозу, сорбит и лизиндекарбоксилазу ферментировали более 25 % изолятов, что подтверждается литературными данными и данными Берджи (таблица 1).
Таблица 1
Биохимические свойства изолятов
| Наименование теста | Результаты постановки реакции | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | По данным Берджи | |
| Цитрат Симмонса | + | + | + | + | + | + | + | + | + | — | — | — | +,- |
| Мочевина (уреаза) | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Сероводород | — | + | — | + | — | — | + | + | + | + | + | + | +, — |
| Подвижность | — | — | — | — | — | — | + | + | + | — | — | — | +,- |
| Индол | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Глюкоза | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Арабиноза | + | + | + | — | + | + | + | + | — | + | + | + | +, (+) |
| Лактоза | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Маннит | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Сорбит | — | + | — | + | — | — | + | + | + | + | + | — | +,- |
| Сахароза | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Лизин | + | + | + | + | + | + | — | — | + | + | + | + | +,- |
| Орнитин | + | + | + | + | + | + | + | + | + | + | + | + | + |
| β-галактозидаза | + | + | + | + | + | + | + | + | + | + | + | + | + |
Представленные биохимические признаки были подтверждены на биохимическом анализаторе Vitek 2 Compact.
При исследовании с поливалентной сальмонеллезной сывороткой все изоляты показали положительную агглютинацию: капля сыворотки просветлилась и в ней образовались отчетливые белые глыбки.
Анализируя данные литературы, мы выяснили, что изоляты S. choleraesuis (свинина), S. enteritidis (свинина и птица), S. typhimurium (говядина, свинина), S. westhampton и S. dublin (молоко) выделены из продуктов питания, которые произведены из инфицированного сальмонеллами сырья.
По классификации Кауфмана-Уайта при анализе антигенной структуре 5 изолятов отнесены к группе О:4 (В), 2 изолята – О:7 (С1), 4 изолята к О:9 (Д1) и 1 – О:3,10 (Е1).
Заключение. Изучены морфологические, ростовые и биохимические свойства бактерий рода Salmonellla. При серотипировании 2 изолята отнесены к подвиду S. choleraesuis, 3 изолята – S. enteritidis, 3 — S. typhimurium, 1 — S. kisangani, 1 — S. westhampton, 1 — S. saintpaul и 1 изолят принадлежал к подвиду S. dublin. Продукты питания были произведены из инфицированного сальмонеллами сырья.
Читайте также:


