Стафилококк с конститутивным mlsb фенотипом что это
Антибиотики прямо под нашим носом
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром – мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее – в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик – лактоциллин [3].
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus – шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6, 7].

Рисунок 1. Staphylococcus aureus и лейкоциты. Рисунок с сайта relatedscience.blogspot.ru.
Staphylococcus aureus – бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5, 7, 8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S.aureus – это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7, 9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S.aureus, MRSA) (рис. 2). Метициллин – это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам.

Рисунок 2 (с сайта thinglink.com). Метициллин-резистентные золотистые стафилококки.
В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6, 9, 10].
Штамм S.lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма – чтобы выявить ген, ответственный за синтез смертельного для S.aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S.lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S.lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий – путем горизонтального переноса.
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S.lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.

Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров – белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид – предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина – 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S.aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) | |||||
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 | |||||
| + 50% человеческой сыворотки крови | 1,5 | ||||||
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 | |||||
| Staphylococcus aureus Mu50 | GISA | 3 | |||||
| Staphylococcus aureus SA113 | 3 | ||||||
| Staphylococcus aureus RN4220 | 3 | ||||||
| Enterococcus faecium BK463 | VRE | 3 | |||||
| Enterococcus faecalis VRE366 | VRE | 12 | |||||
| Listeria monocytogenes ATCC19118 | 6 | ||||||
| Streptococcus pneumoniae ATCC49619 | 1,5 | ||||||
| Bacillus subtilis 168 (trpC2) | 4 | ||||||
| Pseudomonas aeruginosa PAO1 | >50 | ||||||
| Escherichia coli DH5α | >50 | ||||||
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | |||||||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S.aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.

Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях. Рисунок из [5], модифицирован и адаптирован.
Чтобы понять, может ли S.lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S.aureus + S.lugdunensis IVK28 и S.aureus + S.lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S.aureus + S.lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S.aureus + S.lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S.lugdunensis в носу человека колонизацию бактериями S.aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) – S.lugdunensis. И только у одного пациента с S.lugdunensis в носу обитал S.aureus. У всех выделенных штаммов S.lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S.aureus оказались восприимчивы к лугдунину.
Лугдунин оказался первым обнаруженным бактериоцином нового класса – макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S.aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.

Стафилококк признан одним из наиболее распространенных возбудителей различных инфекций человека. Устойчивость к антимикробным препаратам среди стафилококков является растущей проблемой. Это привело к возобновлению интереса к использованию макролидов, линкозамидов и стрептограминов [6, 7]. Макролиды, линкозамиды и стрептограмины были объединены в одну группу (МЛС), это связано с общностью их механизмов действия и резистентности к ним микроорганизмов. Устойчивость к препаратам группы МЛС может быть связана с модификацией мишени действия, их активным выведением и быстрой инактивацией [4].
Наиболее распространенным и клинически важным механизмом резистентности стафилококков является метилирование. Известны два основных типа экспрессии устойчивости, связанной с метилированием: конститутивный и индуцибельный. При конститутивном типе синтез фермента метилазы (соответственно модификация мишени) происходит постоянно и не зависит от внешних условий, и бактерии проявляют перекрестную устойчивость ко всем макролидам, линкозамидам и стрептограминам. При индуцибельном – фермент синтезируется только в ответ на появление в окружающей среде антибиотиков. Штаммы с индуцибельным характером экспрессии метилаз, устойчивые к 14- и 15-членным макролидам, сохраняют чувствительность к 16 -членным макролидам и стрептограминам [4].
В последнее время, клиндамицин из-за его активного проникновения в ткани, является одним из наиболее эффективных антибиотиков в лечении инфекций, вызванных Staphylococcus aureus, особенно кожи и мягких тканей и остеомиелита [8].
Тем не менее выявленные чувствительные к клиндамицину стафилококки могут проявить индуцибельную резистентность во время проводимого лечения. На основании проведенных исследований было сделано заключение, что резистентные к эритромицину и чувствительные к клиндамицину стафилококки в ходе антибиотикотерапии могут приобретать резистентность, что и приводит к неэффективности проводимого лечения. Исходя из этого, возникает необходимость определения индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста, для выявления антагонизма между клиндамицином и эритромицином [9, 10].
Материалы и методы исследования
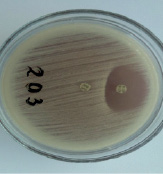
Рис. 1. Д-зона ингибирования вокруг диска с клиндамицином указывает на индуцибельный тип резистентности
Методика постановки D-теста и интерпритация результатов осуществлялась следующим образом: суспензию Staphylococcus spp. мутностью 0,5 McFarland наносили на поверхность Мюллера-Хинтон агара в чашке Петри, затем помещали диски с эритромицином (15 мкг) и клиндамицином (2 мкг) на расстоянии между ними 15 мм. После инкубации при 37°C в течение 18–24 часов уплощение зоны (D-образные) вокруг клиндамицина указывало на индуцибельный тип резистентности к клиндамицину (рис. 1). Если D-тест положительный (D+), то изолят следует считать устойчивым к клиндамицину, если отрицательный (D-), то чувствительным.
Результаты исследования и их обсуждение
По результатам идентификации установлено, что видовой состав выявленных стафилококков включал: коагулазоположительный вид S. aureus – 174 шамма и ряд коагулазонегативных видов (S. epidermidis, S. hyicus, S. auricularis, S. haemolyticus, S. hominis, S. capitis, S. saprophyticus) – 56 штаммов. Среди выявленных стафилококков S. aureus встречался в три раза чаще (рис. 2).
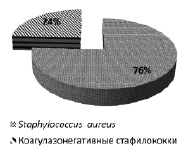
Рис. 2. Частота выявления Staphylococcus aureus и коагулазонегативных стафилококков из ран и свищей у больных хроническим остеомиелитом
Проведена сравнительная характеристика восприимчивости стафилококков к эритромицину и клиндамицину (рис. 3). Было установлено, что чаще встречаются штаммы, резистентные к эритромицину, причем у метициллинрезистентных коагулазонегативных стафилококков (MRCNS) эта разница составляла 36,4 %.
Среди метициллинрезистентных штаммов устойчивых к клиндамицину и эритромицину лидирующее положение занимает S. aureus, среди метициллинчувствительных – коагулазонегативные стафилококки (CNS).
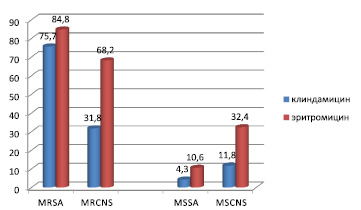
Рис. 3. Сравнительная характеристика резистентности эритромицина и клиндамицина к стафилококкам. Примечание. MRSA – метициллинрезистентные Staphylococcus aureus, MRCNS – метициллинрезистентные коагулазонегативные стафилококки, MSSA – метициллинчувствительные Staphylococcus aureus, MSCNS – метициллинчувствительные коагулазонегативные стафилококки
Сравнение различных типов восприимчивости стафилококка к клиндамицину и эритромицину
Современные тенденции в антибактериальной терапии внебольничных инфекций
Опыт — учитель, очень дорого берущий за уроки, но зато никто не научает лучше его.
Томас Карлейль
Конференцию открывала серия докладов, посвященных вирусным инфекциям дыхательных путей и ЛОР-органов.
Учитывая глобальное распространение устойчивости микроорганизмов ко многим классам антибактериальных препаратов, практическому врачу необходимо четко понимать, когда пациенту необходимо назначать антибиотики, а когда от их назначения следует воздержаться, особенно при таких актуальных сезонных заболеваниях, как острые респираторные вирусные инфекции (ОРВИ).
Так, в своем докладе доцент кафедры терапии Харьковской медицинской академии последипломного образования (ХМАПО), к.м.н. Д.Ю. Сидоров остановился на современных возможностях профилактики и лечения как ОРВИ, так и пандемического гриппа А/Н1N1 с позиций доказательной медицины.
Докладчик отметил, что современная стратегия этиотропной терапии вирусных заболеваний в настоящее время включает использование специфической противовирусной терапии наряду с минимизацией использования антибиотиков. При развитии эпидемии противовирусные препараты являются основными медикаментозными средствами снижения заболеваемости и смертности. В то же время основным методом специфической профилактики гриппа остается вакцинация, которую необходимо проводить не позднее чем за 2–3 месяца до предполагаемой эпидемии гриппа.
Тема смешанных инфекций (вирусно-бактериальных) и рациональности использования антибиотиков для их лечения, а также показаний к их назначению нашла продолжение в докладе д.м.н., профессора И.Г. Березнякова. Среди альтернативных стратегий антибактериальной терапии (АБТ) тонзиллофарингита докладчик остановился на лечении без антибиотиков, отсроченном (или отложенном) их применении и пациент-специфической ротации антибиотиков. Отсроченное (отложенное) применение антибиотиков либо лечение без антибиотиков можно рекомендовать больным из групп низкого риска развития осложнений. При наличии і 3 пересмотренных критериев Центора (по 1 баллу при наличии каждого из нижеследующих критериев: 1) отсутствие кашля; 2) отечные и болезненные передние шейные лимфатические узлы; 3) температура тела > 38 °С; 4) наличие экссудата на миндалинах или их отек, 5) возраст 3–14 лет (у больных в возрасте і 45 лет отнимается 1 балл)), а также при соответствующем настрое пациента/его родителей/опекунов возможна срочная АБТ. Что касается концепции пациент-специфической ротации антибиотиков, то предшествующая АБТ b-лактамами, макролидами и респираторными фторхинолонами (как минимум в последние 3 месяца, предшествующие нынешнему заболеванию) может ассоциироваться с резистентностью к вышеуказанным антибиотикам, поэтому при последующем заболевании инфекциями ЛОР-органов следует применять антибиотик, отличный от использованного ранее, даже если последний до настоящего времени оказывался эффективным. В лечении отита и синусита должна использоваться выжидательная тактика: при отите — симптоматическое лечение (анальгетики, главным образом парацетамол) и динамическое наблюдение за пациентом в течение 24–72 ч, при синусите — симптоматическое лечение без назначения антибиотиков в течение 10 дней от начала заболевания. Антибиотики назначаются при остром среднем отите (ОСО) при отсутствии эффекта или ухудшении состояния и/или по настоянию родителей. Абсолютными показаниями к их назначению являются также возраст до 2 лет, тяжелые формы ОСО с выраженным болевым синдромом, лихорадкой выше 38 °С и сохранением симптомов более 24 часов. При лечении синуситов необходимо знать, что бактериальный возбудитель при остром, рецидивирующем остром синусите и обострении хронического синусита выявляется не более чем в 50–60 % случаев (S.pneumoniae — 20–35 %, H.influenzae — 6–26 %, M.catarrhalis — 0–24 %, S.pyogenes — 1–3 % (до 20 % у детей), S.aureus — до 8 %; анаэробы — до 10 %). Спектр возбудителей хронических синуситов существенно отличается — преобладает смешанная инфекция: анаэробы (до 82 % — Peptostreptococcus spp., Bacteroides spp., Veillonella spp., Prevotella spp., Fusobacterium spp.), коагулазонегативные стафилококки (24–80 %), S.aureus (9–33 %), грамотрицательные бактерии и грибы. Препаратом выбора для лечения ОСО и синуситов (кроме хронического) является амоксициллин. В качестве альтернатив (при непереносимости b-лактамов или при неудачах терапии) могут использоваться защищенные аминопенициллины, антипневмококковые фторхинолоны и макролиды. По результатам целого ряда исследований различий между эффективностью антибиотиков разных классов выявлено не было. Докладчик также отметил, что наряду с умеренной пользой от применения антибиотиков не следует пренебрегать и существенным риском развития нежелательных лекарственных явлений (НЛЯ).
АБТ обострений хронического обструктивного заболевания легких (ХОЗЛ) нашла отражение в докладах и к.м.н. Д.Ю. Сидорова, и профессора И.Г. Березнякова. Так, назначение антибиотиков оправданно прежде всего у больных с обострениями ХОЗЛ, у которых оно протекает с усилением одышки и увеличением продукции мокроты при обязательном увеличении гнойности последней. Антибиотики показаны и при наличии двух из трех перечисленных критериев обострения — если одним из них будет увеличение гнойности мокроты. Наконец, антибиотики назначаются при обострениях у больных с тяжелым течением ХОЗЛ (требующих инвазивной или неинвазивной искусственной вентиляции легких).
Кроме того, Игорь Геннадьевич остановился на проблеме кашля и алгоритмах диагностики различных заболеваний, сопровождающихся этим симптомом. Важное значение придается таким параметрам, как продолжительность кашля, его частота и продуктивность, профессиональные факторы, данные физикального исследования и даже медикаментозная терапия других заболеваний. Поэтому следование диагностическому алгоритму при наличии кашля у больного и планомерная оценка множества характеристик данного симптома значительно облегчают лечащему врачу поиск верного диагноза в лабиринте заболеваний, сопровождающихся кашлем.
Тему трудностей диагностики и лечения саркоидоза в своем докладе поднял зав. кафедрой пульмонологии и фтизиатрии ХМАПО к.м.н. П.И. Потейко. В настоящее время эта болезнь играет все более значимую роль в современной структуре заболеваний. Клинические проявления саркоидоза разнообразны. Превалируют легочные и медиастинальные симптомы: кашель, одышка, боль в груди, иногда недомогание, лихорадка и потеря в весе (90 % случаев), значимую часть составляют костно-мышечные признаки (50–80 %). На долю кожных проявлений (неказефицированные эпителиоидноклеточные гранулемы, узловатая эритема, редко — васкулиты и полиморфная эритема) приходится 10–35 % симптомов, на долю глазных (доброкачественная инфильтрация конъюнктивы и слезных желез, увеит) — до 30 %. Редко встречаются неврологические проявления (менингит, поражение головного и спинного мозга, черепно-мозговых нервов и периферической нервной системы) и сердечные проявления. Последние часто не диагностируются, хотя являются причиной 50 % смертей от саркоидоза.
Определенные трудности также представляет дифференциальная диагностика экссудативных плевритов. Доклад на эту тему также сделал к.м.н. П.И. Потейко. Как правило, плеврит не является самостоятельной нозологической формой, а осложняет течение патологических процессов в области легких, грудной стенки, диафрагмы, органов средостения и поддиафрагмального пространства либо становится проявлением некоторых системных заболеваний.
Дифференциальная диагностика плевральных выпотов представляет трудности из-за отсутствия четких диагностических критериев при большинстве форм экссудативного плеврита. Так, при плевритах разной этиологии объем и характер плеврального выпота могут быть похожими, и наоборот, при плевритах одной этиологии выпот может быть различным. Среди трех наиболее частых категорий экссудатов (более 80 %) выделяют: связанные с туберкулезом легких без доказательств специфического поражения на рентгеновском снимке легких (занимают первое место в странах СНГ, удельный вес — около 40 % всех экссудатов); вызванные инфекцией (на их долю приходится около 20 % всех экссудатов). Так, более или менее выраженный плеврит отмечается у 40 % больных с бактериальной пневмонией, у 20 % пациентов с микоплазменной пневмонией и почти у 70 % больных со стафилококковыми пневмониями. Третью группу составляют плевриты, обусловленные опухолями (20 %).
Из многочисленных болезней, при которых может накапливаться плевральный выпот, Петр Иванович в первую очередь отметил неспецифические заболевания легких (пневмония, абсцесс, гангрена легких), злокачественные опухоли (рак легких и других локализаций, изредка мезотелиома), болезни сердца с застойной недостаточностью (выпот может быть односторонним, чаще правосторонним, и иметь экссудативный характер), тромбоэмболию легочной артерии, травму.
Описание клинических проявлений медикаментозной аллергии, современные возможности ее лабораторной диагностики и тактика лечения аллергических осложнений АБТ нашли свое отражение в докладах, представленных д.м.н., профессором В.Д. Бабаджаном. Так, по мере роста числа лекарственных средств, используемых в клинической практике, увеличивается риск возникновения у больных побочных реакций на медикаменты. Если до появления сульфаниламидов (конец 30-х гг. XX века) осложнения медикаментозного лечения наблюдались лишь у 0,5–1,5 %, то в настоящее время число осложнений терапии встречается уже у 2–3 % амбулаторных и у 6–35 % стационарных пациентов, увеличивая длительность госпитализации на срок от 1 до 5,5 дня.
Среди основных принципов лечения медикаментозных аллергий к числу ведущих можно отнести отмену всех лекарственных средств, кроме жизненно необходимых; гипоаллергенную диету, усиленный водный режим, энтеросорбенты, инфузионную терапию; антигистаминные препараты, глюкокортикостероиды в тяжелых случаях и посиндромную терапию основных проявлений медикаментозной аллергии.
Завершал первый день конференции доклад профессора И.Г. Березнякова и М.Н. Лебединской, посвященный современным представлениям о ступенчатой терапии. Двухэтапное применение антиинфекционных препаратов с переходом с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента возможно в нескольких вариантах. Это либо собственно ступенчатая терапия (sequential therapy): перевод с парентерального на пероральное введение одного и того же медикамента (например, перевод с парентерального введения 500 мг левофлоксацина 1 раз в сутки на прием внутрь того же левофлоксацина с той же кратностью), либо последовательная терапия (switch therapy): перевод с парентерального введения медикамента на прием внутрь другого препарата этого же класса с сопоставимым терапевтическим действием (например, перевод с парентерального введения пенициллина на прием внутрь феноксиметилпенициллина или перевод с парентерального введения ванкомицина на прием внутрь тейкопланина). В третьем варианте — нисходящая терапия (step-down therapy) — имеет место перевод с парентерального введения медикамента на пероральный прием препарата другого класса либо на препарат того же класса, но с иной частотой применения, дозой или спектром активности (в случае с антибиотиками). Например, перевод больного с парентерального введения ампициллин/сульбактама по 1,5 г каждые 6 ч на прием амоксициллин/клавуланата по 875 мг внутрь каждые 12 ч; либо перевод с парентерального введения цефтриаксона на пероральный цефалоспорин III поколения (цефподоксим проксетил и др.).
Второй день конференции в основном затрагивал вопросы организации микробиологических исследований, перспективы использования и интерпретацию иммуноферментного анализа и полимеразной цепной реакции для диагностики инфекционных заболеваний. Не остались без внимания многочисленные аспекты применения антибиотиков при непульмонологических заболеваниях, а также вопросы, непосредственно связанные с АБТ: приверженность к приему антибиотиков, межлекарственные взаимодействия при назначении антибиотиков и применение пробиотиков с лечебной и профилактической целью.
Далее на конференции была затронута такая немаловажная и непосредственно связанная с лечением антибиотиками проблема, как антибиотико-ассоциированные диареи (ААД) и наиболее тяжелая форма ААД — псевдомембранозный колит (ПМК). ПМК — крайнее проявление антибиотикассоциированного колита, характеризующееся частыми осложнениями (перфорация толстой кишки, токсический мегаколон) и высоким уровнем смертности (приблизительно 30 % у тяжелобольных пациентов).
Основным виновником столь тяжкого состояния является Clostridium difficile, грамположительная спорообразующая анаэробная бактерия, возбудитель, отвечающий практически за 100 % случаев ПМК, 50–75 % случаев AAД с колитом и 5–25 % случаев AAД без колита. Частота экзогенной колонизации этим возбудителем напрямую зависит от длительности лечения больного в стационаре (увеличиваясь примерно на 10 % каждую последующую неделю) и назначенного антибиотика. Среди антимикробных препаратов, применение которых относительно часто осложняется развитием ААД, преобладают цефалоспорины, клиндамицин, ампициллин и амоксициллин, другие пенициллины, эритромицин и другие макролиды, тетрациклины, триметоприм/сульфаметоксазол. Редко ААД вызывают тикарциллин/клавуланат, хлорамфеникол, амфотерицин В, хинолоны, рифампицин, аминогликозиды, сульфаниламиды. Из факторов, предрасполагающих к развитию манифестных форм, необходимо отметить экзогенное инфицирование (главным образом госпитализированных пациентов), нарушение микробиоценоза кишечника вследствие предшествующей АБТ, возраст старше 60 лет, сопутствующие заболевания (ожоговая болезнь, уремия, лейкозы и др.), иммуносупрессию, прием ингибиторов протонной помпы и других антисекреторных препаратов, питание через зонд. Если для лечения антибиотико-ассоциированного колита обычно достаточно отмены антибактериального препарата, спровоцировавшего развитие болезни, проведения поддерживающей терапии, направленной на восстановление водно-электролитного баланса, и неназначения препаратов, снижающих перистальтику кишечника, то при ААД, вызванной Clostridium difficile, эти мероприятия будут эффективны только в 15–25 % случаев. Препаратами выбора в терапии ААД являются метронидазол (перорально) либо ванкомицин (перорально). Поскольку в последнее время увеличивается частота выделения энтерококков, резистентных к ванкомицину, его использование в качестве препарата первой линии в терапии ААД не рекомендуется (табл. 1).

Экскурс в АБТ инфекций, вызванных внебольничными метициллинорезистентными штаммами Staphylococcus aureus (MRSA), предоставил на суд аудитории профессор И.Г. Березняков. Он отметил, что наибольшее сродство к b-лактамам наблюдается у пенициллинсвязывающих белков (ПСБ) с небольшой молекулярной массой (ПСБ 1, 2, 3), а резистентность стафилококков к антибиотикам этого класса развивается при наличии ряда условий: при изменении нормальных ПСБ, обретении способности вырабатывать дополнительные ПСБ с низким сродством к b-лактамам либо при чрезмерной выработке нормальных ПСБ (ПСБ 4 и 5) с более низким сродством к b-лактамным антибиотикам, чем у ПСБ 1, 2, 3. Факторами риска инфекции, вызванной MRSA, являются хирургическое вмешательство, диализ, госпитализация или пребывание в домах длительного ухода в течение предшествующего года, присутствие постоянных чрескожных устройств (например, центрального венозного катетера или питательного зонда), MRSA-инфекция, документированная позднее чем через 48 часов после госпитализации, и анамнестические указания на выделение MRSA у пациента в прошлом.
От нозокомиальных MRSA внебольничные MRSA отличаются отсутствием традиционных факторов риска инфицирования (нозокомиальными) MRSA, частой связью с инфекциями мягких тканей и чувствительностью ко многим не-b-лактамным антибиотикам. Среди препаратов, которые могут быть активными в отношении внебольничных штаммов MRSA, можно выделить доксициклин, клиндамицин, ко-тримоксазол, ванкомицин.
Доксициклин показан для лечения неосложненных инфекций кожи и мягких тканей, но не рекомендуется для лечения инвазивных инфекций, противопоказан при беременности и у детей младше 8 лет.
Клиндамицин рекомендуется при инфекциях кожи и мягких тканей. Однако при инфекциях, вызванных внебольничным MRSA с индуцибельной MLSb резистентностью (фенотип устойчивости к макролидам, линкозамидам и стрептограмину В), использование этого препарата должно быть ограничено. Среди НЛЯ, связанных с приемом клиндамицина, чаще других встречаются тошнота, диарея и заболевания, ассоциированные с Clostridium difficile.
Чувствительность внебольничных MRSA к ко-тримоксазолу, по данным SENTRY Antimicrobial Surveillance Program, составляет 91,1 %, но активность этого препарата в отношении стрептококков группы А низкая. Ко-тримоксазол может вызывать сыпь, синдром Стивенса — Джонсона, цитопении. Противопоказаниями к его назначению являются 3-й триместр беременности и возраст детей до 2 мес.
Большой интерес в аудитории вызвал доклад о фармакоэпидемиологических особенностях лечения инфекций дыхательных путей и ЛОР-органов, представленный вице-президентом Украинской ассоциации за рациональное использование антибиотиков А.Г. Погореловым. По словам докладчика, именно человек, как пациент, так и врач, является основной причиной развития антибиотикорезистентности, тесно коррелирующей с клинической неэффективностью. Поскольку антибиотики относятся к невосстановимым ресурсам, то избыточное их применение населением, неправильные представления и недооценка проблемы резистентности врачами и фармацевтами, их назначающими, широкое использование в сельском хозяйстве и ветеринарии ведут к распространению устойчивости среди микроорганизмов и диктуют необходимость поиска все новых и новых классов эффективных антибиотиков.
Подводя итоги услышанному на конференции, нужно отметить, что почти все доклады были посвящены разумному применению антибактериальных препаратов, а именно достижению клинического эффекта у тех больных, которым они прежде всего показаны и у которых их эффективность максимальна. В современных условиях, когда темпы роста резистентности опережают темпы разработки новых антибиотиков, недопустима утрата любого класса антимикробных препаратов из арсенала инструментов практической медицины.
Читайте также:


