Стафилококки возбудители внутрибольничных инфекций
Стафилококки относятся к отделу Firmicutes, сем. Micrococcaceae, роду Staphylococcus. Род включает 27 видов, среди которых имеются патогенные, условно-патогенные виды и сапрофиты. Основные поражения человека вызывают 3 вида: S.aureus, S.epidermidis и S.saprophyticus.
Морфология: имеют шаровидную форму (круглые клетки называются кокками). В препаратах из чистой культуры располагаются в виде беспорядочных скоплений, напоминающих гроздья винограда. В мазках из гноя – одиночно, парами или небольшими кучками. Не имеют спор, жгутиков (неподвижны), могут образовывать нежную капсулу.
Культуральные свойства: факультативные анаэробы, не требовательны к питательным средам, на плотных средах образуют колонии в S-форме – круглые, с ровным краем, окрашенные в кремовый, желтый, оранжевый цвет, на жидких средах дают равномерное помутнение. Растут на солевых средах (5 – 10% NaCCl); молчно-солевой и желточно-солевой агар – элективные среды для стафилококков.
Биохимические свойства: сахаролитические – расщепляют 5 углеводов сред Гисса до кислоты; протеолитические – расщепляют белки с образованием H2S, разжижают желатин в виде воронки, на 4-5 день воронка заполняется жидкостью.
Антигенная структура: имеют около 30 антигенов: белки, полисахариды, тейхоевые кислоты; многие внеклеточные вещества, которые образуют стафилококки, обладают антигенными свойствами.
Резистентность: устойчивы во внешней среде, но чувствительны к дез. растворам, особенно к бриллиантовому зеленому, нередко устойчивы к пенициллину, т. к. образуют фермент пенициллиназу.
Эпидемиология стафилококковых инфекций.
Стафилококки распространены повсеместно и часто входят в состав нормальной микрофлоры человека (носители). Золотистый стафилококк заселяет носовые ходы, брюшную полость, подмышечные области. Эпидермальный стафилококк заселяет гладкую кожу, поверхность слизистых оболочек. Сапрофитический стафилококк заселяет кожные покровы гениталий, слизистую оболочку мочевыводящих путей.
Стафилококковые инфекции называют чумой 20 века, т.е. они опасны и очень распространены, особенно в родильных домах, в хирургических отделениях.
1) источник инфекции – больной человек или здоровый носитель;
2) механизм передачи – смешанный;
3) пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой;
4) восприимчивость населения – зависит от общего состояния и возраста; наиболее восприимчивы новорожденные и дети грудного возраста.
Большинство инфекций носит эндогенный характер и заражение связано с переносом возбудителя из мест заселения на травматизированную (поврежденную) поверхность.
Патогенез и клиника заболеваний.
Входные ворота – любой орган и любая ткань; стафилококки проникают через поврежденные кожные покровы, слизистые оболочки рта, дыхательных путей, мочеполовой системы и т.д.
Стафилококки размножаются в месте проникновения, образуют экзотоксин и ферменты агрессии и вызывают формирование местных гнойно-воспалительных очагов. Распространяясь из этих очагов стафилококки могут попадать в кровь (сепсис), а с кровь. – в другие органы (септикопиемия).
Инкубационный период – от нескольких часов до 3 – 5 дней.
Стафилококки вызывают более 100 нозологических форм заболеваний. Они поражают кожу (фурункулы, карбункулы), подкожную клетчатку (абцессы, флегмоны), дыхательные пути (ангина, пневмония, гаймориты), вызывают маститы, гнойные миозиты и мышечные абцессы, абцессы головного мозга после черепно-мозговых травм, эндокардиты, поражают кости (остеомиелиты, артриты), печень, почки, мочевыводящие пути (пиелонефриты, циститы). Особенно опасны заболевания, когда стафилококки проникают в кровь (сепсис) и поражают внутренние органы (септицемия). Стафилококковые инфекции сопровождаются интоксикацией, повышением температуры, головной болью.
Заболевания протекают остро, но могут иметь и хронический характер.
Синдром токсического шока впервые зарегистрирован в 1980 г. у женщин 15 – 25 лет, использующих тампоны в период менструаций. Проявляется высокой температурой (38,8°С и выше), рвотой, диареей, сыпью, падением кровяного давления и развитием шока, часто приводящего к летальному исходу.
Пищевые отравления проявляются рвотой, водянистой диареей уже через 2 – 6 час. после употребления в пищу инфицированных продуктов, обычно кондитерских изделий с кремом, консервов, мясных и овощных салатов. Проявления исчезают или значительно ослабевают через 24 часа даже без лечения.
Иммунитет: слабый, нередко развивается аллергия к стафилококковым токсинам, что ведет к длительным, хроническим болезням.
Исследуемый материал:гной, отделяемое от ран, мокрота, кровь, рвотные массы, пищевые продукты.
Методы диагностики:
1) бактериоскопический – из гноя готовят мазок, красят по Граму и микроскопируют; в мазке видны лейкоциты, нейтрофилы, отдельные круглые клетки стафилококков и беспорядочные скопления, напоминающие виноградную гроздь (из крови мазок не готовят);
2) бактериологический - выделяют чистую культуру, делая посев материала на питательные среды (чаще на кровяной агар для выявления гемолиза), а затем проводят ее идентификацию – изучают морфологию (окраска по Граму), наличие факторов патогенности (плазмокоагулазы, лецитовителлазы) и биохимические свойства (анаэробное расщепление маннита и глюкозы); обязательным является определение антибиотикограммы; стафилококки – это представители нормальной микрофлоры, поэтому нельзя ограничиваться выделением и идентификацией возбудителя, необходимы количественные методы анализа – определение числа микробов в пробе;
3) биопроба (при пищевых отравлениях) – заражают маленьких котят-сосунков, у которых через час появляются рвота, понос и они погибают.
Серологические реакции не нашли применения.
Применяют антибиотики широкого спектра действия, полусинтетические пенициллины (метициллин, оксациллин), сульфаниламидные препараты. Обязательно определяют антибиотикограмму. В последние годы от больных выделяют стафилококки, устойчивые к большинству химиотерапевтических препаратов. В таких случаях для лечения используют антитоксическую противостафилококковую плазму или иммуноглобулин, полученные из крови доноров, иммунизированных стафилококковым анатоксином. При хронических формах заболеваний также вводят стафилококковый анатоксин, применяют аутовакцину.
Для специфической профилактики (плановых хирургических больных, беременных женщин) может быть использован адсорбированный стафилококковый анатоксин.
Неспецифическая профилактика имеет более важное значение – это соблюдение санитарно-гигиенических правил, закаливание организма.
Не нашли то, что искали? Воспользуйтесь поиском:

Внутрибольничной инфекцией (ВБИ, нозокомиальной инфекцией) называют любое инфекционное заболевание, заражение которым произошло в лечебно-профилактическом учреждении. С середины 20-го века ВБИ представляют собой серьезнейшую проблему здравоохранения различных стран мира. Возбудители их имеют ряд особенностей, благодаря которым они успешно живут и размножаются в больничной среде. По официальным данным ежегодно в РФ до 8% пациентов заражаются нозокомиальными инфекциями, что составляет 2-2,5 миллиона человек в год. Однако, статистический метод учета несовершенен и ряд исследователей считает, что реальная заболеваемость в десятки раз превышает заявленную.
Понятие нозокомиальная инфекция объединяет под собой большое количество различных заболеваний, что приводит к трудностям в ее классификации. Общепринятыми подходами к делению ВБИ являются этиологический (по возбудителю) и по локализации процесса:
| Этиологические группы | Локализация инфекционного процесса |
|---|---|
| Сальмонеллез; Стафилококковая инфекция; Корь; Вирусный гепатит; Синегнойная инфекция; Анаэробная инфекция и другие. | Инфекция дыхательных путей; Кишечная инфекция; Раневая инфекция; Инфекция кожи и подкожно-жировой клетчатки; Бактериальный эндокардит и другие. |
Возбудители

Причинами внутрибольничной инфекции становятся бактерии, вирусы и грибки. Лишь незначительная часть из них относится к патогенным микроорганизмам, гораздо большее значение имеют условно-патогенные микроорганизмы. Они обитают на коже и слизистых человека в норме, а болезнетворность приобретают только при снижении иммунной защиты. Иммунитет слабо реагирует на присутствие условно-патогенной флоры в организме, так как ее антигены привычны ему и не вызывают мощной выработки антител. Нередко возбудители формируют различные ассоциации из нескольких видов бактерий, вирусов, грибков.
Список возбудителей ВБИ беспрестанно растет, на сегодняшний день наибольшую значимость имеют следующие виды:
| Условно-патогенная микрофлора: | Патогенная микрофлора: |
|---|---|
| Стафилококки (золотистый, эпидермальный); | Вирусы гепатитов В,С; |
| Стрептококки (группы А, В, С); | Вирус гриппа; |
| Энтеробактерии; | Вирус кори; |
| Кишечная палочка; | Вирус краснухи; |
| Клебсиелла; | Ротавирус; |
| Протей; | Вирус ветряной оспы (для людей, не переболевших ветрянкой в детстве и детей); |
| Синегнойная палочка (псевдомонада); | Сальмонеллы; |
| Ацинетобактеры; | Шигеллы; |
| Пневмоциста; | Клостридии; |
| Токсоплазма; | Микобактерии туберкулеза; |
| Криптококк; | Дифтерийная палочка. |
| Кандида. |
Перечисленные микроорганизмы обладают одним из механизмов широкого распространения и высокой заразности. Как правило, они имеют несколько путей передачи, некоторые способны жить и размножаться вне живого организма. Мельчайшие частицы вирусов легко разносятся по лечебному учреждению через вентиляционные системы и в короткие сроки заражают большое количество людей. Скученность, близкий контакт, ослабленные больные – все эти факторы способствуют возникновению вспышки и поддерживают ее длительное время.

Бактерии и грибки менее заразны, но они чрезвычайно устойчивы во внешней среде: не поддаются действию дезинфицирующих средств, ультрафиолетового облучения. Некоторые из них формируют споры, которые не погибают даже при длительном кипячении, замачивании в дезинфектантах, замораживании. Свободноживущие бактерии успешно размножаются во влажных средах (на раковинах, в увлажнителях, емкостях с дезсредствами), чем долго поддерживают активность очага внутрибольничной инфекции.
Эпидемиологический процесс
Источники инфекции – это больные люди и бессимптомные носители возбудителя. Чаще всего они встречаются среди пациентов, несколько реже – среди персонала и крайне редко источником становятся посетители стационара. Роль последних невелика в связи с ограничением посещений стационара, организации мест для встречи в фойе, а не в больничных палатах. Передача возбудителей происходит различными путями:
а) Естественные пути распространения:
- Горизонтальные:
- фекально-оральный;
- контактный;
- воздушно-капельный;
- воздушно-пылевой;
- пищевой.
- Вертикальный – через плаценту от матери к плоду.
б) Искусственные (артифициальные) пути распространения:
- Ассоциированный с парентеральными вмешательствами (инъекциями, переливанием крови, пересадкой органов и тканей).
- Ассоциированный с лечебными и диагностическими инвазионными процедурами (искусственная вентиляция легких, эндоскопическое обследование полостей организма, лапароскопическое вмешательство).
По частоте возникновения вспышек внутрибольничной инфекции лидируют:
- Родильные дома;
- Хирургические стационары;
- Отделения реанимации и интенсивной терапии;
- Терапевтические стационары;
- Детские отделения.
Структура заболеваемости зависит от профиля стационара. Так, в хирургии на первое место выходят гнойно-септические инфекции, в терапии – инфекции дыхательных путей, в урологических стационарах – инфекции мочевыделительной системы (в связи с применением катетеров).

Инфекционный процесс развивается при наличии у пациента отягощающих его состояние болезней. Выделяют группы больных, восприимчивых к возбудителям ВБИ:
- Новорожденные;
- Пожилые люди;
- Истощенные;
- Больные с хронической патологией (сахарный диабет, сердечная недостаточность, злокачественные опухоли);
- Длительно получающие антибиотики и антацидные средства (снижающие кислотность желудочного сока);
- ВИЧ-инфицированные;
- Люди, прошедшие курс химио-/лучевой терапии;
- Пациенты после инвазивных манипуляций;
- Больные с ожогами;
- Алкоголики.
Заболеваемость ВБИ вспышечная или спорадическая, то есть, возникает один или несколько случаев болезни одновременно. Заболевших связывает нахождение в одном помещении, применение общего инструментария, совместное употребление больничной пищи, использование общей санитарной комнаты. Сезонность у вспышек отсутствует, они регистрируются в любое время года.
Профилактика ВБИ
Профилактика ВБИ – это наиболее эффективный способ решения проблемы. Для лечения нозокомиальной инфекции необходимы самые современные антибиотики, к которым микроорганизмы не успели выработать резистентность. Таким образом, антибактериальная терапия превращается в бесконечную гонку, в которой возможности человечества весьма ограничены.
Положение дел понимали врачи прошлого века, в связи с чем в 1978 году минздрав СССР выпустил приказ 720, который полностью регламентирует профилактику ВБИ и действует на территории РФ по сей день.
К мерам профилактики относятся:
С развитием фармацевтической и химической промышленности проблема внутрибольничных инфекций приобрела невероятный размах. Неадекватное назначение антибиотиков, применение все более мощных дезинфектантов в избыточных/недостаточных концентрациях приводят к появлению сверхустойчивых штаммов микроорганизмов. Известны случаи, когда из-за агрессивного и резистентного штамма стафилококка целые больничные корпусы предавались огню – более щадящих способов справиться с бактерией не было. Проблема внутрибольничной инфекции – это своеобразное напоминание человечеству о могуществе микроорганизмов, их умении приспосабливаться и выживать.
1.1 . В настоящих методических указаниях представлена информация о роли метициллинрезистентных штаммов золотистого стафилококка в возникновении внутрибольничных инфекций, их микробиологических и эпидемиологических особенностях, изложены традиционные и молекулярно-генетические методы идентификации и типирования.
1.2 . Методические рекомендации разработаны в помощь специалистам органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактических учреждений, осуществляющих организацию и проведение профилактических и противоэпидемических мероприятий по борьбе с внутрибольничными инфекциями.
2.2 . Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации № 554 от 24 июля 2000 г.
2.6 . Методические указания по эпидемиологическому надзору за внутрибольничными инфекциями от 02.09.87. № 28-6/34.
В последнее десятилетие проблема внутрибольничных инфекций (ВБИ) приобрела исключительно большое значение для всех стран мира. Это обусловлено, прежде всего, значительным ростом числа госпитальных штаммов микроорганизмов, обладающих устойчивостью к широкому кругу антимикробных препаратов. Несмотря на значительный недоучет, в Российской Федерации ежегодно регистрируется около 30 тыс. случаев внутрибольничных инфекций, при этом минимальный экономический ущерб составляет более 5 млрд. рублей ежегодно. Среди возбудителей ВБИ одно из первых мест, по-прежнему, принадлежит микроорганизмам рода Staphylococcus , наиболее патогенным представителем которого является S . aureus . Эпидемиологическая ситуация осложняется в связи с широким распространением в стационарах, а также появлением и во внебольничной среде, клинических изолятов S . aureus, устойчивых к оксациллину (ORSA или MRSA ). MRSA способны вызывать разнообразные клинические формы внутрибольничных инфекций, включая наиболее тяжелые, такие как: бактериемия, пневмония, синдром септического шока, септический артрит, остеомиелит и другие, которые требуют длительного и дорогостоящего лечения. Появление осложнений, вызванных MRSA , приводит к увеличению сроков госпитализации, показателей летальности, значительным экономическим потерям. Показано, что рост частоты ВБИ, наблюдаемый в стационарах различных стран мира, обусловлен распространением эпидемических штаммов MRSA , многие из которых способны вырабатывать пирогенные токсины - суперантигены, подавляющие иммунный ответ на S . aureus .
С конца 90-х годов прошлого века в стационарах России отмечается рост частоты выделения MRSA , которая в ряде больниц достигла 30 - 70 %. Это делает неэффективным использование многих антимикробных препаратов и существенно ухудшает качество оказания медицинской помощи населению. В этих условиях совершенствование методов эпидемиологического и микробиологического мониторингов, направленных на выявление эпидемически значимых штаммов, приобретает все более актуальное значение.
4.1. Таксономия и биологические особенности
4.2. Клиническое значение
В настоящее время MRSA являются ведущими возбудителями внутрибольничных инфекций в стационарах многих странах мира. Частота их выделения в стационарах США, Японии, многих стран Западной Европы достигает 40 - 70 %. Исключение составляют, по-видимому, только ряд скандинавских стран, где исторически были приняты жесткие противоэпидемические меры по контролю за распространением таких штаммов. В стационарах Российской Федерации частота выделения MRSA колеблется от 0 до 89 %. Наибольшая частота выделения отмечается в реанимационных, ожоговых, травматологических и хирургических отделениях стационаров, расположенных в крупных городах. Одной из основных причин этой закономерности является концентрация в таких стационарах пациентов с нарушениями целостности кожных покровов и поврежденными иммунологическими барьерами. Наиболее частым местом локализации инфекции являются послеоперационные и ожоговые раны и дыхательные пути. Первичные и вторичные бактериемии наблюдаются примерно у 20 % инфицированных больных. В случае инфицирования ожоговых больных частота бактериемии нередко возрастает до 50 %. Факторами, способствующими развитию бактериемии, является присутствие центрального венозного катетера, анемия, гипотермия и назальное носительство. Развитие бактериемии значительно увеличивает вероятность летального исхода. Особенно высокая смертность, обусловленная бактериемией, наблюдается среди пациентов, находящихся в ожоговых и отделениях интенсивной терапии, где она может достигать 50 % по сравнению с 15 % в контрольной группе. Риск развития летального исхода возрастает почти в три раза среди пациентов, у которых бактериемия обусловлена MRSA по сравнению с пациентами, инфицированными метициллинчувствительными штаммами S. aureus . Развитие госпитальной бактериемии приводит к значительному увеличению стоимости госпитализации. В современных условиях лечение таких пациентов требует, как правило, внутривенного введения ванкомицина, тейкопланина или линезолида, однако клиническая эффективность этих препаратов нередко оказывается значительно ниже, чем у антибиотиков, используемых для лечения пациентов с осложнениями, вызванными метициллинчувствительными S . aureus . По данным Центра по контролю за заболеваниями (США) средняя продолжительность пребывания пациента в больнице в случае хирургического вмешательства составляет 6,1 дня, тогда как при возникновении осложнений, вызванных MRSA она увеличивается до 29,1 дней, при этом средние расходы возрастают с 29455$ до 92363$ в пересчете на каждый случай. Заболевания, вызванные MRSA, могут начинаться на фоне терапии антибиотиками, в том числе аминогликозидами и цефалоспоринами. В этой связи необходимо отметить, что неадекватное назначение антибиотиков в случае тяжелых ВБИ драматически ухудшает прогноз заболевания. Летальность при осложнениях, вызванных MRSA , значительно колеблется и зависит как от возраста пациента, сопутствующего заболевания (артериальная гипертензия, диабет и др.), так и от присоединения дополнительной микрофлоры. Наиболее распространенными вторичными проявлениями инфекции, обусловленной M RSA , являются эндокардиты, гематогенный остеомиелит, септический артрит. Одним из наиболее грозных осложнений, вызываемых MRSA , является синдром токсического шока (СТШ). Клинические проявления СТШ включают следующий симптомокомплекс: гипертермия, сыпь, рвота, диарея, гипотензия, генерализованный отек, острый респираторный дистресс синдром, полиорганная недостаточность, диссеминированная интраваскулярная коагуляция. СТШ может развиться как осложнение после родов, хирургических вмешательств, при суперинфицировании S . aureus трахеальных повреждений, вызванных вирусом гриппа. Недавно описанные стафилококковая скарлатина и синдром упорной десквамации эпителия рассматривают как варианты СТШ.
4.3. Факторы патогенности и вирулентность
Вопрос о вирулентности MRSA остается дискутабельным. Они практически не вызывают заболевания у здоровых лиц из числа медицинского персонала. Вместе с тем, в многочисленных исследованиях показано, что прогноз при тяжелых формах внутрибольничных инфекций, таких как пневмония и бактериемия, значительно хуже среди пациентов, инфицированных MRSA , по сравнению с пациентами, инфицированными метициллинчувствительными S . aureus.
4.4. Генетический контроль устойчивости к метициллину и особенности фенотипической экспрессии
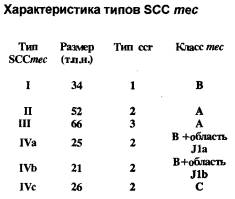
Мишенью действия b -лактамных антибиотиков (как пенициллинов, так и цефалоспоринов) являются транс- и карбоксипептидазы - ферменты, участвующие в биосинтезе основного компонента клеточной стенки микроорганизмов - пептидогликана. Благодаря своей способности связываться с пенициллином и другими b -лактамами данные ферменты получили название пенициллинсвязывающих белков (ПСБ). У Staphylococcus aureus имеются 4 ПСБ, отличающиеся как по молекулярной массе, так и по функциональной активности. Устойчивость метициллинрезистентных штаммов золотистого стафилококка ( MRSA ) к b -лактамным антибиотикам обусловлена продукцией дополнительного пенициллинсвязывающего протеина - ПСБ-2 ¢ , отсутствующего у чувствительных микроорганизмов. При подавлении В -лактамным антибиотиком активности основных пенициллинсвязывающих белков ПСБ-2 ¢ , в силу своего более низкого сродства к препаратам данной группы, продолжает функционировать и сохраняет микробной клетке жизнеспособность. Синтез ПСБ-2 ¢ кодируется геном mec A , расположенным на хромосоме S . aureus , в специфической области, обнаруживаемой только у метициллинрезистетных штаммов стафилококка - тес ДНК. Ме c ДНК представляет новый класс мобильных генетических элементов, который получил название стафилококковая хромосомная кассета тес ( Staphylococcal chromosomal cassette тес = SCCmec ). Выявлено существование 4 типов SCCmec , различающихся как размерами (от 21 до 66 т.п.н.), так и набором генов, составляющих данные кассеты. Разделение на типы основано на различиях в генах, образующих собственно комлекс тес, и в наборе генов, кодирующих рекомбиназы сс r А и сс r В, входящих в различных сочетаниях в стафилококковую хромосомную кассету (рис. 1 ). Комлекс тес может включать: тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ; mec I - регуляторный ген, влияющий на транскрипцию тесА; mecR 1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; а также инсерционные последовательности IS 431 и IS 1272. В настоящее время известны 4 варианта комплекса тес (рис. 2 ).
Кроме того, различия между типами кассет тес обусловлены присутствием ряда дополнительных генов, расположенных в генетических областях J 1а, J 1 b .
Генетическая структура комплексов тес различных классов
• Класс A, IS431 - mecA- mecR1- mec1
• Класс В , IS431 - mecA- D mec R1-IS1272
• Класс С , IS431 - mecA- D mec R1-IS431
• Класс D , IS 431 - mec A - D mec R 1
Рис. 2. тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ;
mecI - регуляторный ген, влияющий на транскрипцию тесА;
mecR 1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; IS431 и IS 1272 - инсерционные последовательности
Уникальность метициллинрезистентности заключается также и в существовании феномена гетерорезистентности, суть которого состоит в том, что в условиях инкубации при 37 °С не все клетки популяции проявляют устойчивость к оксациллину. Генетический контроль феномена гетерорезистентности до настоящего времени полностью не выяснен. Известно только, что на экспрессию устойчивости могут влиять регуляторные гены b -лактамазы, а также ряд дополнительных генов, так называемые fem ( factors essential for methicillin resistance ) или aux , локализованные в различных частях хромосомы S . aureus , вне SCCmec . Сложность регуляции проявляется в фенотипических различиях. Выделяют 4 стабильных фенотипа (класса) резистентности. Первые три класса являются гетерогенными. Это означает, что в популяциях стафилококков, относящихся к этим классам, присутствуют субпопуляции микробных клеток с разным уровнем резистентности. При этом клоны стафилококков, получаемые из изолированных колоний (образовавшихся при рассеве первичной культуры) по популяционному составу полностью совпадают с исходной культурой.
Класс 1. Рост 99,99 % клеток подавляется оксациллином в концентрации 1,5 - 2 мкг/мл, рост 0,01 % микробов подавляется только при 25,0 мкг/мл.
Класс 2. Рост 99,9 % клеток подавляется при концентрации оксациллина 6,0 - 12,0 мкг/мл, тогда как рост 0,1 % микробов подавляется при концентрации > 25,0 мкг/мл.
Класс 3. Рост 99,0 - 99,9 % клеток подавляется при концентрации 50,0 - 200,0 мкг/мл и только рост 0,1 - 1 % микробной популяции подавляется при концентрации оксациллина 400,0 мкг/мл.
Класс 4. Представители этого класса характеризуются гомогенным уровнем устойчивости, который превышает 400,0 мкг/мл для всей популяции.
В связи с наличием гетерогенности по устойчивости к оксациллину могут возникать трудности при идентификации MRSA традиционными микробиологическими методами.
4.5. Особенности эпидемиологии MRSA
Будучи однажды занесенными в стационар, MRS А могут выживать там в течение длительного времени. Это определяет стратегию противоэпидемических мероприятий: очень важно не допустить занос и распространение в стационаре эпидемических штаммов.
Следует отметить, что периодически происходит смена эпидемического штамма, доминирующего на отдельных территориях. Так, по данным стафилококковой референс-лаборатории в Colindale ( London ), в 1996 г. штаммы EMRSA -15 и EMRSA -16 были ответственны за более чем 1500 инцидентов, охвативших трех и более пациентов, в 309 больницах Англии, тогда как остальные эпидемические штаммы были ответственны только за 361 инцидент в 93 больницах. Распространение этих эпидемических штаммов привело к росту смертности от MRSA в 15, а частоты бактериемии в 24 раза за период с 1993 по 2002 г.г. согласно данным национального департамента статистики Великобритании.
Продолжает нарастать спектр антибиоткорезистентности эпидемических штаммов MRSA . Они гораздо быстрее, чем метициллинчувствительные, приобретают устойчивость к препаратам из группы фторхинолонов. Характерной чертой многих эпидемических штаммов MRSA является устойчивость практически ко всем известным классам антимикробных препаратов, за исключением гликопептидов и оксазолидинонов. В последние годы участились случаи выделения изолятов MRSA , обладающих умеренной чувствительностью к ванкомицину и даже ванкомицинрезистентных. Распространение таких штаммов в стационарах России может иметь драматические последствия.
С проблемой госпитальных штаммов MRSA тесно переплетается и проблема MRSA вне госпитального происхождения. Эти штаммы пока не обладают множественной резистентностью к антибиотикам, генетически отличаются от госпитальных штаммов, их происхождение остается неизвестным. Предполагается, что они сформировались из спорадических госпитальных штаммов. Внегоспитальные штаммы MRSA способны вызывать некротизирующую форму пневмонии, характеризующуюся крайне тяжелым течением и требующей госпитализации пациента, в связи с чем возникает угроза заноса и распространения таких штаммов в стационарах.
Основные эпидемические штаммы и клоны MRSA
Международные клоны, идентифицированные в LMMRU ** (г. Нью-Йорк)
Читайте также:


