В отношении стафилококков вырабатывающих бета лактамазу эффективен
1.амоксициллин; 2.ампициллин; 3.бензатин бензилпенициллин; 4.оксациллин; 5.феноксиметилпенициллин.
2. Основным показанием для назначения пиперациллина является:
1.анаэробная инфекция; 2.псевдомонадная инфекция; 3.стафилококковая инфекция; 4.стрептококковая инфекция.
3. Антибиотик, высоко активный в отношении метициллинрезистентных стафилококков:
1.ванкомицин; 2.имипенем; 3.пиперациллин; 4.оксациллин; 5.цефотаксим.
4. Антибиотики, характеризующиеся наибольшей терапевтической широтой:
1.аминогликозиды; 2.хлорамфениколы; 3.гликопептиды; 4.цефалоспорины.
5. Самым широким спектром антимикробного действия обладают:
1.аминогликозиды; 2.гликопептиды; 3.карбапенемы; 4.монобактамы; 5.цефалоспорины.
6. Амоксициллин превосходит ампициллин при приеме внутрь потому, что он характеризуется:
1.большей биодоступностью; 2.большей длительностью действия; 3.большим объемом распределения; 4.большим аффинитетом к молекулярной мишени в стенке микробной клетки.
7. Указать комбинированный препарат - “защищенный” аминопенициллин:
1.ко-амоксиклав; 2.ко-тримоксазол; 3.пиперациллин-тазобактам; 4.тикарциллин-клавулановая кислота.
8. Цефепим является цефалоспорином:
1.I-го поколения; 2.II-го поколения; 3.III-го поколения; 4.IV-го поколения.
9. Клавулановая кислота повышает антимикробную активность пенициллинов, потому что:
1.ингибирует бактериальную бета-лактамазу; 2.повышает эффективность связи с молекулярной мишенью (пенициллинсвязывающий белок); 3.ингибирует секрецию пенициллинов в проксимальных почечных канальцах; 4.улучшает реабсорбцию пенициллинов из почечных канальцев.
10. Бензилпенициллин высоко активен в отношении:
1.Staphylococcus aureus; 2.Streptococcus pneumoniae; 3.N. gonorrhoeae; 4.Clostridium difficile; 5.Bacteroides fragilis.
11. Какие антибиотики, из перечисленных, нарушают синтез клеточной стенки:
1.бета-лактамные антибиотики; 2.тетрациклины; 3.полимиксины; 4.хлорамфеникол.
12. Какой из перечисленных антибиотиков относится к бета-лактамным:
1.стрептомицин; 2.тетрациклин; 3.меропенем; 4.полимиксин.
13. Какой препарат бензилпенициллина относится к биосинтетическим:
1.ампициллин; 2.карбенициллин; 3.бензилпенициллин-бензатин; 4.азлоциллин.
14. Какой препарат относится к ингибиторзащищенным пенициллинам:
1.амоксиклав; 2.ванкомицин; 3.амоксициллин; 4.оксациллин.
15. Какой препарат отличатся высоко активным действием на метициллинрезистентных стафилококков:
1.оксациллин; 2.цефазолин; 3.ванкомицин; 4.эритромицин.
16. Какой макролид имеет наименьший клиренс?
1.азитромицинн; 2.кларитромицин; 3.рокситромицин; 4.эритромицин.
17. Отметить препарат, устойчивый к беталактамазе стафилоккоков:
1.бензилпенициллин; 2.амоксициллин; 3.ампициллин; 4.имипенем.
18. Какой антибиотик эффективен при псевдомембранозном колите?
1.ампициллин; 2.диклоксациклин; 3.ванкомицин; 4.фуразолидон.
19. Наиболее частым осложнением бета-лактамных антибиотиков являются:
1.аллергические реакции; 2.угнетение кроветворения; 3.аритмии; 4.снижение слуха.
20. Какой препарат группы пенициллинов обладает устойчивостью к пенициллиназе и в кислой среде желудка:
1.ампициллин; 2.карбенициллин; 3.амоксиклав; 4.бензилпенициллин.
Антибиотики – ингибиторы синтеза белка.
1. Аплазия костного мозга - редкий, но опасный для жизни побочный эффект лечения:
1.ванкомицином; 2.стрептомицином; 3.тетрациклином; 4.хлорамфениколом (левомицетином); 5.эритромицином.
2. Наибольшим периодом полувыведения характеризуется:
1.азитромицин; 2.азтреонам; 3.доксициклин; 4.рокситромицин; 5.эритромицин.
3. Детям до 8 лет противопоказаны:
1.аминогликозиды; 2.гликопептиды; 3.карбапенемы; 4.монобактамы; 5.тетрациклины.
4. Антибиотики макролиды повышают концентрацию варфарина в плазме, потому что:
1.усиливают его реабсорбцию в почечных канальцах; 2.вытесняют его из связи с белками плазмы крови; 3.повышают его биодоступность при приеме внутрь; 4.угнетают его метаболизм в печени.
5. Хлорамфеникол (левомицетин) показан для лечения тяжелых инфекций:
1.дыхательных путей; 2.мочевыводящих путей; 3.кожи и мягких тканей; 4.ЦНС.
6. Указать антибиотик из группы азалидов (макролидов):
1.азитромицин; 2.азлоциллин; 3.азтреонам; 4.амикацин; 5.амоксициллин.
7.Ототоксическое действие – типичный нежелательный побочный эффект:
1.ампициллина; 2.гентамицина; 3.тетрациклина; 4.хлорамфеникола; 5.эритромицина.
8. Антибиотик, оказывающий длительное постантибиотическое действие:
1.азтреонам; 2.азитромицин; 3.бензатин бензилпенициллин; 4.меропенем; 5.цефтриаксон.
9. Аминогликозиды угнетают синтез белка в микробных клетках, потому что:
1.нарушают процесс считывания кода мРНК; 2.угнетают процесс транспептидации; 3.ингибируют процесс транслокации; 4.ингибируют РНК-полимеразу; 5.ингибируют ДНК-полимеразу.
10. Антибиотики, сходные с макролидами по механизму действия:
1.аминогликозиды; 2.азалиды; 3.цефалоспорины; 4.карбапенемы; 5.монобактамы.
Выбрать антибиотик – ингибитор синтеза белка в бактериальной клетке:
а) ампициллин б) бензилпенициллин в) гентамицин г) карбенициллин
Препаратом 1-ого выбора доксициклин является при:
1.пневмонии; 2.спирохетозе (сифилисе); 3.холере; 4.гонорее.
Что характерно для доксициклина ?
1.плохо всасывается из ЖКТ; 2.снижается биодоступность при приеме с пищей; 3.Т1/2 16-24 часа; 4.основной путь выведения через МВП.
Для аминогликозидов характерно:
1.липофильны; 2.хорошо всасываются из ЖКТ; 3.хорошо проникают через ГЭБ; 4.бактерицидное действие.
В основе механизма действия АГ на синтез белка в микробных клетках лежит их способность угнетать:
1.процесс транспептидации; 2.РНК-полимеразу; 3.ДНК- полимеразу; 4.процесс считывания кода м-РНК.
Препаратом 1-ого выбора стрептомицин является при:
1.бактериальных менингитах; 2.внебольничных пневмониях; 3.чуме; 4.трихомонадозе.
Для хлорамфеникола побочным эффектом при лечении инфекций может быть:
1.нейротоксичность; 2.миорелаксирующий эффект; 3.гематологические осложнения; 4.нарушение вкусовых ощущений.
Для хлорамфеникола характерно:
1.преимущественное действие на Г- отрицательную флору; 2.эффективность при туберкулезе; 3.хорошо проникает через ГЭБ; 4.бактерицидное действие.
1.в связи с его высокой токсичностью; 2.является препаратом выбора при инфекциях мочевыводящих путей; 3.ограничивают применения из-за развития устойчивости и для сохранения его как противотуберкулезного средства 1-го ряда; 4.ввиду низкой антимикробной активности.
1.обладают низкой эффективностью; 2.широко распространена к ним устойчивость; 3.ввиду высокой органотоксичности; 4.ввиду низкой антимикробной активности.
Синтетические противомикробные средства.
1. Средство выбора для лечения анаэробной инфекции:
2. Налидиксовая кислота активна в отношении:
2.грамотрицательных кишечных бактерий
3. Механизм антимикробного действия фторхинолонов реализуется посредством угнетения:
1.дигидроптероатсинтетазы; 2.дигидрофолатредуктазы; 3.дигидропептидазы; 4.тимидинкиназы; 5.топоизомеразы II (ДНК-гиразы).
4. Механизм антимикробного действия сульфаниламидов заключается в ингибировании:
1.дигидроптероатсинтетазы; 2.транспептидазы; 3.ДНК-полимеразы; 4.дигидрофолатредуктазы.
5. Фторхинолоны являются средствами выбора для лечения:
1.анаэробной инфекции; 2.псевдомонадной инфекции; 3.стрептококковой инфекции; 4.микоплазменной инфекции.
6. Группа антимикробных средств с зависимым от времени клинико-фармакокинетическим типом уничтожения микробов:
1.аминогликозиды; 2.макролиды; 3.пенициллины; 4.нитроимидазолы; 5.фторхинолоны.
7. Группа антимикробных средств с зависимым от концентрации клинико-фармакокинетическим типом уничтожения микробов:
1.аминогликозиды; 2.макролиды; 3.пенициллины; 4.нитроимидазолы.
8. Основное показание для применения сульфаниламидов системного действия:
1.инфекции дыхательных путей; 2.инфекции желчевыводящих путей; 3.инфекции кожи и мягких тканей; 4.инфекции мочевыводящих путей.
9. Ко-тримоксазол является средством выбора для лечения:
1.анаэробной инфекции; 2.малярии; 3.микоплазменной инфекции; 4.нокардиоза; 5.риккетсиозов.
10. Механизм антимикробного действия триметоприма заключается в ингибировании:
1.дигидроптероатсинтетазы; 2.транспептидазы; 3.ДНК-полимеразы; 4.дигидрофолатредуктазы.
1.химиотерапия – это подавление возбудителей заболеваний в окружающей среде (предметы ухода, инструменты, выделения больных); 2.химиотерапия – это подавление возбудителей заболеваний на поверхности тела человека (кожа, слизистые оболочки); 3. химиотерапия – это подавление возбудителей заболеваний во внутренних средах макроорганизма; 4.химиотерапия – это воздействие на клетки макроорганизма.
12. К принципам химиотерапии относится следующие:
1.лечение антибактериальными препаратами следует начинать как можно раньше после начала заболевания; 2.препарат следует выбирать с учетом чувствительности возбудителя к химиотерапевтическому средству; 3.дозу химиотерапевтического средства следует назначить с учетом тяжести заболевания у больного; 4.все ответы правильны.
13. Какое из утверждений отражает верно одни из общих принципов химиотерапии инфекционного заболевания:
1.эффективность лечения часто не зависит от продолжительности антибактериальной терапии; 2.клиническое улучшение является основанием для прекращения терапии; 3. после клинического улучшения не следует прекращать лечение и продолжить по необходимости еще 48-72 часа; 4.рекомендуется в процессе лечения каждые 2-3 дня менять препарат.
14. Какой из химиотерапевтических препаратов относится к сульфаниламидам:
1.стрептомицин; 2.эритромицин; 3.менкомицин; 4.сульфадимедин.
15. Механизм действия сульфаниламидов связан с:
1.угнетением дигидрофолатредуктазы; 2.угнетением ЦОГ; 3.конкурентным антагонизмом с ПАБК и угнетением дигидроптероатсинтетазы; 4.конкурентный антагонизм с ГАМК.
16. В очаге гнойного воспаления антимикробное действие сульфаниламидов:
1.не изменяется; 2.ослабляется; 3.усиливается; 4.удлиняется.
17. При применении сульфаниламидов резорбтивного действия возможны следующие побочные эффекты:
1.гемолитическая анемия, метгемоглобинемия; 2.кристалурия; 3.агранулоцитоз; 4.все вышеперечисленное.
18. К производным нитрофурана относится:
1.фталилсульфатиазол (фталазол); 2.нитрогексолин; 3.фуразолидон; 4.налидиксовая
19. Укажите побочные эффекты, характерные для нитрофуранов:
1.диспепсические явления; 2.гепатотоксичность, нейротоксичность; 3.нарушение аппетита; 4.все вышеперечисленное.
20. Укажите производное фторхинолона:
1.нитрофурантоин (фурадонин); 2.метронидазол; 3.ципрофлоксацин; 4.нитроксолин.
21. Укажите механизм действия фторхинолонов:
1.угнетение синтеза бактериальной стенки; 2.повышение проницаемости ЦПМ; 3.угнетение ДНК-гиразы; 4.угнетение ФДЭ-азы.
22. Показания к применению фторхинолонов являются:
1.инфекция мочевыводящих путей; 2.инфекция желудочно-кишечного тракта; 3.инфекция верхних дыхательных путей; 4.все вышеперечисленное.
23. Укажите препарат относящийся к оксазолидинонам:
1.ко-тримоксазол; 2.линкомицин; 3.линезолид; 4.моксифлоксацин.
24. Механизм действия производных оксазолидинонов:
1.угнетение ДНК-гиразы; 2.угнетение ФДЭ-азы; 3.ингибирование процессов синтеза белка; 4.ингибирование дигидрофолатредуктазы.
Антибиотики – ингибиторы синтеза клеточной стенки.
1. Антибиотик, высоко активный в отношении стафилококков, вырабатывающих беталактамазу:
1.амоксициллин; 2.ампициллин; 3.бензатин бензилпенициллин; 4.оксациллин; 5.феноксиметилпенициллин.
2. Основным показанием для назначения пиперациллина является:
1.анаэробная инфекция; 2.псевдомонадная инфекция;3.стафилококковая инфекция; 4.стрептококковая инфекция.
3. Антибиотик, высоко активный в отношении метициллинрезистентных стафилококков:
1.ванкомицин; 2.имипенем; 3.пиперациллин; 4.оксациллин; 5.цефотаксим.
4. Антибиотики, характеризующиеся наибольшей терапевтической широтой:
1.аминогликозиды; 2.хлорамфениколы; 3.гликопептиды; 4.цефалоспорины.
5. Самым широким спектром антимикробного действия обладают:
1.аминогликозиды; 2.гликопептиды; 3.карбапенемы;4.монобактамы; 5.цефалоспорины.
6. Амоксициллин превосходит ампициллин при приеме внутрь потому, что он характеризуется:
1.большей биодоступностью; 2.большей длительностью действия; 3.большим объемом распределения; 4.большим аффинитетом к молекулярной мишени в стенке микробной клетки.
7. Указать комбинированный препарат - “защищенный” аминопенициллин:
1.ко-амоксиклав; 2.ко-тримоксазол; 3.пиперациллин-тазобактам; 4.тикарциллин-клавулановая кислота.
8. Цефепим является цефалоспорином:
1.I-го поколения; 2.II-го поколения; 3.III-го поколения; 4.IV-го поколения.
9. Клавулановая кислота повышает антимикробную активность пенициллинов, потому что:
1.ингибирует бактериальную бета-лактамазу; 2.повышает эффективность связи с молекулярной мишенью (пенициллинсвязывающий белок); 3.ингибирует секрецию пенициллинов в проксимальных почечных канальцах; 4.улучшает реабсорбцию пенициллинов из почечных канальцев.
10. Бензилпенициллин высоко активен в отношении:
1.Staphylococcus aureus; 2.Streptococcus pneumoniae; 3.N. gonorrhoeae; 4.Clostridium difficile; 5.Bacteroides fragilis.
11. Какие антибиотики, из перечисленных, нарушают синтез клеточной стенки:
1.бета-лактамные антибиотики; 2.тетрациклины; 3.полимиксины; 4.хлорамфеникол.
12. Какой из перечисленных антибиотиков относится к бета-лактамным:
1.стрептомицин; 2.тетрациклин; 3.меропенем; 4.полимиксин.
13. Какой препарат бензилпенициллина относится к биосинтетическим:
1.ампициллин; 2.карбенициллин; 3.бензилпенициллин-бензатин; 4.азлоциллин.
14. Какой препарат относится к ингибиторзащищенным пенициллинам:
1.амоксиклав; 2.ванкомицин; 3.амоксициллин; 4.оксациллин.
15. Какой препарат отличатся высоко активным действием на метициллинрезистентных стафилококков:
1.оксациллин; 2.цефазолин; 3.ванкомицин; 4.эритромицин.
Какой макролид имеет наименьший клиренс?
1.азитромицинн; 2.кларитромицин; 3.рокситромицин; 4.эритромицин.
17. Отметить препарат, устойчивый к беталактамазе стафилоккоков:
1.бензилпенициллин; 2.амоксициллин; 3.ампициллин; 4.имипенем.
Какой антибиотик эффективен при псевдомембранозном колите?
1.ампициллин; 2.диклоксациклин; 3.ванкомицин; 4.фуразолидон.
19. Наиболее частым осложнением бета-лактамных антибиотиков являются:
1.аллергические реакции; 2.угнетение кроветворения; 3.аритмии; 4.снижение слуха.
20. Какой препарат группы пенициллинов обладает устойчивостью к пенициллиназе и в кислой среде желудка:
1.ампициллин; 2.карбенициллин; 3.амоксиклав; 4.бензилпенициллин.
Последнее изменение этой страницы: 2016-04-23; Нарушение авторского права страницы
В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 0 С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 0 С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать β - лактамазу судят по наличию роста стандартного штамма стафилококка вокруг исследуемых культур до самого диска.
Выявление метициллинрезистентных стафилококков
На чашку Петри производят посев сплошной линией эталонной культуры, которая устойчива к метициллину и исследуемую культуру раздельно. Перпендикулярно линии посева ставят полоску фильтровальной бумаги, содержащую 25 мкг метициллина. После 18 часов инкубирования при 37 0 С определяют результат, если исследуемая культура образовала зону задержки вокруг полоски бумаги, то она чувствительна к антибиотику, если не образовала зону задержки роста, то метициллинрезистентна.
Определение концентраций антибиотиков в жидкостях и тканях организма, как показатель эффективности антибиотикотерапии
Лечебный эффект антибиотикотерапии определяется взаимоотношением ряда факторов, включающих свойства микроба-возбудителя заболевания, макроорганизма и антибиотика.
Для выбора оптимального режима лечения важно знать особенности кинетики антибиотика в организме больного (особенности всасывания, распределения и проникновения в ткани и жидкости, скорость выведения и др.). Эти показатели в сопоставлении со значениями МПК антибиотика для выделенного возбудителя дают возможность обоснования индивидуального плана лечения больного и прогнозирования его возможной эффективности.
При определении концентрации антибиотиков в организме наиболее широко применяются микробиологические методы исследования, основанные на способности антибиотика задерживать рост тест-микроба. Среди микробиологических методов определения концентраций антибиотиков в жидкостях и тканях организма наибольшее распространение получили метод диффузии в агар и метод серийных разведений в жидкой питательной среде.
Метод диффузии в агар
Метод основан на сравнении степени угнетения роста тест-микроба определенными концентрациями антибиотика в испытуемом материале с угнетением его роста известными концентрациями стандарта антибиотика. Подавление роста тест-микроба осуществляется за счет диффузии антибиотика из исследуемого материала в плотную среду. Рабочими стандартами служат специально изготовленные очищенные образцы антибиотиков, активность которых устанавливают по международным стандартным препаратам. Стандарты сохраняются в запаянных ампулах при температуре 4-10 0 С. На этикетках ампул указано содержание единиц или микрограммов в 1 мг препарата.
Методом диффузии в агар можно определить концентрацию всех антибиотиков, содержащихся в жидкостях (в крови, спинномозговой жидкости, моче, желчи, асцитической жидкости и т.д.) и в тканях организма (в легких, печени, почках, мозге, мышцах и др.).
Для определения концентрации антибиотика в сыворотке кровь после образования сгустка центрифугируют, сыворотку отсасывают и вносят в специальные лунки, изготовленные в агаровых пластинках, либо разводят нормальной сывороткой человека или соответствующим каждому антибиотику буферным раствором.
С целью определения концентрации антибиотиков в тканях органы после удаления остатков крови взвешивают и гомогенизируют путем растирания с кварцевым песком или в специальном смесителе. К гомогенату добавляют дистиллированную воду или соответствующий буфер. Полученную взвесь центрифугируют 30 минут при 2500-3000 об/мин. Концентрацию антибиотиков определяют в надосадочной жидкости.
Для получения воспроизводимых результатов необходима строгая стандартизация опытов. Скорость диффузии растворов в агар зависит от химической природы антибиотиков, состава и рН агаровой среды, буфера в котором готовят рабочие растворы стандарта, испытуемого материала, температуры и времени инкубации. Поэтому при определении концентрации антибиотиков в испытуемых субстратах подбирают оптимальные условия культивирования тест-культуры, оптимальные по составу и рН питательные среды, буферные растворы, обеспечивающие максимальную диффузию растворов антибиотика в среду и четкость очертания зон. Определение проводят по схеме, общей для всех антибиотиков, которая состоит из нескольких этапов.
1) Подготовка чашек со средами и тест-микробом.
2) Приготовление рабочих растворов стандарта антибиотика и испытуемого материала.
Для приготовления растворов стандарта антибиотика делают точную навеску на аналитических весах. Навеску растворяют в соответствующем растворителе (например, для пенициллинов - буфер №1 фосфатный 1/15 М, рН 6,8-7,0, калия фосфат однозамещенный - 3,63 г, натрия фосфат двузамещенный - 7,13 г, вода дистиллированная – до 1000 мл; для ампициллина, оксациллина - 1/15 М фосфатный буфер, рН 6,8-7,0; для эритромицина – 1 мл этанола на 10 мг навески, буфер №4 до 1 мг/мл; для канамицина - вода дистиллированная и т.д.) расчёта 1 мг или 1 мл или 1000 ЕД в 1 мл (основной раствор). Дальнейшее разведение основных растворов доводят до нужных концентраций.
Для стандарта каждого антибиотика определяют концентрацию раствора, обеспечивающую образование оптимальных зон задержки тест-культуры (контрольная концентрация). При приготовлении растворов испытуемого материала нужно стремиться создать концентрации антибиотиков в близких контрольной концентрации стандарта пределах. Приготовленные разведения стандарта антибиотика и испытуемого материала вносят в стерильные цилиндрики из нержавеющей стали или алюминия, расставленные по 6 в чашке на поверхности застывшей питательной среды. Вместо цилиндриков можно вносить испытуемые растворы в предварительно сделанные в толще агара лунки диаметром 8 мм или пропитывать ими бумажные диски. Однако при использовании дисков иногда получаются зоны неправильной величины и формы, что связано с неравномерной диффузией антибиотика из диска. Растворы стандарта и испытуемого образца вносят в цилиндрики или лунки специальной капельницей или пипеткой в объеме 0,1 мл, чередуя стандартный и испытуемый растворы. Для каждого испытания используют не менее 3-х чашек. Чашки инкубируют при 37 0 С в течение 16 часов, затем измеряют диаметры зон задержки роста тест-микроба, образуемыми растворами.
3) Расчет активности испытуемого препарата.
Концентрацию антибиотика в испытуемом субстрате определяют по стандартной кривой. Для построения стандартной кривой используют 5 концентраций стандартного препарата. Одна из концентраций, по которой вносят поправки для всех других, является контрольной. Для каждой концентрации, кроме контрольной, используют 3 чашки (всего 12 чашек). В 3 цилиндрика или лунки каждой чашки вносят раствор контрольной концентрации, в 3 другие – одну из взятых концентраций стандарта. После измерения зон задержки роста для каждой концентрации выводят среднюю величину зоны на 3 чашках, затем находят среднюю величину зоны для контрольной концентрации на всех чашках (12 х 3 = 36 зон).
По разности между средней величиной зоны контрольной концентрации, выведенной из всех чашек, и средней величиной зоны контрольной концентрации, определенной из 3 чашек с каждой отдельной концентрацией находят поправку к величине зоны данной концентрации. Поправку прибавляют к средней величине зоны данной концентрации, если она положительная, и вычитают, если отрицательная.
Пример. Средняя величина зоны контрольной концентрации 1 ЕД/мл равна 19,2 мл (выведена из 36 зон). Средняя величина зоны для той же концентрации, выведенная из 3 чашек, на которых испытывался раствор, соответствующий 0,8 ЕД/мл, равна 19 мм. Величина поправки составляет +0,2 мм. Средняя величина зоны для концентрации 0,8 ЕД/мл составляет 17,9 мм, после внесения поправки: 17,9 мм + 0,2 мм = 18,1 мм. Таким же образом исправляют значение величин зон для остальных концентраций, используемых при построении стандартной кривой.
На полулогарифмической сетке расчёта активности антибиотиков по исправленным значениям величин зон взятых концентраций и средней величине зоны контрольной концентрации строят стандартную кривую, откладывая на оси абсцисс величины зон против значений соответствующих концентраций на оси ординат. При постоянных условиях опыта стандартной кривой можно пользоваться длительно, проверяя угол наклона для каждой вновь приготовленной серии питательной среды по 2-3 концентрациям стандарта на 3-5 чашках.
При определении концентрации антибиотика в сыворотке или другом субстрате испытуемый субстрат разводят до предполагаемого уровня, близкого к контрольной концентрации. В зависимости от количества испытуемого материала применяют одну или несколько чашек на каждое разведение. Параллельно с испытуемым материалом на каждую чашку вносят контрольную концентрацию стандарта антибиотика. После инкубации при 37 0 С в течение 16-18 часов измеряют зоны задержки роста тест-микроба, образуемые контрольной концентрацией стандарта и испытуемым раствором.
Разность между найденными средними величинами зон испытуемого образца и контрольной концентрации прибавляют к величине зоны контрольной концентрации на стандартной кривой. Затем по кривой находят концентрацию, соответствующую найденной величине зоны в ЕД/мл. Умножая полученную концентрацию на степень разведения испытуемого материала, определяют содержание антибиотика в 1 мл испытуемого материала. Точность метода составляет ±10%.
При определении активности антибиотиков методом диффузии в агар ответ получают через 16-18 часов. Существуют ускоренные методы определения, с помощью которых результаты можно установить уже через 3-5 часов. Ускорение опыта достигается путем увеличения посевной дозы тест-культуры на 1 мл питательной среды, повышением температуры инкубации до 38-45 0 С или проявлением плохо видимых зон и слабо выраженных микробных газонов через 3-5 часов инкубации химическими методами. В последнем случае поверхность питательной среды обрабатывают 2% раствором красной кровяной соли и 1% раствором железо - аммиачных квасцов. Микробный газон при этом окрашивается в темно-синий цвет, на фоне которого четко вырисовываются светлые зоны подавления роста.
Метод серийных разведений
Для определения содержания антибиотика в жидкостях организма (кровь, экссудаты полостей, ликвор и др.) можно также использовать метод последовательных разведений в жидкой среде.
Питательной средой при этом служит среда Гисса с глюкозой и реактивом Андреде (рН 7,2) или фенол - сывороточная среда (2 мл
10% раствора глюкозы, 2 мл сыворотки крови человека, 6 мл дистиллированной воды и 0,25 мл насыщенного раствора фенолрота).
Среды заражают стандартизированной взвесью определенного для каждого антибиотика тест-микроба из расчета 1000-10000 микробных клеток на 1 мл среды. Зараженную среду разливают по 0,2 или 0,5 мл в стерильные пробирки. Для каждого образца готовят два ряда по 10 пробирок в каждом. Первый ряд служит для разведения раствора стандарта антибиотика (стандарт разводят до нужной концентрации сывороткой человека или здорового животного), второй – для разведения испытуемого материала (например, сыворотки). Разведения (двукратные, последовательные) испытуемого раствора и стандартного образца производят в объеме 0,2 или 0,5 мл засеянной среды. Контролями опыта служат незаражённая (контроль прозрачности и стерильности) и заражённая соответствующим тест-микробом (контроль роста микроба) среды. Результаты учитывают после 16-18 ч инкубации при 37 0 С по изменению цвета (среда Гисса становится розовой, фенол - сывороточная - из красной при рН 7,2 становится желтой за счет сбраживания растущими микроорганизмами глюкозы и изменения рН) и помутнению среды. Для того, чтобы установить концентрацию антибиотиков в исследуемой сыворотке, умножают наибольшее разведение сыворотки, задерживающее рост тест-микроба (разведение в последней пробирке с прозрачной, не изменившей цвета средой), на наименьшую концентрацию стандарта антибиотика в пробирке с отсутствием роста. Полученная величина соответствует содержанию антибиотика в 1 мл исследуемой сыворотки. Например, концентрация пенициллина в сыворотке крови определяют по следующей таблице 5.
Таблица 5. - Определение содержания пенициллина в сыворотке
| Разведение сыворотки Рост тест-микроба | 1:2 - | 1:4 - | 1:8 - | 1:16 + | 1:32 + | 1:64 + |
| Концентрация стандарта пенициллина в среде в ЕД/мл Рост тест-микроба | 0,2 - | 0,1 - | 0,05 - | 0,025 - | 0,125 + | 0,0063 + |
| Примечание: (+) – рост микроба; (-) – отсутствие микроба |
В приведённом примере раствор стандарта пенициллина задерживает рост тест-микроба в концентрации 0,025 ЕД/мл, а испытуемая сыворотка – в разведении 1:8. Содержание пенициллина в неразведённой сыворотке соответствует 0,025 x 8=0,2 ЕД/мл.
Кроме определения концентрации антибиотиков в тканях и жидкостях организма, описанные микробиологические методы используют для определения активности образцов на всех стадиях производства антибиотиков, для определения стабильности антибиотиков или препаратов, содержащих антибиотики. Химические или физико-химические методы исследования количественного содержания антибиотика в препарате применяют в том случае, если получаемые результаты совпадают с результатами микробиологической оценки активности.
Разумеется, указанные методы определения антибиотикочувствительности бактерий должны проводиться в сертифицированных, аттестованных (лучше аккредитованных) микробиологических лабораториях. Однако большинство районных больниц не имеют таковых, в связи с чем ВОЗ в порядке исключения допускает возможность использования ориентировочных методов оценки антибиотикочувствительности. Например, по мазку из исследуемого материала, окрашенного по Граму, определив наличие или преобладание грамположительных или грамотрицательных бактерий, можно ориентировать клиницистов на выбор стартовой антибиотикотерапии. Допускается также (В.В. Мельникова, 1984) определение антибиотикочувствительности совокупной микрофлоры без выделения чистых культур, что занимает 18-24 часа от момента поступления материала в лабораторию. В последующие дни при наличии условий возможно более детальное исследование чистых культур бактерий с коррекцией при необходимости начатой стартовой антибактериальной терапии.
Таким образом, определение чувствительности возбудителей инфекционного процесса к антибактериальным препаратам является основным лабораторным методом, на основе которого осуществляется выбор оптимального и эффективного препарата для лечения.
Ежегодно миллионы людей сталкиваются с инфекционными заболеваниями. Некоторые болезни проходят очень быстро и не требуют использования противомикробных препаратов, а с другими можно справиться исключительно антибиотиками бета-лактамной группы. Они отличаются низкой токсичностью и высокой клинической эффективностью.
Общая классификация бета-лактамных антибиотиков
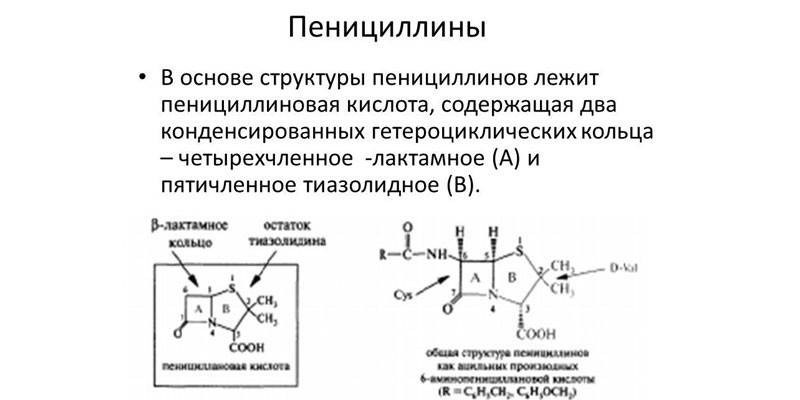
Противомикробные лекарства появились в 1928 году. Александр Флеминг в ходе опытов заметил, что стафилококки гибнут от воздействия обыкновенной плесени. В процессе многолетних исследований учеными были синтезированы антибиотики бета-лактамного ряда. Отличительной особенностью антибактериальных препаратов этого вида является наличие бета-лактамного кольца в молекулярной формуле. К антибиотикам этой группы относят:
- Пенициллины. Их получают из колоний плесневых грибов.
- Цефалоспорины. Вещества, обладающие схожей с пенициллинами структурой, но способные справиться с пенициллинустойчивыми микроорганизмами.
- Карбапенемы. Отличаются более устойчивой к бета- лактамазам структурой.
- Монобактамы. Вещества, эффективные только против грамотрицательных бактерий.
Бета-лактамы этого вида были обнаружены Александром Флемингом. Бактериолог оставил кусочек плесневелого хлеба возле колонии стафилококков, и заметил, что возле плесени болезнетворных микроорганизмов нет. В чистом виде антибиотик синтезировали только в 1938 году. Пенициллин полностью безопасен для млекопитающих, т.к. в их организме отсутствует муреин, но у некоторых людей есть врожденная непереносимость этого вещества. Антибактериальные лекарства можно разделить на природные и искусственно синтезированные.
Самыми эффективными считаются полусинтетические пенициллины, т.к. они губительны для большинства грамположительных и грамотрицательных бактерий. Они воздействуют на пенициллинсвязывающие белки микроорганизмов, которые являются основным компонентом клеточной стенки. После введения пенициллины быстро проникают в легкие, почки, слизистые оболочки кишечника и репродуктивных органов, костный мозг и кости (при синтезе кальция), плевральной и перитонеальной жидкости.
Пенициллины назначают при заражении грамположительными и грамотрицательными палочками, кокками, спирохетами, синегнойной палочкой и другими бактериями. Природные антибиотики сегодня используют при эмпирической терапии, т.е. когда диагноз точно не установлен. В иных случаях доктора назначают полусинтетические пенициллины. Показания к применению:
- инфицирование крови;
- рожистое воспаление;
- остеомиелит;
- менингококковые инфекции;
- пневмония;
- гнойный плеврит;
- дифтерия;
- тонзиллит;
- инфекционно-воспалительные заболевания ушей, ротовой полости, носа;
- актиномикозы;
- злокачественный карбункул.
При проблемах с функционированием печени, почек, сердца препараты назначают в пониженных дозировках. Максимальная детская доза составляет 300 мг/сутки. Бета-лактамные антибиотики нельзя употреблять без контроля для лечения перечисленных болезней, т.к. штаммы болезнетворных бактерий очень быстро развивают к ним устойчивость. При несоблюдении этого правила пациент рискует себе сильно навредить.
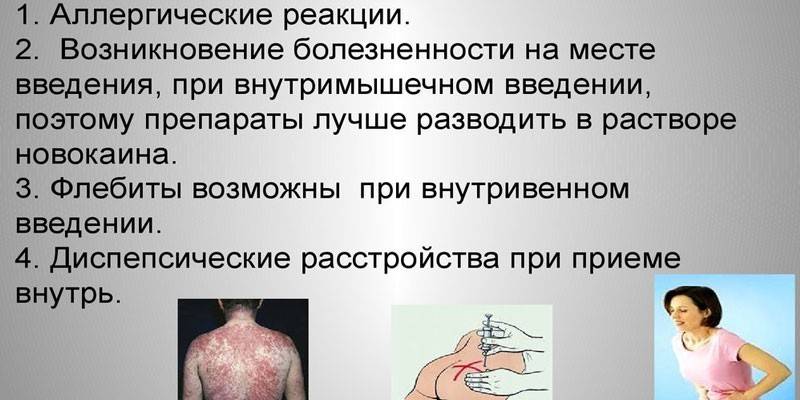
При индивидуальной непереносимости использовать пенициллины для лечения прогрессирующих инфекций нельзя. Людям, с диагностированной эпилепсией, препарат не вводят в область между надкостницей и оболочкой спинного мозга. Побочные эффекты при соблюдении дозировок проявляются очень редко. Пациенты могут столкнуться с:
- расстройством желудочно-кишечного тракта (ЖКТ): тошнотой, рвотой, поносом, жидким стулом;
- слабостью, сонливостью, повышенной раздражительностью;
- кандидозом ротовой полости или влагалища;
- дисбактериозом;
- задержкой воды в организме и отеками.
У пенициллинов есть определенные особенности, которые могут привести к появлению нежелательных эффектов. Антибиотики нельзя смешивать в одном шприце или одной инфузионной системе с аминогликозидами, т.к. эти вещества несовместимы по физико-химическим свойствам. При комбинировании ампициллинов с аллопуринолом сильно возрастает риск развития аллергической реакции.
Использование повышенных доз бета-лактамных веществ этого вида с калийсберегающими диуретиками, ингибиторами ангиотензинпревращающего фермента (АПФ), препаратами калия сильно увеличивает риск гиперкалиемии. При лечении инфекций, вызванных синегнойной палочкой, больной должен временно отказаться от антикоагулянтов, антиагрегантов, тромболитиков. Если пациент этого не сделает, он столкнется с повышенной кровоточивостью.
Практически все антибиотики снижают эффективность пероральных контрацептивов, т.к. энтерогепатическая циркуляция эстрогенов нарушается. Метотрексат под воздействием пенициллинов будет медленнее выводиться из организма, что сильно повлияет на выработку фолиевой кислоты. Бета-лактамные препараты не следует принимать с сульфаниламидами. Эта комбинация веществ снизит бактерицидный эффект пенициллинов и сильно повысит вероятность развития аллергической реакции.
Все пенициллины можно разделить на природные и полусинтетические. К первой группе относят антибиотики узкого спектра действия. Они способны справиться исключительно с грамположительными бактериями и кокками. Полусинтетические пенициллины получают в искусственных условиях из конкретных штаммов плесневых грибов. В медицине выделены следующие подгруппы и подтипы пенициллинов:
Читайте также:


