Активность синтеза белка в нервных клетках
Хорошо известно, что необходимыми метаболитами для биосинтеза белков в клетке являются аминокислоты (АК), АТР, аминоацил-тРНКсинтетазы (APC) и тРНК. Активирование AK осуществляется в два этапа: сначала на APC в присутствии ATP происходит активирование АК: AK + ATP-APC ⇔ AK-AMP-APC + PPi, где AK-AMP — аминоациладенилат (он остается в комплексе с АРС), PPi — пирофосфат; затем происходит акцептирование AK молекулой тРНК: AK-AMP + тРНК ⇔ AK- тРНК, где АК-тРНК — аминоацил-тРНК. На этом этапе AK присоединяется к 2′- или 3′-гидроксильной группе рибозы на 3′-конце молекулы тРНК. Для биосинтеза белка из активированных аминокислот необходимо участие мРНК, рибосомы и аминоацил-тРНК. Синтез белка в нейронах центральной нервной системы должен незамедлительно реагировать на любые изменения гомеостаза снижением или увеличением интенсивности синтеза белка (по единственному принципу — выживает тот, кто быстрее получит информацию, обработает ее и адекватно на нее прореагирует). В процессе эволюционного развития нейронов мозга для синтеза белка в нейронах были созданы особые условия и сняты все ограничения, используемые в биохимических реакциях метаболизма живой материи. Синтез белка в нейронах является основным преобразователем всех эндогенных и экзогенных информационных потоков, и от надежности этого процесса зависит не только судьба индивида, но существование и процветание популяции в целом. AK являются для нервной ткани источником синтеза большого числа биологически важных соединений, таких как специфические белки, пептиды, нейромедиаторы, гормоны, витамины, биологически активные амины и др. Интенсивность биохимических реакций контролируется и ограничивается количеством каждого из субстратов, принимающих участие в реакции. Для белка единственным и самым важным расходным субстратом является АК, и природа позаботилась о том, чтобы активность важного информационного преобразователя не зависела от ограничения AK при продолжительном интенсивном белковом синтезе.
• перенос AK часто происходит против высоких концентрационных градиентов;
• этот процесс энергозависим;
• на него влияют температура и pH среды;
• он ингибируется анаэробным состоянием клеток;
• перенос AK связан с активным мембранным транспортом ионов, например он Ма+-зависим;
• обнаружено конкурентное торможение мембранного транспорта одних AK другими.
Эксперименты показывают, что процесс синтеза белка идет с освобождением большого количества свободной энергии. Из анализа энергетического баланса выше представленных реакций видно, что обе реакции сами по себе не дают выигрыша свободной энергии (гидролиз в стандартных условиях) и, следовательно, эти реакции не должны протекать с большим сдвигом в сторону синтеза. Если в естественных условиях PPi гидролизуется пирофосфатазой до ортофосфата в параллельной реакции, то общий энергетический баланс составит n*60 кДж на 1 моль белка: nPPi + nН2О → 2nP * n*30 кДж/моль.
Недавние исследования по протеомному составу мозга умерших людей с БA и здоровых людей выявило 827 уникальных белков. Среди этих белков 227 были найдены у 9 из 10 пациентов с БA. Из этих 227 белков 69 отличались по уровню по сравнению со здоровым мозгом: уровень 37 белков был увеличен, а 32 — уменьшен значительно. Из этих 69 белков 46 ранее были уже упомянуты в работах по протеомному и иммуногистохимическому изучению как связанные с БA. 23 белка из 69 пока никак не упоминались в качестве связанных с БA. Среди белков с увеличенным уровнем при BA оказались белки, связанные с энергетическим метаболизмом мозга, такие как: аспартатаминотрансферазы, альдегид дегидрогеназы, 6-фосфоглюконатдегидрогеназы, транскетолазы, глутатион S-трансферазы Р, карбоангидразы 2, α-енолаза, малат-дегидрогеназа и сывороточный альбумин.
Автор текстов – Анисимова Е.С.
Продавать тексты нельзя (авторские права защищены). Курсив не зубрите.
85. 1. Регуляция биосинтеза белка у эукариот. (п.81)
Синтез белка регулируется на разных этапах:
регулируются синтез и процессинг РНК,
трансляция
и посттрансляционная модификация.
Но в первую очередь регулируется синтез про-РНК – транскрипция.
От активности транскрипции зависит концентрация РНК –
чем активнее транскрипция, тем больше РНК и тем быстрее может синтезироваться белок.
Скорость транскрипции зависит от того, может ли работать фермент транскрипции –
РНК-полимераза.
В частности, от того, может ли РНК-полимераза связаться с тем участком ДНК перед гЕном,
с которого начинается транскрипция и который называется ПРОМОТОРОМ.
Кроме РНК-полимеразы,
для транскрипции нужен еще ряд белков,
минимальный набор которых называется базальным транскрипционным комплексом (БАК).
Работа БАКа и РНК-полимеразы регулируется специальным белком, который называется КОАКТИВАТОРОМ.
Активность коактиватора регулируется рядом белков,
которые называются транскрипционными факторами (ТФ)
и связываются со специальными участками ДНК,
которые называются регуляторными участками ДНК или реактивными элементами ДНК.
Способность транскрипционных факторов регулировать транскрипцию, связываться с коактиватором и с регуляторными участками ДНК регулируется:
1) присоединением к ним и отщеплением от них фосфата (фосфорилированием и дефосфорилированием – п.6),
2) протеинкиназами и протеинфосфатазами,
3) присоединением гидрофобных гормонов к ТФ
(такие ТФ, с которыми связываются гидрофобные гормоны, являются рецепторами гидрофобных гормонов).
85. 2. Регуляция синтеза белка гормонами.
Андрогены сетчатой зоны применяют при дистрофии, переломах, инфаркте, для заживления язв.
Из-за большего количества андрогенов мышечная масса у мужчин больше, чем у женщин.
При дефиците инсулина (п.102 и 103) снижение синтеза белка приводит к риску гангрены, замедленному заживлению.
Дефицит СТГ и ИФР (п.100) приводит к карликовости.
Дефицит ФРК может стать причиной денегеративных заболеваний,
а применение ФРК может помочь вылечить их.
Гормоны, стимулирующие распад белка
М Е Х А Н И З М влияния гормонов на синтез белка. См. п.92-95.
Гидрофобные гормоны
(йодтиронины, ГКС, половые и др.) влияют на синтез белков,
связываясь со своими рецепторами внутри клетки,
которые являются транскрипционными факторами:
связываются со специальными (регуляторными) участками ДНК
и со специальным белком, который называется коактиватором.
Коактиватор связывается с белками базального транскрипционного комплекса,
который участвует в транскрипции (синтезе (про-)РНК).
Регулируя синтез РНК, коактиватор регулирует количество РНК
и возможность синтеза кодируемого этой мРНК белка.
Гидрофильные гормоны влияют на синтез РНК и белка,
связываясь с рецепторами на мембране и передавая сигнал транскрипционным факторам через вторые посредники и протеинкиназы – см. п. 93-95.
85. 2. И Н Д У К Ц И И И Р Е П Р Е С С И И
Синтез белка можно ускорить и в итоге увеличить концентрацию белка.
И, наоборот, синтез белка можно замедлить и в итоге увеличить концентрацию белка.
Ускорение синтеза белка,
ведущее к увеличению концентрации белка,
называется ИНДУКЦИЕЙ.
Замедление синтеза белка,
ведущее к снижению концентрации белка,
называется РЕПРЕССИЕЙ.
Факторы, под влиянием которых происходит индукция, называются ИНДУКТОРАМИ,
а факторы, под влиянием которых происходит репрессия, называются РЕПРЕССОРАМИ.
Индукторы и репрессоры влияют на синтез белка чаще всего
за счет изменения скорости транскрипции,
но могут изменять и скорость трансляции.
Известны разные индукторы и репрессоры,
в зависимости от типа которых различают ряд форм индукции и репрессии:
Ф о р м ы и н д у к ц и и и р е п р е с с и и
1. Субстратная индукция и катаболитная репрессия.
Если индуктором является субстрат фермента,
то индукция называется СУБСТРАТНОЙ.
Пример субстратной индукции – индуктором синтеза амилазы является ее субстрат – крахмал (п.30).
У грудных детей амилаза (п.30) не вырабатывается,
потому что амилаза им не нужна (в молоке крахмала нет, для переваривания которого нужна амилаза).
Необходимость в выработке амилазы появляется при появлении в пище крахмала,
и амилаза начинается вырабатываться под действием крахмала,
когда ребенка начинают кормить кашами, пюре.
Все знают, что накормить грудного ребёнка тарелкой каши при первом же кормлении нельзя,
что введение прикорма должно быть постепенным –
это связано с тем, что выработка амилазы увеличивается постепенно.
При длительном голодании выработка пищеварительных ферментов снижается,
поэтому после длительного голодания человеку нельзя много есть –
в начале можно есть только понемногу.
Продукты реакций (и метаболических путей) обычно снижают эти реакции –
это пример регуляции по принципу отрицательной обратной связи (п.90).
Скорость реакций снижается за счет снижения активности ферментов
(то есть за счет ингибирования ферментов)
и/или за счет снижения синтеза ферментов (то есть за счет репрессии) – п.6,7.
Репрессия (подавление) синтеза ферментов
под действием продуктов их реакций называется катаболитной репрессией.
При этом продукты реакций могут не быть катаболитами, то есть продуктами катаболизма.
Примеры катаболитной репрессии –
1) снижение синтеза ферментов, синтезирующих нуклеотиды, под действием самих нуклеотидов – п.72,
2) снижение синтеза ключевого фермента синтеза холестерина (ГМГ-КоА редуктазы) под действием холестерина (холестерин является репрессором) – п.48.
2. Гормональная индукция и репрессия
Индукторами и репрессорами бывают гормоны –
в этом случае индукция и репрессия называются ГОРМОНАЛЬНЫМИ.
Примеры гормональной индукции –
ГКС индуцируют синтез ключевых ферментов ГНГ и аминотранфераз,
что приводит к синтезу глюкозы (п.33, 37, 108),
ее поступлению в кровь и возникновению гипергликемии.
Инсулин индуцирует синтез ключевых ферментов гликолиза, что способствует выработке энергии в клетке (п.102).
Пример гормональной репрессии –
инсулин репрессирует синтез ключевых ферментов ГНГ,
что приводит к гипогликемии.
ГКС репрессируют синтез ключевых ферментов гликолиза.
Тестостерон и другие андрогены индуцируют синтез мышечных белков,
что приводит к большей мышечной массе у мужчин.
ГКС репрессируют синтез проопиомеланокортина, что приводит к снижению выработки АКТГ (ООС), эндорфинов и т.д..
3. Лекарственная индукция и репрессия.
Некоторые лекарства индуцируют или репрессируют синтез определенных белков.
Индукция и репрессия синтеза белков под действием лекарств называются ЛЕКАРСТВЕННЫМИ.
Фенобарбитал индуцирует синтез цитохрома Р 450 и ферментов коньюгации – п.118.
Поскольку ферменты коньюгации обезвреживают билирубин (свободный),
то фенобарбитал применяют для индукции синтеза ферментов коньюгации при желтухе новорожденных.
Антибиотики
репрессируют матричные синтезы у бактерий,
что приводит к прекращению размножения и гибели бактерий, то есть к антибактериальному эффекту.
При этом антибиотики не подавляют матричные синтезы человека.
Антибиотики могут подавлять (репрессировать) синтез белка у бактерий,
ингибируя ферменты синтеза белка или РНК.
4. Редокс-индукция и редокс-репрессия.
Активные формы кислорода (АФК, п.27)
индуцируют синтез белков, участвующих в иммунных, воспалительных и аллергических реакциях,
а антиоксиданты (глутатион и другие) репрессируют синтез этих белков.
Это одна из причин, почему при дефиците АФК и избытке иммунитете снижается;
но при избытке АФК и дефиците антиоксидантов иммунитет тоже снижается,
так как избыток АФК приводит к гибели лейкоцитов – п.121.
Индукция под действием АФК
репрессия под действием антиоксидантов
называются РЕДОКС-индукцией и редокс-репрессией.
5. При клеточном шоке усиливается выработка шаперонов – см. п. 83.
.
Основным условием существования любых живых организмов является наличие тонкой, гибкой, согласованно действующей системы регуляции, в которой все элементы тесно связаны друг с другом. В белковом синтезе не только количественный и качественный состав белков, но и время синтеза имеют большое значение. От этого зависит приспособление микроорганизмов к условиям окружающей питательной среды как биологической необходимости или приспособление сложного многоклеточного организма к физиологическим потребностям при изменении внутренних и внешних условий.
Клетки живых организмов обладают способностью синтезировать огромное количество разнообразных белков. Однако они никогда не синтезируют все белки. Количество и разнообразие белков, в частности ферментов, определяются степенью их участия в метаболизме. Более того, интенсивность обмена регулируется скоростью синтеза белка и параллельно контролируется аллостерическим путем (см. главу 4). Таким образом, синтез белка регулируется внешними и внутренними факторами и условиями, которые диктуют клетке синтез такого количества белка и такого набора белков, которые необходимы для выполнения физиологических функций. Все это свидетельствует о весьма сложном, тонком и целесообразном механизме регуляции синтеза белка в клетке.
Согласно теории Ф. Жакоба и Ж. Моно, в биосинтезе белка у бактерий участвуют по крайней мере 3 типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК являются основой для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано, служит матрицей для биосинтеза белка. Регуляция синтеза белка путем индукции представлена на рис. 14.12.
В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего название гена-регулятора. Структурные гены и ген-регулятор расположены в разных участках цепи ДНК, поэтому связь между ними, как предполагают Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрес-сора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе (рис. 14.13). Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Образование такого комплекса приводит к блокированию синтеза мРНК и, следовательно, синтеза белка, т.е. функция гена-регулятора состоит в том, чтобы через белок-репрессор прекращать (запрещать) деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Если такой индуктор соединяется с репрессором, то последний теряет способность связываться с геном-оператором, который, таким образом, выходит из-под контроля гена-регулятора, и начинается синтез мРНК. Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что репрессор теряет способность связываться с геном-оператором. Процесс этот аналогичен взаимоотношениям алло-стерического центра фермента с эффектором, под влиянием которого изменяется третичная структура фермента и он теряет способность связываться со своим субстратом.
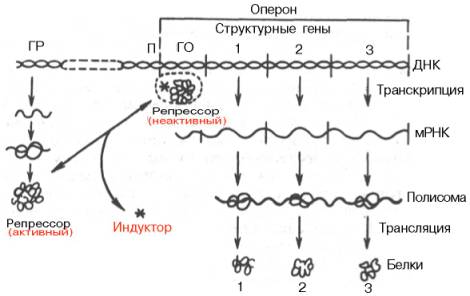
Рис. 14.12. Регуляция синтеза белка путем индукции (схема). ГР - ген-регулятор; П - промотор; ГО - ген-оператор.
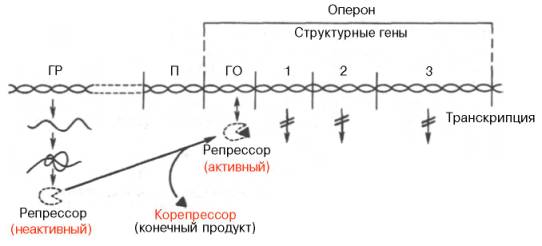
Рис. 14.13. Регуляция синтеза белка путем репрессии (схема). Обозначения те же, что на рис. 14.12.
Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояния репрессора. Этот реп-рессор представляет собой тетрамерный белок с общей мол. массой около 150000. Если он находится в активном состоянии, т.е. не связан с индуктором, то блокирует ген-оператор и синтеза мРНК не происходит. При поступлении метаболита – индуктора – в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижают его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК.
Конечный продукт выступает, таким образом, в качестве корепрес-сора. Имеются данные, что в качестве корепрессоров в синтезе ферментов обмена аминокислот, по-видимому, выступает не только свободная аминокислота как конечный продукт биосинтетической реакции, но и комплекс ее с тРНК – аминоацил-тРНК.
В регуляции экспрессии структурных генов специфическое участие принимает особый белок – катаболитный генактивирующий белок (от англ. catabolite gene activation protein, сокращенно CAP). Этот белок, взаимодействующий с цАМФ, образует комплекс, способствующий прикреплению РНК-полимеразы к промоторному участку генома. В присутствии комплекса САР-цАМФ фермент может начать транскрипцию оперона, включая структурные гены, т.е. в клетках имеется еще один, дополнительный САР-цАМФ-регулятор, действующий, скорее всего, в качестве положительного регулятора, поскольку его присутствие необходимо для начала экспрессии гена.
Таким образом, концепция Ф. Жакоба и Ж. Моно о механизме проявления (экспрессии) активности генов признана одним из блестящих достижений молекулярной биологии. Она явилась логическим развитием многочисленных исследований, проведенных генетиками и биохимиками в предшествующие десятилетия.
Регуляция экспрессии активности генов у эукариот осуществляется значительно более сложным путем, поскольку процессы транскрипции и трансляции разделены не только пространственно ядерной биомембраной, но и во времени. Эта регуляция базируется как минимум на 6 уровнях сложных биологических процессов, определяющих скорость синтеза и распада генетического продукта (рис. 14.14).
Для большинства эукариотических клеток, как и клеток прокариот, стадия инициации транскрипции является основной, главной регуляторной точкой экспрессии активности генов. Тем не менее имеются существенные различия: во-первых, место процессов транскрипции (в ядре) и трансляции (в цитоплазме); во-вторых, активирование транскрипции у эукари-от связано с множеством сложных изменений структуры хроматина в транскрибируемой области; в-третьих, в эукариотических клетках превалируют положительные регуляторные механизмы над отрицательными.
Положительная или отрицательная регуляция определяется типом белков, вовлеченных в механизм регуляции. Получены доказательства существования минимум 3 типов белков, участвующих в регуляции процесса инициации транскрипции, опосредованного через РНК-полимеразу: специфические факторы, репрессоры и активаторы. Первые вызывают изменение специфичности РНК-полимеразы к данному промотору или группе промоторов; репрессоры связываются с промотором, блокируя тем самым доступ РНК-полимеразы к промотору; активаторы, напротив, связываются вблизи промоторного участка, повышая связывание промотора и РНК-полимеразы.
В многоклеточных организмах среднее число регуляторных сайтов для одного гена минимум равно пяти; положительные регуляторные белки связываются со своими специфическими последовательностями в структуре ДНК (вероятнее всего, посредством водородных связей между амидной группой Глн или Асн и пуриновыми и пиримидиновыми основаниями нуклеотидов). Следует указать еще на один момент, почему эукариоти-ческая клетка использует положительные механизмы регуляции экспрессии генов. Подсчитано, что в геноме человека содержится около 100000 генов, соответственно каждая клетка при отрицательном механизме регуляции могла бы синтезировать 100000 разных репрессоров, причем в достаточных количествах. При положительном механизме регуляции большинство генов в принципе неактивно, соответственно молекула РНК-полимеразы не связывается с промотором и клетка синтезирует ограниченный и избирательный круг активаторных белков, необходимых для инициации транскрипции.
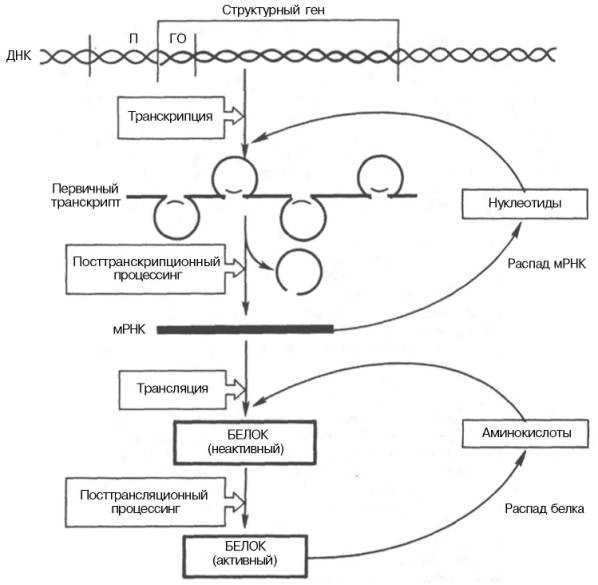
Рис. 14.14. Схематическое изображение регуляции экспрессии активности гена у эукариот.
У эукариот выделены и охарактеризованы также пять регуляторных белков, получивших название транскрипционных факторов (TF: IIА, IIВ, IID, IIЕ и IIF). Они необходимы для узнавания участка (сайта) ДНК, названного TATA (concensus последовательности, ТАТАААА). Детальный молекулярный механизм действия факторов транскрипции пока не раскрыт.
Более подробно в структурном и функциональном отношении у эука-риот изучена группа белков, получивших название белков – активаторов транскрипции. Эти белки имеют специфические структурные домены для связывания с другими, но определенными регуляторными нуклеотидными последовательностями в молекуле ДНК. В частности, они содержат домен, специфически связывающийся с ДНК, и один или несколько доменов, необходимых для активирования или взаимодействия с другими регуляторными белками. Среди этих белков – активаторов транскрипции имеются белки, содержащие богатые глутамином домены (до 25%) и богатые пролином домены. Следует отметить, однако, что некоторые из них или почти все регуляторные белки активируют транскрипцию не прямо, а опосредованно – через промежуточные белки, названные коактиваторами. Происхождение и механизм действия последних также не выяснены.
Современные знания о механизмах регуляции экспрессии генов на посттранскрипционном и посттрансляционном уровнях (см. рис. 14.4) были подробно рассмотрены ранее (см. главы 13 и 14).
Рассмотрим кратко вопрос о регуляции процессов дифференцировки клеток высших организмов. ДНК, присутствующая во всех соматических клетках, вероятнее всего, имеет одинаковую первичную структуру у данного организма и соответственно располагает информацией для синтеза любых или всех белков тела. Тем не менее клетки печени, например, синтезируют сывороточные белки, а клетки молочной железы – белки молока. Нет сомнения в том, что в дифференцированных клетках имеется весьма тонкий механизм контроля деятельности ДНК в разных тканях, обеспечивающий синтез многообразия белков.
Механизмы, лежащие в основе этой регуляции, пока неизвестны. Для их объяснения существует ряд гипотез. Предполагают, что контроль осуществляется на уровне транскрипции по аналогии с индукцией ферментов у бактерий и что в этом случае в клетках животных должны функционировать аналогичные репрессоры. С молекулой ДНК у эукариот связаны гистоны, поэтому считается, что именно эти белки выполняют роль репрессоров. Прямых доказательств их роли в качестве репрессоров не получено, хотя, как было показано, в клетках эукариот открыт класс регуляторных белков процесса транскрипции. Высказано предположение, что в ядре синтезируется высокомолекулярная молекула мРНК, содержащая информацию для синтеза широкого разнообразия белков, но в цитоплазму попадает только небольшая часть зрелой мРНК, а основная часть ее распадается. Неясны, однако, биологический смысл и назначение этого механизма избирательного распада и соответственно траты огромной массы молекулы мРНК.
Существует еще одно предположение, что на ДНК клетки синтезируются все мыслимые, возможные мРНК, которые поступают в цитоплазму, и процесс трансляции регулируется путем специфического и избирательного взаимодействия рибосом с определенными молекулами мРНК.
Синтез белка отличается от других матричных биосинтезов тем, что между матрицей и продуктом нет комплементарного соответствия. Поскольку матрица построена из 4 нуклеотидов, а продукт, полипептидная цепь, — из 20 аминокислот, существует определенный закон шифрования аминокислот в нуклеотидной последовательности матрицы, т.е. биологический код.
Биологический код
Биологический код — это способ записи информации об аминокислотной последовательности белков с помощью последовательности нуклеотидов в ДНК или РНК. Он характеризуется следующими свойствами: триплетностью, специфичностью, универсальностью, наличием терминирующих кодонов, вырожденностью .
Основными компонентами белоксинтезирующей системы являются мРНК, аминокислоты, тРНК, аминоацил-тРНК-синтетазы, рибосомы, факторы инициации, элонгации и терминации, источники энергии и кофакторы.
Синтез аминоацил-тРНК (аа-тРНК) катализируют аминоацил-тРНК-синтетазы, обладающие абсолютной специфичностью к аминокислоте и относительной — к тРНК. В связи с вырожденностью кода тРНК больше, чем аминокислот, и существуют изоакцепторные тРНК, отличающиеся по строению антикодона, но связывающиеся с одной и той же аминокислотой. Название каждой из 20 аминоацил-тРНК-синтетаз отражает название аминокислоты, которая активируется в ходе этой реакции. Так, реакцию активации глутамата катализирует глутамил-тРНК-синтетаза, которая при соединяет a-СООН- группу аминокислоты к 3′-ОН-концу тРНК за счет энергии АТР.
| Необходимые компоненты | Функции |
| Аминокислоты | Субстраты для синтеза белков |
| тРНК | тРНК выполняют функцию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном — с кодоном мРНК |
| Аминоацил-тРНК- синтетазы | Каждая аминоацил-тРНК-синтетаза катализирует реакцию специфического связывания одной из 20 аминокислот с соответствующей тРНК |
| мРНК | Матрица содержит линейную последовательность кодонов, определяющих первичную структуру белков |
| Рибосомы | Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков |
| АТР, GTP | Источники энергии |
| Белковые факторы инициации, элонгации, терминации | Специфические внерибосомные белки, необходимые для процесса трансляции: факторы инициации, элонгации, терминации |
| Ионы магния | Кофактор, стабилизирующий структуру рибосом |
Инициация
События на рибосоме включают этапы инициации, элонгации и терминации. Инициация начинается с присоединения к малой субъединице рибосомы факторов инициации, комплекса Мет-тРНК Мет с GTP и мРНК в области кэпа и инициирующего кодона AUG. После связывания антикодона Мет-тРНК Мет с кодоном AUG происходит присоединение 608-субъединицы рибосомы, сопровождающееся гидролизом GTP и отделением факторов инициации. Формируется 808-рибосома, у которой Мет-тРНК Мет находится в Р (пептидильном)-центре, а А (аминоацильный)-центр свободен (рис.2 ).

Рис.2. Инициация белкового синтеза.
Элонгация
Этап элонгации включает три последовательные стадии (рис.3).
Связывание аа-тРНК в А-центре. В рибосому, у которой в Р-центре находится Meт-тPHK Мет , в А-центр присоединяется первая аа-тРНК. Выбор аа-тРНК определяется строением кодона мРНК, поскольку между кодоном мРНК и антикодоном тРНК возникает комплементарное взаимодействие. Связывание аа-тРНК с мРНК происходит с использованием энергии GTP и при участии фактора элонгации EF1.


Рис.3. Элонгация полипептидной цепи
1 — включение аа-тРНК в А-центр,
2 — образование пептидной связи. Стадию катализирует обладающая пептидилтрансферазной активностью рРНК,
3 — стадия транслокации Стадии элонгации 1—3 повторяются.
Транслокация

Терминация
Подавление матричных биосинтезов может быть достигнуто либо путем структурной модификации матрицы и рибосомх, либо путем инактивации ферментов. Прекращение синтеза ДНК, РНК или белка вызывает гибель всех клеток, поэтому многие ингибиторы матричных биосинтезов являются ядами для организма человека.
a-Аманитин — токсин, который содержится в теле белой поганки Amanita phalloides и ингибирует эукариотические РНК-полимеразы, в особенности РНК-полимеразу II. Энтеротоксин возбудителя дифтерии является специфическим ингибитором трансляции у эукариотов, блокрируя один из факторов элонгации.
Антибиотики, подавляющие процесс транскрипции и трансляции и специфичные в отношении белоксинтезирующей системы прокариотов, могут использоваться как антибактериальные препараты, а антибиотики, нарушающие матричную функцию ДНК, нашли применение при лечении злокачественных новообразований и являются противоопухолевыми препаратами (например, доксорубицин, дауномицин).
В последние годы проводятся исследования по созданию препаратов, обеспечивающих доставку ингибитора только в опухолевые клетки. Это достигается связыванием цитотоксических антибиотиков с белками, рецепторы к которым имеются главным образом на опухолевых клетках.
Некоторые антибиотики — рифампицин, эритромицин, тетрациклин и др. — селективно ингибируют синтез РНК или белка в бактериальных клетках, практически не влияя на белковый синтез в клетках млекопитающих. Высокая избирательность этой группы соединений объясняется различиями в структуре РНК-полимераз и рибосом эукариотических и прокариотических клеток. Например, эритромицин ингибирует транслокацию, тетрациклин — связывание аа-тРНК в А- центре.
Многие вирусы, например вирусы оспы, гриппа и полиомиелита, попадая в организм человека, выключают синтез ДНК, РНК и белков в клетках организма хозяина и переключают РНК и белок-синтезирующий аппарат на репродукцию вирусных нуклеиновых кислот и белков.
Защиту организма от вирусных инфекций обеспечивают интерфероны. Семейство этих белков синтезируется в клетках эукариотов в ответ на заражение вирусом. Они через торможение фактора инициации eIF2 прекращает работу белоксинтезирующего аппарата. Интерфероны повышают активность рибонуклеазы, расщепляющей матричные и рибосомные РНК клетки, что также снижает синтез белка в инфицированных клетках.
Адаптация
Адаптация организмов к различным воздействиям окружающей среды осуществляется, в частности, путем изменения экспрессии (активности) генов. Этот процесс, в деталях изученный на бактериях и вирусах, включает взаимодействие специфических белков с участками ДНК в непосредственной близости от стартового участка транскрипции. Эукариотические клетки используют этот же принцип, хотя в регуляции экспрессии генов реализуются и некоторые другие механизмы.
У прокариотов определенные белки связываются с регуляторными участками оперона и предотвращают или усиливают связывание РНК-полимеразы с промотором.
Механизм индукции
Если оперон регулируется по механизму индукции (например, лактозный оперон), то в отсутствие индуктора (лактозы) белок-репрессор связан с оператором. Поскольку участки оператора и промотора перекрываются, то присоединение репрессора к оператору препятствует связыванию РНК-полимеразы с промотором и транскрипция структурных генов оперона не идет. Когда индуктор появляется в среде, он присоединяется к белку- репрессору, изменяет его конформацию и снижает сродство к оператору. РНК-полимераза связывается с промотором и транскрибирует структурные гены .
Механизм репрессии
При регуляции оперона по механизму репрессии (например, гистидиновый или триптофановый опероны) белок-репрессор не имеет сродства к оператору. Когда к белку-репрессору присоединится небольшая молекула — корепрессор (гистидин или триптофан), то в результате происходящих в белковой молекуле конформационных изменений комплекс белок-репрессор—корепрессор приобретает сродство к оператору и прекращает транскрипцию.
В клетках млекопитающих существуют два вида регуляции биосинтеза белков:
• кратковременная, обеспечивающая адаптацию организма к возможным изменениям окружающей среды;
• длительная, стабильная, определяющая дифференцировку клеток и разный белковый состав органов и тканей.
В хроматине разных органов и тканей наряду с огромными транскрипционно неактивными или стабильно репрессированными участками имеются активные или потенциально активные участки. За малым исключением (лимфоциты), каждая клетка организма содержит один и тот же набор генов. Существование специализированных органов и тканей зависит от дифференциальной экспрессии генов, это означает, что в дифференцировании клетках разных тканей транскрибируются разные участки хроматина.

Рис.4 Адаптивная регуляция транскрипции.
Адаптивная регуляция у высших организмов отличается от регуляции транскрипции у прокариотов многообразием сигналов, которые контролируют 1. начало процесса на молекуле ДНК, 2. частоту, с которой он происходит.
ТАТА-участок промотора присоединяет ТАТА-связывающий белок (ТАТА-фактор), факторы транскрипции А и В, которые обеспечивают взаимодействие с РНК-полимеразой и определяют стартовую точку транскрипции (рис 4).
Минимальный синтез мРНК становится возможным после связывания РНК-полимеразы с транскрипционными факторами F, Е, Н.
Если, кроме указанных компонентов, с ТАТА-связывающим белком образуют комплекс белки, присоединенные к регуляторным участкам ДНК, то скорость транскрипции меняется. Она возрастет, если это будут белки-активаторы, обеспечивающие взаимодействие с энхансерами (усилителями), и снижается, если к ТАТА-связывающему белку присоединится белок, взаимодействующий с участком сайленсера (тушителя транскрипции).
Регуляторные зоны ДНК — энхансеры и сайленсеры — различны по числу и расположению на молекуле ДНК для разных генов в разных тканях, т.е. являются тканеспецифическими характеристиками. Они могут располагаться за тысячи нуклеотидных пар от стартовой точки транскрипции перед, после или внутри гена, связывать комплексы белков с метаболитами или гормонами и влиять на конформацию гена.
Естественный отбор и биологическая эволюция невозможны без генетической изменчивости, которая возникает за счет мутаций и рекомбинаций в процессе мейоза. В последнем случае происходит обмен участками ДНК между гомологичными хромосомами родителей.
Мутации
Мутации — это нерепарированные изменения первичной структуры ДНК, появляющиеся в молекуле в ответ на дефекты в paботе ДНК-полимераз или ДНК-репарирующей системы, воздействия внешней и внутренней среды. 2. Точечные мутации в основном бывают трех видов:
• замены (это наиболее распространенный тип повреждений молекулы ДНК; (Различают 2 типа замены оснований: транзиции и трансверсии. Под транзициями понимают замену пуриновых оснований на пуриновые и пиримидиновых на пиримидиновые (Т—С и A—G). Трансверсиями называют замену пуриновых оснований на пиримидиновые и наоборот. Другой причиной замены оснований является ошибочное включение в цепь ДНК химически измененное основание (или модифицированное основание). Следует отметить, что генные мутации по типу замены оснований происходят либо до репликации, либо в процессе репликации. Если эти изменения не исправляются в процессе репарации, то они становятся достоянием сначала одной, а затем и двух цепей ДНК. Следовательно, источником возникновения этой категории мутаций являются ошибки в процессах репликации или репарации).
• делеции (или выпадения) нуклеотидов
Каждый тип мутации вызывает разные последствия. Так, замена нуклеотида:
• может сопровождаться включением в белок одной измененной аминокислоты (миссенс-мутация). Такого типа мутации возникают при действии алкилирующих агентов.( Алкильная группа присоединяется к N7 пуринового кольца гуанина, изменяя его ионизацию и характер связывания с другим нуклеотидом в комплементарной паре. В результате против алкилированного гуанина встает тимин, а следовательно, в последующем поколении параG—C заменяется А-Т).
Делеции и вставки
Делеции и вставки также приводят к неоднозначным результатам:
• если включается или выпадает один нуклеотид или участок ДНК, в котором число нуклеотидов не кратно 3, то происходит сдвиг рамки считывания информации и при трансляции вся информация, расположенная за местом мутации, читается неверно. Возникает белок, у которого за местом мутации расположена случайная последовательность аминокислот. Такого типа мутации вызывают вещества, ин-теркалирующие между азотистыми основаниями молекулы ДНК;
• если выпадает или включается в ДНК участок с длиной цепи, кратной 3, то сдвига рамки считывания информации не происходит (деления или вставка без сдвига рамки считывания информации). Белок, который зашифрован такой матрицей, будет либо укорочен (при делении), либо удлинен (при вставке) на одну или несколько аминокислот.
3. В большинстве случаев мутации влияют на экспрессию или структуру генов, что проявляется в снижении количества или изменении структуры белкового продукта, а следовательно, и его функциональной активности. Иногда снижение или полное отсутствие белка является результатом мутаций в регуляторных участках генов.
Следовательно, при генных мутациях схема такова: в результате генной мутации (молекулярный дефект) возникает патологический первичный эффект, это приводит к каскаду биохимических нарушений в клетках, органе и организме. Такая последовательность событий лежит в основе генных болезней. Отмечено 4 варианта патологических первичных эффектов.
Первый вариант связан с выработкой избыточного количества продукта вследствие усиления генной активности.
Второй вариант связан с выработкой аномальных белков. Это приводит к нарушению в той системе, работу которой обеспечивает данных белок.
Например, (вследствие замены одной аминокислоты) при серповидно-клеточной анемии синтезируется аномальный гемоглобин, который обладает пониженной растворимостью, способностью к полимеризации. В результате при недостатке кислорода такой гемоглобин быстро кристаллизуется, эритроциты приобретают форму серпа, быстро склеиваются, что приводит к закупорке капилляров.
Третий вариант связан с отсутствием первичных продуктов. Это наиболее распространенный вариант. В результате отсутствия того или иного белка (чаще всего фермента) биохимические реакции с его участием не проходят. Это приводит к накоплению продуктов-предшественников, чаще всего токсичных. Например, при фенилкетонурии не происходит превращение фенилаланина в тирозин из-за отсутствия соответствующего фермента. В результате нарушается синтез миелиновой оболочки в аксонах ЦНС, на уровне организма развивается тяжелая форма умственной недостаточности. Другим примером отсутствия белков является дефицит ферментов системы репарации или репликации. Это приводит к развитию злокачественных новообразований.
Четвертый вариант — это выработка уменьшенного количества продукта, например, белков. Это приводит к их недостатку в организме и к отклонениям в обмене веществ.
Классификация генных болезней
В основу классификации генных болезней положены 3 принципа: генетический, клинический и патогенетический.
Патогенетическая классификация зависит от поражения основного патогенетического звена.
В связи с функциональной значимостью первичных продуктов генные болезни делятся на:
1.наследственные нарушения ферментных систем или энзимопатии;
2.дефекты белков крови или гемоглобинопатии;
3.дефекты структурных белков или коллагеновые болезни;
4.генные болезни с невыясненным первичным биохимическим дефектом.
В последнее время стали рассматривать 5 категорию, к которой относятся болезни накопления (недостаток лизосомальных ферментов), а также митохондриальные и пероксисомные болезни, определяющие патологию функции и обмена клеточных органелл.
Основные способы диагностики генных болезней — биохимический и молекулярно- генетический. Лечение наследственных заболеваний: диетотерапия (например, при галактоземии назначают диету, не содержащую галактозу. Индивид выживает, но причина болезни не устраняется), введение недостающего фактора (ферменты — при недостатке, глобулин Rh, который предупреждает образование антител Rh при гемолитической болезни новорожденных).. Все эти виды лечения относятся к симптоматическим или патогенетическим, не устраняют причину болезни, индивиды, вступая в детородный возраст, передают неблагоприятные гены своим потомкам.
Читайте также:


