Черная субстанция при болезни паркинсона
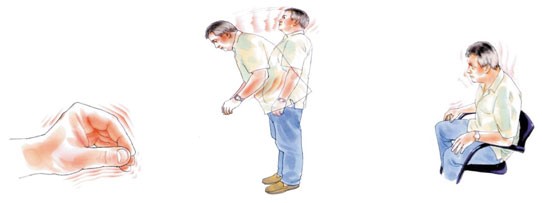
При болезни Паркинсона поражаются нейроны головного мозга
Болезнь Паркинсона является самым распространенным в мире заболеванием, протекающим с двигательными нарушениями.
Болезнь Паркинсона встречается среди представителей всех рас, мужчины несколько более предрасположены к развитию заболевания, чем женщины.
Болезнь Паркинсона считается заболеванием людей пожилого возраста. Средний возраст начала заболевания составляет 60–65 лет. (Хотя при раннем развитии болезни Паркинсона первые симптомы могут появиться в возрасте от 21 до 40 лет. Среди всех пациентов с болезнью Паркинсона раннее развитие заболевания наблюдается в 5–10% случаев).
Чёрная субстанция имеет сложную структуру и обильное кровоснабжение, что говорит о высокой роли её компонентов в системе координации жизнедеятельности.
Благодаря чёрной субстанции осуществляются функции: движения глаз, она регулирует и координирует мелкие и точные движения, в частности, пальцев; координирует процессы жевания и глотания. Имеются данные о роли чёрной субстанции в регуляции многих вегетативных функций: дыхания, сердечной деятельности, тонуса кровеносных сосудов.
Чёрная субстанция имеет решающее значение в развитии многих заболеваний, включая болезнь Паркинсона. Повреждение чёрной субстанции человека, приводит к произвольным движениям головы и рук, когда больной сидит спокойно (болезнь Паркинсона). Нередко, возникает т. н. экстрапирамидный синдром в виде:
- мышечной гипертонии, при этом некоторые гиперкинезы (хореические) связаны с мышечной гипотонией;
- гипокинезии (Олигокинезии), то есть уменьшением двигательной инициативы и затруднениями при переходе из состояния покоя в состояние движения и наоборот;
- брадикинезии, замедлением движений и уменьшением их амплитуды;
- преобладания сгибательной позы (согнутая спина, наклонённая к груди голова, согнутые в локтях и лучезапястных руки и в коленях - ноги);
- гипомимии, снижение или отсутствие мимики;
- монотонной, тихой и глухой речи;
- отсутствия содружественных движений;
- гиперкинезами (Тремор, торсионный спазм, атетоз, хорея, миоклонии, локализованный спазм).
Возможности инструментальной диагностики болезни Паркинсона остаются крайне ограниченными. Сравнительно недавно было показано, что с помощью транскраниальной сонографии возможна визуализация структур головного мозга и выявление определенных изменений, характерных для различных экстрапирамидных заболеваний.
Основными преимуществами транскраниальной сонографии по сравнению с другими методами исследования являются относительно не высокая стоимость исследования, неинвазивность, короткое время проведения исследования и возможность многократного обследования без риска для здоровья пациента.
Единственным ограничением применения транскраниальной сонографии является отсутствие височного окна, что имеет место приблизительно в 10% случаев, главным образом, у женщин пожилого возраста.
Значение слова Гипер. по Ефремовой:
Гипер. - Начальная часть сложных слов, вносящая значение: превышающий какую-л. норму (гиперзаряд, гиперзвуковой, гиперпространство, гиперреализм, гиперсекреция, гипертония, гипертрофия и т.п.).
Эхогенность, эхоплотность – ультразвуковая яркость
Характеристики эхогенность и эхоструктура являются основными в ультразвуковой диагностике, они используются совместно для описания любых визуальных объектов.
"Мой супруг — офицер, человек очень уравновешенный. Он всю жизнь работал, ни на что не жаловался, я никогда не слышала от него про усталость. Но приблизительно шесть лет назад он стал слишком тихим, мало разговаривал — просто сидел и смотрел в одну точку. Мне даже в голову не пришло, что он болен. Наоборот, ругала, что раньше времени постарел. Примерно тогда же к нам приехала двоюродная сестра из Англии — она работает в больнице — и сразу сказала, что у Рафика все очень плохо, нужно завтра же вести его к врачу. Так мы узнали о болезни Паркинсона", — вспоминает Седа из Еревана.
Что такое болезнь Паркинсона
Паркинсон — одна из самых страшных фамилий, что можно услышать в кабинете у невролога. Ее носил английский врач, который в 1817 году подробно описал шесть случаев загадочной болезни. День рождения Джеймса Паркинсона, 11 апреля, и выбран памятной датой Всемирной организацией здравоохранения. Из-за основных симптомов Паркинсон называл недуг дрожательным параличом: движения больных замедляются, становятся скованными, мышцы сильно напрягаются, а руки, ноги, подбородок или все тело бесконтрольно трясутся. Впрочем, в четверти случаев дрожания — самого известного признака болезни — нет.
Все это напоминает обыкновенную старость. Двигательные симптомы — собирательно их называют паркинсонизмом — встречаются у многих здоровых стариков. Но болезнь Паркинсона этим не исчерпывается. На поздних стадиях человек легко теряет равновесие, то и дело застывает на месте во время ходьбы, ему трудно говорить, глотать, спать, появляются тревога, депрессия и апатия, мучают запоры, падает кровяное давление, слабеет память, а под конец часто развивается слабоумие. Самое печальное — вылечить болезнь Паркинсона пока невозможно.
В начале XX века российский невропатолог Константин Третьяков выяснил, что при болезни Паркинсона гибнут клетки черной субстанции, области мозга, которая частично отвечает за движения, мотивацию, обучение. Что вызывает смерть нейронов, неизвестно. Возможно, дело в сбоях внутри клеток, но еще замечено, что внутри них скапливается вредный белок. Оба процесса наверняка как-то связаны, но ученые не знают, как именно.
В 2013 году физиолог Сьюзан Гринфилд из Оксфордского университета представила новую модель развития нейродегенеративных заболеваний, в том числе болезней Паркинсона и Альцгеймера. Гринфилд предположила, что при повреждении мозга, например, от сильного удара выделяется особое вещество. У маленьких детей из-за него растут новые клетки, а на взрослых оно, судя всему, действует противоположным образом, дальше повреждая клетки. После этого следует еще больший выброс вещества, и цепная реакция постепенно разрушает мозг. По злой иронии взрослые впадают в младенчество из-за фермента, необходимого младенцам.

Впрочем, догадка Гринфилд объясняет не все. Болезнь Паркинсона связана с наследственностью: близкий родственник с таким же диагнозом или тремором другой природы — главный фактор риска. На втором месте — запоры: иногда их вызывают изменения в мозге, когда еще не появились двигательные симптомы. Также риск растет, если человек никогда не курил, живет за городом, пьет колодезную воду, но при этом сталкивался с пестицидами, а снижается — у любителей кофе, алкоголя и гипертоников. В чем тут секрет, непонятно, как непонятно, почему болезнь Паркинсона обычно начинается в старости: если на пятом десятке лет болеет примерно один из 2500 человек, то на девятом — уже один из 53.
Новую зацепку дала свежая работа ученых из Университета Томаса Джефферсона: возможно, болезнь Паркинсона связана с иммунной системой. Исследователи взяли мышей с мутантным геном, который часто встречается у больных, и ввели им безвредные остатки бактерий. Из-за этого у зверьков началось воспаление, затронувшее и мозг, причем иммунных клеток было в 3–5 раз больше, чем у обычных мышей. Из-за этого в мозге мутантов начались процессы, губительные для нейронов черной субстанции. Как и в модели Гринфилд, процессы эти оказались циклическими: воспаление в мозге может остаться даже после того, как тело справилось с инфекцией. Впрочем, сами авторы исследования признаются, что в этом механизме еще многое не ясно.
Каково живется больным и их близким
В России болезнь Паркинсона есть примерно у 210–220 тыс. человек. Но эти данные рассчитаны по косвенным показателям, а единого реестра не существует. Анастасия Обухова, кандидат медицинских наук с кафедры нервных болезней Сеченовского университета и специалист по болезни Паркинсона, считает эту статистику заниженной. "Многие больные впервые приходят уже на развернутых стадиях болезни. При расспросе удается выяснить, что признаки появились еще несколько лет назад. У большинства наших людей действует принцип "Пока гром не грянет, мужик не перекрестится": они читают в интернете, спрашивают соседок, а к врачу не обращаются. Это в Москве, а в маленьких городках и поселках к врачу идут только если совсем помирают", — объясняет Обухова.
Вдобавок попасть на прием не так-то просто. Для этого сначала нужно сходить к терапевту, чтобы тот направил к неврологу. Но и тогда нет гарантии, что человеку поставят правильный диагноз и назначат нужное лечение. "Врач в поликлинике не может разбираться во всем, поэтому должен послать больного к узкому специалисту. А окружных паркинсонологов, по-моему, убрали. Во всяком случае, пациенты на это жаловались", — рассказывает Обухова. Правда, если больной все-таки попал к нужному доктору, лечить его будут на мировом уровне. Оттого в Россию с болезнью Паркинсона прилетают даже из других стран.
Одиссею по кабинетам приходится часто повторять, потому что болезнь прогрессирует — терапию нужно подстраивать. Лечение обходится дорого: месячный запас некоторых лекарств стоит по 3–5 тыс. рублей, а на поздних стадиях назначают сразу несколько препаратов. "В районных поликлиниках лекарства иногда дают бесплатно, но только дешевые дженерики. Комментировать их качество не буду. Иногда нужных лекарств нет. Тогда их заменяют чем-то другим. Пациентам от этого плохо", — объясняет Обухова.
Дофамин. Нервные клетки, которые передают импульсы с помощью дофамина, сосредоточены преимущественно в трёх областях: в гипоталамусе, в чёрной субстанции и в вентральной покрышке. Нейромедиатором он работает только тут.
Итак, гипоталамус. Те нервные клетки, которые пользуются дофамином, чтобы общаться между собой, в этой области довольно замкнуты друг на друга: далеко свои аксоны не тянут, предпочитают свой тесный внутренний круг. Но при этом рулят довольно важными системными функциями: могут отдать команду на выработку ряда гормонов или тормознуть её, могут также, к примеру, понизить мотивацию на предмет чего-нибудь пожрать, могут усилить агрессивность или повысить либидо. Раз — и вектор человеческого поведения заметно поменялся.
Ну с гипоталамусом учёным ещё долго разбираться, там уж очень тесно и сложно намешано нервного и гормонального, а вот в чёрном веществе и в вентральной покрышке дофаминовые нервные клетки изучены подробнее. Не в последнюю очередь из-за паркинсонизма, шизофрении и наркотиков.
Если дофамина в чёрном веществе дофига, и чёрная субстанция активна, то такие люди — как правило, живчики. То есть, с удовольствием двигаются, танцуют, занимаются спортом и вообще получают кайф от движения. Те, кто победнее дофамином в своей чёрной субстанции — внешне кажутся более ленивыми, зато умеют получать удовольствие от чего-то иного: еды, например, новизны как таковой, созерцания.
Отростки нервных клеток из этой чёрной субстанции не только между собой соединены: в отличие от тех, что в гипоталамуса, у них более длинные лапки. И много таких отростков идут вверх, к большим полушариям головного мозга. И в частности — к скоплениям нервных клеток, которые названы базальными ганглиями. 80% этих ганглиев отвечают за движения.
На оставшиеся 20% идут отростки от другого образования —вентральной покрышки - на них-то как раз во многом завязана система, которая отвечает за формирование потребностей и мотиваций, которая тесно связана с эмоциями.
Соответственно, и нарушение работы в этой связке тоже не проходит для человека бесследно. Если в силу ряда (в том числе генетических) причин покрышка работает слабо — человек недополучает положительные эмоции от новизны. И в ряде случаев это оказывается стержнем будущей депрессии. Если дофамина в покрышке слишком много — получите скачку идей и неспособность долго сосредоточиться на одной мысли, как при выраженной мании. В отдельных же случаях система срабатывает вхолостую: вроде бы и нет входящего стимула, а отклик в покрышке почему-то возник.
Среди тех базальных ганглиев, к которым идут отростки от покрышки, есть такое образование — прилежащее ядро, или nucleus accumbens - центр, генерирующий положительные эмоции.
Именно на связь покрышки с прилежащим ядром и действуют наркотики амфетамин и кокаин, разгоняя, усиливая действие дофамина в ней. Именно это действие и даёт тот фейерверк положительных эмоций, тот прилив бодрости и сил, а также ощущение предельной собранности и кристальной ясности мышления вкупе с его быстротой.
![]()
Уж если в заголовок вынес болезнь Паркинсона, то как-то надо поподробнее про неё. И не понятно за каким ты в конце наркоту приплел ко всему. Начал за здравие, а кончил за упокой
Наркота, типа феназепама, вызывает синдром паркинсонизма
Внутри шизофрении. Часть 1.
Заболевание, которое можно счесть за шизофрению, было известно с древних времен, возможно, даже доисторических. Отчетливые упоминания есть в Библии (помните, как царь Навухудоносор кушал траву с луга?), ими сквозит Античность и так далее. Однако утверждать на 100% ничего невозможно: существуют психозы и помимо шизофрении, а также есть, например, паразиты, поражающие нервную систему и способные вызвать галлюцинации. К тому же, не надо забывать о сифилисе, который с человеком живет уж точно не меньше, чем шизофрения.

В историю шизофрении я не собираюсь сильно вдаваться, поскольку об этом много сказано. Все написанное выше я упоминаю только с одной целью: чтобы показать, насколько сложный и ускользающий смысл вкладывается в этот термин.
Здесь нужно сделать небольшую оговорку: нам с вами, с раннего детства давящимися плодами науки, которые созревали в течение столетий, люди прошлого могут казаться очень недалекими. Ну как тут было не отличить, скажем, расстройства настроения и психозы? Ну вот больного глючит, как скотину, а вот он просто грустный сидит. Очевидно же, что это разные заболевания! На самом деле, нет. Главная боль всей медицины состоит в том, что одна болезнь в большинстве случаев не мешает развиваться другой. И расстройства настроения (аффективные расстройства) не только не мешают психозам, а зачастую сочетаются.
(Вот и сам Крепелин):

Надо сказать, что в те годы содержимое черепа было настоящим черным ящиком для науки. Оно и сейчас в значительной мере остается черным ящиком, но тогда мы даже представить не могли, КАКАЯ херня там творится. Все эти нервные связи, нейромедиаторы, нейронные сети, колонки, контуры… Едва ли хоть кто-то догадывался, что все может быть устроено так странно. Сама идея о том, что электрическая активность мозга большей частью опосредуется химическими веществами – дикость какая-то. Поэтому все, что оставалось психиатрам тех лет – наблюдать и накапливать знания, надеясь на психиатров будущего.
Для того, чтобы хоть немного приоткрыть завесу тайны над заболеванием, нужны были очень крупные открытия в нейробиологии и нейрофизиологии, которые в те времена были невозможны просто технологически. Первый толчкок, который помог предположить истинные причины шизофрении, был со стороны фармакологии. Это открытие аминазина. Цитата с одного ресурса:
В 1950 году французский нейрохирург Генри Лабори предположил, что чрезмерные переживания его пациентов перед операцией вызывают выброс избыточного количества гистамина. Гистамин — небольшая молекула, которая регулирует сотни процессов в организме: от выделения желудочного сока до температуры. Лабори считал, что именно чрезмерный выброс гистамина из-за тревоги пациентов может вызывать осложнения анестезии и даже внезапную смерть.
Лабори методом проб и ошибок пытался подобрать подходящий антигистаминный препарат. Совершенно случайно он обнаружил, что не самое популярное лекарство — хлорпромазин — действительно успокаивает пациентов. Более того, хлорпромазин усиливал действие анестезии.
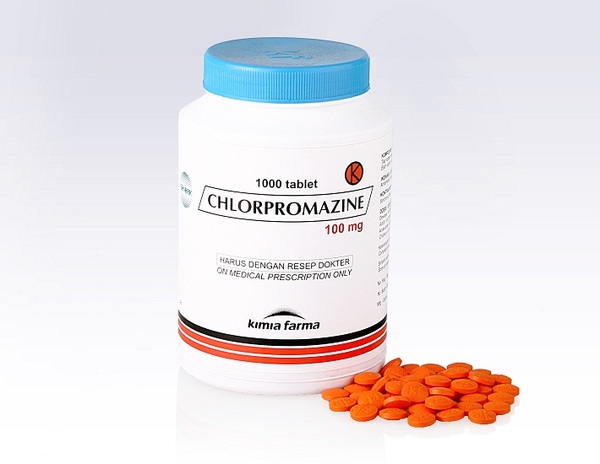
Предположение довольно типичное для тех времен, хотя и неверное. Тем не менее, ошибочное предположение привело к великому открытию – открытию первого на свете нейролептика. А сочетание нейролептиков с анестетиками используется до сих пор (нейролептанальгезия). Нейролептики (они же антипсихотики) – препараты, (относительно) избирательно действующие на симптомы психоза – бред и галлюцинации. Это открытие, в конечном счете, и помогло составить современные представления о причинах и патогенезе (т.е развитии болезни) шизофрении. Последовавшие исследования позволили открыть различные рецепторы в головном мозге, в том числе рецептора домафина. Именно тогда и оказалось, что основным эффектом нейролептиков является блокада эффектов дофамина, а дальше все заверте…
Вот мы и подошли к тому, чтобы описать сегодняшние представления о патогенезе шизофрении. Только представьте, какую дикую работу пришлось проделать, чтобы подойти к примерному представлению о том, как развивается эта психическая болезнь. Я буду идти в своем рассказе по такому принципу: от самых элементарных представлений на уровне молекул и клеток до нарушений в работе мозга в целом, а затем до нарушений психики.

Возможно, у вас уже возник вопрос: а почему тогда не использовать методы типа позитронно-эмисионной томографии или ф-МРТ и не выявить, какие отделы мозга работают неправильно? Да, заманчивая идея, и это, конечно же, пытались сделать, и даже есть результаты. Однако результаты эти породили больше вопросов, чем ответов. Действительно, удалось найти нарушения в работе мозга при шизофрении на ПЭТ и ф-МРТ, и касаются они преимущественно работы височных и лобных долей мозга, а также лимбической системы и их взаимодействия. Однако они встречаются не только при шизофрении, и не у всех шизофреников идентичны, чтобы можно было вбить в программу шаблон, который бы автоматически определял подобные изменения. Идея не нова, и в свое время изучали шизофрению с помощью рентгена, эхоэнцефалографии/скопии и других методик, однако результат всегда был похожим: да, что-то есть, но данных, однозначно указывающих на шизофрению, нет.

Как видно, даже здесь шизофрения дает прикурить. Очень мозаичное и скользкое заболевание, не дающее нам никакой нити, за которую можно было бы уцепиться и распустить весь клубок. Таким же оно предстает перед психиатрами – королева масок.
Как нетрудно догадаться, эти анатомические изменения порождают нейрохимические изменения, и тут, боюсь, придется вкратце напомнить основы нейрохимии мозга.
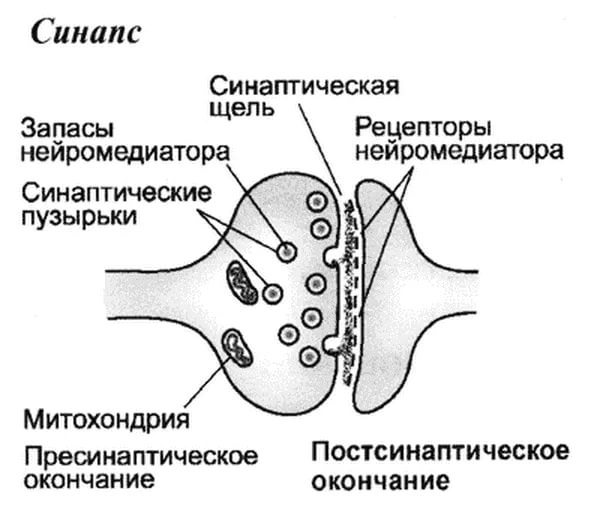
В нашем мозге постоянно осуществляется напряженная работа, которая проявляется в передаче электрических импульсов между нейронами. Соединение между двумя нейронами осуществляется с помощью специальной структуры – синапса. Примерно так он выглядит:

Болезнь Паркинсона (синонимы: идиопатический синдром паркинсонизма, дрожательный паралич) — медленно прогрессирующее хроническое неврологическое заболевание, характерное для лиц старшей возрастной группы. Относится к дегенеративным заболеваниям экстрапирамидной моторной системы. Вызвано прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, — прежде всего в чёрной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведет к активирующему влиянию базальных ганглиев на кору головного мозга.
Ведущими симптомами (иначе: основные или кардинальные симптомы) являются:
Современная медицина пока не может излечить заболевание или замедлить его прогрессирование (этиологическая или патогенетическая терапия), однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных.
Болезнь Паркинсона составляет 70—80 % случаев синдрома паркинсонизма. Она является наиболее частым нейродегенеративным заболеванием после болезни Альцгеймера. Заболевание встречается повсеместно. Его частота колеблется от 60 до 140 человек на 100 тысяч населения, число больных значительно увеличивается среди представителей старшей возрастной группы. Удельный вес людей с болезнью Паркинсона в возрастной группе старше 60 лет составляет 1 %, а старше 85 лет — от 2,6 % до 4 %. Чаще всего первые симптомы заболевания появляются в 55—60 лет. Однако в ряде случаев болезнь может развиться и в возрасте до 40 (болезнь Паркинсона с ранним началом) или до 20 лет (ювенильная форма заболевания).
Мужчины болеют несколько чаще, чем женщины . Существенных расовых различий в структуре заболеваемости не выявлено.
Этиология болезни Паркинсона на вторую половину 2011 года окончательно не выяснена. Этиологическими факторами риска считаются старение, генетическая предрасположенность, воздействие факторов окружающей среды. Патоморфологически нормальное старение сопровождается уменьшением числа нейронов чёрной субстанции и наличием в них телец Леви. Старению также сопутствуют нейрохимические изменения в стриатуме — снижение содержания дофамина и фермента тирозингидроксилазы, а также уменьшение числа дофаминовых рецепторов. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении.
Около 15 % людей с болезнью Паркинсона имеют семейный анамнез данного заболевания. Однако гены, ответственные за развитие болезни Паркинсона, не идентифицированы.
Причинами паркинсоноподобных проявлений также могут быть воздействие факторов окружающей среды (пестициды, гербициды, соли тяжёлых металлов), хроническая цереброваскулярная недостаточность или употребление лекарств, вызывающих экстрапирамидные побочные эффекты.
Установлено, что после инъекции вещества 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) развивается паркинсонизм. МФТП проникает через ГЭБ и под действием МАО-B окисляется до 1-метил-4-фенилпиридина (МФП+). МФП+ проникает в митохондрии и ингибирует комплекс I дыхательной цепи. Сходство химического строения МФТП и некоторых пестицидов (например, ротенон, паракват) и гербицидов (например, Агент Оранж) позволило предположить, что МФТП-подобные токсины окружающей среды способствуют развитию болезни Паркинсона. К факторам риска относят также проживание в сельской местности и близость промышленных предприятий и карьеров.
Риск развития болезни Паркинсона у курильщиков в 3 раза ниже, чем у некурильщиков. Предполагают, что это связано с дофамин-стимулирующим эффектом никотина. Кроме того, это можно объяснить наличием в дыме табака соединений, действие которых подобно ингибиторам МАО. От развития болезни Паркинсона защищает также употребление кофеина.
Окислительная гипотеза предполагает, что свободные радикалы, образующиеся при окислительном метаболизме дофамина, играют важную роль в развитии и прогрессировании болезни Паркинсона. Содержание веществ, которые могут служить донором электронов, в чёрном веществе увеличивается, что способствует образованию свободных радикалов[2]. Кроме того, при окислении дофамина под действием МАО образуется пероксид водорода. Если пероксид водорода не связывается с глутатионом, то происходит накопление весьма реактивных гидроксильных радикалов, которые вступают в реакцию с липидами клеточных мембран, вызывая перекисное окисление липидов и гибель клеток.
При болезни Паркинсона поражаются структуры экстрапирамидной системы — базальные ядра и чёрное вещество, голубое пятно и другие. Наиболее выраженные изменения отмечают в передних отделах чёрной субстанции. Характерные для болезни Паркинсона симптомы возникают при гибели 60—80 % нейронов данного анатомического образования.
Макроскопические изменения характеризуются депигментацией содержащих меланин областей чёрного вещества и голубого пятна. При микроскопическом исследовании поражённых областей выявляют уменьшение числа нервных клеток. В них определяется наличие телец Леви. Также происходит гибель астроцитов (разновидности глиальных клеток) и активация микроглии. Тельца Леви образуются вследствие скопления в цитоплазме белка ?-синуклеина. Наличие телец Леви — один из признаков болезни Паркинсона.
Тесная взаимосвязь между составляющими экстрапирамидной системы — паллидумом и стриатумом — обеспечивается многочисленными пучками нервных волокон. Благодаря связям между таламусом и стриопаллидарной системой образуются рефлекторные дуги, обеспечивающие выполнение многочисленных стереотипных и автоматизированных движений (например, ходьба, бег, плаванье, езда на велосипеде и др.). Тесная связь стриопаллидарной системы с ядрами гипоталамуса определяет её роль в механизмах эмоциональных реакций. В норме экстрапирамидная система посылает импульсы к периферическим двигательным нейронам. Эти сигналы играют важную роль в обеспечении миостатики путём готовности мышц к произвольным движениям. От деятельности данного отдела центральной нервной системы зависит способность человека принимать оптимальную для намеченного действия позу, достигается необходимое соотношение тонуса мышц-агонистов и мышц-антагонистов, а также плавность и соразмерность произвольных движений во времени и пространстве.
Открытие роли нейромедиаторов позволило объяснить функции экстрапирамидной системы, а также причины возникновения клинических проявлений болезни Паркинсона и паркинсонизма. В мозге существует несколько дофаминергических систем. Одна из них начинается в нейронах чёрной субстанции, аксоны которых через ножку мозга, внутреннюю капсулу, бледный шар доходят до полосатого тела (лат. corpus striatum). Терминальные отделы этих аксонов содержат большое количество дофамина и его производных. Дегенерация данного нигростриарного дофаминергического пути является основным причинным фактором развития болезни Паркинсона. Вторая восходящая дофаминергическая система — мезолимбический путь. Он начинается от клеток интерпедункулярного ядра среднего мозга и заканчивается в гипоталамусе и лобных долях головного мозга. Этот путь принимает участие в контроле настроения, поведении и контролирует начало двигательного акта и движений аффективной реакции (движений, которые сопровождают эмоции).
Почерк при болезни Паркинсона .

На рисунке видны рваные движения там, где предполагаются плавные линии
Гипокинезия — снижение спонтанной двигательной активности. Больной может застывать, часами сохраняя неподвижность. Характерна общая скованность. Активные движения возникают после некоторого промедления, темп их замедлен — брадикинезия. Больной ходит мелкими шагами, ступни при этом располагаются параллельно друг другу — кукольная походка. Лицо маскообразное (амимия), взгляд застывший, мигания редкие. Улыбка, гримаса плача возникают с запозданием и так же медленно исчезают.
Речь лишена выразительности, монотонна и имеет тенденцию к затуханию. В результате характерного для болезни Паркинсона уменьшения амплитуды движений почерк становится мелким — микрография.
Одним из проявлений олигокинезии (уменьшение количества движений) является отсутствие физиологических синкинезий (содружественных движений). При ходьбе руки не совершают обычных размашистых движений, они остаются прижатыми к туловищу (ахейрокинез). При взгляде вверх не отмечается наморщивания лба. Сжатие пальцев в кулак не сопровождается разгибанием кисти. Больной не может выполнять несколько целенаправленных движений одновременно. Все действия напоминают автоматические.
Вегетативные и психические расстройства.
Кроме нарушений двигательной сферы, при болезни Паркинсона отмечаются вегетативные расстройства, а также нарушения обмена веществ. Следствием может быть либо истощение (кахексия), либо ожирение. Секреторные расстройства проявляются сальностью кожных покровов, особенно лица, повышенным слюноотделением, избыточной потливостью.
Психические расстройства при болезни Паркинсона могут быть обусловлены как самим заболеванием, так и антипаркинсоническими препаратами. Начальные признаки психоза (страх, растерянность, бессонница, галлюцинаторно-параноидное состояние с нарушением ориентировки) отмечают у 20 % амбулаторных и двух третей больных с тяжёлой формой паркинсонизма. Слабоумие выражено слабее, чем при сенильной деменции. У 47 % наблюдают депрессии, у 40 % — расстройства сна и патологическую утомляемость. Больные безынициативны, вялы, а также назойливы, склонны к повторению одних и тех же вопросов.
Различают несколько клинических форм заболевания — ригидно-брадикинетическую, дрожательно-ригидную и дрожательную:
Наиболее часто применяемой в медицине является классификация стадий паркинсонизма по Хён и Яру. Впервые она была опубликована в 1967 году в журнале Neurology Маргарет Хён (англ. Hoehn) и Мелвином Яром (англ. Yahr). Изначально она описывала 5 стадий прогрессирования болезни Паркинсона (1 — 5). Впоследствии шкалу модифицировали, дополнив её стадиями 0, 1,5 и 2,5.
- Стадия 0 — нет признаков заболевания.
- Стадия 1 — симптомы проявляются на одной из конечностей.
- Стадия 1,5 — симптоматика проявляется на одной из конечностей и туловище.
- Стадия 2 — двусторонние проявления без постуральной неустойчивости.
- Стадия 2,5 — двусторонние проявления с постуральной неустойчивостью. Больной способен преодолевать инерцию движения, вызванную толчком.
- Стадия 3 — двусторонние проявления. Постуральная неустойчивость. Больной способен к самообслуживанию.
- Стадия 4 — обездвиженность, потребность в посторонней помощи. При этом больной способен ходить и/или стоять без поддержки.
- Стадия 5 — больной прикован к креслу или кровати. Тяжёлая инвалидизация.

Консервативное лечение.
В настоящее время болезнь Паркинсона является неизлечимой, все существующие методы лечения направлены на облегчение её симптомов (симптоматическое лечение).
Основные препараты, устраняющие двигательные нарушения: леводопа (чаще в комбинации с периферическими ингибиторами ДОФА-декарбоксилазы или реже с ингибиторами КОМТ), агонисты дофаминовых рецепторов[en] и ингибиторы МАО-Б.
Дофаминергические препараты.
Диоксифенилаланин (сокращённо допа, или дофа) — биогенное вещество, которое образуется в организме из тирозина и является предшественником дофамина, в свою очередь являющегося предшественником норадреналина. В связи с тем, что при болезни Паркинсона содержание дофамина в головном мозге значительно снижено, для лечения заболевания целесообразно применение веществ, повышающих его содержание в ЦНС. Сам дофамин не может быть использован для этой цели, так как он плохо проникает через гемато-энцефалический барьер.
Леводопа.
В качестве лекарственного препарата широко применяют синтетический левовращающий изомер диоксифенилаланина (сокращённо L-дофа), который значительно активнее правовращающего. Леводопа хорошо всасывается при приёме внутрь. Бо?льшая часть препарата попадает в печень и превращается в дофамин, который не проникает через гемато-энцефалический барьер. Для уменьшения декарбоксилирования препарат рекомендуют применять с ингибиторами дофа-декарбоксилазы (бенсеразидом, карбидопой).
Препарат эффективен при болезни Паркинсона и паркинсонизме. Он уменьшает гипокинезию и ригидность. При треморе, дисфагии и слюнотечении лечебный эффект достигается у 50—60 %.
Препарат можно назначать с центральными холиноблокаторами и не следует применять с необратимыми ингибиторами моноаминоксидазы (МАО).
При применении возможны побочные эффекты: диспепсические явления (тошнота, рвота, потеря аппетита), гипотензия, аритмии, гиперкинезы и др.
У пациентов младше 60—70 лет назначение леводопы из-за развития побочных явлений и снижения эффективности при длительной терапии стараются отложить и применяют другие лекарственные средства. Лечение пациентов старше 70 лет даже в начальных стадиях рекомендуют начинать с леводопы, что объясняют меньшей эффективностью препаратов других групп и более частыми соматическими и психическими побочными эффектами в этом возрасте.
Агонисты дофамина.
В качестве основного лечения также используются агонисты дофаминовых рецепторов (бромокриптин, перголид, прамипексол, ропинирол, каберголин, апоморфин, лизурид). Препараты данной группы являются специфическими центральными агонистами дофаминовых рецепторов. Имитируя действие дофамина, они вызывают те же фармакологические эффекты, что и леводопа.
По сравнению с леводопой они реже вызывают дискинезии и другие двигательные расстройства, но чаще оказывают иные побочные эффекты: отёки, сонливость, запоры, головокружение, галлюцинации, тошноту. Ингибиторы МАО типа Б и катехол-О-метилтрансферазы.
Данная группа препаратов избирательно подавляет активность ферментов, которые расщепляют дофамин: моноаминоксидаза (МАО типа Б) и катехол-О-метилтрансфераза (КОМТ). ингибиторы МАО-Б (например, селегилин, разагилин] и ингибиторы КОМТ (например, энтакапон и толкапон) замедляют неуклонное прогрессирование болезни Паркинсона. Фармакологические эффекты аналогичны леводопе, хотя их выраженность значительно меньше. Они позволяют усилить эффекты леводопы, не повышая и даже снижая её суммарную дозу.
Ингибиторы обратного нейронального захвата дофамина
Непрямые дофаминомиметики (амантадин, глудантан) повышают чувствительность рецепторов к соответствующему медиатору. Данные препараты усиливают выделение дофамина из пресинаптических окончаний и тормозят его обратный нейрональный захват. Лекарственные средства данной группы вызывают те же фармакологические эффекты, что и леводопа, то есть они преимущественно подавляют гипокинезию и мышечную ригидность, значительно меньше влияя на тремор.
Центральные холиноблокаторы
Тригексифенидил — основной препарат группы центральных холиноблокаторов, применяемых для лечения болезни Паркинсона
Применяемые ранее препараты белладонны действуют преимущественно на периферические ацетилхолиновые рецепторы и меньше — на холинорецепторы мозга. В связи с этим терапевтическое действие данных препаратов относительно невелико. Вместе с этим они вызывают ряд побочных явлений: сухость во рту, нарушение аккомодации, задержку мочи, общую слабость, головокружение и др. Современные синтетические противопаркинсонические центральные холиноблокаторы характеризуются более избирательным действием. Они широко применяются при лечении экстрапирамидных заболеваний, а также неврологических осложнений, вызываемых нейролептиками. Отличительным свойством центральных холиноблокаторов является то, что они в большей степени воздействуют на тремор; в меньшей мере влияют на ригидность и брадикинезию. В связи с периферическим действием уменьшается слюнотечение, в меньшей степени потоотделение и сальность кожи.
Хирургические методы лечения можно разделить на два типа : деструктивные операции и стимуляцию глубинных мозговых структур.
Деструктивные операции
К деструктивным операциям, применяемым при болезни Паркинсона, относятся таломо- и паллидотомия.
Таламотомия показана лишь в тех случаях, когда основным симптомом заболевания является тремор. Для получения положительного результата от операции больные должны соответствовать нескольким критериям: болезнь Паркинсона проявляется односторонним тремором, консервативное лечение неэффективно. Показано, что разрушение вентрального промежуточного ядра таламуса (лат. nucleus ventralis intramedius) приводит к снижению тремора у больных паркинсонизмом. Согласно литературным данным, эффективность операции по устранению тремора при болезни Паркинсона достигает 96 %. При этом те же авторы отмечают высокий риск осложнений (до 1/6 - стойких и примерно 1/2 - преходящих).
К осложнениям, возникающим после таламотомии, относят дизартрию, абулию, дисфазию, диспраксию.
Паллидотомия может быть показана больным с преобладанием двигательных расстройств, для которых консервативное лечение неэффективно. Процедура заключается во введении иглы в бледный шар (лат. globus pallidus) с последующим его частичным разрушением.
Паллидотомия является относительно безопасной процедурой. При анализе 85 статей, посвящённых паллидотомии, и соответственно результатов лечения 1510 больных выделены такие осложнения данной операции: Эффективность паллидотомии при болезни Паркинсона достаточно высока. Гипокинезия в противоположных стороне операции конечностях снижается в 82 % случаев.

С развитием радиохирургии появилась новая возможность производить разрушение соответствующих нервных структур без травматизации окружающих структур и тканей.
Для получения информации о записи на прием к специалистам просим обращаться по телефонам:
8 499 324-93-39; 8 499 324-44-97, +7 906 749-98-00
или по электронной почте Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript. / Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Читайте также:


