Глубокая стимуляция мозга для лечения болезни паркинсона

Что такое болезнь Паркинсона и каковы методы ее лечения
Заболевание имеет различные проявления.
Глубокая стимуляция мозга для лечения болезни Паркинсона
Среди них — такие нарушения, как мелкий тремор (дрожание) конечностей, повышение тонуса мышц, замедленность и затруднённость движений, уменьшение двигательной активности, появления гнусавости и смазанности речи, скованность и неловкость в движениях, изменения походки (шаркающая, мелкие шажки), изменения почерка (мелкий дрожащий почерк). Имеются и иные, не связанные с двигательной активностью, нарушения.
Причины болезни до конца не известны и сегодня, спустя почти две сотни лет, хотя медицинская наука сильно продвинулась в понимании механизмов развития болезни Паркинсона и в возможностях ее лечения.
В настоящее время развитие симптомов болезни связывают с разрушением допаминовых нейронов в определенных участках головного мозга, и уменьшением уровня этого биологически активного вещества в мозгу.
Основой лечения болезни Паркинсона являются различные лекарства, повышающие уровень допамина в определенных участках головного мозга, или препятствующие его быстрому разрушению. Эти препараты не излечивают болезнь, но помогают существенно уменьшить ее неприятные симптомы, позволить больному оставаться активным и работоспособным человеком.
Я помню одного своего пациента, пожилого человека, который болел болезнью Паркинсона уже несколько лет и был хорошо скомпенсирован с помощью лекарств. Однажды он появился в моем кабинете в сопровождении жены, которая буквально волочила его на себе. Она пожаловалась на резкое ухудшение его состояния. Сам он почти не мог двигаться из-за скованности всех мышц и сильного тремора. После недолгого расспроса оказалось, что около недели он не принимал один из препаратов от болезни Паркинсона – просто забыл. Естественно, я посоветовал ему немедленно возобновить прием лекарства. Еще через несколько дней он пришел ко мне сам. Изменение его состояния было драматическим — он широко шагал, свободно двигался, и выглядел уже не как инвалид, а как вполне самостоятельный и активный человек.
Современные препараты для лечения болезни Паркинсона очень эффективны и позволяют пациентам долго сохранять работоспособность. Проблема в том, что это заболевание обычно имеет прогрессивный характер . Если в первые годы заболевания для подавления двигательных нарушений достаточно назначение одного препарата в небольшой дозе, то постепенно появляется необходимость добавлять дополнительные лекарства, увеличивать их дозы . После многих лет болезни зачастую и целый коктейль из нескольких лекарств в максимальных дозах становится недостаточно эффективным. Пациенты теряют работоспособность, требуют помощи в выполнении ежедневных видов активности, таких, как одевание, мытье, еда, хождение. Дополнительным методом в тех ситуациях, когда лекарства уже не помогают, является хирургическое лечение болезни Паркинсона.
С давних пор было замечено, что у больных с проявлениями болезни Паркинсона иногда бывает частичное подавление тремора и двигательных расстройств в случае поражения определенных участков мозга из-за травмы или инсульта. В начале XX века ученые обнаружили, что разрушение небольшого числа клеток структур мозга, отвечающих за аномальную двигательную активность, уменьшает тремор. И хотя подобная операция сопровождается мышечной слабостью, больные предпочитали лечь под нож, чем жить с постоянно трясущимися руками.
До открытия эффективных лекарственных препаратов для лечения болезни Паркинсона деструктивные операции на головном мозге были довольно распространены. К несчастью, хирургическое вмешательство не стало решением всех проблем. Если при этом затрагивались оба полушария, или место разрушения подкорковых структур было выбрано не совсем точно, могли возникнуть такие серьезные осложнения, как нарушение речи и когнитивных функций.
В 1970-х гг. обнаружилось, что высокочастотная электростимуляция отдельных частей головного мозга имитирует их разрушение, не вызывая при этом никаких серьезных побочных эффектов. После того, как разработчики этого метода, Алим Бенабид (Alim Benabid) и Пьер Поллак (Pierre Pollak) из Гренобльского университета во Франции, сообщили, что подобная стимуляция приводит к значительному уменьшению тремора и ригидности, метод вышел на одно из первых мест в лечении паркинсонизма. Впрочем, стимуляция глубинных структур головного мозга не может остановить патологический процесс и не решает проблем, связанных с иными, нежели двигательные, нарушениями. Тем не менее, эта методика в настоящее время широко распространена в развитых странах и позволяет помочь многим пациентам, у которых лекарственное лечение уже не эффективно.
Что такое глубокая стимуляция мозга?
Глубокая стимуляция мозга – это метод лечения болезни Паркинсона, некоторых видов тремора и других нарушений движений, при котором происходит подавление активности участков мозга, ответственных за симптомы этих болезней. При глубокой стимуляции головного мозга, специальные электроды вводятся в таламус (для лечения обычного тремора и рассеянного склероза)
Импульсный генератор можно легко программировать с помощью компьютера, который посылает ему команды посредством радиосигналов. В зависимости от использования, стимуляторы могут сохранять работоспособность в организме от трех до пяти лет. Процедура замены импульсного генератора относительнo проста.
Как выполняется операция?
Большинству людей с болезнью Паркинсона требуется введение электродов в оба полушария мозга. Есть несколько способов, с помощью которых определяется точное место установки. Один из способов обнаружить целевую область – использовать только результаты компьютерной или магнитно-резонансной томографии. Другой – использовать технику записи электрических потенциалов с участков мозга, создавая карту его электрической активности.
Пациенты обычно подвергаются хирургической процедуре в два этапа. В ходе первого этапа операции, электроды, с помощью стереотаксической техники, обеспечивающей максимальную точность их установки, вводятся в заранее выбранные участки мозга, однако остаются не присоединенными к стимулятору. Наружные концы электродов оставляются под кожей головы, и разрез зашивается. Неделю спустя пациент повторно госпитализируется на очень короткое время, и постоянные электроды, ранее введенные в его мозг, подключаются к импульсному генератору.
Только две-четыре недели спустя, импульсный генератор впервые включается и настраивается. Процесс настройки может занять несколько недель, пока будут окончательно подобраны режимы стимуляции и лекарственные препараты, которые подавят симптомы паркинсонизма.
Обычно глубокая стимуляция мозга вызывает очень мало побочных эффектов.
Каковы преимущества глубокой стимуляции головного мозга?
Глубокая стимуляция мозга имеет много преимуществ. Во-первых, она не требует целенаправленного уничтожения какой-либо части головного мозга — и, следовательно, имеет меньше осложнений, чем деструктивные операции — такие, как таламотомия и паллидотомия.
Кроме того, электрическая стимуляция является регулируемой, и ее параметры могут быть изменены при изменении состояния пациента или смены принимаемых им лекарств. Не требуется никакой дополнительной операции для внесения корректив.
Еще одно важное преимущество глубокой стимуляции головного мозга относится к возможным в будущем методам лечения.
Рак шейки матки - это один из наиболее распространенных видов рака, успехи в лечении которого в .
Аккуратные щупальца с инструментами ювелирно, шаг за шагом разделяют ткани. Опухоль медленными, .

Исследование: Пациенты продолжают отмечать улучшения в лечении тремора спустя 10 лет после оперативного вмешательства.
Новое исследование показывает, что пациенты с болезнью Паркинсона, которые прошли глубокую стимуляцию мозга, могут ожидать, что новая технология позволит контролировать такие симптомы, как мелкий тремор в течение 10 лет и более. Кроме того, после процедуры наблюдается ослабление проявления таких симптомов, как плохая речь и нарушение равновесия.
Для глубокой стимуляции мозга применяется прибор, работающий от батареи, действие которого аналогично кардиостимулятору. Прибор посылает электрические импульсы, которые стимулируют участки мозга, отвечающие за контроль движений. Как сообщается, импульсы блокируют аномальные сигналы, которые вызывают многие изнуряющие симптомы болезни Паркинсона, такие как мелкий тремор, замедленность движений, скованность и затрудненную речь.
Данная процедура применялась в течение десятилетия, и обычно назначается тем людям, которым медицинские препараты не приносят облегчения.
Для того чтобы найти ответ на этот вопрос, исследователи проверили группу из 18 человек, которым была показана глубокая стимуляция головного мозга в Западном госпитале Торонто (Toronto Western Hospital) в период с 1996 по 2000 годы.
Пациентов записывали на видеопленку, когда они выполняли ряд физических движений. Их проверяли до начала операции, через один год и через пять лет после проведения операции, а в последнем исследовании и спустя 10 лет после оперативного вмешательства.
Пациентов проверяли по четырем разным состояниям:

- без приема препаратов и с отключенным стимулятором мозга;
- без приема препаратов и подключенным стимулятором;
- с приемом медицинских препаратов, но без стимуляции;
- с приемом препаратов и одновременной стимуляцией.
Врач оценивал видео, но не знал о состоянии пациента.
Спустя 10 лет исследователи увидели, что у пациентов все еще отмечались улучшения.
Когда пациенты не принимали медицинские препараты и даже спустя 10 лет после процедуры глубокой стимуляции мозга, отмечались общие улучшения движений на 25%, тремор улучшился более чем на 85%, замедленность движений на 23%, по сравнению с движениями пациентов с отключенным стимулятором.
Когда исследователи сравнили свои результаты состояния больных за прошедшие годы, они выявили, что некоторые улучшения длятся дольше, чем другие.
Спустя некоторое время пациенты, которые участвовали в исследовании, отметили, что их речь стала немного хуже. Способность вставать со стула сразу после стимуляции улучшилась, но по прошествии 5 лет, эффект стимуляции стал хуже, а спустя 10 лет пациенты стали вставать со стула хуже, чем раньше, до установки аппарата.
Аналогично с осанкой и ходьбой: спустя 1 год отмечались положительные улучшения, но через 10 лет симптомы вновь стали проявляться так же, как и в самом начале лечения.
Также вам могут быть интересны следующие материалы по теме:
Что могут ожидать пациенты
Эксперты, не принимавшие участие в исследовании заявляют, что результаты совпадают с теми результатами, которые они наблюдали у своих пациентов.
Другие эксперты соглашаются с этой точкой зрения.
Он также замечает, что сокращения количества принимаемых препаратов может способствовать снижению некоторых серьезных побочных эффектов, в том числе и сонливости, потери ориентации и галлюцинаций.
На видео: профессор Шабалов В. А. устанавливает в мозг человека, страдающего паркинсонизмом, специальное устройство, с помощью которого больной может просто отключить свою болезнь.
Как мы экономим на добавках и витаминах: пробиотики, витамины, предназначенные при неврологических болезнях и пр. и мы заказываем на iHerb (по ссылке скидка 5$). Доставка в Москву всего 1-2 недели. Многое дешевле в несколько раз, нежели брать в российском магазине, а некоторые товары в принципе не найти в России.

Рубрика: Медицина
Дата публикации: 02.11.2018 2018-11-02
Статья просмотрена: 321 раз
Данный обзор литературы направлен на исследование тенденций в использовании наиболее эффективной и распространенной формы нейромодуляции, а именно глубокой стимуляции мозга, с конкретным применением к болезни Паркинсона.
Ключевые слова: болезнь Паркинсона, глубокая стимуляция головного мозга.
Болезнь Паркинсона — хроническое нейродегенеративное заболевание, вызванное прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, и вызывающее моторные нарушения: мышечную ригидность, гипокинезию, тремор покоя, постуральную неустойчивость. Так же характерны немоторные проявления: боль, парестезии, сенсорные аномалии, вегетативная дисфункция, нарушения поведения и сна [1].
На протяжении многих лет основным лечением болезни Паркинсона является терапия леводопой [2], чья эффективность несомненна, однако приводит к леводопа-индуцированным дискинезиям [3]. Появление осложнений, связанных с леводопой, и резистентных к ней симптомов вызывает потребность в разработке лучших методов лечения, в частности в исследовании различных форм нейромодуляции. В 1987 году при проведении стереотаксической таламотомии было замечено, что высокочастотная стимуляция способна остановить экстрапирамидный тремор [4]. Впоследствии в 1994 году впервые была применена глубокая стимуляция мозга в качестве лечения болезни Паркинсона [5]. Клинические испытания показывают, что глубокая стимуляция мозга может превосходить медикаментозную терапию и значительно улучшать двигательные функции и качество жизни пациента [6].
Терапевтический эффект глубокой стимуляция мозга достигается за счет высокочастотных (обычно более 100 Гц) электрических импульсов, которые поступают через электроды, имплантированные в субкортикальные области мозга [7]. В настоящее время считается, что применение электрических импульсов оказывает ингибирующее воздействие на тела нейронов, близко расположенных к электрическому полю, а также возбуждающее действие на аксоны. Глубокая стимуляция мозга вызывает нейрохимические изменения: стимулирует астроциты и индуцирует распространение волн кальция, что приводит к высвобождению аденозина и глутамата [8]. При болезни Паркинсона электрофизиологическим признаком является повышенная бета-активность базальных ганглиев (8–35 Гц), которая подавляется допамином и глубокой стимуляцией мозга высокой частоты [9].
Успех терапии глубокой стимуляции мозга во многом зависит от тщательного отбора пациентов, в ходе которого используют международные критерии:
– Идиопатическая болезнь Паркинсона (согласно критериям болезни Паркинсона Британского банка мозга: брадикинезия, мышечная ригидности, тремор покоя, медленно прогрессирующее течение, эффект от приема леводопы, отсутствие мозжечковой и пирамидной симптоматики) длительностью более 5 лет.
– Инвалидизация, несмотря на оптимальное фармакологическое лечение, включая побочные эффекты от длительного применения леводопы.
– Высокая чувствительность к леводопе (компенсация симптоматики в период “включения”: оцениваются симптомы болезни Паркинсона утром в состоянии “выключения” до приема леводопы и в состоянии “включения” после приема форсированной дозы леводопы).
– Стадия по шкале Хен–Яра должна быть не выше III в состоянии “включения”.
– Возраст до 70 лет (в связи с риском хирургических осложнений и необратимым ухудшением когнитивных функций после операции).
– Отсутствие когнитивных нарушений.
Критерии, исключающие хирургическое лечение:
– Психические нарушения (острый психоз, деменция, расстройства поведения).
– Органические поражения базальных ганглиев.
– Синдром паркинсонизма (пациенты с вторичным паркинсонизмом плохо реагируют на ГСМ).
– Тяжелые соматические заболевания [10], [11].
Суть глубокой стимуляции мозга состоит в имплантации электродов в зоны мишени, расположенные в подкорковых образованиях головного мозга. Затем электроды соединяются с имплантируемым под кожу стимулятором, обычно под ключицей, который генерирует электрические импульсы и стимулирует ядро. Параметры стимуляции — амплитуда, частота и ширина импульса — задаются врачом [12].
И как только пациент будет признан хорошим кандидатом для глубокой стимуляции мозга, необходимо выбрать точку мишень. Мишени при болезни Паркинсона:
1) субталамическое ядро,
2) внутренняя часть бледного шара,
3) промежуточное ядро таламуса.
Стимуляция промежуточного ядра таламуса может быть применена у пациентов с дрожательной формой болезни Паркинсона, поскольку облегчает только тремор. Отсутствие эффективности при других моторных симптомах и риск транзиторной дизартрии ограничивает его использование и в качестве зон стимуляции больший интерес представляет стимуляция бледного шара и субталамического ядра, которая позволяет улучшить весь спектр моторной дисфункции при болезни Паркинсона [13], [14].
Когда основной целью является уменьшение дофаминергических препаратов предпочтительно использовать субталамическое ядро. В случае, когда снижение количества медикаментов не ожидается, и целью является сокращение дискинезий, используется внутренняя часть бледного шара. Если имеется вероятность снижения когнитивных функций пациента, рекомендуется также рассмотреть возможность использования в качестве цели бледный шар, учитывая и другие цели процедуры [15].
Обнаружить целевую область можно с помощью МРТ (большая вероятность погрешности, учитывая небольшие размеры точек мишеней) или записи электрических потенциалов — интраоперационная нейрофизиологическая диагностика, которая может быть использована, в том числе и для регистрации поведенческих реакций пациента [16].
Процедура имплантации хорошо переносится, но, как и все операции, не лишена осложнений, которые выделяют в две группы: связанные с хирургическим вмешательством и связанные с оборудованием. К первой группе относятся: внутричерепные кровоизлияния, судороги, интраоперационная брадикардия, тромбоз глубоких вен, эмболия легочной артерии, аспирационная пневмония. Во вторую группу осложнений входят эрозии и инфекции [17], [18], [19].
- Jankovic J. Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008;79(4):368–76.
- Fahn S. Levodopa in the treatment of Parkinson's disease. J Neural Transm Suppl. 2006;71:1–15.
- Pandey S, Srivanitchapoom P. Levodopa-induced dyskinesia: clinical features, pathophysiology, and medical management. Ann Indian Acad Neurol. 2017;20(3):190–8.
- Bergman H, Wichmann T, DeLong MR. Reversal of experimental parkinsonism by lesions of the subthalamic nucleus. Science. 1990;249(4975):1436–8.
- Benabid AL, Pollak P, Gross C, Hoffmann D, Benazzouz A, Gao DM, et al. Acute and long-term effects of subthalamic nucleus stimulation in Parkinson’s disease. Stereotact Funct Neurosurg. 1994;62(1–4):76–84.
- Deuschl G, Schade-Brittinger C, Krack P, Volkmann J, Schafer H, Botzel K, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med. 2006;355(9):896–908.
- Lozano CS, Tam J, Lozano AM. The changing landscape of surgery for Parkinson’s disease. Mov Disord Off J Mov Disord Soc. 2017;30.
- Vedam-Mai V, van Battum EY, Kamphuis W, Feenstra MG, Denys D, Reynolds BA, et al. Deep brain stimulation and the role of astrocytes. Mol Psychiatry. 2012;17(2):124–31.
- Ray NJ, Jenkinson N, Wang S, Holland P, Brittain JS, Joint C, et al. Local field potential beta activity in the subthalamic nucleus of patients with Parkinson’s disease is associated with improvements in bradykinesia after dopamine and deep brain stimulation. Exp Neurol. 2008;213(1):108–13.
- Williams A, Gill S, Varma T, Jenkinson C, Quinn N, Mitchell R, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised, open-label trial. Lancet Neurol. 2010;9(6):581–91.
- Munhoz, R., Picillo, M., Fox, S., Bruno, V., Panisset, M., Honey, C., & Fasano, A. (2016). Eligibility Criteria for Deep Brain Stimulation in Parkinson’s Disease, Tremor, and Dystonia. Canadian Journal of Neurological Sciences / Journal Canadien Des Sciences Neurologiques, 43(4), 462–471.
- Baylis, F. “I Am Who I Am”: On the Perceived Threats to Personal Identity from Deep Brain Stimulation. Neuroethics (2013) 6: 513.
- Pedrosa DJ, Timmermann L: Review: management of Parkinson’s disease. Neuropsychiatr Dis Treat 2013, 9: 321–340.
- Chao, Y., Gang, L., Na, Z. L., Ming, W. Y., Zhong, W. S., & Mian, W. S. (2007). Surgical Management of Parkinson’s Disease: Update and Review. Interventional Neuroradiology, 13(4), 359–368.
- Anand Rughani, MD Jason M Schwalb, MD Christos Sidiropoulos, MD Julie Pilitsis, MD, PhD Adolfo Ramirez-Zamora, MD, et all. Congress of Neurological Surgeons Systematic Review and Evidence-Based Guideline on Subthalamic Nucleus and Globus Pallidus Internus Deep Brain Stimulation for the Treatment of Patients With Parkinson's Disease: Executive Summary. Neurosurgery, Volume 82, Issue 6, 1 June 2018, Pages 753–756.
- Kobayashi K., Katayama Y. Intraoperative Microelectrode Recording. In: Itakura T. (eds) Deep Brain Stimulation for Neurological Disorders. Springer (2015).
- Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in Parkinson’s disease. The New England Journal of Medicine. 2001; 345(13):956–63.
- Sillay KA, Larson PS, Starr PA. Deep brain stimulator hardware-related infections: incidence and management in a large series. Neurosurgery. 2008;62(2):360–6.
- Chan DTM, Zhu XL, Yeung JHM, Mok VCT, Wong E, Lau C, et al. Complications of deep brain stimulation: a collective review. Asian J Surg. 2009;32(4):258–63.
Обе цели, бледный шар и субталамическое ядро, сравнивались в рандомизированных исследованиях по оценке улучшения с помощью единой рейтинговой шкалы болезни Паркинсона (UPDRS). В исследовании Krack et al. в категории двигательных расстройств отмечено улучшение в 71% для группы стимуляции субталамического ядра (без лекарств), а в группе стимуляции бледного шара показатель был лишь 39% из-за менее выраженного влияния на акинезии. Тем не менее, в небольшом рандомизированном проспективном исследовании Burchiel et al. не нашли значительной разницы в двигательной сфере в обеих группах.
В нерандомизированном проспективном исследовании, пациенты были оценены через три месяца после хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра (96 больных) и ХГСМ бледного шара (38 пациентов). Леводопа-индуцированные дискинезии были на том же уровне в обеих группах, в то время как другие моторные показатели указывали на более выраженное улучшение в группе стимуляции субталамического ядра.
Однако через шесть месяцев снижение дискинезии было выше в группе хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра, чем в группе стимуляции бледного шара (74% против 64%). Имеющиеся на сегодняшний день данные показывают умеренное преимущество хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра для моторной дисфункции. Кроме того, снижение дозы лекарств возможно при хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра, но не хронической глубокой стимуляции мозга (ХГСМ) бледного шара.
Эквивалент леводопы при хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра может быть уменьшен на 65% по сравнению с предоперационной дозой. Еще одним недостатком хронической глубокой стимуляции мозга (ХГСМ) бледного шара является высокий расход энергии для эффективной стимуляции.
В соответствии с критериями доказательной медицины, субталамическое ядро стало основной мишенью для ХГСМ. Двусторонние имплантации двух ХГСМ электродов, подключенных к одной ИГИ, являются стандартной процедурой. Это приводит к улучшению основных проявлений БП. В среднем показатель двигательных параметров почти во всех исследованиях колеблется от 40 до 70%.
Глубокая стимуляция мозга (ГСМ) субталамического ядра оказывает нейропротекторное действие — возможно, связанное с подавлением токсичности глутамата и снижением гибели клеток в черном веществе. Однако как показано по данным ПЭТ прогрессирование заболевания у пациентов с распространенной болезнью Паркинскона (БП) продолжается, несмотря на то, что они получили эффективное стимулирование в соответствии с улучшенной шкалой UPDRS.
В немецком многоцентровом исследования в двух группах были изучены 156 пациентов с поздними стадиями болезни Паркинсона (БП) и тяжелыми двигательными нарушениями, сравнивались результаты лечения ХГСМ в сочетании с медикаментозной терапией и результаты в группе получавшей только лекарственные препараты. Через шесть месяцев наблюдения результаты были лучше в группе пациентов с ХГСМ, деятельность в повседневной жизни, эмоциональное благополучие, телесный дискомфорт были улучшены на 24-38%.
В другом исследовании оценивалось влияние возраста. У 52 пациентов с болезнью Паркинсона (БП) улучшение двигательных функций составило 62% у пациентов моложе 60 лет, 37% в возрасте 60-70 лет и лишь 22% среди тех, кто был старше 70 лет. В то время как отмечено влияние на двигательные симптомы, существенное влияние на речь, замерзание и психологические симптомы, такие как депрессия, не связанные со слабоумием, отсуствуют. Влияние ГСМ субталамического ядра на когнитивные функции пациентов с болезнью Паркинсона (БП) было оценено в нескольких исследованиях.
В швейцарском исследовании, из 57 пациентов с болезнью Паркинсона (БП), которые подверглись глубокая стимуляция мозга (ГСМ) субталамического ядра у 24,5% развилась деменция, соответствующая критериям деменции болезни Паркинсона (БП). Остальная часть пациентов оставалась когнитивно стабильной в течение трех лет (DSM-IV и UPDRS шкалы). Частота ухудшений когнитивных функций была такой же, как у пациентов с болезнью Паркинсона (БП) при консервативном лечении. По крайней мере, большинство опубликованных данных говорит о том, что ГСМ субталамического ядра незначительно влияет на познавательные способности.
Тем не менее, некоторые подгруппы пациентов (старшего возраста) находятся в более высокой группе риска развития когнитивных и нейроповеденческих нарушений. Недостатком ГСМ субталамического ядра является необходимость в более сложной регулировке стимуляции и препаратов леводопы для конкретного пациента в послеоперационном периоде. В некоторых случаях после ГСМ субталамического ядра могут возникать побочные психиатрические реакции. Переходная ангедония не является редкостью. Начало или ухудшение существующей депрессии после операции происходит у небольшого процента пациентов, поэтому необходима предоперационная психоневрологическая оценка, и в послеоперационном периоде она также является важной частью наблюдения за пациентом.
У большинства пациентов сразу после операции появились поведенческие побочные эффекты, которые уменьшились в долгосрочной перспективе без специфической терапии. Возникновение нервно-психических побочных эффектов, в таких случаях является многофакторным.

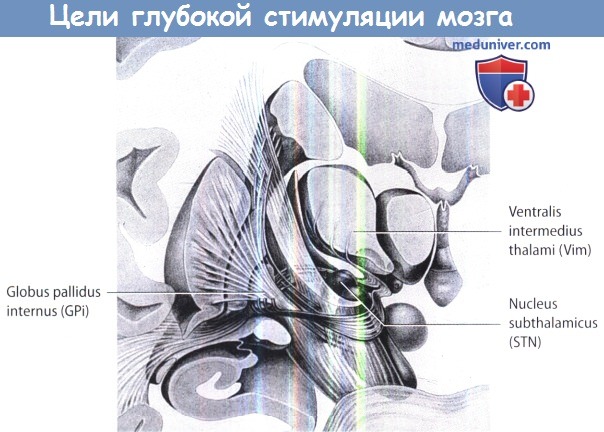
Общие анатомические цели для глубокой стимуляции мозга. 
Анатомические цели для глубокой стимуляции мозга при лечении двигательных расстройств.
Многие знают о том, что одним из способов лечения болезни Паркинсона является нейрохирургическая операция. Небольшая часть читателей хорошо понимает, о чем идет речь, и уже серьезно задумывается об операции для себя или своих близких. Но большинство все же слабо представляет себе, что это такое, кому показаны и противопоказаны операции и как врачи научились проникать в мозг без нарушения других функций тела.
До 1980-х единственным хирургическим способом облегчить симптомы болезни Паркинсона была общемировая практика деструкций – разрушение нервных клеток в тех частях мозга, которые отвечают за движение. Деструктивные операции (таламотомия, паллидотомия) до сих пор практикуются, но их основной минус – это необратимость разрушений, т.е. погибшие клетки не восстанавливаются.
Альтернативой деструкциям при болезни Паркинсона стала операция по глубокой стимуляции мозга, или DBS – Deep Brain Stimulation.

Пионерами в этой области выступили французы – нейрохирург Алим Бенабид (Alim Benabid) и невролог Пьер Поллак (Pierre Pollak), которые в 1980-е в Гренобле впервые провели операцию по имплантированию электродов в раздел мозга под названием гипоталамическое ядро. Впоследствии глубокая стимуляция мозга стала золотым стандартом хирургического лечения болезни Паркинсона.
На данный момент операция по глубокой стимуляции мозга показана пациентам на более продвинутой стадии заболевания, когда симптомы болезни сложно контролировать медикаментозно без серьезных побочных эффектов.
Я делюсь подробным и понятным описанием операции, которое я нашла на одном русскоязычном сайте.
Система для DBS состоит из трех компонентов:
• Электрод, представляющий собой тонкий изолированный провод с открытым концом, внедряемый в мозг посредством небольшого отверстия на черепе.
• Подкожная система проводов, которая позволяет поместить генератор сигналов на расстоянии от головного мозга. Провода размещаются под кожей и проходят через голову, шею и плечи.
• Нейростимулятор – устройство, генерирующее импульсы. Размещается также подкожно, обычно в области ключицы.

Компоненты устройств для пациента
Процедуру проводят квалифицированные нейрохирурги. Установка компонентов системы проходит в два этапа. На первом этапе под местной анестезией проделывается небольшое отверстие в черепе. Процедура проводится без общей анестезии для того, чтобы во время установки общаться с пациентом и уточнять его ощущения.
Введение электрода проходит без болей, поскольку мозг человека обладает уникальной особенностью – он не может передавать болевые сигналы, потому что не имеет болевых рецепторов. Для точного введения электродов используется система трехмерной компьютерной навигации, что позволяет точно определить зону головного мозга, ответственную за тремор.
После установки электродов в течение нескольких недель устройство настраивается посредством регулировки специальных магнитов. Настройка может проходить в течение нескольких недель.
Когда эффективность достигнута, осуществляется второй этап процедуры – размещение нейростимулятора, которое может проводиться либо под общей, либо под местной анестезией.
После завершения этапов процедуры пациенту выдается специальное устройство магнитного действия, с помощью которого он может управлять прибором (включать или выключать). Батареи в нейростимуляторе хватает на 3-5 лет, самые современные устройства имеют более долгий срок службы – до 10 лет.
На видео вы можете увидеть пациента с болезнью Паркинсона 1) до операции; 2) сразу после операции без включения электродов; 3) электроды подключены.
Важно знать!
! Глубокая стимуляция мозга подходит НЕ всем людям с болезнью Паркинсона.
Большое число людей с болезнью Паркинсона, которые задумываются об операции, не являются подходящими для нее кандидатами. В то же время часть пациентов, которым эта операция принесет серьезное облегчение, совершенно не знают о ней.
! Глубокая стимуляция уменьшает проявления болезни Паркинсона, но не дает полного излечения и не влияет на прогресс заболевания.
! Операция DBS влияет на тремор, скованность и замедленность движений.
! После глубокой стимуляции мозга пациенты продолжают принимать антипаркинсонические лекарства, но уже в меньшей дозировке.
Кто является идеальным кандидатом на глубокую стимуляцию мозга и как врачи делают отбор?
1. Идиопатическая форма болезни Паркинсона (болезнь возникла сама по себе без связи с генетическими нарушениями или другими заболеваниями, такими как инсульт)
4. Исчерпан весь ресурс медикаментозного лечения
5. Отсутствие деменций и когнитивных нарушений
6. Реалистичные ожидания от операции
Кому НЕ подходит глубокая стимуляция мозга?
Здесь есть несколько важных показателей:
1. Минимальный или отсутствующий эффект от принятия леводопосодержащих лекарств
2. Серьезные когнитивные нарушения
3. Депрессии или другие психические расстройства
4. Неконтролируемая гипертензия или повышенная склонность организма к кровотечениям и кровоизлияниям
Наиболее подходящее время для операции со времени постановки диагноза показано на рисунке.

Лучшее время для глубокой стимуляции мозга
Возможные осложнения после операции:
- Увеличение веса (у 95% пациентов)
- Нарушение речи
- Гиперкинезы
Обратите внимание, как ученые в США и других странах работают над улучшением операции по глубокой стимуляции мозга. Возможно, и в наших странах скоро появится что-то подобное.
Традиционно, два наиболее распространенных места стимуляции – это области субталамического ядра и бледного шара. Но другие зоны также обладают потенциалом.
• Внедрение электродов в проводящие пути, соединяющие различные области мозга
• Стимуляция с обратной связью (“closed-loop” stimulation)
Предполагается, что встроенное в мозг устройство будет записывать волны, излучаемые мозгом. На основе этих сигналов можно будет определять дисфункциональные периоды работы мозга (например, когда ухудшаются симптомы болезни в течение дня) и включать электроды именно в период ухудшений (сейчас стимуляторы работают без остановки).
Такая ограниченная стимуляция позволит сохранить продолжительность жизни батареи и потенциально удлинить время действия терапевтического эффекта от операции.
• Высокоинтенсивный сфокусированный ультразвук (пока на стадии клинических испытаний)
Эта методика – альтернатива деструкциям и подойдет пациентам, которым в силу медицинских показателей не подходит глубокая стимуляция мозга. Процедура является неинвазивной (не нарушается целостность тканей) и направлена на разрушение клеток, выполняющих моторную функцию.
Давайте подведем небольшой итог.
Если вы или ваши близкие принимаете препараты леводопы и относительно хорошо себя чувствуете, то имейте операцию в виду как альтернативу на будущее. Пока не исчерпаны медикаментозные возможности, операция может подождать.
Читайте также:
- Борозда лучевого нерва на плечевой кости находится борозда
- Конспект урока система органов в организме уровни организации организма нервная и гуморальная регуляция
- Массаж при неврите плечевого нерва
- Наследственность и нервно психические заболевания
- Какие структуры при слиянии образуют спинномозговой нерв



