Каналы в нервных клетках
• Ионные каналы позволяют ионам проходить через пору, что вызывает быстрые (микросекунды) изменения мембранного потенциала
• Каналы обладают селективностью в отношении определенных ионов, катионов или анионов
• Каналы регулируют внутриклеточную концентрацию таких регуляторных ионов, как Ca 2+
Ионные каналы, регулируемые лигандами, представляют собой белки, пронизывающие мембрану и состоящие из нескольких субъединиц, которые образуют в мембране заполненные водой поры, и регулируют их транспортную активность. На рисунке ниже представлена кристаллическая структура ацетилхолинового никотинового рецептора. При стимуляции внеклеточными агонистами, происходит перегруппировка субъединиц, и они ориентируются таким образом, что пора открывается.
При этом возникает контакт между водной средой, находящейся по обеим сторонам мембраны. Диаметр поры позволяет свободно доффундировать ионам с одной стороны мембраны на другую под действием электрического и химического градиента, который устанавливается за счет функционирования ионных насосов и переносчиков. Селективность каналов по отношению к определенным ионам регулируется изменениями диаметра пор и количеством гидрофильных остатков в составе их белков. Таким образом, ионный канал, играющий роль рецептора, обеспечивает прохождение только определенных катионов или анионов, отобранных из числа многих.
Ионные каналы, регулируемые лигандом, представляют собой самый быстрый из известных в биологии механизмов передачи сигналов. Канал открывается через несколько микросекунд после связывания лиганда-агониста. В синапсах, где нейромедиаторам необходимо диффундировать на расстояние менее чем 0,1 мкм, сигнал в постсинаптическую клетку поступает через 100 микросекунд. Напротив, для G-белков, стимулированных рецепторами, требуется около 100 миллисекунд для того, чтобы прошел обмен ГДФ на ГТФ, а рецепторная протеинкиназа работает еще медленнее.
Наряду с нейронами и мышцами, для многих клеток важнейшими рецепторами являются ионные каналы, находящиеся под контролем лигандов. Важную роль в системе передачи сигналов играют также такие ионные каналы, которые находятся под контролем лигандов, относящихся к другим классам.
Передача сигналов ионными каналами отличается от сигнальных систем с участием рецепторов, описанных в настоящей главе, тем, что для каналов не существует непосредственных белковых мишеней и специфических вторичных мессенджеров. В большинстве случаев поток ионов через канал увеличивает или снижает мембранный потенциал клетки и, таким образом, модулирует все транспортные процессы с участием метаболитов или ионов, которые осуществляются под действием электрического поля
Внутри клетки животных, на мембране, поддерживается отрицательный потенциал за счет удаления ионов Na+ и поступления ионов К+. Таким образом, открытие канала селективного для Na+ приводит к деполяризации клетки, а открытие канала для К+ — к ее гиперполяризации. Аналогичным образом, открытие Cl- каналов также вызывает гиперполяризацию клетки, поскольку ионы Cl-, главным образом, находятся во внеклеточном пространстве. Посредством этих электрических эффектов информация передается эффекторным белкам, которые энергетически сопряжены с мембранным потенциалом или со специфическими ионными градиентами, или же связаны с определенными ионами (например, с ионами Ca 2+ ), концентрация которых при открытии канала меняется.
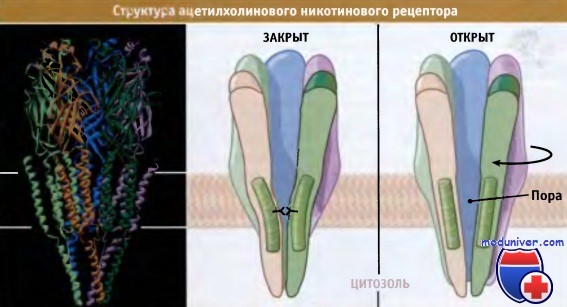
Холинергический никотиновый рецептор представляет собой селективный катионный канал,
который состоит из пяти гомологичных, но обычно неидентичных субъединиц, образующих олигомер.
Этот олигомер представляет собой первичный а-спиральный кор, проходящий сквозь мембрану.
В этом коре создается сам канал, и его открытие и закрытие обеспечиваются кооперативными изменениями в характере сборки субъединиц.
Структура построена по данным Protein Data Bank file 2BG9.
Ацетилхолиновые никотиновые рецепторы являются прототипом рецепторных ионых каналов и представляют собой первые рецепторы, которые оказались ионными каналами. Они представляют собой неселективные катионные каналы, которые вызывают деполяризацию клетки-мишени за счет входа в нее ионов Na+. Эти рецепторы являются хорошим примером возбудимых рецепторов нейромышечного синапса, где они запускают сокращение, однако в нейронах и во многих других клетках известно существование их альтернативных изоформ.
В мышцах дополяризация, наступающая под действием никотина, действует как Ca 2+ -канал, чувствительный к величине потенциала и позволяющий ионам кальция выходить из саркоплазматического ретикулума в цитозоль. Кальций действует как вторичный (или третичный) мессенджер, вызывающий сокращение. В некоторых секреторных клетках никотиновые рецепторы способствуют экзо-цитозу по аналогичному механизму, при котором Са+ запускает этот процесс. В нейронах, у которых стимуляция никотином приводит к возникновению потенциала действия (деполяризация, которая быстро распространяется по нейрону), начальная деполяризация распознается Na+-каналами, зависимыми от величины потенциала. Их открытие (вместе с функционированием других каналов) приводит к распространению по нейрону потенциала действия.
Нервная система богата рецепторными катионными каналами, реагирующими на другие нейромедиаторы, наиболее распространенным среди которых является глутаминовая кислота (Glu). Три отдельных семейства рецепторов глутамата разделяют общие свойства катионной проводимости, однако для каждого из них характерен собственный спектр реакций на лекарственные препараты. Все они действуют как активаторы нейронов с одной интересной особенностью: семейство рецепторов NMDA, названное так по чувствительности к определенному лекарству, наряду с проницаемостью для Na+, также пропускают ионы Ca 2+ . Таким образом, существенным компонентом их активности являются ионы кальция, которые действуют как вторичный мессенджер на большое количество мишеней.
Постоянная стимуляция каналов NMDA глутаматом, который выходит во внеклеточную среду при повреждениях или при действии лекарств, может вызвать поступление в клетку токсических количеств кальция, что приведет к гибели нейрона.
Вторая функциональная группа рецепторных каналов селективна для анионов и за счет поступления в клетку-мишень ионов Cl- вызывает ее гиперполяризацию. Анион-селективные рецепторы включают рецепторы у-аминомасляной кислоты (GABA) и глицина (Gly). У нейронов гиперполяризация может тормозить инициацию потенциала действия и/или высвобождение нейромедиаторов.
К числу наиболее обширного семейства каналов, контролируемых лигандами, относятся TRP и близкая к ним группа, около 30 представителей которых обнаружены в клетках млекопитающих. Эти каналы также найдены у беспозвоночных. Каналы TRP обладают селективностью по отношению к ионам Ca 2+ и образованы тетрамерами или идентичными субъединицами, окружающими центральный канал. Каждая субъединица состоит из связки шести гомологичных спиралей, проходящих через мембрану. Однако их N- и С-концевые участки содержат несколько различных доменов. Это регуляторные домены, а также домены, ответственные за белковые взаимодействия, в том числе домены протеинкиназы (субстраты которой пока неизвестны).
Через все каналы TRP осуществляется трансмембранный поток Ca 2+ , что обеспечивает его функционирование в качестве вторичного мессенджера, однако различные изоформы TRP обладают разными физиологическими функциями. Являющаяся прототипом форма TRP обнаружена в фоторецепторах беспозвоночных и регулирует поток кальция из внутриклеточных депо в цитоплазму, тем самым обеспечивая передачу зрительного сигналов. Другие формы обеспечивают вход кальция в клетку из ее окружения, еще одни осуществляют поступление катиона в эндоплазматический ретикулум, практически непосредственно из внеклеточного пространства, поскольку образуют мост между плазматической мембраной и каналами эндоплазматического ретикулума в точках, где мембраны примыкают друг к другу.
Еще более разнообразна регуляция функционирования каналов TRP. Различные каналы реагируют на тепло, холод, болевые раздражители, давление и осмомолярность. Активность многих TRP находится под положительным или отрицательным контролем таких липидов, как эйкозаноиды, диацилглицерин и PIP2. Например, капсаицин, обусловливающий жгучий вкус перца, является агонистом некоторых ваниллоидных рецепторов (TRPV). Некоторые каналы TRP являются механосенсорами, которые позволяют ресничкам улавливать токи жидкости. Наиболее известным является сенсорный канал наружных волосковых клеток внутреннего уха. Этот канал открывается, когда под действием тока жидкости, вызванного звуковым воздействием, сгибаются апикальные реснички волосковых клеток.

Проведение сигналов в головном мозге зависит от способности нейронов отвечать на очень слабые стимулы быстрыми и значительными изменениями электрического потенциала , проходящего через клеточную мембрану. В сенсорных клетках мембранный потенциал изменяется в ответ на действие физического стимула: рецепторы глаза отвечают , в частности, на простые фотоны света , обонятельные нейроны - на прямое воздействие молекул одоранта и нейроны органа слуха - в ответ на слабые изменения звуковых волн. В основе всех этих сенсорных ответов лежит эффект действия потенциала, в течение которого происходят изменения мембранного потенциала со скоростью 500 вольт в секунду. В быстром изменении мембранного потенциала, обеспечивающего процесс передачи информации в центральной нервной системе принимают участие каналы ионов - определенный класс интегральных мембранных протеинов , найденных во всех клетках организма. Ионные каналы нейронов оптимально реагируют в ответ на действие химических и физических сигналов. В различных отделах центральной нервной системы они гетерогенны ( разные типы каналов) и реагируют в ответ на специфические сигналы. Поскольку ключевая роль ионных каналов заключается в проведении электрических сигналов, то их повреждение может стать причиной различных неврологических и психических расстройств. Однако, поражение ионных каналов может стать причиной не только болезней нервной системы , но и расстройств со стороны других органов , например, скелетных мышц или мышцы сердца ( некоторые варианты аритмий). Ионные каналы могут быть мишенями для лекарственных препаратов.
Ионные каналы представляют собой не только поры в липидной мембране , но они отличаются различной структурой протеинов , которые окружаются двойным слоем липидов. Диаметр ионов К+ больше , чем ионов Na+, оба канала открываются в ответ на деполяризацию мембраны , причем ее степень влияет на скорость открытия каналов ( каналы Na+ открываются более быстро). Когда деполяризация достигает определенного уровня каналы Na+ начинают закрываться. Процесс , при котором каналы Na+ закрыты в течении пролонгированной деполяризации обозначают термином "инактивация". Такая деполяризация становится стимулом ( причиной) перключения каналов Na+ между тремя различными состояниями : отдыхом, активацией и инактивацией и, которые соотвествуют трем различным конформациям протеина каналов Na+, по контрасту аксоны , содержащие каналы К+ не инактивируются , а остаются на протяжении того времени пока мембрана деполяризуется , по крайней мере, для вольтаж - фиксированной деполяризации это время составляет десять миллисекунд. В инактивном состоянии каналы Na+ закрыты и не могут открыться при дальнейшей деполяризации мембраны.
Ионные каналы могут быть повреждены в результате воздействия на организм токсинов и медикаментов. Таким образом, становится очевидным, что ионные каналы играют важнейшую роль в физиологии и патофизиологии нервной системы.
В дополнении к ионным каналам , нейроны содержат второй значимый класс протеинов , специально предназначенный для движения ионов через клеточную мембрану - это транспортеры ионнов или помпы. Данные протеины не принимают участия в проведении быстрых нейронных сигналов , а учавствуют в стабилизации и увеличении концентрации градиентов физиологически значимых ионнах во внешней и внутренней среде нейрона ( Na+ и К+ помпы транспортируют ионы со скоростью 100 ионов в секунду ). В случае активности ACh рецептора, как транспортера , "шлюз" для ионов открывается и ионы проходят через мембрану со скоростью 10 миллионов в секунду. Приток ( поступление _ ионов Ca2+ контролируется каналами и при их нарушении может стать причиной метаболических нарушений внутри клеток , стать причной активации различных энзимов ( ферментов) и других протеинов, облегчающих процесс нейротрансмиссии и даже привести к изменениям экспрессии генов.
Ионные каналы имеют три основных свойства ( выполняют три главные функции):
- они распознают и выбирают специфические ионны;
- они открываются и закрываются в ответ на специфические электрические , механические или химические сигналы;
- они обеспечивают прохождение ионнов черех клеточную мембрану.
Ионные каналы в нервной и мышечной ткани обеспечивают прохождение ионов в очень быстрые отрезки времени , тем самым обеспечивая большую скорость изменения электрических зарядов. ( около 100 миллионов ионов могут проходить через простой канал каждую секунду). Скорость прохождения ионнов через каналы регулируется энзимами , каталазой и углеродной ангидразой, которые ограничивают процессы диффузии. Скорость ( уровень) трансфера ионов через каналы был впервые описан в начале 70-х годов прошлого столетия при исследовании нейротранмиттера ацетилхолина ( ACh) и связывающегося с рецептором клеточной мембраны скелетных мышечных волокон в синапсе между невром и мышцей.
Каждый тип ионных каналов специфичен, так, например, негативный потенциал покоя нейронов в большинстве случаев детерминируется каналами К+, а потенциал действия - каналами Na+. Различные типы ионных помп влияет на градиент концентрации таких ионов как Na+, K+, Ca2+, Cl - ионов.
Таким образом, в момент нанесения на возбудимую клетку внешнего раздражителя в нее в течение очень короткого времени входят ионы натрия, и мембрана клетки деполяризуется настолько, что наблюдается овершут, но в следующее мгновение резко возрастает ток К + из клетки, в результате чего потенциал на мембране возвращается к уровню покоя: -70 мВ. Напомним, что в покое мембрана возбудимых клеток вполне проницаема для К + , а для Na + является практически непреодолимым препятствием.
Так каким же образом обеспечиваются токи ионов через мембрану в момент генерации ПД? Оказывается, в клеточной мембране возбудимых клеток располагаются особые белковые молекулы, образующие ионные каналы. Восходящая фаза ПД реализуется за счет работы потенциалзависимых натриевых каналов. Когда клетка находится в состоянии покоя, этот канал закрыт (рис. 8.8).

Рис. 8.8. Схема работы потенциалзависимого натриевого канала:
а — канал закрыт; 6 — канал открыт; в — канал инактивирован; г — канал возвращен в исходное состояние и готов к работе; А — активационная створка;
И — инактивационная створка
Если же клетку раздражают каким-либо внешним стимулом, то ПП на мембране начинает сдвигаться от -70 мВ к -50 мВ. Для большинства нервных клеток достаточно сдвига ПП на 20 мВ (т.е. до -50 мВ) для того, чтобы пространственная конфигурация белковой молекулы канала изменилась, образуя проход, по которому в клетку устремляются по градиенту концентрации ионы натрия. Происходит это из-за того, что часть молекулы канала (которую назвали активационной створкой канала) сдвигается, и открывается канал для ионов натрия. Однако в следующее мгновение другая часть канальной молекулы белка (названная инактивационной створкой канала) перекрывает движение ионов через канал (см. рис. 8.8).
Натриевый канал находится в открытом состоянии всего 1 мс, но за это время через него в клетку успевает пройти около 6 тыс. ионов Na + . Конечно, работа одного канала не может заметно деполяризовать клетку, но натриевых каналов на мембране возбудимых клеток очень много — около 100 на площади в 1 мкм 2 . После срабатывания канал за несколько миллисекунд
возвращается в исходное состояние и может открыться снова, если клетка подвергнется раздражению (см. рис. 8.8). Но для того, чтобы Na + -Kana.T перешел из состояния, изображенного на рис. 8.8, в, в состояние, изображенное на рис. 8.8, а, необходимо, чтобы потенциал на мембране достиг ПП. Восстановление ГГП на мембране осуществляется благодаря тому, что сразу же после закрытия натриевого канала через свои особые каналы из клетки выходят положительно заряженные ионы К + . Калиевые каналы действуют по тем же принципам, что и натриевые, однако у них есть только одна створка, которая открывает и закрывает путь ионам калия из клетки.
В настоящее время открыто несколько видов натриевых и калиевых каналов. Они различаются величиной порога открывания, скоростью открывания и закрывания, пропускной способностью для ионов, механизмом открывания.
Существуют также особые малоизбирательные каналы для анионов и катионов и, наоборот, очень избирательные каналы для Са 2+ и С1“.
Сразу после того, как активационная створка пропускает в клетку порцию натрия, канал снова активировать невозможно (см. рис. 8.8), так как необходимо сначала вернуть в исходное состояние инактивационную створку. В этом состоянии канал называют абсолютно рефрактерным, т.е. неспособным к работе. По длительности абсолютная рефрактерность равна приблизительно 1 мс. Наличие абсолютной рефрактерности не позволяет отдельным ПД накладываться друг на друга и ограничивает максимальную частоту разрядов нервных клеток величиной 500—700 Гц. Вслед за стадией абсолютной рефрактерное™ наступает относительная рефрактерность: лишь часть Ыа + -капалов вернулась в состояние готовности, еще не закрыты все потенциалзависимые К + -каналы. В таких условиях запуск ПД возможен, но только под действием более мощного стимула.
Нормальная работа ионных каналов очень важна для организма. Ведь нарушение их работы приводит к очень быстрому развитию нарушений функционирования ЦНС, судорогам, параличам и т.и. — в зависимости от того, какой вид каналов дезорганизован.
Природа очень далеко зашла по пути создания блокаторов ионных каналов, которыми по справедливости вооружила и хищников, и тех, кто от этих хищников обороняется.
Один из сильнейших ядов содержится в тканях рыбы-иглобрюха, называемой японцами рыбой фугу. У этих тропических рыб особенно ядовиты печень и яичники. Несмотря на это, иглобрюх является деликатесом японской кухни. Яд из тканей этих рыб называется тетродотоксином, и достаточно попадания в организм человека всего лишь 0,5 мг токсина, чтобы он погиб. Для сравнения: знаменитый цианистый калий приблизительно в 100 раз менее ядовит. Тетродотоксин действует с наружной стороны натриевого канала, блокируя вход в него натрия. В результате генерация ПД становится невозможной, что приводит к расслаблению мускулатуры и параличу дыхания.
Еще более страшный яд содержится в коже внешне совершенно безобидных лягушек из рода листолазов, живущих в Южной Америке. Этот яд, называемый батрахотоксином, ядовитее цианистого калия в 500 раз! Одна маленькая лягушка носит в коже столько яда, что им можно погубить до 350 человек. Батрахотоксин блокирует натриевый канал в момент его открытия, не давая створкам захлопнуться, после чего он не может закрыться, и натрий, поступая в клетку без ограничений, приводит к ее перевозбуждению. В результате, как правило, первыми нс выдерживают клетки сердечной мышцы, и сердце перестает биться.
Похожим эффектом обладают яды скорпионов, поддерживающие натриевые каналы в открытом положении. Блокаторы натриевых каналов вырабатывают и водоросли (сак- ситоксин), и высшие растения (аконитин).
Еще одна группа веществ, оказывающих свой лечебный эффект через воздействие на натриевые каналы, — местные анестетики (новокаин, лидокаин, прокаин и многие другие). Молекулы этих веществ проникают в канал изнутри клетки, снижая натриевые токи и блокируя проведение электрических сигналов но тонким безмякотным нервным волокнам. Как раз по таким волокнам передастся в мозг информация о болевых воздействиях. Таким образом, местные анестетики на время блокируют болевые ощущения.
В настоящее время известно множество типов Na + - и К + -каналов, характерных для тех или иных клеток организма. Эти каналы отличаются друг от друга условиями, в которых они открываются и закрываются, пропускной способностью, скоростью открывания и закрывания и т.п. Кроме того, найдены каналы для С1
Значительную роль во всех возбудимых тканях играют кальциевые токи, идущие по градиенту концентрации в клетку. Существуют специфические потенциалзависимые каналы, через которые Са 2+ входит в клетку, выполняя при этом две функции: как положительно заряженный ион - деполяризует мембрану и как мощный внутриклеточный регуляторный фактор — меняет работу всех систем клетки.
Очень важны кальциевые токи в процессах возбуждения мышц и передачи информации от клетки к клетке. В эволюции каналы для кальция, по-видимому, возникли очень рано и Са 2+ -ток через мембрану древнее Ка + -тока. Каналы для кальция открываются относительно медленно, плотность их на мембране меньше, чем каналов для Na + , но зато Са 2+ -каналы не закрываются до конца, обеспечивая постоянный слабый вход этого иона в клетку. Блокаторами кальциевого тока через каналы являются многие двухвалентные ионы: кадмий, кобальт, марганец и др.
В заключение этого параграфа еще раз сравним работу ионных каналов и ионных насосов (Ыа + /К + -АТФ-аза). Задача обеих систем — транспорт ионов через мембрану возбудимой клетки, но на этом их сходство и заканчивается.
Сравнение пассивного (каналы) и активного (насосы) транспорта Na + и К + через клеточную мембрану
Белки, открывая проход от одной поверхности клеточной мембраны к другой, способствуют правильной зарядке клетки
В медицинских новостях то и дело появляется информация о том, что учёные нашли очередной способ воздействия на ионные каналы — то они пытаются их активировать, то, наоборот, спешат блокировать. Например, совсем недавно были опубликовано сообщение об исследованиях профессора Тель-Авивского университета ( Tel Aviv University ) Майкла Гуревитца (Michael Gurevitz), который разрабатывает новое болеутоляющее на основе компонентов яда израильского жёлтого скорпиона — одного из самых опасных скорпионов в мире. Предполагается, что этот препарат будет воздействовать на натриевые каналы, которые отвечают за восприятие боли, и станет эффективным обезболевающим нового поколения. Об ионных каналах вспоминают, и когда речь заходит об онкологических заболеваниях, сердечно-сосудистых отклонениях и даже вредных пристрастиях. Так что же это за каналы и почему их работа так важна?
Живая клетка — это не статичное образование, в ней постоянно происходит обмен веществ, ведь взаимодействие клеток друг с другом и внешней средой — необходимое условие для поддержания жизни организма. Обмен этот происходит через мембрану (оболочку) клеток, через которую при необходимости должны проникать многие элементы: ионы, аминокислоты, нуклеотиды.
Для проведения потока ионов через свою пору ионные каналы используют разность потенциалов. Так как возникающий при движении ионов ток можно измерить — причём даже для одиночного канала, за поведением мембранных ионных каналов легко наблюдать. Каналы спонтанно и часто открываются и закрываются. И эти переходы из одной формы в другую можно изучать методами рентгеновской дифракции , мёссбауэровской спектроскопии и ядерно-магнитного резонанса . Благодаря этим исследованиям стало ясно, что эти каналы — высокоорганизованные струтуры, не просто трубка с водой, а лабиринт быстро двигающихся электрически нейтральных и заряженных молекулярных групп.
Существуют десятки разновидностей ионных каналов. Самую большую группу составляют калиевые каналы, в которую входит около сорока видов. И каждая разновидность уникальна по своим структурным характеристикам и выполняемым функциям. Например, калиевые каналы большой проводимости (через них проходит бóльшее количество ионов калия, чем по другим каналам) состоят из круных фрагментов белка, субъединиц, свернутых в α-спираль. Их дополняют относительно короткие фрагменты, которые кроме первичной спиральной обладают также вторичной β-структурой. Они, в свою очередь, подразделяются на β-1, β-2, β-3 или β-4, каждая из которых придаёт каналу уникальные свойства. Например, β-4 делает канал устойчивым к блокатору ибериотоксину. Если же блокада канала осуществлена удачно, ток через канал проходить не будет.
Блокирование этих важных каналов приводит к серьёзнейшим изменениям в организме. И нет ничего удивительного в том, что ионные каналы стали основной мишенью для разработки новых ядов и химического оружия. Так, один из мощнейших нервнопаралитических ядов, известных человечеству, тетродотоксин, блокирует натриевые каналы. Благодаря большим размерам молекулы тетродотоксин буквально закупоривает пору натриевого канала, так что прохождение ионов натрия через неё становится невозможным, и нервный импульс не передаётся от клетки к клетке. Мышцы замирают — ведь они подчиняются сигналам нервной системы. Токсины сходного действия, например конотоксин, находятся в арсенале змей и морских моллюсков и помогают им парализовать жертву.
В медицине сегодняшнего дня целый ряд заболеваний объясняют нарушением в работе ионных каналов. Хотя они имеют совершенно разные пути лечения, общность их причин позволило выделить их в отдельную группу. Они включают как приобретенные, так и наследственные недуги.
Например, с нарушением функции целой группы ионных каналов, включая натриевые и калиевые, связывают развитие синдрома хронической усталости. Из наследственных заболеваний, вызванных нарушением функционирования ионных каналов, можно упомянуть эпилепсию, которая вызвана сбоями в работе калиевых каналов большой проводимости. Под руководством профессора Ричарда Алдрича ( Richard Aldrich ) из Техасского университета в Сан-Антонио ( University of Texas at San Antonio ) удалось доказать, ставя опыты на трансгенных мышах, у которых был заблокирован ген KCNMB4, что при недостаточном количестве бета4 субъединиц калиевый канал неадекватно отвечает на нервное возбуждение, что приводит к конвульсиям.
С недостаточной функцией β-1 субъединицы канала связывают развитие гипертонии. Если по какой-то причине аминокислотный состав белка β-1 субъединицы не соответствует норме, то канал с такой субъединицей не в состоянии поддерживать расширение стенкок сосудов , из-за чего возникает напряжение артерий и развивается гипертония. Об этом свидетельствуют, например, исследования Ральфа Кёлера ( Ralf Köhler ) из Университета Южной Дании ( Syddansk Universitet ).
Ещё одно широко распространённое сердечно-сосудистое заболевание — синдром удлинённого QT связывают с мутациями в генах, кодирующих калиевые каналы сердечной мышцы, которое приводит к усилению активности калиевых каналов и меняет нормальный поток калия в сердечной мышце.
Нарушения функций кальциевых каналов приводят к атаксиям — состояниям, при которых невозможна координация движений.
Наконец, муковисцидоз (или фиброзно-кистозная дегенерация) — тяжелейшее заболевание дыхательной системы и желудочно-кишечного тракта наряду с другими причинами связывают с мутациями в CFTR гене, кодирующем хлорный канал.
Так что нормальное функционирование ионных каналов любого типа исключительно важно для здоровья человека.
Активаторы калиевых каналов (икорандил, миноксидил, диазоксид, пинацидил) тоже вызывают расширение коронарных сосудов и сосудов в периферических органах. Воздействовать на калиевые каналы пытаются и для остановки инсультов, вызванных спазмом сосудов головного мозга.
Популярные в хирургической практике местные анестетики — лидокаин и новокаин блокируют ощущение боли путём закупорки натриевых каналов. Правда, побочный эффект этих препаратов состоит в том, что они приводят к потере не только болевой, но и тактильной чувствительности.
Однако удалось установить, что на помощь в такой ситуации могут прийти другие ионные каналы — так называемые TRP ( Transient receptor potential ). Это семейство каналов насчитывает множество видов, которые характеризуются слабой селективностью и пропускают большинство положительно заряженных ионов, включая натрий, кальций и магний.
Особая группа TRP каналов, которая расположена в нервных клетках, реагирующих на боль, чувствительна к присутствию активного компонента перца чили — капсаицину. Если активировать TRP каналы капсаицином, то последующее введение лидокаина будет избирательно блокировать только эти TRP каналы, то есть каналы, расположеные исключительно в болевых нейронах. Таким образом, можно будет избавиться от побочного действия обезболевающего.
Относительная простота тестирования работы ионных каналов и многообещающие результаты делают их привлекательной мишенью для фармацевтической индустрии. К тому же, многие ныне существующие препараты со временем теряют свою эффективность: организм привыкает к ним и реагирует не так, как задумывали создатели. Учёным приходится постоянно искать пути устранения различных сбоев, а ионные каналы — это, можно сказать, основа жизни. И сегодня манипуляции ими, с одной стороны, привлекают многомиллиардные инвестиции, а с другой — дают определённую надежду страдающим самыми разными недугами.
- 3647
- 2,3
- 1
- 7
![]()
Олег Жуков
![]()
Анна Петренко![]()
Андрей Панов




Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
10 имп./с) и быстрые (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Потенциал действия
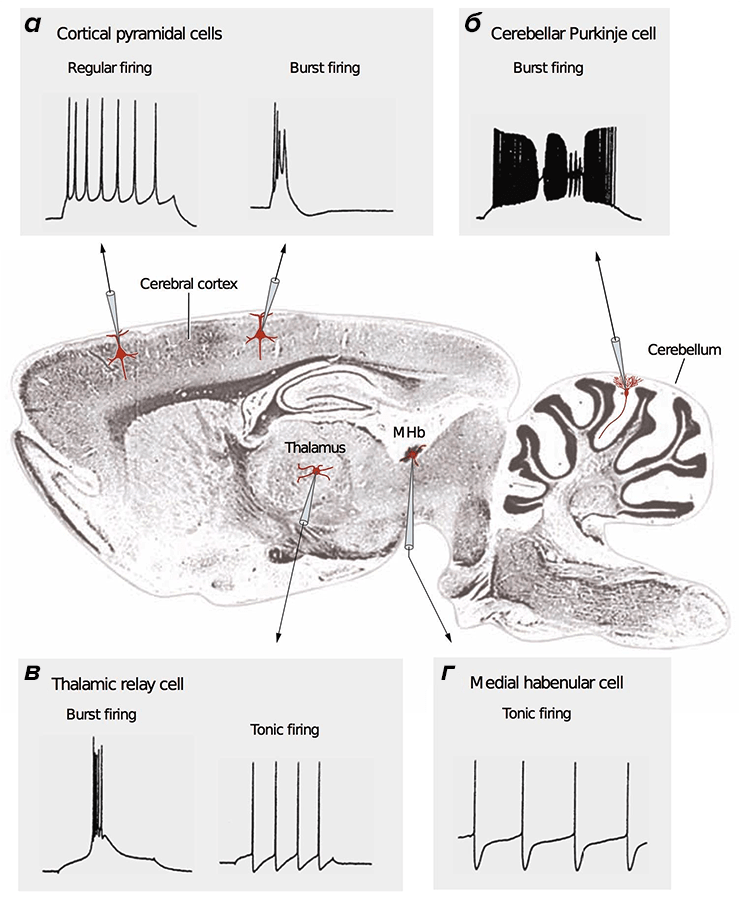
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
- Мембрана и ионы. Плазматическая мембрана нейрона поддерживает неравномерное распределение веществ между клеткой и внеклеточной средой (рис. 3б) [31–33]. В числе этих веществ есть и маленькие ионы, из которых для описания ПД важны К + и Nа + .
Ионов Na + внутри клетки мало, снаружи — много. Из-за этого они постоянно стремятся попасть в клетку. Напротив, ионов К + много внутри клетки, и они норовят из нее выйти. Самостоятельно ионы этого сделать не могут, потому что мембрана для них непроницаема. Для прохождения ионов через мембрану необходимо открывание специальных белков — ионных каналов мембраны.
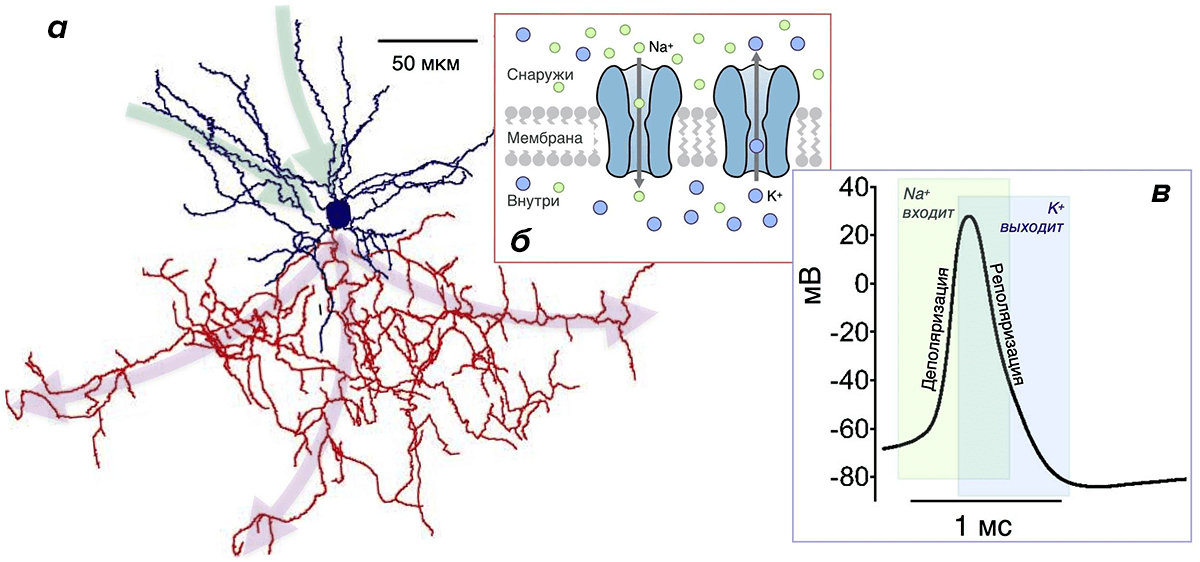
Рисунок 3. Нейрон, ионные каналы и потенциал действия. а — Реконструкция клетки-канделябра коры головного мозга крысы. Синим окрашены дендриты и тело нейрона (синее пятно в центре), красным — аксон (у многих типов нейронов аксон разветвлен намного больше, чем дендриты [8], [11], [35]). Зеленые и малиновые стрелки указывают направление потока информации: дендриты и тело нейрона принимают ее, аксон — отправляет ее к другим нейронам. б — Мембрана нейрона, как и любой другой клетки, содержит ионные каналы. Зеленые кружки — ионы Na + , синие — ионы К + . в — Изменение мембранного потенциала при генерации потенциала действия (ПД) нейроном Пуркинье. Зеленая область: Na-каналы открыты, в нейрон входят ионы Na + , происходит деполяризация. Синяя область: открыты К-каналы, К + выходит, происходит реполяризация. Перекрывание зеленой и синей областей соответствует периоду, когда происходит одновременный вход Na + и выход К + .
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
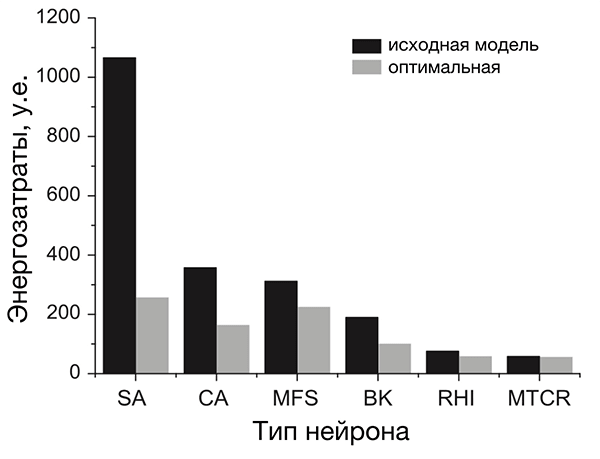
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Читайте также:





