Миоклонус при болезни паркинсона
Что такое миоклония?
Миоклония (или миоклонус) — это симптом, а не заболевание, характеризующаяся кратковременным быстрым сокращениям мышц или группы мышц.
Миоклонические подёргивания или толчки обычно вызываются внезапными сокращениями мышц, называемыми положительным миоклонусом, или мышечным расслаблением, называемым отрицательным миоклонусом. Миоклонические подёргивания могут происходить поодиночке или последовательно, по шаблону или без шаблона. Они могут происходить нечасто или многократно каждую минуту. Миоклония иногда возникает в ответ на внешнее событие или когда человек пытается сделать движение. Человек, испытывающий подёргивания, не может контролировать их.
В своей простейшей форме миоклония состоит из подергивания мышц с последующим расслаблением. В пример можно привести икоту, что тоже является миоклонией. Другими знакомыми примерами состояния являются подергивания, которые некоторые люди испытывают во время засыпания. Эти простые формы миоклонии встречаются у нормальных, здоровых людей и не вызывают затруднений. При более широком распространении состояние может вызывать постоянные шокоподобные сокращения в группе мышц.
В некоторых случаях миоклония начинается в одной области тела и распространяется в мышцы в других областях. Более тяжелые случаи состояния могут исказить движение и серьезно ограничить способность человека есть, говорить или ходить. Эти типы миоклонии могут указывать на основное заболевание мозга или нервов.
Диагноз устанавливают на основании признаков и иногда подтверждают результатами электромиографического исследования. Лечение включает в себя коррекцию обратимых заболеваний головного мозга или нервной системы и симптоматическую терапию лекарственными препаратами.
Причины миоклонии
Миоклонус может развиться в ответ на:
- инфекцию;
- травму головного или спинного мозга;
- инсульт;
- опухоли головного мозга;
- почечную недостаточность;
- печеночную недостаточность;
- болезни накопления липидов;
- химическое или лекарственное отравление;
- и другие нарушения.
Длительное лишение мозга кислорода, называемая гипоксией, может привести к постгипоксической миоклонии. Состояние может возникать и сам по себе, но чаще всего это один из нескольких симптомов, связанных с различными расстройствами нервной системы. Например, миоклонический подергивание может развиться у пациентов с:
Миоклонические толчки также часта наблюдаются у людей с эпилепсией, расстройством, при котором электрическая активность в мозге становится беспорядочной, что приводит к судорогам.
Типы миоклонии
Классифицировать множество различных форм миоклонуса сложно, потому что причины, последствия и реакции на терапию сильно различаются. Ниже перечислены наиболее часто описываемые типы.
Симптомы миоклонии

Миоклония может быть слабой или тяжелой. Мышцы могут сокращаться быстро или медленно, ритмично и неритмично. Миоклонические подергивания могут быть редкими или частыми. Они могут наступать спонтанно или под действием внезапного шума, света или движения. Например, их можно спровоцировать, потянувшись за каким-нибудь предметом или делая шаг. При болезни Крейтцфельдта–Якоба (редкое дегенеративное заболевание головного мозга) миоклония усиливается при внезапном испуге.
Миоклония, развившаяся в результате нарушения метаболизма, может быть длительной и затрагивать разные группы мышц, иногда приводя к судорогам.
Диагностика
Диагноз ставиться на основании признаков, осмотра врача, анализов крови, магнитно-резонансная томография и электромиографического исследования.
- Обычно выполняются анализы крови для определения уровня сахара, кальция, магния и натрия в крови. Отклонения уровней этих веществ от нормы могут свидетельствовать о том, что причиной является метаболическое расстройство.
- Чтобы обнаружить изменения в головном мозге, характерные, например, для болезни Альцгеймера, проводится магнитно-резонансная томография (МРТ).
- У пациентов с судорожным расстройством для выявления миоклонии может выполняться электроэнцефалография.
Лечение миоклонии
Лечение миоклонии направлено на лекарства, которые могут помочь уменьшить симптомы. Препаратом первого выбора для лечения, особенно определенных видов миоклонии действия, является клоназепам, тип транквилизатора. Дозировки клоназепама обычно увеличивают постепенно, пока больной не почувствует улучшений или не появятся побочные эффекты. Сонливость и потеря координации являются общими побочными эффектами. Благоприятные эффекты клоназепама могут со временем уменьшаться, если у человека разовьется толерантность к препарату.
Многие лекарства, используемые для лечения миоклонии, такие как барбитураты, леветирацетам, фенитоин и примидон, также используются для лечения эпилепсии. Барбитураты замедляют центральную нервную систему и вызывают транквилизирующий или антисейзерный эффект. Фенитоин, леветирацетам и примидон являются эффективными противоэпилептическими препаратами, хотя фенитоин может вызывать печеночную недостаточность или оказывать другие вредные долгосрочные эффекты. Вальпроат натрия является альтернативной терапией миоклонуса и может использоваться как один, так и в сочетании с клоназепамом. Хотя клоназепам и/или вальпроат натрия эффективны для большинства людей с расстройством, у некоторых людей возникают побочные реакции на эти препараты.
Некоторые исследования показали, что дозы 5-гидрокситриптофана (5-HTP), строительного блока серотонина, приводят к улучшению у людей с некоторыми типами миоклонии и ПМЭ. Однако другие исследования показывают, что терапия 5-HTP не эффективна для всех людей, и, фактически, может ухудшить состояние некоторых людей. Эти различия в эффекте 5-HTP на людей с миоклонией еще не объяснены, но они могут предложить важные подсказки к основным отклонениям в рецепторах серотонина.
Сложное происхождение расстройства может потребовать использования нескольких лекарств для эффективного лечения. Хотя некоторые лекарства имеют ограниченный эффект при использовании по отдельности, они могут иметь больший эффект при использовании с лекарствами, которые действуют на различные пути или механизмы в мозге. Комбинируя некоторые из этих препаратов, ученые надеются добиться большего контроля над миоклоническими симптомами. Некоторые лекарства, которые в настоящее время изучаются в различных комбинациях, включают клоназепам, вальпроат натрия, леветирацетам и примидон. Гормональная терапия также может улучшить реакцию на антимиоклонические препараты у некоторых людей.
Профилактика
Защитите себя от травмы головного мозга, надев шлем или головной убор во время таких действий, как езда на велосипеде или мотоцикле.
Обратитесь к врачу, если у вас начались судороги после начала приема нового лекарства, чтобы можно было внести изменения.
Прогноз
Простые формы миоклонии встречаются у нормальных, здоровых людей и не вызывают серьезных проблем. В некоторых случаях расстройство начинается в одной области тела и распространяется в мышцы в других областях. Более тяжелые случаи миоклонии могут исказить движение и серьезно ограничить способность человека есть, говорить или ходить. Эти типы миоклонии могут указывать на заболевание головного мозга или нервов.
Хотя клоназепам и вальпроат натрия эффективны для лечения большинства случаев расстройства, у некоторых людей на эти препараты возникают побочные реакции. Кроме того, преимущества клоназепама может уменьшаться при длительном приеме.
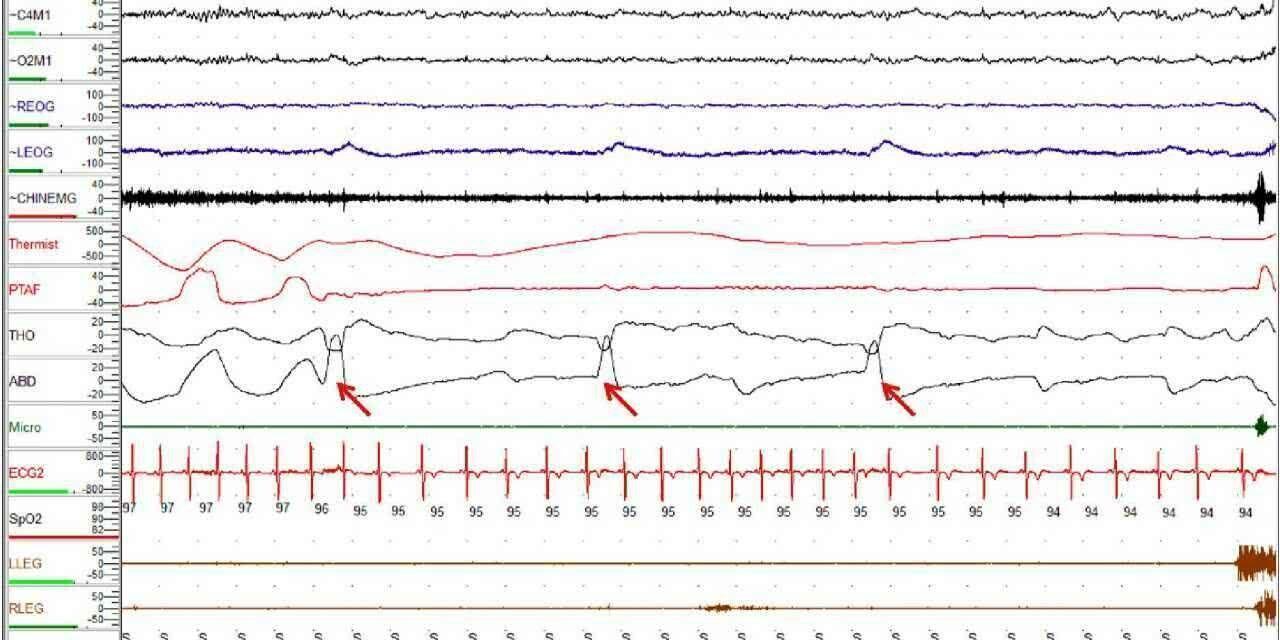
Для данного расстройства сна характерно появление одного или нескольких мышечных сокращений во время сна. Сокращения мышц появляются с различной частотой и периодичностью. Сокращения являются непродолжительными, напоминающими мышечные подергивания (твитчи). Наиболее часто возникают эти движения в следующих мышечных группах:
— Пальцы рук;
— Пальцы ног;
— Мышцы углов рта.
Сокращения не приводят к появлению выраженного движения в мышце. В большинстве случаев движения практически не видны. Движения возникают нерегулярно, на протяжении от одного до нескольких часов в течение ночи. За ночь число таких движений может быть значительным.
Кластеры мышечных подергиваний (твитчей) во время REM-фаза сна возникают у всех людей. В отличие от них, фрагментарный миоклонус возникает во всех стадиях NREM-сна, также как и во время REM-сна. Кроме того, фрагментарный миоклонус не проявляется в виде кластеров.
Фрагментарный миоклонус легко спутать с периодическими движениями конечностей во время сна. Однако периодические движения конечностей во сне имеют большую продолжительность — каждое движение может продолжаться до 5 секунд. Кроме того, для периодических движений конечностей характерен ритмический паттерн появления. Фрагментарный миоклонус является менее регулярным.
Фрагментарный миоклонус может возникнуть как во время сна, так и во время бодрствования. Как правило, Вы можете и не знать о появлении этих мышечных сокращений. Однако, частым осложнением этих движений может стать нарушение непрерывности сна. В результате этого пациент может жаловаться на избыточную дневную сонливость или утомляемость. Могут возникнуть проблемы с памятью и концентрацией внимания.
Кроме того, у этих больных часто отмечаются и другие виды связанных со сном двигательных нарушений или мышечных расстройств.
По мере увеличения возраста пациента выраженность фрагментарного миоклонуса остается относительно постоянной. Это расстройство не связано с нейродегенеративными расстройствами, такими, как болезнь Паркинсона.
У кого возникает это расстройство сна?
Данное расстройство часто встречается у практически здоровых людей. Фрагментарный миоклонус выявляется у 5 — 10% людей, предъявляющих жалобы на избыточную дневную сонливость. Чаще встречается это расстройство у взрослых мужчин. Вероятность появления миоклонуса выше у людей, страдающих от других видов расстройств сна.
Примерами этих расстройств могут быть:
— Апноэ сна;
— Бессонница;
— Нарколепсия;
— Другие двигательные расстройства.
Часто выявляется фрагментарный миоклонус у детей с С-типом болезни Ниемана-Пика.
Как мне узнать, не страдаю ли я от этого расстройства сна?
1. У Вас возникают непродолжительные, напоминающие подергивания сокращения мышц пальцев рук, ног или угла рта во время сна или бодрствования?
2. Эти движения возникают с непостоянной периодичностью?
3. Исследование сна показало наличие 5 или более мышечных сокращений в минуту на протяжении 20 или более минут во время любой из стадий сна?
Кроме того, важно установить, нет ли каких то других причин, способных вызвать у Вас эти проблемы. Указанные нарушения могут быть следствием любой из указанных ниже причин, таких как:
— Другое расстройство сна;
— Заболевание внутренних органов и нервной системы;
— Применение лекарственных препаратов;
— Психическое расстройство;
— Злоупотребление алкоголем, наркотиками и пр.
Скорее всего, Вы можете и не знать о наличии этих мышечных сокращений. Дневные симптомы могут иметь место, а могут и отсутствовать. Поэтому Вам может быть сложно ответить на вопрос о том, страдаете ли Вы от этого расстройства.
Нужно ли мне обращаться к специалисту в области расстройств сна?
Врач-сомнолог — это специалист, который в наибольшей степени подготовлен для того, чтобы помочь Вас с решением этой проблемы. В первую очередь врач постарается исключить какие-либо другие причины мышечных подергиваний во сне.
Что нужно будет знать врачу?
Специалист в области расстройств сна спросит Вас о том, когда начались проявления этого расстройства и с какой периодичностью они возникают. Вы также должны будете сказать врачу о том, что по Вашему мнению, вызывает эти мышечные подергивания.
Врачу нужна будет полная информация о состоянии Вашего здоровья и перенесенных заболеваниях. Обязательно сообщите врачу о том, принимали ли Вы ранее и принимаете ли сейчас какие-либо лекарства. Также сообщите врачу, не страдали ли Вы или члены Вашей семьи когда-либо от какого-нибудь расстройства сна.
Нужно ли будет мне проходить какие-либо исследования?
Для уточнения природы данного расстройства сна может потребоваться проведения инструментального исследования сна. Это исследование называется полисомнографией. Для проведения исследования пациент должен провести ночь в лаборатории сна. Исследование включает в себя регистрацию мозговых волн, работы сердца и дыхания во время сна. Кроме того, записываются движения ног и рук во время сна.
Результаты исследования позволяют подтвердить или исключить другие виды расстройств сна, которые могли бы быть причиной этих движений. Различные виды расстройств могут потребовать различных подходов к лечению. Важной задачей является исключение судорожной активности, а также нормальных физиологических мышечных подергиваний (твитчей).
Как лечится это расстройство сна?
Клоназепам (Klonopin®) часто используется для лечения фрагментарного миоклонуса. Также могут применяться некоторые противосудорожные препараты.
Миоклонии – это непроизвольные движения, быстрые отрывистые сокращения отдельных мышц или их групп. Обычно вовлекается мускулатура конечностей, туловища или лица без потери сознания. Миоклонии бывают физиологическими или патологическими, развитие которых связывают с эпилепсией, дегенеративными и инфекционными заболеваниями, метаболически-гипоксическими нарушениями. Диагностика проводится клиническими, лабораторными и инструментальными методами (МРТ, ЭЭГ). Лечение предполагает устранение обратимых состояний и поддерживающую терапию.
- Причины миоклонии
- Физиологические процессы
Причины миоклонии
Иногда мышечные подергивания считаются вариантом нормы. Физиологические миоклонии чаще всего наблюдаются при засыпании и в ранней фазе сна (гипнагогические), особенно после физического или эмоционального переутомления. В зависимости от степени вовлечения мускулатуры они бывают фокальными, мультифокальными, генерализованными. У детей до полугода такие движения могут возникнуть при кормлении или во время игры.
Быстрые и короткие сокращения мышц провоцируются внезапными раздражителями – световыми, звуковыми, двигательными. В сочетании с вегетативными изменениями (потливостью, учащенным сердцебиением, одышкой) они напоминают реакцию испуга. Другой распространенной ситуацией является диафрагмальная миоклония или икота, возникающая при раздражении блуждающего нерва от заглатывания воздуха или быстрой еды.
Миоклонические приступы входят в клиническую картину различных форм эпилепсии. При этом выделяют несколько путей их развития с учетом локализации первичного очага возбуждения в ЦНС – кортикальный, таламокортикальный, с неизвестным механизмом. Патологическая импульсация из коры моторных зон головного мозга характерна для следующих миоклоний:
- Кортикальные рефлекторные: прогрессирующие миоклонус-эпилепсии, миоклония век с абсансами.
- Кортикальные с ритмичными быстрыми вспышками:синдром Ангельмана, непрогрессирующие энцефалопатии (при туберозном склерозе, синдроме Дауна), семейная миоклоническая эпилепсия.
- Вторично генерализованные:синдром Драве и Леннокса-Гасто.
Для большинства прогрессирующих миоклонус-эпилепсий характерно аутосомно-рецессивное наследование. Это обширная группа заболеваний, в которую входят болезни накопления (Гоше, нейрональный липофусциноз, GM2-ганглиозидоз), болезнь Лафоры, Унферрихта-Лундборга. Также к ним относят сиалидоз и дентарубро-паллидольюисову атрофию.
Клиническая картина миоклонус-эпилепсий разнообразна. Наряду с быстрыми спонтанными подергиваниями в дистальных отделах конечностей наблюдаются парциальные и генерализованные приступы (клонические, тонико-клонические), абсансы. Выраженная кортикальная миоклония сопровождается мозжечковыми расстройствами, может привести к обездвиживанию пациента.
Доброкачественная миоклония младенческого возраста – это такое состояние, единственным симптомом которого становятся подергивания в плечевом поясе, идущие изолированно или сериями. Подобные пароксизмы могут сопровождаться одновременным снижением тонуса мышц шеи, что описывается как быстрый кивок головой. Некоторые из этих приступов провоцируются прикосновением.
Миоклонические приступы встречаются при дегенеративном поражении подкорковых структур ЦНС, отвечающих за регуляцию непроизвольных движений. Их описывают как непостоянный признак у лиц, страдающих деменцией с тельцами Леви (ДТЛ), хореей Гентингтона, прогрессирующим надъядерным параличом. Схожие проявления наблюдают при болезни Паркинсона, Альцгеймера, мозжечковой миоклонической диссинергии Ханта.
Миоклонии при ДТЛ – довольно частая форма двигательных нарушений. Для заболевания характерны симптомы паркинсонизма в виде тремора пальцев, замедленности движений и постуральной неустойчивости. Отмечаются прогрессирующие когнитивные нарушения, рано развиваются зрительно-пространственные, вегетативные, нейропсихиатрические расстройства (галлюцинации, делирий, депрессия).
Распространенные миоклонии возникают на фоне гипоксического повреждения головного мозга. Причиной могут быть остановка сердца, коматозные состояния, отравление угарным газом. После глубокой гипоксии из-за тяжелого приступа удушья, асфиксии или инфаркта миокарда наблюдаются кинетические миоклонусы, описанные как синдром Ланса-Адамса. В его развитии предполагается роль корковой и стволовой дисрегуляции моторных функций.
Для гипоксического поражения мозга характерны интенционные миоклонии – нерегулярные подергивания мышц, которые усиливаются при достижении цели (на фоне выполнения пальценосовой или пальцемолоточковой пробы). Они наблюдаются только в конечности, совершающей быстрое движение. При медленных действиях патологические сокращения обычно отсутствуют.
![]()
Развитие миоклоний связывают с нейроинфекциями вирусной природы: летаргическим, герпетическим, клещевым энцефалитом. В последнем случае отмечают фокальную эпилепсию Кожевникова. Она проявляется типичным миоклонусом, сочетающимся с фокальными или вторично генерализованными судорожными приступами, очаговыми неврологическими симптомами (центральным гемипарезом), расстройствами психики.
Кортикальные миоклонии при кожевниковской эпилепсии затрагивают строго определенные мышечные группы. Они постоянны и не исчезают во сне, характеризуются ритмичностью и стереотипностью, усиливаются при волнении и целенаправленных движениях. Обычно такие подергивания развиваются только в одной руке, реже вовлекается половина лица на той же стороне.
Еще одна причина пароксизмов – подострый склерозирующий панэнцефалит. Болезнь проявляется подергиваниями конечностей, головы и туловища, резкими сгибательными движениями по типу кивков, множественными дискинезиями. Далее присоединяются смешанные судороги, парезы и параличи. На поздних стадиях возникает децеребрационная ригидность, нарушения глотания и дыхания, слепота.
Частой причиной миоклонии становятся дисметаболические состояния. Они обусловлены нарушением биохимических и энергетических процессов в моноаминергических нейронах базальных ядер и мозговой коры. Генерализованные миоклонии мышц описаны при уремии, печеночной недостаточности, электролитных нарушениях (гипокальциемии, гипонатриемии, гипомагниемии). Мышечными подергиваниями проявляются гипогликемия и некетонемическая гипергликемия.
Прямое нейротоксическое действие химических веществ обусловлено нарушением образования и проведения импульса, модификацией пластического и энергетического обменов. Опосредованное влияние реализуется через дисфункцию внутренних органов, отвечающих за экскрецию и детоксикацию. Как проявление острой интоксикации миоклонии возникают при отравлениях тяжелыми металлами (включая висмут), ДДТ, бромистым метилом.
Ятрогенные миоклонии мышц обусловлены передозировкой медикаментов. Сочетание с экстрапирамидными и мозжечковыми симптомами типично для приема препаратов лития, нейролептиков, трициклических антидепрессантов. Причиной подергиваний бывают бензодиазепины, антигистаминные средства, антиконвульсанты. Сходные эффекты описаны для пенициллина и цефалоспоринов.
Диагностика
Мышечные сокращения выявляются на основании клинического обследования с неврологическим осмотром. Подтвердить причину миоклоний врачу-неврологу помогают результаты дополнительных исследований. Учитывая этиологическое разнообразие патологии, сопровождающейся такими приступами, в схемах диагностики могут присутствовать различные процедуры:
- Лабораторные анализы. В биохимическом анализе крови обращают внимание на электролиты, почечные и печеночные пробы, острофазовые белки. Серологическая диагностика дает возможность выявить антитела к инфекциям, а исследование ликвора – установить характер энцефалитических реакций.
- Томографические методы. При подозрении на органическую патологию ЦНС используют современные средства нейровизуализации. Наиболее информативной для оценки состояния мозгового вещества и оболочек становится МРТ. По интенсивности сигнала и размерам очагов можно предположить их происхождение.
- Электроэнцефалография. Ключевой метод выявления эпилептической активности – ЭЭГ. Позволяет определить фокальные или генерализованные разряды (пики, спайк-волны) с анализом их частоты и локализации. Исследование дополняется провокационными пробами – фотостимуляцией, гипервентиляцией.
![]()
Лечение
Терапия проводится преимущественно консервативными методами, объем и характер медицинской помощи определяются конкретной ситуацией. Доброкачественные миоклонии не требуют лечения, в тяжелых случаях необходима активная комплексная коррекция. Основу лечения составляют медикаменты, действие которых реализуется по нескольким направлениям:
- Этиотропное. При вирусных инфекциях могут назначать интерфероны, изопринозин, ламивудин. Улучшение при клещевом энцефалите достигается после терапии специфическими иммуноглобулинами.
- Патогенетическое. Большое значение имеет коррекция нарушенного метаболизма и мозговой гипоксии. Для этого используют электролиты, глюкозу, антигипоксанты. Детоксикация предполагает инфузионную поддержку, применение сорбентов, антидотов.
- Симптоматическое. Ключевой компонент терапии – антиконвульсанты. Наиболее эффективны клоназепам, вальпроаты, леветирацетам. Некоторые миоклонии хорошо отвечают на 5-гидрокситриптофан с карбидопой, высокие дозы пирацетама.
При неэффективности противосудорожных средств рассматривается вопрос о назначении кетогенной диеты. Для устранения уремии или выраженной химической интоксикации показаны экстракорпоральные методы – гемодиализ, плазмаферез, гемосорбция. Реабилитация пациентов с энцефалопатиями предполагает гипербарическую оксигенацию, церебральную гипотермию, рефлексотерапию.
Для лечения кортикальных миоклоний, резистентных к медикаментам, предлагают нейрохирургическое вмешательство в объеме функциональной гемисферэктомии. Некоторые фокальные приступы нуждаются в радикальном устранении грубых органических причин – опухоли или ангиомы. При болезни Унферрихта-Лундборга и синдроме Леннокса-Гасто рекомендуют стимуляцию блуждающего нерва.
Весь процесс лечения болезни Паркинсона (БП) можно разделить на два этапа: начальный, когда отмечается улучшение в состоянии больных и терапия, как правило, не сопровождается серьезными осложнениями, и более поздний, характеризующийся появлением новых симптомов и ятрогенных — связанных с лечением осложнений. Большинство больных, получающих специфическую антипаркинсоническую терапию, находятся на втором этапе лечения.
В соответствии со сказанным и побочные эффекты лечения БП ДОФА и его производными (ДОФА-содержащими) препаратами принято разделять на ранние и поздние. Ранние побочные явления (снижение аппетита, тошнота, рвота, диспепсические расстройства, ортостатическая гипотензия и др.) обычно возникают в первые дни и недели лечения дофаминомиметиками. Поздние побочные эффекты проявляются спустя 2—9 лет от начала терапии этими препаратами. Адаптация больного к ранним побочным эффектам в большинстве случаев достигается снижением дозы препарата без назначения дополнительных лекарственных средств. Поздние побочные явления труднее поддаются коррекции и требуют дифференцированного терапевтического подхода.
Снижение порога развития некоторых побочных эффектов выражается в том, что при длительном лечении возникает тенденция к появлению оральных гиперкинезов при все меньшей дозе препарата. Снижение дозы леводопы приводит лишь к временному устранению гиперкинеза. Спустя какое-то время оральный гиперкинез появляется вновь и при меньшей дозе. Если же необходимо повышение дозы, эта локальная дискинезия может превратиться в генерализованный хореический гиперкинез.
Снижение эффективности терапии проявляется постепенным уменьшением продолжительности клинического эффекта отдельной дозы леводопы, что заставляет больного сокращать интервалы между приемами лекарства и в конце концов повышать его суточную дозу.
В последнее время все большее внимание в мире в плане преодоления проблемы осложнений поздних стадий терапии БП уделяется агонистам дофаминовых (ДА) рецепторов. Среди них активно применяются бромокриптин (парлодел), перголид (пермакс), пирибедил (проноран), прамипексол (мирапекс), ропинирол (реквип), допергин (лисенил, лизурид), апоморфин, каберголин и др. Все они являются агонистами Д2-рецепторов (в отношении Д1-рецепторов они ведут себя по-разному). Применение апоморфина ограничивается его нефротоксическими свойствами. Меньше побочных эффектов дают неэрголиновые производные, например проноран. Тошнота, рвота, ортостатические головокружения, которые могут возникать в начале применения агонистов ДА-рецепторов, устраняются назначением домперидона (мотилиума).
Агонисты ДА-рецепторов в разной степени воздействуют на все основные симптомы БП: тремор, ригидность, брадикинезию. Кроме того, им приписывают антиоксидантный эффект. Крайне важно, что от препаратов леводопы агонисты ДА-рецепторов отличаются меньшей способностью индуцировать дискинезии. Это их свойство активно используется в последнее время как для уменьшения выраженности осложнений терапии БП в ее поздних стадиях, так и с целью их профилактики. Кроме того, агонисты ДА-рецепторов хорошо сочетаются с используемыми препаратами других классов для лечения БП. Согласно последним данным, они оказывают также нейропротективное действие.
При длительной терапии БП пациент, как правило, постепенно расширяет арсенал используемых лечебных средств, добавляя в схему лечения другие препараты, что всегда необходимо учитывать при коррекции тех или иных побочных эффектов. Серьезными и труднокурабельными осложнениями специфической терапии паркинсонизма иногда становятся ортостатическая гипотензия и психические расстройства на фоне комплексной терапии.
Поскольку ортостатическую гипотензию способны вызывать все ДОФА-содержащие препараты и агонисты ДА-рецепторов, прежде всего в таких случаях необходимо выяснить, какое именно лекарственное средство вызывает ортостатическую гипотензию у больного.
Психические нарушения при БП могут проявиться выраженной тревогой, ажитацией, галлюцинациями (чаще зрительными), спутанностью, а также бредом и другими психотическими расстройствами. Большинство грубых психических нарушений (кроме деменции) при БП, как правило, индуцированы лекарствами.
Антипаркинсонические препараты всех типов способны вызывать психические нарушения, особенно это характерно для дофаминомиметиков и холинолитиков. Дело в том, что дофаминомиметики усиливают дофаминергическую трансмиссию не только в нигростриарной системе, но и во всем мозге, в том числе в лимбических структурах. Избыточная стимуляция ДА-рецепторов в лимбической системе (особенно при их гиперчувствительности) способна спровоцировать психотические расстройства. Первым признаком такой дофаминергической гиперстимуляции становится тревожный аффект, который в той или иной степени наблюдается практически у всех больных, длительно принимающих дофаминомиметики. Выразительный тревожно-напряженный взгляд, несмотря на гипомимию, легко выдает их состояние. В дальнейшем у отдельных больных появляются зрительные галлюцинации, которые в типичных случаях сначала возникают по ночам, точнее, во время спонтанных ночных пробуждений. При этом зрительные галлюцинации начинают беспокоить больного только в момент перехода от сна к бодрствованию и потому бывают весьма кратковременными.
Каждый здоровый человек просыпается несколько раз за ночь. Эти короткие пробуждения часто не фиксируются в памяти, так как человек быстро засыпает. При БП во время таких пробуждений могут возникать зрительные галлюцинации (незнакомые люди, животные и т.п.), что обычно пугает больного и заставляет окончательно проснуться, при этом галлюцинации исчезают. Такие расстройства имеют и определенное прогностическое значение: при их появлении увеличивается вероятность развития психотических эпизодов в состоянии бодрствования.
Не менее типично для этих пациентов учащение ярких, запоминающихся сновидений. Наблюдаются фрагментация сна, частые сноговорения, нередко дневная сонливость и другие нарушения цикла бодрствование — сон. Все указанные нарушения имеют тенденцию со временем нарастать. Рано или поздно к ним присоединяются психические нарушения в состоянии бодрствования, что является неблагоприятным прогностическим признаком, особенно если им сопутствует появление симптомов деменции. Такие больные вообще плохо поддаются какому бы то ни было лечению. Выраженные и постоянные психические нарушения отражают, по-видимому, распространение атрофически-дегенеративного процесса в мозге, т.е. ту стадию заболевания, когда потенциальные возможности терапии становятся весьма ограниченными.
Терапия психических расстройств требует участия и психиатра, и невролога. К сожалению, психиатры часто подходят к лечению этих расстройств точно так же, как и к любым другим психическим нарушениям, и назначают антипсихотические препараты (нейролептики), не задумываясь о последствиях. Основной механизм действия нейролептиков состоит в блокаде ДА-рецепторов в мозге, а эти рецепторы обладают определенной спецификой в разных отделах мозга. Классические нейролептики, не имеющиея такой специфики, блокируют ДА-рецепторы в разных отделах мозга.
Особого внимания заслуживает вопрос о применении холинолитиков при БП. В нигростриарном комплексе при этом заболевании действительно имеет место холинергическая гиперактивность, что оправдывает применение холинолитиков (циклодол, акинетон, бензтропин, проциклидин и др.). В то же время в других областях мозга, в частности в лобной коре и гиппокампе, происходит гибель холинергических нейронов со вторичным увеличением плотности холинергических рецепторов. Холинолитики, блокирующие холинергические рецепторы, всегда усугубляют дефицит холинергических влияний в указанных мозговых системах и увеличивают тем самым риск психических, особенно мнестических, расстройств. Наиболее опасны в этом отношении холинолитики у больных с признаками деменции. Применение этих препаратов приемлемо лишь у молодых пациентов и лишь когда они дают реальное (субъективно и объективно заметное) облегчение, что отмечается далеко не у всех больных.
Как уже говорилось, одними из ранних проявлений дискинезии нередко становятся оральные гиперкинезы. Наблюдение за спонтанной двигательной активностью в оральной области служит гарантией своевременного обнаружения первых признаков лекарственной дискинезии. Появление повышенной двигательной активности в виде оральных автоматизмов облизывания, оскаливания, чмоканья и т.п. отражает относительную дофаминергическую избыточность и служит противопоказанием к дальнейшему наращиванию дозы леводопы.
Непроизвольные движения, вызванные леводопой, встречаются у 50—90% больных БП, длительно (более 5 лет) получающих ДОФА-содержащие препараты. Иногда дискинезии причиняют лишь косметическое неудобство больному, но нередко становятся настолько выраженными, что дезадаптируют больного в большей степени, чем проявления паркинсонизма.
Акатизия — неспособность длительно оставаться в покое из-за потребности в постоянном движении. Это состояние сопровождается ощущением беспокойства или тревоги. Данный феномен встречается примерно у каждого четвертого больного идиопатическим паркинсонизмом. Акатизия может предшествовать терапии, но чаще появляется в процессе такого лечения и иногда усиливается в ответ на каждую отдельную дозу леводопы.
Стереотипии представляют редкое осложнение заместительной терапии и двигательным рисунком мало отличаются от стереотипии при психических заболеваниях или вызванных нейролептиками.
Лечебная коррекция флюктуации и дискинезий зависит от их типа. Большинство лекарственных дискинезий возникают на высоте действия препарата, что объясняют избыточной стимуляцией гиперчувствительных ДА-рецепторов. Традиционным направлением преодоления таких флюктуации и дискинезий является снижение дозы леводопы или попытка поддержать стабильный уровень активации ДА-рецепторов в стриатуме. Самым простым приемом является уменьшение разовой дозы леводопы. Чтобы избежать при этом нарастания гипокинезии, необходимо сохранить суточную дозу на прежнем уровне. Таким образом, дробный прием малых доз является одним из простых способов предотвращения флюктуации и дискинезий. Однако нередко такое снижение и дробление дозы леводопы приводит к более короткому и менее предсказуемому эффекту терапии.
Другая лечебная тактика рекомендуется для уменьшения синдромов off-периода. Так как эти побочные эффекты (например, дистония, гипокинезия, боль, императивные позывы на мочеиспускание off-периода, депрессия off-периода и т.д.) появляются в связи со снижением концентрации леводопы в плазме крови, основным принципом их коррекции становятся пролонгирование лечебного эффекта препарата. С этой целью созданы ДОФА-содержащие препараты пролонгированного действия (мадопар HBS, синемет СК). Некоторые типы флюктуации, протекающих с гипокинезией (утренняя гипокинезия, послеобеденная гипокинезия, внезапно наступившая дисфагия и др.) неплохо поддаются коррекции с помощью быстродействующего мадопара (Madopar dispersible). Другой возможностью, все чаще используемой на практике, является добавление к терапии агонистов ДА-рецепторов, которые обладают большей продолжительностью действия по сравнению с препаратами леводопы. При применении всех исследованных агонистов ДА-рецепторов было продемонстрировано увеличение on-периода. Амантадин, селективные ингибиторы МАО также назначаются таким пациентам; в качестве вспомогательных средств можно использовать холинолитики (при дистоническом типе дискинезий), бензодиазепины и другие препараты, применяемые для лечения различных форм дискинезий (в том числе и некоторые нейролептики).
Еще одним новым классом препаратов для лечения БП являются ингибиторы катехол-О-метилтрансферазы (КОМТ) — толкапон и энтакопон. В связи со все еще недостаточным опытом их применения назначают их преимущественно в последующих стадиях прогрессирующей БП. Снижение эффективности терапии после назначения и этого класса препаратов свидетельствует о том, что фармакотерапевтические подходы вообще исчерпали свои потенциальные возможности, и становится обоснованным вопрос о хирургическом лечении заболевания. Используют методы стереотаксической деструкции и электростимуляции (особенно при дрожательных формах) ядер таламуса, бледного шара, субталамического ядра и других структур мозга. Замечено, что лекарственные дискинезии, появившиеся у больных, ранее подвергшихся стереотаксической таламотомии, не распространяются на конечности, контралатеральные оперированному полушарию. В отличие от обычных операций при БП, здесь рекомендуют выбирать в качестве мишени не вентролатеральное, а вентрооральное ядро таламуса. В перспективе возможно и применение трансплантации эмбриональной ткани.
Основная проблема терапии в поздних стадиях БП заключается в том, что даже при соблюдении упомянутых принципов терапии успех лечения далеко не гарантирован. Во многом это связано с тем, что разнообразные проявления БП поздних стадий обусловлены различными — как ятрогенными, так и неятрогенными механизмами. Важно при этом подчеркнуть, что при гемипаркинсонизме (через эту стадию проходит большинство больных) длительное введение дофаминомиметиков снижает чувствительность рецепторов не только в пораженном полушарии, но и в интактном, что неблагоприятно сказывается на клинических проявлениях этого прогрессирующего заболевания.
С другой стороны, появление таких симптомов, как on-off, дискинезии, болезненные спазмы стопы (до лечения леводопой этих симптомов не бывает), имеет совершенно другой генез — относительная избыточность дофамина (гиперчувствительность ДА-рецепторов). При этом симптомы дефицита дофамина и его относительной избыточности могут присутствовать в клинической картине одновременно.
Приступы застывания, пропульсии и падения нередко выходят в клинической картине болезни на первый план и почти не поддаются терапии. Дело в том, что эти симптомы, согласно современным представлениям, находятся не под дофаминергическим контролем (изменение доз дофаминомиметиков не влияет на их выраженность), а под контролем норадренергических механизмов мозга.
Некоторые психические нарушения, особенно деменция, и вегетативные расстройства могут быть связаны в большей степени с продолжающимся прогрессированием заболевания и вовлечением все новых нейрональных систем головного и спинного мозга. Напомним, что патогенез БП связан не только с дефицитом дофамина в мозге. Показано, что в реализации отдельных симптомов БП могут также участвовать серотонинергические, норадренергические, ГАМК-ергические, холинергические и пептидергические биохимические системы, для коррекции которых пока еще мало терапевтических возможностей.
Профилактика осложнений терапии БП становится на сегодняшний день ключевым аспектом лечения этого заболевания. Многие из перечисленных выше труднокурабельных ситуаций легче предотвратить, чем лечить. Этот важный вывод заставил существенно пересмотреть некоторые устаревшие принципы терапии БП. Общим правилом терапии БП стало стремление лечить ее начальные стадии не леводопой, а другими препаратами из класса агонистов дофамина, амантадина, трициклических антидепрессантов, ингибиторов МАО и т.д., а саму леводопу по возможности резервировать до тех пор, пока без нее уже нельзя удовлетворительно поддерживать функциональные возможности больного. По тем же соображениям не рекомендуют форсировать дозу леводопы. Чем меньше кумулятивная доза базового препарата, тем лучше перспективы у больного и тем позже проявляются поздние побочные эффекты. В последнее время в поздних стадиях БП находят применение ДОФА-содержащие препараты нового поколения, основные преимущества которых заключаются в способности уменьшать латентное время on-периода, не снижая его длительности. Ограничение белков в пищевых продуктах усиливает эффект ДОФА-содержащих лекарственных средств. При этом всегда необходимо помнить, что каждое изменение в схеме лечения больного должно осуществляться по возможности с минимальным повышением суточной дозы леводопы. Любое повышение суточной дозы леводопы должно быть мотивировано клиническими данными и допустимо лишь при отсутствии других возможностей оптимизации терапии.
По мнению большинства специалистов, начальные стадии БП предпочтительнее лечить агонистами ДА-рецепторов, список которых постоянно пополняется новыми формами. Назначение агонистов ДА-рецепторов позволяет отсрочить применение леводопы на срок от 6 мес до 3 лет. Таким образом, агонисты ДА-рецепторов (в комбинации с другими современными антипаркинсоническими средствами) становятся наиболее популярными средствами лечения как ранних (монотерапия), так и поздних стадий БП. Более долгий период полураспада этих препаратов в организме, более стабильная фармакодинамика и меньшая зависимость от сохранности дофаминовых терминалей определяют преимущества агонистов ДА-рецепторов. Все они обладают похожим спектром действия на симптомы БП, хотя некоторые из них имеют свои особенности в отношении как побочных эффектов, так и силы влияния на отдельные проявления болезни.
Выбор конкретного препарата и способа его дозирования определяется в первую очередь стадией заболевания и наличием или отсутствием ятрогенных побочных эффектов, характером последних, а также типом новых симптомов, связанных с прогрессированием самого заболевания (деменция, депрессия, постуральные нарушения, дизартрия, периферическая вегетативная недостаточность, нарушения поведения, связанные со сном, и др.).
Стратегические разработки новых терапевтических подходов при БП, без которых сегодня невозможно решить проблему поздних побочных эффектов, нацелены в перспективе на создание агонистов ДА-рецепторов пролонгированного действия, антиэксайтотоксических препаратов, эффективных антиоксидантов, нейротрофических факторов, антиапоптозных средств. Серьезные перспективы лечения связывают также с возможностями генной инженерии и созданием новых иммуномодуляторов. Дальнейшие усилия по совершенствованию и оптимизации терапии уже известными способами также оправданны, так как не все терапевтические ресурсы в этом направлении исчерпаны. К перспективным направлениям относятся разработка эффективных методов постоянного парентерального введения леводопы, создание более адекватных, рациональных схем лечения, профилактики и коррекции отдельных побочных эффектов, более широкое применение нелекарственных методов с целью минимизации поздних побочных эффектов, улучшения социальной адаптации и качества жизни как пациентов, так и членов их семей.
Читайте также:




