Нервная регуляция обмена глюкозы
Постоянство уровня глюкозы в крови – важнейшее условие поддержания нормальной жизнедеятельности организма. Нормогликемия является результатом слаженной работы нервной системы, гормонов и печени.
Печень – единственный орган, депонирующий глюкозу (в виде гликогена) для нужд всего организма. Благодаря активной фосфатазе глюкозо-6-фосфата гепатоциты способны образовывать свободную глюкозу, которая, в отличие от её фосфорилированных форм, может проникать через мембрану клеток в общий круг кровообращения.
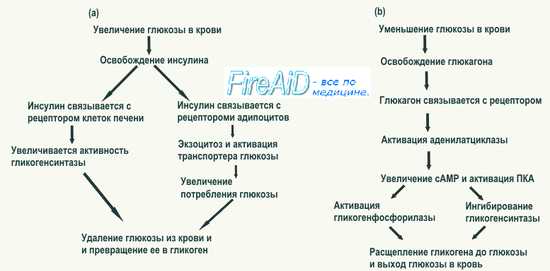
Из гормонов выдающуюся роль играет инсулин. Инсулин оказывает свое действие только на инсулинзависимые ткани, прежде всего, на мышечную и жировую. Мозг, лимфатическая ткань, эритроциты относятся к инсулиннезависимым. В отличие от других органов, действие инсулина не связано с рецепторными механизмами его влияния на метаболизм гепатоцитов. Хотя глюкоза свободно проникает в печёночные клетки, но это возможно только при условии повышенной её концентрации в крови. При гипогликемии, напротив, печень отдаёт глюкозу в кровь (даже несмотря на высокий уровень инсулина в сыворотке).
Наиболее существенным действием инсулина на организм является снижение нормального или повышенного уровня глюкозы в крови – вплоть до развития гипогликемического шока при введении высоких доз инсулина. Уровень глюкозы в крови снижается в результате: 1. Ускорения поступления глюкозы в клетки. 2. Повышения использования глюкозы клетками.
1. Инсулин ускоряет поступление моносахаридов в инсулинзависимые ткани, особенно глюкозы (а также сахаров схожей конфигурации в положении С1-С3), но не фруктозы. Связывание инсулина со своим рецептором на плазматической мембране приводит к перемещению запасных белков-переносчиков глюкозы (глют 4) из внутриклеточных депо и включению их в мембрану.
2. Инсулин активирует использование клетками глюкозы путём:
· активирования и индукции синтеза ключевых ферментов гликолиза (глюкокиназы, фосфофруктокиназы, пируваткиназы).
· Увеличения включения глюкозы в пентозофосфатный путь (активирование дегидрогеназ глюкозо-6-фосфата и 6-фосфоглюконата).
· Повышения синтеза гликогена за счёт стимуляции образования глюкозо-6-фосфата и активирования гликогенсинтазы (одновременно инсулин ингибирует гликогенфосфорилазу).
· Торможения активности ключевых ферментов глюконеогенеза (пируваткарбоксилазы, фосфоенолПВКкарбоксикиназы, бифосфатазы, глюкозо-6-фосфатазы) и реп-рессии их синтеза (уставлен факт репрессии гена фосфоенолПВКкарбоксикиназы).
Другие гормоны, как правило, способствуют увеличению содержания глюкозы в крови.
Глюкагон и адреналин приводят к росту гликемии путём активации гликогенолиза в печени (активирование гликогенфосфорилазы), однако в отличие от адреналина глюкагон не влияет на гликогенфосфорилазу мышц. Кроме того, глюкагон активирует глюконеогенез в печени, следствием чего также является увеличение концентрации глюкозы в крови.
Глюкокортикоидыспособствуют повышению уровня глюкозы в крови за счёт стимуляции глюконеогенеза (ускоряя катаболизм белков в мышечной и лимфоидной тканях, эти гормоны увеличивают содержание в крови аминокислот, которые, поступая в печень, становятся субстратами глюконеогенеза). Кроме того, глюкокортикоиды препятствуют утилизации глюкозы клетками организма.
Гормон роставызывает увеличение гликемии опосредованно: стимулируя распад липидов, он приводит увеличению уровня жирных кислот в крови и клетках, снижая тем самым потребность последних в глюкозе (жирные кислоты – ингибиторы использования глюкозы клетками).
Тироксин,особенно вырабатываемый в избыточных количествах при гиперфункции щитовидной железы, также способствует повышению уровня глюкозы в крови (за счёт увеличения гликогенолиза).
При нормальном уровне глюкозыв крови почки полностью её реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9-10 ммоль/л (почечный порог), то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии.
В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6-8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета.
Проверка способности организма регулировать содержание глюкозы в крови (толерантность к глюкозе) используется для диагностики сахарного диабета при постановке перорального глюкозо-толерантного теста:
Первая проба крови берётся натощак после ночного голодания. Затём больному в течение 5 мин. дают выпить раствор глюкозы (75г глюкозы, растворённой в 300 мл воды). После этого каждые 30 мин. на протяжении 2-х часов определяют содержание глюкозы в крови
Должность и ф.и.о. автора лекции
Дата
По биологической химии
для студентов_____2-го_____ курса ___лечебного___________________факультета
Тема:___Углеводы 4. Патология углеводного обмена
1.Сформировать представления о молекулярных механизмах основных нарушений углеводного обмена.
1.Биохимия человека:, Р.Марри, Д.Греннер, П.Мейес, В.Родуэлл.- М.книга ,2004.- т.1.с..
2.Основы биохимии:А.Уайт, Ф.Хендлер,Э.Смит, Р.Хилл, И.Леман.-М. книга,
1981,т. -.2,.с. 639- 641,
3.Наглядная биохимия: Кольман., Рем К.-Г-М.книга 2004г.
4.Биохимические основы . под. ред. член- корр. РАН Е.С. Северина. М.Медицина,2000.-с.179-205.
Скорость транспорта глюкозы, как и транспорта других моносахаридов, существенно увеличивается инсулином. Если поджелудочная железа продуцирует большие количества инсулина, скорость транспорта глюкозы в большинстве клеток возрастает более чем в 10 раз по сравнению со скоростью транспорта глюкозы при отсутствии инсулина. Напротив, при отсутствии инсулина количество глюкозы, которое может диффундировать внутрь большинства клеток, за исключением клеток мозга и печени, столь мало, что не в состоянии обеспечить нормальный уровень энергетических потребностей.
Скорость потребления глюкозы большинством клеток находится под контролирующим влиянием скорости продукции инсулина поджелудочной железой.
Как только глюкоза попадает в клетки, она связывается с фосфатными радикалами в соответствии со следующей схемой реакции: Глюкоза=>Глюкозо-6-фосфат.
Фосфорилирование осуществляется главным образом ферментом глюкокиназой в печени или гексокиназой в большинстве других клеток. Фосфорилирование глюкозы является почти полностью необратимой реакцией, исключая клетки печени, эпителиоциты почечного тубулярного аппарата и клетки кишечного эпителия, в которых присутствует другой фермент — глюкофосфорилаза. Будучи активирована, она может сделать реакцию обратимой. В большинстве тканей организма фосфорилирование служит способом захвата глюкозы клетками. Это происходит в связи со способностью глюкозы немедленно связываться с фосфатом, а в такой форме она не может выходить обратно из клетки, кроме некоторых особых случаев, в частности из клеток печени, которые располагают ферментом фосфатазой.
После поступления внутрь клетки глюкоза практически немедленно используется клеткой для энергетических целей либо запасается в виде гликогена, который является крупным полимером глюкозы.
Все клетки организма способны запасать какие-то количества гликогена, но особенно большие его количества депонируются клетками печени, которая может запасать гликоген в количествах, составляющих от 5 до 8% веса этого органа, или мышечными клетками, содержание гликогена в которых составляет от 1 до 3%. Молекула гликогена может полимеризоваться так, что в состоянии иметь практически любую молекулярную массу; в среднем молекулярная масса гликогена составляет около 5 млн. В большинстве случаев гликоген, осаждаясь, образует крупные гранулы.
Превращение моносахаридов в преципитирующее соединение с большой молекулярной массой (гликоген) дает возможность запасать большие количества углеводов без заметного изменения осмотического давления во внутриклеточном пространстве. Высокая концентрация растворимых моносахаридов с низкой молекулярной массой могла бы приводить к катастрофическим последствиям для клеток в связи с формированием огромного градиента осмотического давления по обе стороны клеточной мембраны.
Химические реакции образования гликогена показаны на рисунке. На рисунке видно, что глюкозо-6-фосфат становится глюкозо-1-фосфатом, который затем превращается в глюкозоуридинфосфат, в итоге образующий гликоген. Для этих превращений необходимы специфические ферменты. Кроме того, и другие моносахариды, превращаясь в глюкозу, могут участвовать в образовании гликогена. Более мелкие соединения, включая молочную кислоту, глицерол, пировиноградную кислоту и некоторые дезаминированные аминокислоты, также могут превращаться в глюкозу или близкие ей соединения и затем становиться гликогеном.
Процесс расщепления гликогена, хранящегося в клетках, который сопровождается высвобождением глюкозы, называют гликогенолизом. Затем глюкоза может использоваться в целях получения энергии. Гликогенолиз невозможен без реакций, обратных реакциям получения гликогена, при этом каждая вновь отщепляющаяся от гликогена молекула глюкозы подвергается фосфорилированию, катализируемому ферментом фосфорилазой. В состоянии покоя фосфорилаза пребывает в неактивном состоянии, поэтому гликоген может храниться в депо. Когда появляется необходимость получить глюкозу из гликогена, прежде всего должна активироваться фосфорилаза. Это может достигаться несколькими путями.
Активация фосфорилазы адреналином или глюкагоном.
Два гормона — адреналин и глюкагон — могут активировать фосфорилазу и таким образом ускорять процессы гликогенолиза. Начальные моменты влияний этих гормонов связаны с образованием в клетках циклического аденозинмонофосфатау который затем запускает каскад химических реакций, активирующих фосфорилазу.
Адреналин выделяется из мозгового вещества надпочечников под влиянием активации симпатической нервной системы, поэтому одна из ее функций заключается в обеспечении обменных процессов. Эффект адреналина особенно заметен в отношении клеток печени и скелетных мышц, что обеспечивает наряду с влияниями симпатической нервной системы готовность организма к действию.
Глюкагон — гормон, выделяемый альфа-клетками поджелудочной железы, когда концентрация глюкозы в крови снижается до слишком низких значений. Он стимулирует образование циклического АМФ главным образом в клетках печени, что, в свою очередь, обеспечивает превращение в печени гликогена в глюкозу и ее высвобождение в кровь, повышая таким образом концентрацию глюкозы в крови.
Гормональная регуляция обменных процессов обусловлена деятельностью эндокринной системы. Выделяют три основных вида влияний гормонов на метаболизм: 1) на активность ферментов, 2) на синтез ферментов, 3) на проницаемость мембран (Меньшиков, 1970).
Влияние гормонов на активность ферментов обусловлено их воздействием на структуру молекулы фермента, переводом фермента из неактивной формы в активную и. т. д. При этом гормоны активируют одни ферменты и тормозят действие других.
Влияние гормонов на синтез ферментов осуществляется путем воздействия на генетический аппарат клетки. Так, гормоны коры надпочечников активируют гены ДНК и усиливают синтез РНК, как информационной, так и транспортной. В результате повышается синтез соответствующих ферментов.
Многие гормоны способны активно воздействовать и на проницаемость клеточных мембран и мембран клеточных органелл, в которых осуществляются отдельные фазы обмена веществ. Так, инсулин повышает проницаемость клеточных мембран некоторых тканей по отношению к глюкозе, в результате чего ее поступление в клетки усиливается. Гормон щитовидной железы — тироксин влияет на состояние мембраны митохондрий, гормон коры надпочечников — гидрокортикозона на мембрану лизосом.
Наиболее важная регуляция метаболизма осуществляется нервной системой.Воздействие нервной системы на метаболизм связывают главным образом с деятельностью симпатического отдела нервной системы, с его адаптационно-трофической функцией (Л. А. Орбели). Трофический эффект свойствен и другим нервным волокнам, кроме симпатических. Перерезка нервов приводит к нарушению метаболизма в тканях.
Сущность непосредственного трофического влияния нервной системы на клетки изучена недостаточно. Полагают, что вещества, регулирующие трофику тканей (возможно, продукты метаболизма нуклеиновых кислот), синтезируются в теле нервной клетки и поступают в аксоплазму. Последняя непрерывно передвигается в проксимально-дистальном направлении. Таким путем ток аксоплазмы обеспечивает транспорт их к периферическим органам. Существенная роль в регуляции метаболизма принадлежит медиаторам симпатической нервной системы — норадреналину и ацетилхолину. В метаболизме клетки эти медиаторы влияют на активность ферментов.
Центральная нервная система оказывает свое влияние на обмен веществ. Особая роль принадлежит гипоталамической области головного мозга, в гипоталамусе локализованы ядра и центры, в которых осуществляется анализ состояния внутренней среды организма, формируются управляющие сигналы и посредством эфферентных систем приспосабливают ход метаболизма потребностям организма.
Эфферентными звеньями системы регуляции обмена являются симпатический и парасимпатический отделы вегетативной нервной системы и эндокринная система. Сигналы из гипоталамуса могут доходить до отдельных эндокринных желез чисто нервным путем, главным образом по симпатическим ветвям. Кроме того, в гипоталамусе вырабатываются вещества пептидной структуры (нейрогормоны), стимулирующие функцию передней доли гипофиза, а через нее — ряда эндокринных желез.
Через гипоталамическую область мозга осуществляется и влияние коры больших полушарий мозга на обмен веществ. Таким образом, нервные и эндокринные механизмы функционируют как единая нейрогуморальная система (рис. 25).
Рис. 25. Интегрирующие функции нервной, эндокринной и сосудистой систем в метаболизме (по: Андреева и др., 1998)
Регуляция белкового обмена. Влияния центральной нервной системы на процессы синтеза и распада белка осуществляется как прямым путем, так и опосредовано, путем изменения функционального состояния желез внутренней секреции. Мозговая регуляция белкового обмена связана с деятельностью гипоталамической области промежуточного мозга.Удаление коры больших полушарий у животных вызывает понижение интенсивности белкового обмена, особенно синтеза белка. Это доказано в опытах на животных, так у молодых животных резко замедляется рост и накопление массы тела.
Влияние гормонов на белковый обмен довольно разнообразно: одни гормоны стимулируют синтез белка, то есть оказывают анаболическое действие, другие преимущественно активируют процессы распада белка, то есть являются гормонами катаболического действия (рис. 26).


АНАБОЛИЗМ
Гормоны щитовидной железы
Гормоны коры надпочечников
Рис. 26. Влияние гормонов на обмен белков (по: Држевецкая, 1994)
Соматотропин — гормон, вырабатываемый в передней доле гипофиза, является мощным анаболическим гормоном. В период роста организма он стимулирует рост скелета и увеличение белковой массы всех органов и тканей. На протяжении остальной жизни человека соматотропин обеспечивает процессы синтеза белка, необходимые для нормальной жизнедеятельности.
Инсулин также является гормоном анаболического действия. Он оказывает на белковый обмен как непосредственное влияние, так и опосредовано через углеводный обмен. Непосредственное влияние инсулина на белковый обмен обусловлено тем, что он повышает проницаемость клеточных мембран по отношению к аминокислотам. В результате усиливается переход аминокислот из внеклеточной среды внутрь клетки и тем самым активируется внутриклеточный синтез белка. Кроме того, под влиянием инсулина усиливается потребление глюкозы клетками ряда тканей, в результате чего освобождается значительное количество энергии. Эта энергия частично используется на процессы белкового синтеза.
Гормоны щитовидной железы (тироксин и трийодтиронин)оказывают на белковый обмен различное действие в зависимости от белкового питания, исходного состояния белкового обмена и функции самой щитовидной железы. При нормальном функционировании щитовидной железы гормоны стимулируют синтез белка и благодаря этому активируют рост, развитие и дифференциацию тканей и органов. Наиболее выраженное анаболическое влияние гормоны щитовидной железы оказывают в условиях недостатка белкового питания, тем самым способствуя максимальному использованию поступающих в организм аминокислот. В условиях избыточного белкового питания гормоны щитовидной железы оказывают катаболическое действие, активируя процессы распада белка.
Глюкокортикоиды (гидрокортизон, кортикостерон) — гормоны коры надпочечников — оказывают на обмен белка выраженное катаболическое действие, причем степень этого действия в разных тканях неодинакова. Наиболее усиленный распад белка под влиянием глюкокортикоидов обнаруживается в лимфоидной, мышечной и соединительной тканях. При этом освобождаются аминокислоты, которые подвергаются дезоминированию. Безазотистый остаток аминокислот превращается затем в глюкозу и гликоген. Таким образом, глюкокортикоиды не только усиливают распад белка ряда тканей, но и активируют гликогенез — новообразование углеводов. Иное действие оказывают глюкокортикоиды на печень. Они активируют процессы синтеза белковых структур в печени, а также происходящий в печени синтез белков плазмы крови.
Кортикотропин влияет на белковый обмен в основном через кору надпочечников, стимулируя биосинтез глюкокортикоидов.
Половые гормоны. Женские половые гормоны (эстрогены) стимулируют синтез белка в тканях женской половой сферы (матка, грудные железы и др.) Мужские половые гормоны (андрогены) также обладают анаболическим действием, но значительно более широким, чем эстрогены. Андрогены усиливают синтез белка не только в мужских половых органах, но и в других тканях. Анаболическое свойство андрогенов имеет практическое значение и используется для создания синтетических препаратов, обладающих выраженным анаболическим влиянием на белковый обмен. Они применяются для стимуляции роста детей, отстающих в физическом развитии.
У детей в регуляции белкового обмена отмечаются существенные изменения. Так, в периоде внутриутробного развития синтез белка активирует гормон плаценты — соматотропин. После рождения усиленный синтез белка продолжается под влиянием собственного соматотропина ребенка. Он стимулирует рост скелета и увеличение массы органов. В связи с этим в здоровом растущем организме азотистый баланс всегда положителен.
Важное анаболическое действие осуществляет инсулин, продукция которого у детей относительно больше, чем у взрослых людей. Инсулин усиливает транспорт аминокислот через цитоплазматические мембраны, а вызываемое им понижение уровня глюкозы в крови стимулирует выделение соматотропина из гипофиза. При недостатке инсулина (сахарном диабете) дети отстают в росте от своих здоровых сверстников.
После начала функционирования гонад анаболическое действие на белковый обмен начинают оказывать половые гормоны. Тестостерон активирует синтез белка в печени, почках, сердце и скелетных мышцах.
Глюкокортикоиды действуют двояко: в лимфоидной, мышечной и соединительной ткани они усиливают распад белка, в результате чего освобождаются аминокислоты для синтеза белка в других тканях, а также углеводов — важнейшего источника энергии.
Регуляция углеводного обмена. Нервная регуляция углеводного обмена осуществляется структурами продолговатого мозга (расположенными в области дна IV желудочка), гипоталамической областью и корой больших полушарий головного мозга. Центральным звеном регуляции углеводного и других видов обмена является гипоталамус. Отсюда регулирующие влияния реализуются через вегетативную нервную систему и гуморальным путем, включающим эндокринные железы.
Выраженным влиянием на углеводный обмен обладает инсулин — гормон, вырабатываемый В-клетками островков поджелудочной железы. При введении инсулина уровень глюкозы в крови снижается. Это объясняется тем, что под влиянием инсулина увеличивается потребление сахара клетками тканей, особенно мышечной и жировой. В печени и мышцах усиливается синтез гликогена, а в жировой ткани происходит образование жира из глюкозы. Наряду с этим инсулин тормозит процессы гликогенеза в печени.
Гюкогон — гормон, продуцируемый А-клетками поджелудочной железы. Он активирует гликогенолиз в печени, в результате чего освобождается свободная глюкоза, поступающая затем в кровь. Адреналин — гормон мозгового слоя надпочечников. Совместно с глюкагоном активирует фосфорилазу печени, тем самым вызывает распад печеночного гликогена. Одновременно усиливает распад гликогена мышц, поэтому после введения адреналина или избыточного его образования увеличивается концетрация и сахара, и молочной кислоты в крови.
Глюкокортикоиды — гормоны коркового слоя надпочечников. Под их действием усиливается глюконеогенез — образование сахара из неуглеводов, что приводит к увеличению уровня глюкозы в крови и содержания гликогена в печени. Соматотропин — гормон гипофиза — уменьшает утилизацию глюкозы периферическими тканями и одновременно усиливает распад жира, доставляя тем самым исходный материал для глюконеогенеза. Гормоны щитовидной железы — тироксин и трийодтиронин, по современным представлениям, в умеренных дозах усиливают всасывание моносахаридов в кишечнике.
Регуляция жирового обмена осуществляется нервной и эндокринной системами, а также тканевыми механизмами и тесно связана с углеводным обменом. Так повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот тормозит синтез триглицеридов и усиливает их расщепление.
Таким образом, осуществляется взаимосвязь жирового и углеводного обмена в обеспечении энергетических нужд в организме: при избытке одного из источников энергии (глюкозы) происходит депонирование триглицеридов в жировой ткани, при недостатке углеводов (гипогликемия) триглицериды расщепляются с образованием неэстерифицированных жирных кислот, служащих источником энергии. Указанные процессы находятся под влиянием нервных и эндокринных воздействий. Нервные влияния на жировой обмен контролируются гипоталамусом. Особую роль играют ядра, расположенные в его задней доле.
Так, при разрушении вентромедиальных ядер гипоталамуса развивается длительное повышение аппетита и усиление отложения жира. Разрушение вентролатеральных ядер напротив ведет к потере аппетита и исхуданию.
Имеются данные, свидетельствующие о прямых нервных влияниях на обмен жиров (опыты с перерезкой нервов). Симпатические влияния тормозят синтез триглицеридов и усиливают их распад, а парасимпатические, наоборот, способствуют отложению жира.
Ряд гормонов оказывает влияние на жировой обмен. Так, выраженным жиромобилизующим действием обладают адреналини норадреналин — гормоны мозгового слоя надпочечников. Аналогичным действием обладают соматотропный гормон гипофиза и тироксин — гормон щитовидной железы. Наоборот тормозят мобилизацию жира глюкокортикоиды — гормоны коры надпочечников. Подобное действие оказывает инсулин — гормон поджелудочной железы.
| | | следующая лекция ==> | |
| Возрастные особенности жирового обмена | | | Роль минеральных веществ и воды в жизнедеятельности организма |
Дата добавления: 2017-11-04 ; просмотров: 4041 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Поможем написать любую работу на аналогичную тему
Регуляция углеводного обмена осуществляется на всех его этапах нервной системой и гормонами. Помимо этого, активность ферментов отдельных путей метаболизма углеводов регулируется по принципу “обратной связи”, в основе которого лежит аллостерический механизм взаимодействия фермента с эффектором. К аллостерическим эффекторам можно отнести конечные продукты реакции, субстраты, некоторые метаболиты, адениловые мононуклеотиды. Важнейшую роль в выборе направленности углеводного обмена (синтез или распад углеводов) играет соотношение коферментов НАД+/НАДН∙Н+ и энергетический потенциал клетки.
Постоянство уровня глюкозы в крови – важнейшее условие поддержания нормальной жизнедеятельности организма. Нормогликемия является результатом слаженной работы нервной системы, гормонов и печени.
Печень – единственный орган, депонирующий глюкозу (в виде гликогена) для нужд всего организма. Благодаря активной фосфатазе глюкозо-6-фосфата гепатоциты способны образовывать свободную глюкозу, которая, в отличие от ее фосфорилированных форм, может проникать через мембрану клеток в общий круг кровообращения.
Выдающуюся роль среди гормонов играет инсулин. Он оказывает действие только на инсулинзависимые ткани, прежде всего, на мышечную и жировую. Мозг, лимфатическая ткань, эритроциты относятся к инсулиннезависимым. Поступление глюкозы в печеночные клетки и выход глюкозы в кровь из печени также являются независимыми от инсулина процессами.
Наиболее существенным действием инсулина на организм является снижение нормального или повышенного уровня глюкозы в крови – вплоть до развития гипогликемического шока при введении высоких доз инсулина. Уровень глюкозы в крови снижается в результате: 1) ускорения поступления глюкозы в клетки; 2)повышения использования глюкозы клетками.
Инсулин ускоряет поступление моносахаридов в инсулинзависимые ткани, особенно глюкозы (а также сахаров схожей конфигурации в положении С-1– С-3), но не фруктозы. Связывание инсулина со своим рецептором на плазматической мембране приводит к перемещению запасных белков-переносчиков глюкозы (ГЛУТ 4) из внутриклеточных депо и включению их в мембрану.
Инсулин активирует использование клетками глюкозы путем:
- активирования и индукции синтеза ключевых ферментов гликолиза (глюкокиназы, фосфофруктокиназы, пируваткиназы);
- увеличения включения глюкозы в пентозофосфатный путь (активирование дегидрогеназ глюкозо-6-фосфата и 6-фосфоглюконата);
- повышения синтеза гликогена за счет стимуляции образования глюкозо-6-фосфата и активирования гликогенсинтазы (одновременно инсулин ингибирует гликогенфосфорилазу);
- торможения активности ключевых ферментов глюконеогенеза (пируваткарбоксилазы, фосфоенолпируваткарбоксикиназы, дифосфатазы, глюкозо-6-фосфатазы) и репрессии их синтеза (уставлен факт репрессии гена фосфоенолпируваткарбоксикиназы).
Другие гормоны, как правило, способствуют увеличению содержания глюкозы в крови.
Глюкагон и адреналин приводят к росту гликемии путем активации гликогенолиза в печени (активирование гликогенфосфорилазы), однако в отличие от адреналина глюкагон не влияет на гликогенфосфорилазу мышц. Кроме того, глюкагон активирует глюконеогенез в печени, следствием чего также является увеличение концентрации глюкозы в крови.
Глюкокортикоиды способствуют повышению уровня глюкозы в крови за счет стимуляции глюконеогенеза (ускоряя катаболизм белков в мышечной и лимфоидной тканях, эти гормоны увеличивают содержание в крови аминокислот, которые, поступая в печень, становятся субстратами глюконеогенеза). Кроме того, глюкокортикоиды препятствуют утилизации глюкозы клетками организма.
Гормон роста вызывает увеличение гликемии опосредованно: стимулируя распад липидов, он приводит к увеличению уровня жирных кислот в крови и клетках, снижая тем самым потребность последних в глюкозе (жирные кислоты – ингибиторы использования глюкозы клетками).
Тироксин, особенно вырабатываемый в избыточных количествах при гиперфункции щитовидной железы, также способствует повышению уровня глюкозы в крови (за счет увеличения гликогенолиза).
При нормальном уровне глюкозы в крови почки полностью ее реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9–10 ммоль/л (почечный порог), то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии.
В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6–8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета.
Проверка способности организма регулировать содержание глюкозы в крови (толерантность к глюкозе) используется для диагностики сахарного диабета при постановке перорального глюкозо-толерантного теста. Первая проба крови берется натощак после ночного голодания. Затем больному в течение 5 мин. дают выпить раствор глюкозы из расчета 1 г глюкозы на кг массы тела (1,5 г сахарозы) в 200 мл воды. После этого каждые 30 мин на протяжении 2 ч определяют содержание глюкозы в крови и полученные результаты используют для построения “сахарных кривых”. Некоторые варианты таких кривых в сравнении с данными, полученными у здорового человека, приводятся на рис.5.21. Гликемические кривые у детей имеют такой же характер, что и у взрослых, с тем лишь отличием, что повышение концентрации глюкозы в крови у детей после нагрузки меньшее.
Рис.5.21. Гликемические кривые при однократной нагрузке глюкозой в норме и при некоторых патологических состояниях
Таблица 5.3. Критерии ВОЗ, используемые при диагностике сахарного диабета и нарушения толерантности к глюкозе
Постоянство уровня глюкозы в крови – важнейшее условие поддержания нормальной жизнедеятельности организма. Нормогликемия является результатом слаженной работы нервной системы, гормонов и печени.
Печень – единственный орган, депонирующий глюкозу (в виде гликогена) для нужд всего организма. Благодаря активной фосфатазе глюкозо-6-фосфата гепатоциты способны образовывать свободную глюкозу, которая, в отличие от её фосфорилированных форм, может проникать через мембрану клеток в общий круг кровообращения.
Из гормонов выдающуюся роль играет инсулин. Инсулин оказывает свое действие только на инсулинзависимые ткани, прежде всего, на мышечную и жировую. Мозг, лимфатическая ткань, эритроциты относятся к инсулиннезависимым. В отличие от других органов, действие инсулина не связано с рецепторными механизмами его влияния на метаболизм гепатоцитов. Хотя глюкоза свободно проникает в печёночные клетки, но это возможно только при условии повышенной её концентрации в крови. При гипогликемии, напротив, печень отдаёт глюкозу в кровь (даже несмотря на высокий уровень инсулина в сыворотке).
Наиболее существенным действием инсулина на организм является снижение нормального или повышенного уровня глюкозы в крови – вплоть до развития гипогликемического шока при введении высоких доз инсулина. Уровень глюкозы в крови снижается в результате: 1. Ускорения поступления глюкозы в клетки. 2. Повышения использования глюкозы клетками.
Инсулин ускоряет поступление моносахаридов в инсулинзависимые ткани, особенно глюкозы (а также сахаров схожей конфигурации в положении С1-С3), но не фруктозы. Связывание инсулина со своим рецептором на плазматической мембране приводит к перемещению запасных белков-переносчиков глюкозы (глют 4) из внутриклеточных депо и включению их в мембрану.
Инсулин активирует использование клетками глюкозы путём:
активирования и индукции синтеза ключевых ферментов гликолиза (глюкокиназы, фосфофруктокиназы, пируваткиназы).
Увеличения включения глюкозы в пентозофосфатный путь (активирование дегидрогеназ глюкозо-6-фосфата и 6-фосфоглюконата).
Повышения синтеза гликогена за счёт стимуляции образования глюкозо-6-фосфата и активирования гликогенсинтазы (одновременно инсулин ингибирует гликогенфосфорилазу).
Торможения активности ключевых ферментов глюконеогенеза (пируваткарбоксилазы, фосфоенол-ПВК-карбоксикиназы, бифосфатазы, глюкозо-6-фосфатазы) и реп-рессии их синтеза (уставлен факт репрессии гена фосфоенолПВКкарбоксикиназы).
Другие гормоны, как правило, способствуют увеличению содержания глюкозы в крови.
Глюкагон и адреналин приводят к росту гликемии путём активации гликогенолиза в печени (активирование гликогенфосфорилазы), однако в отличие от адреналина глюкагон не влияет на гликогенфосфорилазу мышц. Кроме того, глюкагон активирует глюконеогенез в печени, следствием чего также является увеличение концентрации глюкозы в крови.
Глюкокортикоиды способствуют повышению уровня глюкозы в крови за счёт стимуляции глюконеогенеза (ускоряя катаболизм белков в мышечной и лимфоидной тканях, эти гормоны увеличивают содержание в крови аминокислот, которые, поступая в печень, становятся субстратами глюконеогенеза). Кроме того, глюкокортикоиды препятствуют утилизации глюкозы клетками организма.
Гормон роста вызывает увеличение гликемии опосредованно: стимулируя распад липидов, он приводит увеличению уровня жирных кислот в крови и клетках, снижая тем самым потребность последних в глюкозе (жирные кислоты – ингибиторы использования глюкозы клетками).
Тироксин, особенно вырабатываемый в избыточных количествах при гиперфункции щитовидной железы, также способствует повышению уровня глюкозы в крови (за счёт увеличения гликогенолиза).
При нормальном уровне глюкозы в крови почки полностью её реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9-10 ммоль/л (почечный порог), то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии.
В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6-8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета.
Проверка способности организма регулировать содержание глюкозы в крови (толерантность к глюкозе) используется для диагностики сахарного диабета при постановке перорального глюкозо-толерантного теста:
Первая проба крови берётся натощак после ночного голодания. Затём больному в течение 5 мин. дают выпить раствор глюкозы (75г глюкозы, растворённой в 300 мл воды). После этого каждые 30 мин. на протяжении 2-х часов определяют содержание глюкозы в крови

Рис. 10 “ Сахарная кривая “ в норме и при патологии
Должность и ф.и.о. автора лекции
Министерство здравоохранения Республики Беларусь
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)____________________
По биологической химии
для студентов 2-го курса лечебного факультета
Тема: Углеводы 4. Патология углеводного обмена
1.Сформировать представления о молекулярных механизмах основных нарушений углеводного обмена.
1.Биохимия человека:, Р.Марри, Д.Греннер, П.Мейес, В.Родуэлл.- М.книга ,2004.- т.1.с. 205-211., 212-224.
2.Основы биохимии:А.Уайт, Ф.Хендлер,Э.Смит, Р.Хилл, И.Леман.-М. книга,
1981,т. -.2,.с. 639- 641,
3.Наглядная биохимия: Кольман., Рем К.-Г-М.книга 2004г.
4.Биохимические основы . под. ред. член- корр. РАН Е.С. Северина. М.Медицина,2000.-с.179-205.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
Перечень учебных вопросов
Количество времени в мин
Механизмы регуляции уровня глюкозы в крови
Сахарный диабет I типа, диагностика СД
Гиперинсулинизм( гипогликемия, ожирение, СД II тип)
Галактоземия, фруктоземия. Гликогенозы
Читайте также:


