Нервный импульс натрий и калий
Понятие о рецепторах и нервных импульсах натрий-каливый насос. Синапс. Рефлекторная дуга и ее звенья
Рецепторы(от лат. receptor – принимающий) — нервные образования, преобразующие химико–физические воздействия из внешней или внутренней среды организма в нервные импульсы. По месту своего расположения и по выполняемым функциям рецепторы могут быть расклассифицированы на экстерорецепторы, интерорецепторы и проприоцепторы. В соответствии с характером воспринимаемого воздействия различаются механо—, термо—, фото—, хемо— и электрорецепторы.
Нервный импульс - это движущаяся волна изменений в состоянии мембраны, включающая в себя структурные изменения (открытие и закрытие ионных каналов), химические (изменяющиеся потоки ионов) и электрические (деполяризацию, позитивную поляризацию и реполяризацию).
Упрощенно действие натрий-калиевого насоса можно представить следующим образом.
1. С внутренней стороны мембраны к молекуле белка-переносчика поступают АТФ и ионы натрия, а с наружной — ионы калия.
2. Молекула переносчика осуществляет гидролиз одной молекулы АТФ.
3. При участии трех ионов натрия за счет энергии АТФ к переносчику присоединяется остаток фосфорной кислоты (фосфорилирование переносчика); сами эти три иона натрия также присоединяются к переносчику.
4. В результате присоединения остатка фосфорной кислоты происходит такое изменение формы молекулы переносчика (конформация), что ионы натрия оказываются по другую сторону мембраны, уже вне клетки.
5. Три иона натрия выделяются во внешнюю среду, а вместо них с фосфорилированным переносчиком соединяются два иона калия.
6. Присоединение двух ионов калия вызывает дефосфорилирование переносчика — отдачу им остатка фосфорной кислоты.
7. Дефосфорилирование, в свою очередь, вызывает такую конформацию переносчика, что ионы калия оказываются по другую сторону мембраны, внутри клетки.
8. Ионы калия высвобождаются внутри клетки, и весь процесс повторяется.
Си́напс — место контакта между двумя нейронами или между нейроном и получающей сигнал эффекторной клеткой. Служит для передачинервного импульса между двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться.
Рефлекторная дуга (нервная дуга) — путь, проходимый нервными импульсами при осуществлениирефлекса.
Рефлекторная дуга состоит из:
· рецептора — нервное звено, воспринимающее раздражение;
· афферентного звена — центростремительное нервное волокно — отростки рецепторных нейронов, осуществляющие передачу импульсов от чувствительных нервных окончаний в центральную нервную систему;
· центрального звена — нервный центр (необязательный элемент, например для аксон-рефлекса);
· эфферентного звена — осуществляют передачу от нервного центра к эффектору.
· эффектора — исполнительный орган, деятельность которого изменяется в результате рефлекса.
· моносинаптические, двухнейронные рефлекторные дуги;
· полисинаптические рефлекторные дуги (включают три и более нейронов).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Кандидат биологических наук Л. Чайлахян, научный сотрудник Института биофизики АН СССР
Велика и заманчива цель, но неимоверно сложен объект исследования. Шутка сказать, этот килограмм ткани представляет собой сложнейшую систему связи десятков миллиардов нервных клеток.
Однако первый существенный шаг к познанию работы мозга уже сделан. Может быть, он один из самых легких, но он чрезвычайно важен для всего дальнейшего.
Я имею в виду исследование механизма передачи нервных импульсов — сигналов, бегущих по нервам, как по проводам. Именно эти сигналы являются той азбукой мозга, с помощью которой органы чувств посылают в центральную нервную систему сведения-депеши о событиях во внешнем мире. Нервными импульсами зашифровывает мозг свои приказы мышцам и различным внутренним органам. Наконец, на языке этих сигналов говорят между собой отдельные нервные клетки и нервные центры.
В проблеме изучения механизма нервного импульса и его распространения можно выделить два основных вопроса: природа проведения нервного импульса или возбуждения в пределах одной клетки — по волокну и механизм передачи нервного импульса от клетки к клетке — через синапсы.
Какова природа сигналов, передающихся от клетки к клетка по нервным волокнам?
Этой проблемой человек интересовался уже давно, Декарт предполагал, что распространение сигнала связано с переливанием жидкости по нервам, как по трубкам. Ньютон думал, что это чисто механический процесс. Когда появилась электромагнитная теория, ученые решили, что нервный импульс аналогичен движению тока по проводнику со скоростью, близкой к скорости распространения электромагнитных колебаний. Наконец, с развитием биохимии появилась точка зрения, что движение нервного импульса — это распространение вдоль по нервному волокну особой биохимической реакции.
И всё же ни одно из этих представлений не оправдалось.
В настоящее время природа нервного импульса раскрыта: это удивительно тонкий электрохимический процесс, в основе которого лежит перемещение ионов через оболочку клетки.
Большой вклад в раскрытие этой природы внесли работы трех ученых: Алана Ходжкина, профессора биофизики Кембриджского университета; Эндрью Хаксли, профессора физиологии Лондонского университета, и Джона Экклса, профессора физиологии австралийского университета в Канберре. Им присуждена Нобелевская премия в области медицины за 1963 год,
Впервые предположение об электрохимической природе нервного импульса высказал известный немецкий физиолог Бернштейн в начале нашего столетия.
К началу двадцатого века было довольно многое известно о нервном возбуждении. Ученые уже знали, что нервное волокно можно возбудить электрическим током, причем возбуждение всегда возникает под катодом — под минусом. Было известно, что возбужденная область нерва заряжается отрицательно по отношению к невозбужденному участку. Было установлено, что нервный импульс в каждой точке длится всего 0,001—0,002 секунды, что величина возбуждения не зависит от силы раздражения, как громкость звонка в нашей квартире не зависит от того, как сильно мы нажимаем на кнопку. Наконец, ученые установили, что носителями электрического тока в живых тканях являются ионы; причем внутри клетки основной электролит — соли калия, а в тканевой жидкости — соли натрия. Внутри большинства клеток концентрация ионов калия в 30—50 раз больше, чем в крови и в межклеточной жидкости, омывающей клетки.
И вот на основании всех этих данных Бернштейн предположил, что оболочка нервных и мышечных клеток представляет собой особую полупроницаемую мембрану. Она проницаема только для ионов К + ; для всех остальных ионов, в том числе и для находящихся внутри клетки отрицательно заряженных анионов, путь закрыт. Ясно, что калий по законам диффузии будет стремиться выйти из клетки, в клетке возникает избыток анионов, и по обе стороны мембраны появится разность потенциалов: снаружи — плюс (избыток катионов), внутри — минус (избыток анионов). Эта разность потенциалов получила название потенциала покоя. Таким образом, в покое, в невозбужденном состоянии внутренняя часть клетки всегда заряжена отрицательно по сравнению с наружным раствором.
Бернштейн предположил, что в момент возбуждения нервного волокна происходят структурные изменения поверхностной мембраны, ее поры как бы увеличиваются, и она становится проницаемой для всех ионов. При этом, естественно, разность потенциалов исчезает. Это и вызывает нервный сигнал.
Мембранная теория Бернштейма быстро завоевала признание и просуществовала свыше 40 лет, вплоть до середины нашего столетия.
Но уже в конце 30-х годов теория Бернштейна встретилась с непреодолимыми противоречиями. Сильный удар ей был нанесен в 1939 году тонкими экспериментами Ходжкина и Хаксли. Эти ученые впервые измерили абсолютные величины мембранного потенциала нервного волокна в покое и при возбуждении. Оказалось, что при возбуждении мембранный потенциал не просто уменьшался до нуля, а переходил через ноль на несколько десятков милливольт. То есть внутренняя часть волокна из отрицательной становилась положительной.
Но мало ниспровергнуть теорию, надо заменить ее другой: наука не терпит вакуума. И Ходжкин, Хаксли, Катц в 1949—1953 годах предлагают новую теорию. Она получает название натриевой.
Здесь читатель вправе удивиться: до сих пор о натрии не было речи. В этом все и дело. Ученые установили с помощью меченых атомов, что в передаче нервного импульса замешаны не только ионы калия и анионы, но и ионы натрия и хлора.
В организме достаточно ионов натрия и хлора, все знают, что кровь соленая на вкус. Причем натрия в межклеточной жидкости в 5—10 раз больше, чем внутри нервного волокна.
Что же это может означать? Ученые предположили, что при возбуждении в первый момент резко увеличивается проницаемость мембраны только для натрия. Проницаемость становится в десятки раз больше, чем для ионов калия. А так как натрия снаружи в 5—10 рез больше, чем внутри, то он будет стремиться войти в нервное волокно. И тогда внутренняя часть волокна станет положительной.
А через какое-то время — после возбуждения — равновесие восстанавливается: мембрана начинает пропускать и ионы калия. И они выходят наружу. Тем самым они компенсируют тот положительный заряд, который был внесен внутрь волокна ионами натрия.
Совсем нелегко было прийти к таким представлениям. И вот почему: диаметр иона натрия в растворе раза в полтора больше диаметра ионов калия и хлора. И совершенно непонятно, каким образом больший по размеру ион проходит там, где не может пройти меньший.
Нужно было решительно изменить взгляд на механизм перехода ионов через мембраны. Ясно, что только рассуждениями о порах в мембране здесь не обойтись. И тогда была высказана идея, что ионы могут пересекать мембрану совершенно другим способом, с помощью тайных до поры до времени союзников — особых органических молекул-переносчиков, спрятанных в самой мембране. С помощью такой молекулы ионы могут пересекать мембрану в любом месте, а не только через поры. Причем эти молекулы-такси хорошо различают своих пассажиров, они не путают ионы натрия с ионами калия.
Интересно, что нервные волокна тратят на свою основную работу — проведение нервных импульсов — всего около 15 минут в сутки. Однако готовы к этому волокна в любую секунду: все элементы нервного волокна работают без перерыва — 24 часа в сутки. Нервные волокна в этом смысле подобны самолетам-перехватчикам, у которых непрерывно работают моторы для мгновенного вылета, однако сам вылет может состояться лишь раз в несколько месяцев.
Мы познакомились сейчас с первой половиной таинственного акта прохождения нервного импульса — вдоль одного волокна. А как же передается возбуждение от клетки к клетке, через места стыков — синапсы. Этот вопрос был исследован в блестящих опытах третьего нобелевского лауреата, Джона Экклса.
Возбуждение не может непосредственно перейти с нервных окончаний одной клетки на тело или дендриты другой клетки. Практически весь ток вытекает через синаптическую щель в наружную жидкость, и в соседнюю клетку через синапс попадает ничтожная его доля, неспособная вызвать возбуждение. Таким образом, в области синапсов электрическая непрерывность в распространении нервного импульса нарушается. Здесь, на стыке двух клеток, в силу вступает совершенно другой механизм.
Когда возбуждение подходит к окончанию клетки, к месту синапса, в межклеточную жидкость выделяются физиологически активные вещества — медиаторы, или посредники. Они становятся связующим звеном в передаче информации от клетки к клетке. Медиатор химически взаимодействует со второй нервной клеткой, изменяет ионную проницаемость ее мембраны — как бы пробивает брешь, в которую устремляются многие ионы, в том числе и ионы натрия.
Итак, благодаря работам Ходжкина, Хаксли и Экклса важнейшие состояния нервной клетки — возбуждение и торможение — можно описать в терминах ионных процессов, в терминах структурно-химических перестроек поверхностных мембран. На основании этих работ уже можно делать предположения о возможных механизмах кратковременной и долговременной памяти, о пластических свойствах нервной ткани. Однако это разговор о механизмах в пределах одной или нескольких клеток. Это лишь, азбука мозга. По-видимому, следующий этап, возможно, гораздо более трудный, — вскрытие законов, по которым строится координирующая деятельность тысяч нервных клеток, распознание языка, на котором говорят между собой нервные центры.
Мы сейчас в познании работы мозга находимся на уровне ребенка, который узнал буквы алфавита, но не умеет связывать их в слова. Однако недалеко время, когда ученые с помощью кода — элементарных биохимических актов, происходящих в нервной клетке, прочтут увлекательнейший диалог между нервными центрами мозга.
Детальное описание иллюстраций
Нервные импульсы распространяются при перемещении ионов через мембрану нервной клетки и передаются из одной нервной клетки в другую с помощью нейромедиаторов.
В результате эволюции нервной системы человека и других животных возникли сложные информационные сети, процессы в которых основаны на химических реакциях. Важнейшим элементом нервной системы являются специализированные клетки нейроны. Нейроны состоят из компактного тела клетки, содержащего ядро и другие органеллы. От этого тела отходит несколько разветвленных отростков. Большинство таких отростков, называемых дендритами, служат точками контакта для приема сигналов от других нейронов. Один отросток, как правило самый длинный, называется аксоном и передает сигналы на другие нейроны. Конец аксона может многократно ветвиться, и каждая из этих более мелких ветвей способна соединиться со следующим нейроном.
Во внешнем слое аксона находится сложная структура, образованная множеством молекул, выступающих в роли каналов, по которым могут поступать ионы — как внутрь, так и наружу клетки. Один конец этих молекул, отклоняясь, присоединяется к атому-мишени. После этого энергия других частей клетки используется на то, чтобы вытолкнуть этот атом за пределы клетки, тогда как процесс, действующий в обратном направлении, вводит внутрь клетки другую молекулу. Наибольшее значение имеет молекулярный насос, который выводит из клетки ионы натрия и вводит в нее ионы калия (натрий-калиевый насос).
Когда клетка находится в покое и не проводит нервных импульсов, натрий-калиевый насос перемещает ионы калия внутрь клетки и выводит ионы натрия наружу (представьте себе клетку, содержащую пресную воду и окруженную соленой водой). Из-за такого дисбаланса разность потенциалов на мембране аксона достигает 70 милливольт (приблизительно 5% от напряжения обычной батарейки АА).
Однако при изменении состояния клетки и стимуляции аксона электрическим импульсом равновесие на мембране нарушается, и натрий-калиевый насос на короткое время начинает работать в обратном направлении. Положительно заряженные ионы натрия проникают внутрь аксона, а ионы калия откачиваются наружу. На мгновение внутренняя среда аксона приобретает положительный заряд. При этом каналы натрий-калиевого насоса деформируются, блокируя дальнейший приток натрия, а ионы калия продолжают выходить наружу, и исходная разность потенциалов восстанавливается. Тем временем ионы натрия распространяются внутри аксона, изменяя мембрану в нижней части аксона. При этом состояние расположенных ниже насосов меняется, способствуя дальнейшему распространению импульса. Резкое изменение напряжения, вызванное стремительными перемещения ионов натрия и калия, называют потенциалом действия. При прохождении потенциала действия через определенную точку аксона, насосы включаются и восстанавливают состояние покоя.
Когда импульс достигает конца основной части тела аксона, его необходимо передать либо следующему нижележащему нейрону, либо, если речь идет о нейронах головного мозга, по многочисленным ответвлениям многим другим нейронам. Для такой передачи используется абсолютно иной процесс, нежели для передачи импульса вдоль аксона. Каждый нейрон отделен от своего соседа небольшой щелью, называемой синапсом. Потенциал действия не может перескочить через эту щель, поэтому нужно найти какой-то другой способ для передачи импульса следующему нейрону. В конце каждого отростка имеются крошечные мешочки, называющие (пресинаптическими) пузырьками, в каждом из которых находятся особые соединения — нейромедиаторы. При поступлении потенциала действия из этих пузырьков высвобождаются молекулы нейромедиаторов, пересекающие синапс и присоединяющиеся к специфичным молекулярным рецепторам на мембране нижележащих нейронов. При присоединении нейромедиатора равновесие на мембране нейрона нарушается. Сейчас мы рассмотрим, возникает ли при таком нарушении равновесия новый потенциал действия (нейрофизиологи продолжают искать ответ на этот важный вопрос до сих пор).
После того как нейромедиаторы передадут нервный импульс от одного нейрона на следующий, они могут просто диффундировать, или подвергнуться химическому расщеплению, или вернуться обратно в свои пузырьки (этот процесс нескладно называется обратным захватом). В конце XX века было сделано поразительное научное открытие — оказывается, лекарства, влияющие на выброс и обратный захват нейромедиаторов, могут коренным образом изменять психическое состояние человека. Прозак (Prozac*) и сходные с ним антидепрессанты блокируют обратный захват нейромедиатора серотонина. Складывается впечатление, что болезнь Паркинсона взаимосвязана с дефицитом нейромедиатора допамина в головном мозге. Исследователи, изучающие пограничные состояния в психиатрии, пытаются понять, как эти соединения влияют на человеческий рассудок.
Нервный импульс - электрический импульс или нет?
Имеются разные точки зрения: химическая и электрическая. Результаты гууглевания.
Дмитрий. Почему нервы не провода, а нервный импульс не ток. (4.09.2013)
НЕРВНЫЙ ИМПУЛЬС - волна возбуждения, к-рая распространяется по нервному волокну и служит для передачи информации от периферич. рецепторных (чувствительных) окончаний к нервным центрам, внутри центр. нервной системы и от неё к исполнительным аппаратам - мышцам и железам. Прохождение Н. и. сопровождается переходными электрич. процессами, к-рые можно зарегистрировать как внеклеточными, так и внутриклеточными электродами. Вдоль нервного волокна Нервный импусьс распространяется в виде волны электрич. потенциала. В синапсе происходит смена механизма распространения. Когда Н. и. достигает пресинаптич. окончания, в синаптич. щель выделяется активное хим. вещество - м е д и а т о р. Медиатор диффундирует через синаптич. щель и меняет проницаемость постсинаптич. мембраны, в результате чего на ней возникает потенциал, вновь генерирующий распространяющийся импульс. Так действует хим. синапс. Встречается также электрич. синапс, когда след. нейрон возбуждается электрически. Состояние покоя нервного волокна. стационарно благодаря действию ионных насосов, причём мембранный потенциал в условиях разомкнутой цепи определяется из равенства нулю полного электрич. тока.
Процесс нервного возбуждения развивается следующим образом (см. также Биофизика). Если пропустить через аксон слабый импульс тока, приводящий к деполяризации мембраны, то после снятия внеш. воздействия потенциал монотонно возвращается к исходному уровню. В этих условиях аксон ведёт себя как пассивная электрич. цепь, состоящая из конденсатора и пост. сопротивления.
Если импульс тока превышает нек-рую пороговую величину, потенциал продолжает изменяться и после выключения возмущения.
Мембрана нервного волокна представляет собой нелинейный ионный проводник, свойства к-рого существенно зависят от электрич. поля.
ИОННЫЕ НАСОСЫ молекулярные структуры, встроенные в биол. мембраны и осуществляющие перенос ионов в сторону более высокого электрохим. потенциала
СЕМЁНОВ С.Н. О ФОНОННОЙ ПРИРОДЕ НЕРВНОГО ИМПУЛЬСА С ПОЗИЦИЙ ДИНАМИКИ ЭВОЛЮЦИИ. (29.05.2013)
Семёнов С.Н. Фонон – квант биологической (клеточной) мембраны.
Николаев Л.А. ′Металлы в живых организмах′ - Москва: Просвещение, 1986 - с.127
В научно-популярной форме автор рассказывает о роли металлов в биохимических процессах, протекающих в живых организмах. Книга будет способствовать расширению кругозора учащихся.
В распространении по нерву электрических импульсов принимают участие оба иона (натрия и калия).
Хамзина Оксана Альбертовна
- Физика, 11 класс
- учитель физики
- МБОУ СОШ№22
- Россия
НАУЧНО – ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА Электрическая природа нервного импульса
Нервный импульс — электрический импульс, распространяющийся по нервному волокну. При помощи передачи нервных импульсов происходит обмен информацией междунейронами и передача информации от нейронов к клеткам других тканей организма.
Нервный импульс проходит по центральной нервной системе и от неё к исполнительным аппаратам — скелетной мускулатуре, гладким мышцам внутренних органов и сосудов, железам внешней и внутренней секреции, от периферических рецепторных (чувствительных) окончаний к нервным центрам.
Возникновение и распространение нервного импульса обеспечивается электрическими свойствами мембраны и цитоплазмы нервных клеток.
17 октября 2017
- 871
- 0,7
- 2
- 3
Представление нейрона, который можно запускать и выключать с помощью света.
![]()
Виталий Шевченко
![]()
Антон Чугунов![]()
Андрей Панов




Как управлять мозгом с помощью света?
Оптогенетика — это способ управления определенными клетками с помощью света. Чаще всего речь идет о нейронах и мышечных клетках — так называемых электровозбудимых клетках. Как это работает? Для нормального существования клетка старается поддерживать определенные условия внутри и снаружи себя. По разные стороны мембраны клетки находятся ионы, но в различных концентрациях. В частности, внутри клетки преобладают ионы калия, а снаружи — ионы натрия и хлора. Причем, соотношение заряженных ионов таково, что клетка внутри заряжена более отрицательно (имеет отрицательный мембранный потенциал [2], равный примерно −70 мВ). Теперь, если мы каким-либо образом извне направим положительные заряды внутрь клетки, произойдет ее деполяризация, и клетка возбудится (возникнет потенциал действия). У нейронов в мембране находятся свои белки, которые реагируют на изменение потенциала. Именно они отвечают за распространение нервного импульса по цепочке нейронов.
В природе есть различные организмы, жизнь которых зависит от наличия света. Поглощая фотоны, естественные белки в этих организмах могут переносить различные ионы через мембрану клеток (например, протоны или ионы натрия). Если в нейрон или мышечную клетку внедрить такой белок, переносящий положительные ионы внутрь, и посветить на эту клетку, то мы искусственно запустим нервный импульс. Мы также можем и заблокировать прохождение импульса: для этого нужно, напротив, еще сильнее уменьшить мембранный потенциал — так, чтобы собственные клеточные белки не справились с повышением потенциала до нужного порога. Такое уменьшение называется гиперполяризацией. Этого можно добиться, выкачивая положительные ионы из клетки или закачивая в нее отрицательные.
Обобщая, можно сказать, что оптогенетика находит белки-транспортёры, реагирующие на свет, пытается доставить эти белки в нужные клетки и создает решения, как же посветить на эти клетки светом (это особенно сложно, когда хочется светить на клетки глубоко в мозге). Причем, это система модульная, ее составные компоненты можно заменять.
Скальпель, зажим, родопсин
Классические оптогенетические инструменты — галородопсин, археародопсин и канальный родопсин (рис. 1) [5]. Галородопсин и археародопсин используются для деактивации нейронов, они блокируют передачу нервного импульса. Под действием света галородопсин переносит отрицательно заряженные ионы хлора внутрь клетки, тем самым вызывая гиперполяризацию нейрона. Археародопсин выкачивает протоны (положительные заряды) из клетки, это, естественно, также гиперполяризует нейрон. И галородопсин, и археародопсин — это так называемые насосы, помпы. Если вокруг есть нужный им ион (а он есть почти всегда), то, поглотив квант света, эти белки активно перенесут ион с одной стороны мембраны на другую.
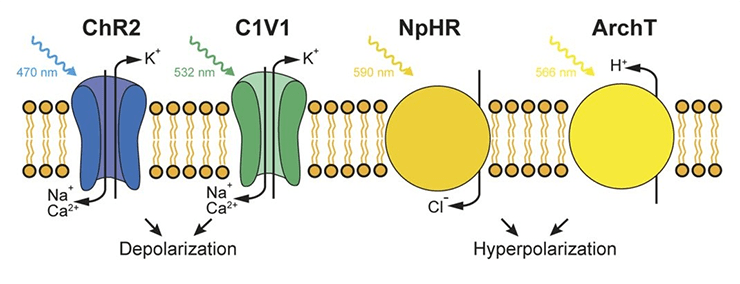
Рисунок 1. Принципы работы классических оптогенетических инструментов: канального родопсина, галородопсина и протонного насоса (археародопсина). Перенос ионов натрия внутрь клетки, обусловленный канальным родопсином 2, приводит к деполяризации, а перенос ионов хлора галородопсином или протонов археародопсином приводят к гиперполяризации клетки.
Канальный родопсин в настоящее время широко используют для активации электровозбудимых клеток. Он долгое время оставался единственным белком, способным на это. Канальный родопсин позволяет положительным ионам перетекать из области с их большей концентрацией в область с меньшей. Из внеклеточного пространства внутрь клетки идет поток ионов натрия, и нейрон возбуждается.
Несмотря на то, что три классических белка-транспортёра в принципе решают задачи активации и деактивации электровозбудимых клеток, у каждого из них есть свои преимущества и недостатки. Например, галородопсин с недостаточно высокой скоростью переносит ионы хлора, а археародопсин в своей работе использует протоны и меняет кислотность среды вокруг нейрона, отчего клетка может начать чувствовать себя неважно. Канальный родопсин — замечательный инструмент, но переносит ионы только пассивно: ему нужна разность концентраций ионов, чтобы все работало. Кроме этого, канальный родопсин не избирателен к ионам и эффективен, только если его освещать синим или фиолетовым светом, а такое коротковолноое излучение очень неглубоко проникает в ткани (рис. 2). Это ограничивает возможность применения белка, если интересующий нас участок мозга или мышцы находится глубоко.
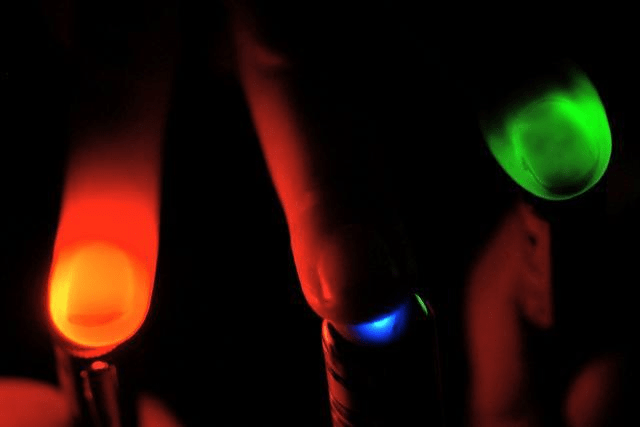
Рисунок 2. В практических применениях оптогенетики важно иметь возможность облучать клетки в глубине тканей. На рисунке видно, что красный свет может просветить ткани глубоко, в то время как синий свет не может проникнуть даже на толщину пальца.
Оптогенетические инструменты будущего
Именно поэтому не прекращается поиск, разработка и оптимизация оптогенетических инструментов нового поколения. В последнее время существенно изменили и подстроили параметры работы популярного канального родопсина: с помощью направленного введения мутаций можно получить его аналоги, более быстрые и специфичные к ионам кальция, с оптимумом работы, сдвинутым в более длинноволновую часть спектра.
Исследование баз данных белков и организмов позволяет отыскивать новые белки-транспортёры, пригодные для нужд оптогенетики. Каждая из этих находок ценна по-своему. Открытые анионные канальные родопсины [6] позволяют деактивировать нейроны, создавая поток отрицательных зарядов внутрь клетки. Химерный белок, состоящий из фоточувствительной части и вирусного калиевого канала [7], может деактивировать нейроны, пропуская ионы калия из цитоплазмы во внеклеточное пространство.
Мы с коллегами из лаборатории перспективных исследований мембранных белков МФТИ [8] внесли свой вклад в открытие и рациональный инжиниринг новых оптогенетических инструментов.
В 2013 году японские ученые открыли натриевый насос KR2 [9], выкачивающие натрий из клетки. Нам с коллегами в 2015 году удалось закристаллизовать белок и решить его структуру в различных функциональных состояниях. Полученные результаты мы опубликовали в журнале Nature Structural and Molecular Biology [10]. Анализируя структуры (рис. 3), мы разобрались в механизмах и условиях работы белка KR2. Оказалось, что у него есть полость, отвечающая за избирательность иона, который будет перенесен. И внеся в белок мутации, затрагивающие эту полость, нам удалось получить модификацию белка, которая прокачивает ионы калия [9], [10]. А ведь именно на паре ионов натрия/калия работают собственные клеточные белки, ответственные за прохождение нервного импульса. Таким образом, на основе полученных данных мы смогли создать более естественный, физиологический оптогенетический инструмент. Хотелось бы отметить, что это пример того, как человек, используя свои знания и воображение, может подстраивать под собственные нужды то, что придумала природа.
Наша группа включает в себя тех, кто может произвести белок в большом количестве, кто имеет большой опыт в кристаллизации мембранных белков (а это очень непростая задача!) и кто умеет решить структуру белка, получив данные рентгеновской дифракции. Затем мы анализируем полученную информацию и проводим дальнейшие эксперименты с модификациями белка. Новые функции мутантных форм исследуем электрофизиологически, методом локальной фиксации потенциала [1]. Финальным аккордом мы стараемся продемонстрировать применимость изученного белка в нервных клетках.
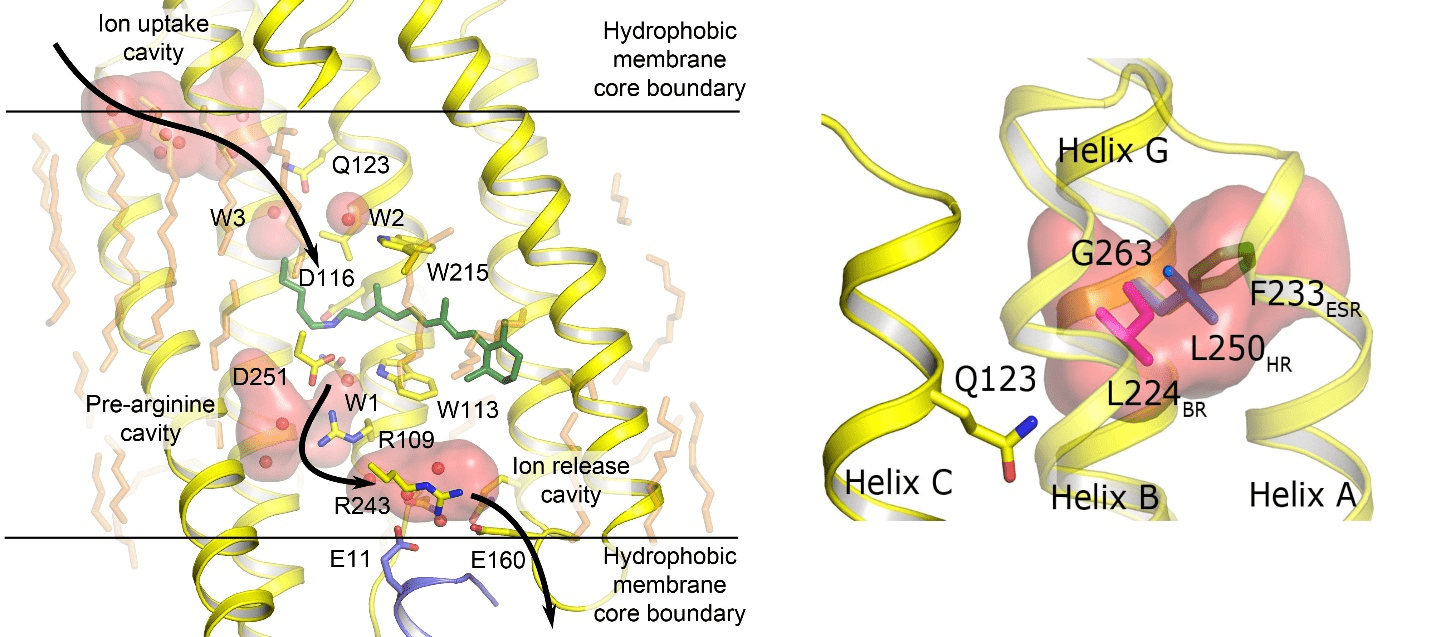
Рисунок 3. Решенная структура натриевого насоса KR2. Слева показана структура KR2, стрелками указан путь иона натрия при прокачивании. Слева сверху на структуре показана полость, где захватывается ион. Полость исполняет роль селективного фильтра. Справа эта полость показана крупно. Разными цветами показаны перепробованные нами мутации, чтобы превратить натриевый насос в калиевый.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Наконец, буквально две недели назад мы опубликовали статью в журнале Science Advances [11], где фактически брошен вызов монополисту — канальному родопсину. Мы открыли протонный насос, переносящий протоны внутрь клетки. Чтобы его найти, мы исследовали широкое множество родопсинов — таких, чья функция была еще неизвестна. Буквально, мы изучали разные микроорганизмы, старались найти те, которые живут в каких-то экзотических условиях. Мы перебрали с десяток кандидатов, прежде чем нашли тот, который давал бы надежду на дальнейшее практическое применение. Ксенородопсины — так называется семейство таких насосов — обнаружены в крошечных археях (наногалоархеях), которые обитают в щелочных водоемах. Мы считаем, что эти организмы используют такой белок для поддержания гомеостаза, преодолевая негативное действие окружающей среды. Ксенородопсины эффективно работают, поглощая красный свет, что позволяет использовать их глубоко в тканях. Поэтому мы смело утверждаем, что открытые белки могут составить достойную конкуренцию канальному родопсину (рис. 4).

Рисунок 4. У исследователей, которым нужно активировать нервные клетки, теперь есть выбор: ксенородопсин (оптимум активности в красном диапазоне) или канальный родопсин (оптимум — в синем диапазоне).
Ксенородопсины переносят протон достаточно быстро, и уже через 2,5 миллисекунды готовы перенести следующий протон. Фактически, это означает, что белок может возбуждать человеческие нейроны с максимальной скоростью. Ксенородопсины способны занять нишу работы с мышечными клетками. Дело в том, что мышечные клетки очень чувствительны к транспорту кальция. Поэтому, при работе с мышцами хотелось бы избежать переноса кальция, чего не может обеспечить канальный родопсин, потому что он неселективен (рис. 1). А ксенородопсины могут.
Как и в случае с натриевым насосом, нам удалось решить структуру ксенородопсина (рис. 5, слева) и понять механизм переноса протона. Многие исследователи, которые работают в области фотоактивных белков, были очень удивлены тому, что такой белок мог найтись в природе. Широко распространено мнение, что перенос протонов через мембрану подобных микроорганизмов в первую очередь обеспечивает клетку энергией. А поведение ксенородопосина не вписывалось в эту картину. Поэтому мы специально показывали на модельных клетках HEK293, что есть ток внутрь (рис. 5, справа сверху). Причем направление тока оставалось тем же, даже если к клетке приложить удерживающее напряжение. Ксенородопсины способны насильно вкачивать протоны в цитоплазму. В этой же работе мы поставили восклицательный знак: на деле показав, что белок может возбуждать нейроны с высокой частотой (рис. 5, справа снизу).
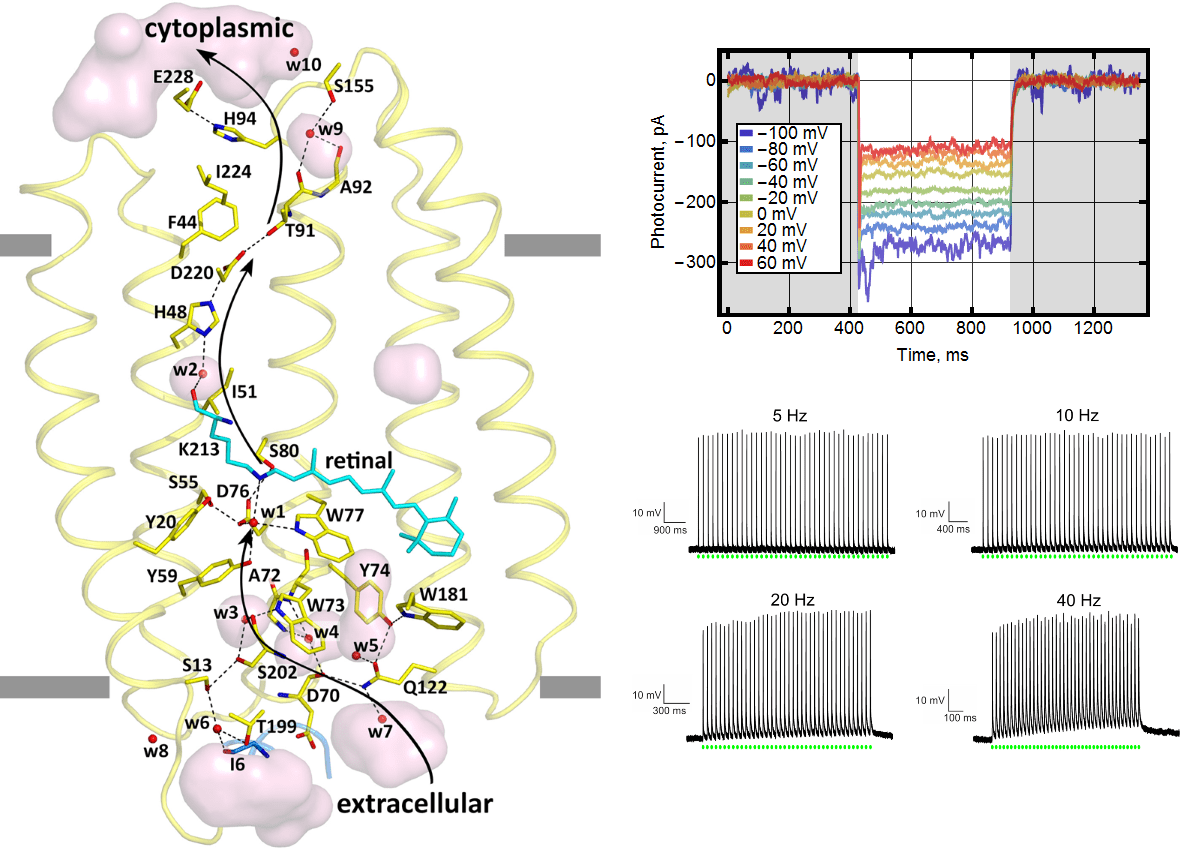
Рисунок 5. Ксенородопсин и его работа. Слева показана кристаллическая структура обратного протонного насоса — ксенородопсина. Справа сверху — наличие тока внутрь клеток HEK293 при различных напряжениях, приложенных к клетке. Справа снизу — возбуждаемые потенциалы действия при облучении нейронов световыми импульсами, повторяющимися с разной частотой.
Чтобы увидеть рисунок в полном размере, нажмите на него.
В заключение
Исследования мозга и минимально инвазивная терапия заболеваний, связанных с нервной системой, продолжают и продолжат быть актуальными в течение XXI века. Оптогенетика и ее инструменты — молекулярные машины и белки-транспортёры — дадут возможность улучшить качество жизни людей с перманентными болевыми синдромами, нейродегенеративными возрастными заболеваниями, помогут частично восстановить зрение и слух [12], [13], а возможно, и мышечные дисфункции. Фундаментальные исследования, поиск и рациональная модификация белков будут лежать в основе успеха оптогенетических подходов в терапии.
Читайте также:





