Нобелевская премия за лечение болезни паркинсона
Мы гордимся тем, что наши ценности неизменны:
- продукция высокого качества
- безопасный и надежный бизнес
- профессиональный сервис
Мы гордимся тем, что наши ценности неизменны:
- продукция высокого качества
- безопасный и надежный бизнес
- профессиональный сервис
200 лет болезни Паркинсона
Болезнь Паркинсона известна уже почти 200 лет. В 1817 году Джеймс Паркинсон обессмертил свое имя, опубликовав подробное описание всего 6 случаев дрожательного паралича в статье, которая называлась "An Essay on the Shaking Palsy". В наши дни паркинсонизм считается вторым по распространенности нейродегенеративным расстройством после болезни Альцгеймера.
Риск заболевания паркинсонизмом возрастает с 1% у тех, кому за 60, до 4% у людей старше 80 лет. Но не милует он и более молодых - в 5-10% случаев заболевание начинается в возрасте от 20 до 50 лет.
Например, известный актер Майкл Фокс, полюбившийся многим после серии фильмов "Назад в будущее", уже 20 лет борется с болезнью Паркинсона, которой заболел в 30-летнем возрасте. По одной из версий, болезнь развилась у него после съемки неудачной сцены повешения в фильме "Обратно в будущее-3".
Версия, конечно, эффектная, и не хуже любой другой, так как, увы, за 200 лет причина болезни Паркинсона не установлена. Нет, конечно, многое о ней ученым стало известно, и даже Нобелевская премия за 2000 год по медицине была присуждена за объяснение механизма болезни Паркинсона. Но объяснить не значит излечить, а механизм и причина - не всегда одно и тоже. Короче, официальная медицина на сегодняшний день причины паркинсонизма не знает, и лечить болезнь Паркинсона не умеет. Вот такой вот печальный факт.
Печальный он еще и потому, что болезнь Паркинсона имеет тенденцию развиваться. Начинаясь со скованности и дрожания мышц, замедленности движений и трудностей с равновесием, паркинсонизм со временем может приводить к слабоумию, тем чаще, чем длительнее период заболевания. Риск слабоумия при болезни Паркинсона возрастает в 6 раз, и в целом деменцией заболевает около 30% больных паркинсонизмом. Это связано со снижением качества жизни и необходимостью в уходе, а также с повышенной смертностью.
Мировое сообщество серьезно озабочено проблемой борьбы с паркинсонизмом, существует несколько крупных организаций содействия проведению научных исследований и повышению качества жизни людей, больных паркинсонизмом, и их семей. День рождения Джеймса Паркинсона, 11 апреля, объявлен Всемирным днем борьбы с паркинсонизмом, а символом международного движения стал красный тюльпан (даже выведен специальный сорт "Доктор Джеймс Паркинсон").
К сожалению, реальных успехов в лечении паркинсонизма медицина пока не достигла. Ни Майклу Фоксу, ни Мохаммеду Али мировые светила не помогли справиться с болезнью. Что же тогда говорить о миллионах простых смертных!
В 1950-х годах шведским ученым Арвидом Карлссоном были исследованы биохимические изменения в клетках мозга, которые приводят к болезни Паркинсона. В черном веществе мозга, которое участвует в регуляции двигательной функции, вырабатывается допамин - нейромедиатор, отвечающий за передачу нервных импульсов. Арвид Карлссон обнаружил, что у больных паркинсонизмом выработка допамина снижается, и связал это с разрушением нейронов, ответственных за производство допамина.
Было обнаружено, что у больных болезнью Паркинсона в черном веществе гибнет до 80 % клеток, производящих допамин. Причина гибели этих клеток до сих пор не установлена, однако и при болезни Паркинсона, и при болезни Альцгеймера внутри нейронов обнаруживаются тельца Леви - внутриклеточные образования, возникающие, как предполагается, при распаде клеточного скелета.
В 2000 году Арвиду Карлссону, Эрику Канделу и Полу Грингарду была присуждена Нобелевская премия по физиологии и медицине за доказательство связи болезни Паркинсона с выработкой допамина и открытие метода лечения болезни Паркинсона.
Не совсем, правда, понятно насчет лечения, судя по тому, что его как не было, так и нет. Но, по крайней мере, Карлссон продемонстрировал, что препараты, уменьшающие уровень допамина, у животных снижают контроль над движением. Поэтому направление лечения определилось - повышать этот самый уровень искусственным путем.
Собственно говоря, больше ничего о причинах болезни Паркинсона не известно. Что же все-таки вызывает нарушение функции производства допамина, никто не знает. Поэтому в большинстве случаев ставится диагноз "идиопатический паркинсонизм" (то есть, не имеющий конкретной причины). Лишь в 15% случаев болезнь Паркинсона связывают с наследственностью - когда имеется ближайший родственник, также страдающий паркинсонизмом. Связывают вполне произвольно, так как причинную связь никто еще не доказал.
И только в 5% случаев заболевание связывается с мутацией одного из нескольких специфических генов. Один из этих генов - белок альфа-синуклеин (SNCA) - является основным компонентом телец Леви, но опять-таки процент этих мутаций составляет всего 2% от случаев семейных заболеваний. А видов мутаций SNCA около 40, и, следовательно, столько же, если не больше, найдется причин, их вызывающих. На генном, естественно, уровне.
Различного вида домыслы, типа того, что паркинсонизм у Фокса возник из-за того, что его подвесили за шею, а у Мохаммеда Али - из-за перенесенных им черепно-мозговых травм - относятся к разряду спекуляций. Почему-то считается, что врачу изрекать ничем не доказанную чушь можно, а вот говорить о том, что нейродегенеративные заболевания могут иметь паразитарную природу - это нарушение врачебной этики.
Кстати, сам Мохаммед Али считает, что никакой особенной предрасположенности к паркинсонизму у боксеров нет. Уж наверное, логичнее предположить наличие у боксеров предпосылок к инсультам, чем к избирательному разрушению клеток черного тела.
Что ж, большого прогресса в лечении паркинсонизма медицина пока не достигла. Также мало что известно о факторах риска и факторах устойчивости к заболеванию паркинсонизмом. Давайте вкратце их рассмотрим.
Итак, следующие факторы увеличивают риск болезни Паркинсона и ухудшают прогноз.
1. Данные четко указывают на повышенный риск заболевания паркинсонизмом у людей, работавших с некоторыми видами пестицидов. Возможно, именно с этим связано то, что в сельских местностях заболеваемость болезнью Паркинсона выше. Установлено, что такие пестициды, как ротенон или паракват, органо-хлористые соединения (ДДТ и линдан) и гербициды, такие как печально известный "Эйджент Оранж", могут удвоить, а то и утроить риск болезни Паркинсона.
Исследования показали, что частота заболеваний болезнью Паркинсона у садоводов-любителей выше на 9%, чем у людей, которые не имеют отношения к пестицидам. У фермеров вероятность заболеть оказалась выше на 43 процента.
2. Токсины и тяжелые металлы также могут способствовать заболеванию паркинсонизмом, например, у шахтеров, длительно контактирующих с марганцевой рудой. Хотя убедительных исследований, подтверждающих воздействие тяжелых металлов, за счет их возможного накопления в черной субстанции, пока нет.
3. В 2005 году была опубликована интересная информация о том, что у мужчин среднего возраста, которые выпивают стакан или два стакана молока ежедневно, может позже возрастать риск заболевания. Какие ингредиенты или возможные загрязнения в молоке отвечают за этот эффект, неясно, но исследования показывают, что это не кальций. Этот факт также может способствовать повышению заболеваемости в сельской местности.
4. Прием амфетаминов по рецептам тоже может повысить отдаленный риск заболевания.
5. Обнаружена также взаимосвязь между болезнью Паркинсона и чистотой питьевой воды (исследование проводилось в мае 2010 года). Учитывая загрязненность химикатами природных источников, употребление неочищенной воды (даже родниковой), значительно повышает риск заболевания паркинсонизмом.
Как видим, по сравнению с другими заболеваниями, факторов риска для болезни Паркинсона выявлено довольно мало. Теперь о факторах, улучшающих прогноз.
1. Четко установлено, что курильщики меньше рискуют заболеть паркинсонизмом - на 30% меньше, чем некурящие. Причина этого неизвестна, но предполагают, что никотин действует как стимулятор выработки допамина. Табачный дым содержит соединения, действующие как ингибиторы МАО, которые также могут способствовать этому эффекту.
2. В нескольких крупных исследованиях было показано, что употребление кофеина связано с уменьшением риска развития болезни Паркинсона у мужчин. По сравнению с людьми, которые выпивают 1-2 чашки кофе в день, уровень заболеваемости у людей, которые выпивают 3-4 чашки, меньше на 15%; у тех, кто выпивает 5-6 чашек, - на 35%; а у тех, кто выпивает более 7 чашек в день - на 70%.
Для женщин в исследованиях были получены противоречивые результаты. Исследователи склонны считать, что это связано с тем, что не было учтено возможное влияние гормонозаместительной терапии. В дополнительных исследованиях было показано, что женщины в постменопаузе, принимавшие гормональные препараты и выпивавшие больше пяти чашек кофе в день, были в полтора раза более склонны к развитию болезни Паркинсона, чем те, кто не проходил ГЗТ.
Похоже, что женщинам, принимающим гормональные препараты (думаю, это относится и к оральным ПЗС), не стоит слишком увлекаться кофе, если они не хотят попасть в паркинсоновскую группу риска. Эти два удовольствия не следует совмещать, чтобы не получить гремучую смесь.
3. В некоторых исследованиях было показано, что средиземноморская диета, в частности, употребление в пищу орехов (кроме арахиса) и оливкового масла снижает риск развития заболевания. Защитное действие может оказывать также употребление достаточного количества экологически чистых овощей и фруктов, хотя и не дает 100%-й гарантии.
Несмотря на широко распространенную лекарственную терапию, болезнь Паркинсона остается прогрессирующей и неизлечимой. При ранних симптомах современная терапия оказывает определенное действие, главным образом, за счет стимуляции выработки допамина. Однако, по мере прогрессирования болезни, эти препараты становятся неэффективными, и в то же время вызывают осложнения - дискинезию и судороги.
Терапия при болезни Паркинсона включает назначение холинолитических средств (атропин, скополамин), синтетических препаратов (циклодол, тропацин, ридинол, динезин, мидокалм), витамина В6. Для улучшения подвижности мышц применяют L-допу (обычно в сочетании с ингибиторами декарбоксилазы и фермента COMT), агонисты допамина и ингибиторы МАО-B.
Для лечения пациентов с болезнью Паркинсона более молодого возраста в некоторых случаях применяют хирургическое вмешательство. Некоторую эффективность показывают также диета и двигательные упражнения.
Леводопа наиболее широко используется для лечения паркинсонизма уже более 30 лет. Поскольку моторные симптомы вызываются отсутствием допамина в черной субстанции, прием леводопы временно уменьшает нарушения двигательных функций.
Однако только 5-10% леводопы проходит через гематоэнцефалический барьер. Остальное количество препарата часто метаболизируется в допамин в других местах, вызывая различные побочные эффекты, в том числе тошноту, дискинезию и тугоподвижность суставов. Ингибиторы декарбоксилазы помогают предотвратить эти побочные эффекты, тем самым повышая биодоступность леводопы.
Ингибиторы COMT (катехол-О-метилтрансферазы) продлевают эффект леводопы, однако их польза ограничивается возможными побочными эффектами, такими как повреждение печени.
Агонисты допамина (например, апоморфин) имеют сходное действие с леводопой. Они предпочтительнее для начального лечения в более молодом возрасте, тогда как леводопа - в более позднем. Агонисты допамина имеют значительное, хотя обычно более мягкое побочное действие, включая сонливость, галлюцинации, бессонницу, тошноту и запор. Поскольку такие эффекты, как расстройство сознания и галлюцинации, встречаются довольно часто, больные, получающие апоморфин, нуждаются в постоянном наблюдении.
Ингибиторы МАО-B повышают уровень допамина в базальных клетках, блокируя его метаболизм. Они не дают ферменту МАО-В разрушать допамин, который производят допаминергические нейроны. Прием ингибиторов МАО-B позволяет уменьшить моторные симптомы и отсрочить необходимость леводопы в начале заболевания, но они производят больше побочных эффектов и менее эффективны, чем леводопа.
Из хирургических методов наиболее часто используется глубокая стимуляция мозга (DBS). Она заключается во введении в мозг электрического стимулятора, который посылает импульсы определенным областям мозга. DBS применяется в случаях далеко зашедшей болезни Паркинсона, когда медикаментозного лечения уже недостаточно, или для тех, кто не переносит лекарства.
Менее распространенными хирургическими методами являются паллидотомия и таламотомия конкретных подкорковых областей (доступны лишь некоторым нейрохирургам) и экспериментальный метод - нейротрансплантация.
Реабилитация - регулярные физические упражнения с или без физиотерапии - может быть полезна для поддержания и улучшения подвижности, гибкости, силы, походки и в целом качества жизни. Реабилитация также широко практикуется при лечении речевых расстройств, связанных с болезнью Паркинсона. Правда, исследований эффективности трудотерапии проводилось мало, но есть некоторые признаки того, что она может улучшить двигательные навыки и качество жизни в течение всего срока лечения.
Диета необходима для того, чтобы нормализовать процесс пищеварения, который может быть нарушен при болезни Паркинсона, в результате чего может быть запор и гастропарез; избежать потери или набора веса, улучшить ситуацию при проблемах с глотанием (дисфагии). Кроме того, сбалансированное питание улучшает усвоение лекарственных средств.
Леводопа и белки используют одну и ту же систему транспортировки в кишечнике и через гематоэнцефалический барьер, тем самым конкурируя за усвоение. Если принимать их вместе, эффективность препарата снижается.
Поэтому при приеме леводопы следует избегать чрезмерного употребления белков, а рекомендуется хорошо сбалансированная диета типа средиземноморской. Чтобы свести к минимуму взаимодействие с белками, леводопу следует принимать за 30 минут до еды.
Хотя другого лечения медицина пока не предлагает, последние исследования показывают, что на самом деле прием леводопы не лечит болезнь Паркинсона, а ускоряет (!) прогрессирование заболевания. В статье, опубликованной в "New England Journal of Medicine", сообщалось о результатах сканирования мозга 361 пациента с болезнью Паркинсона. В двух группах пациентов у тех, кто получал леводопу, симптоматика была лучше, чем у тех, кто получал плацебо. Однако сканирование мозга показало, что пациенты, принимавшие леводопу, утратили больше критических нервных клеток.
Ученые предполагают, что, возможно, леводопа выступает в качестве окислителя, вызывающего повреждение нервных клеток. Так что долгосрочный прогноз при лечении леводопой остается пока неясным.
Перспективы в лечении болезни Паркинсона в настоящее время связывают с разработкой и совершенствованием антиэксайтотоксических (препятствующих дегенерации двигательных нейронов) и нейропротективных препаратов, новых и более эффективных нейротрофинов (поддерживающих жизнеспособность нейронов) и антиапоптозных средств.
Это направление, очевидно, чисто аллопатическое, то есть, направленное на "поддержку штанов", которые спадают по неизвестной причине.
Более перспективным, по моему мнению, является другое направление - разработка более эффективных антиоксидантов и иммуномодуляторов, но и это чисто оборонительные мероприятия, а одной обороной добиться решающего успеха невозможно. Хотя технологии здесь применяются впечатляющие - вплоть до генной инженерии.
И еще одно направление - "путь глубокого бурения". Нет, такого термина в медицине пока не существует, я сам его придумал для обозначения некоторых разработок типа генных исследований, стволовых клеток и нейрохирургии. Пока средства на дорогие исследования выделяются, почему бы их не освоить и не забуриться поглубже, чтобы с поверхности не было видно, чем ты там занимаешься?
Ну в самом деле, если твердо связать с мутацией генов можно только 5% случаев заболевания паркинсонизмом, нельзя же считать генные исследования единственным средством для воздействия на причину заболевания! Что модно, то модно, но не более того. И результаты, по крайней мере, пока - или не имеющие никакого практического применения, или же малочисленные и противоречащие один другому.
Пересадка стволовых и нервных клеток тоже поражала воображение, до тех пор, пока недавно не было установлено, что пересадка клеток мозга не является панацеей от болезни Паркинсона. При посмертном вскрытии нескольких пациентов, перенесших пересадку мозговой ткани абортированных эмбрионов, было обнаружено, что трансплантаты тоже поражены болезнью Паркинсона. Об этом сообщили в журнале "Nature Medicine" Джеффри Кордовер и его коллеги из Медицинского центра при Университете Раш (Чикаго) в 2007 году.
Ученые пока не могут предсказать, будут ли поражаться болезнью собственные стволовые клетки пациентов, но это вполне возможно, даже если они получены из клеток кожи. Единственный положительный вывод, который, я считаю, можно сделать из этого негативного факта - это подтверждение возможной инфекционной природы болезни Паркинсона, о которой речь пойдет ниже.
Такой вывод, собственно говоря, сделали и авторы исследования, о котором шла речь выше. Они не исключают, что заражение пересаженных здоровых клеток от больных вызывается аномальным белком альфа-синуклеином (тем самым, из которого состоят тельца Леви) - то есть, передача болезни Паркинсона происходит так же, как и при прионовых болезнях (в частности, при коровьем бешенстве). В качестве альтернативного варианта называется также аутоиммунная реакция, приводящая к воспалительным процессам в пересаженной ткани.
Остается еще надеяться на чудо, которое помогло исцелиться от болезни Паркинсона 49-летней французской монахине Мари Симон-Пьер. Когда 13 мая 2005 года Бенедикт XVI выразил согласие досрочно начать процесс беатификации своего предшественника, сестры монастыря во время совместной молитвы стали просить покойного Иоанна Павла II о заступничестве перед Богом за исцеление больной сестры Мари.
Ровно через два месяца после смерти Иоанна Павла II Симон-Пьер исцелилась - исчезли боль и непроизвольное дрожание конечностей. Медики не смогли с помощью естественнонаучных методов объяснить факт исцеления. Тут, сами понимаете, нужно, чтобы было кому за вас молиться.
И поэтому сейчас настало время поговорить о двух не слишком популярных в официальных кругах теориях, объясняющих причины заболевания болезнью Паркинсона.

Представленный фрагмент произведения размещен по согласованию с распространителем легального контента ООО "ЛитРес" (не более 20% исходного текста). Если вы считаете, что размещение материала нарушает чьи-либо права, то сообщите нам об этом.
Оплатили, но не знаете что делать дальше?
Автор книги: Аркадий Эйзлер
Возрастные ограничения: +12
Текущая страница: 13 (всего у книги 25 страниц) [доступный отрывок для чтения: 6 страниц]
Мы уже неоднократно упоминали светлые головы, внесшие весомый вклад в развитие науки, диагностики и терапии БП, начиная от ее первооткрывателя Джеймса Паркинсона. Мы будем и в дальнейшем продолжать высоко отмечать многолетнюю интенсивную работу этих локомотивов науки, доносящих результаты своих усилий до широкой общественности – начиная от публикаций в именитых интернациональных научных изданиях, и заканчивая получением бесценнейшего из трофеев – Нобелевской премии. Однако все громче раздаются голоса, ставящие под сомнение некоторые заключения ответственных органов, выражая непонимание мотивов, которыми руководствуется высокая комиссия при вынесении решений. Людей, связавших свою судьбу с БП, волнует факт деформации исторических приоритетов, возникших в связи оценкой деятельности отдельных ученых и их вкладов в развитие науки о БП и разработку методов её лечения.
Вскоре появились первые наблюдения, показывающие, что допамин имеет собственную функцию в организме. Хорникевич, работавший в то время в Оксфорде, подтвердил эти предположения своими экспериментами на морских свинках. В то время специалисты изучали допамин в опытах с животными только при изучении синтеза норадреналина. Но именно допамин стал предметом острой конкурентной борьбы между шведом А. Карлссоном и австрийцем украинского происхождения О. Хорникевичем, которые в одно и то же время установили зависимость между недостатком допамина и болезнью Паркинсона.
В. БИРКМАЙЕР, СОГЛАСИЛСЯ ПРИМЕНИТЬ ТЕРАПИЮ УЧЕНОГО У СЕБЯ В КЛИНИКЕ И БЫЛ УДИВЛЕН БЫСТРЫМ И НЕОЖИДАННЫМ УСПЕХОМ.
ПРИКОВАННЫЕ К ПОСТЕЛИ ПАЦИЕНТЫ МОГЛИ СНОВА ВСТАВАТЬ, ДАЖЕ ХОДИТЬ, ИХ РЕЧЬ СНОВА СТАЛА ПОНЯТНОЙ.
Еще в Оксфорде Хорникевич доказал, что допамин выполняет и другие, собственные функции в организме. Возвратившись в Вену в 1959 г., он начал выявлять это вещество в мозге крыс и наблюдать, как медикаменты, действующие на мозг, влияют на концентрацию допамина. Позже ученый и его коллеги приступили и к изучению мозга пациентов, умерших вследствие болезни Паркинсона. Несмотря на то, что по причине нестабильности субстанции этот материал был малопригоден для работы, ученые продолжили свои исследования.
В то время стало известно, что субстанция резерпина вызывает у животных симптомы, подобные болезни Паркинсона у людей. Первоначально, до появления современных нейролептических средств, резерпин применяли для лечения психических заболеваний и как антигипертоническое средство для лечения артериального давления. В тканях мозга резерпин опустошает запасы биогенных аминов, включая допамин, серотонин и норадреналин. Медикамент вызывал у пациентов появление симптомов болезни Паркинсона, которые прекращались при отмене препарата.
Между тем, шведские исследователи установили, что концентрация допамина особенно высока в центрах мозга, ответственных за моторику. Вскоре после того, как Хорникевич возвратился в Вену, Карлссон опубликовал сообщение о наличии допамина в определенных участках мозга, а именно, в базальных ганглиях – ответственных за реализацию автоматических движений и планирование моторных программ. Тем самым была также установлена связь недостатка допамина с болезнью Паркинсона.
Мы уже отмечали, что открыватели механизмов болезни Паркинсона шли параллельным курсом с познанием законов возникновения и лечения болезни Альцгеймера, и в центр внимания ученых попадал каждый раз один из сигнальных трансмиттеров – допамин, который вместе с ацетилхолином, серотонином и адреналином рассматривались только как носители информации. Однако, позже было установлено, что если ацетилхолин, на самом деле, является переносчиком информации между нервными окончаниями, то допамин, в отличие от ранее существующего мнения, отвечает за моторику движений и степень раздражения. Между ними возникает своеобразный разговор. Впоследствии также стало ясно, что только допамин уже в раннем возрасте влияет на процесс обучения, доводя скорость опознавания образца до автоматизма.
Ученым очень трудно расставаться со своими идеями, даже если они ложные. В эти идеи вложены бессонные ночи раздумий, долгие годы труда, много материальных средств. Отказаться от своих взглядов – означает признать поражение своих идей и бесперспективность своей работы в острой конкурентной борьбе концепций и мнений и тем самым обречь себя на финансовое и идейное вымирание. Бывает и наоборот – когда при конкурентной борьбе идей происходит взаимное стимулирование, появляется чувство азарта и возникает потребность в обмене опытом. Нередко общая картина успеха вырисовывается во всех деталях, когда добавляется очередной камешек в мозаичную картину, и часто огромный и сложный процесс приводится в движение посредством простого зубчатого зацепления маленького колесика. Случается и так, что различные эксперименты в одинаковых областях протекают параллельно, и они очень ценны для науки, ибо дают импульсы для новых идей и расширения наших знаний с удвоенной вероятностью.
Хорникевич никогда не прекращал заниматься проблемой болезни Паркинсона. Недавно он опубликовал две работы, в которых возвращается к самому началу своих исследований. Еще в 1960 г. Хорникевич вместе со своим коллегой Эрингером (Ehringer) отметил при болезни Паркинсона пониженное содержание в мозге адреналина. Впоследствии он безуспешно пытался обратить внимание других ученых на это явление. Дело в том, что препарат L-Dopa – субстанция предшественника допамина – настолько успешно применялся для лечения паркинсонизма, что интерес всех исследователей был прикован только к допамину. Самого Хорникевича эти наблюдения за адреналином не оставляли и не оставляют в покое до сих пор – и по праву!
МЕДИКАМЕНТ L-DOPA БЫЛ И ОСТАЕТСЯ СТАНДАРТНЫМ В ЛЕЧЕНИИ БОЛЕЗНИ ПАРКИНСОНА, НО НОВЫЕ ПУТИ В БОРЬБЕ С ЭТОЙ БОЛЕЗНЬЮ ОТКРЫВАЕТ И ГЕННАЯ ТЕХНОЛОГИЯ.
Сейчас Хорникевич концентрируется на улучшении своей терапии с учетом уменьшения побочных явлений. Очень важную роль играет при этом индивидуальная нейрохимия отдельных пациентов, которой в недалеком будущем необходимо будет уделять большее внимание.
Итак, оба нейрофармаколога, Карлссон и Хорникевич, не только развили учение и теорию о допамине, но и довели ее до практического применения для лечения пациентов.
К заслугам Карлссона относится не только установление влияния недостатка допамина на возникновение и развитие болезни Паркинсона, но также и на поведение других переносчиков сигнальных веществ в нервной системе. Его работы внесли большой вклад в производство антидепрессивных препаратов. Кроме того, Карлссон выяснил механизм действия медикаментов, применяемых, например, для лечения шизофрении.
К концу 60-х годов было еще неясно, как действуют, например, допамин, норадреналин и серотонин в качестве трансмиттеров в центральной нервной системе. Заслуга другого Нобелевского лауреата Пола Грингарда (Р. Greengard) состоит в том, что он разгадал основополагающие молекулярные феномены, происходящие на местах контактов нервных клеток – синапсов. Прежде всего, его интересовали так называемые, медленные синапсовые передачи. Они играют важную роль в функциях центральной нервной системы и влияют, например, на настроение и внимание.
Как установил Грингард, медленные синапсовые передачи тесно связаны с реакциями, называемыми фосфорированием. При этом связь фосфатных групп с молекулой изменяет ее форму и функции. Ученый наблюдал, что допамин вызывает в клетке биохимический каскад, который влияет на многочисленные протеины, а также и на молекулярные щели, называемые ионными каналами. Через эти каналы, сосредоточенные в клеточной мембране, в клетку могут проникать определенные ионы, например, кальций, в результате чего в синапсах выделяется повышенное количество переносчиков информации – трансмиттеров. Это ведет к изменению электрического потенциала и, тем самым, к изменению уровня активности нервной клетки – со всеми последствиями для функций мозга.
Фосфорирование протеинов играет важную роль в феноменах, которые разгадал третий Нобелевский лауреат 2002 г. Эрик Кандел. Ему удалось перекинуть мост между элементарными молекулярными процессами и высшими функциями головного мозга, такими как обучение и память.
При повторении раздражения организм улитки реагирует сильнее – очевидно, он научился отвечать на опасность. Если моллюск подвергнуть такому раздражению многократно, накопленный опыт поведения переходит в долговременную память, удерживающую информацию уже на период до нескольких недель. Как установил Кандел, это связано не с изменением уже имеющихся протеинов, а с синтезом новых, которые проникают в ядро клетки, вызывают там процесс считывания информации с определенных генов и перевода ее в белок. В итоге синапсы изменяют свои свойства.
К ЗАСЛУГАМ КАРЛССОНА ОТНОСИТСЯ НЕ ТОЛЬКО УСТАНОВЛЕНИЕ ВЛИЯНИЯ НЕДОСТАТКА ДОПАМИНА НА ВОЗНИКНОВЕНИЕ И РАЗВИТИЕ БОЛЕЗНИ ПАРКИНСОНА, НО ТАКЖЕ И НА ПОВЕДЕНИЕ ДРУГИХ ПЕРЕНОСЧИКОВ СИГНАЛЬНЫХ ВЕЩЕСТВ В НЕРВНОЙ СИСТЕМЕ.
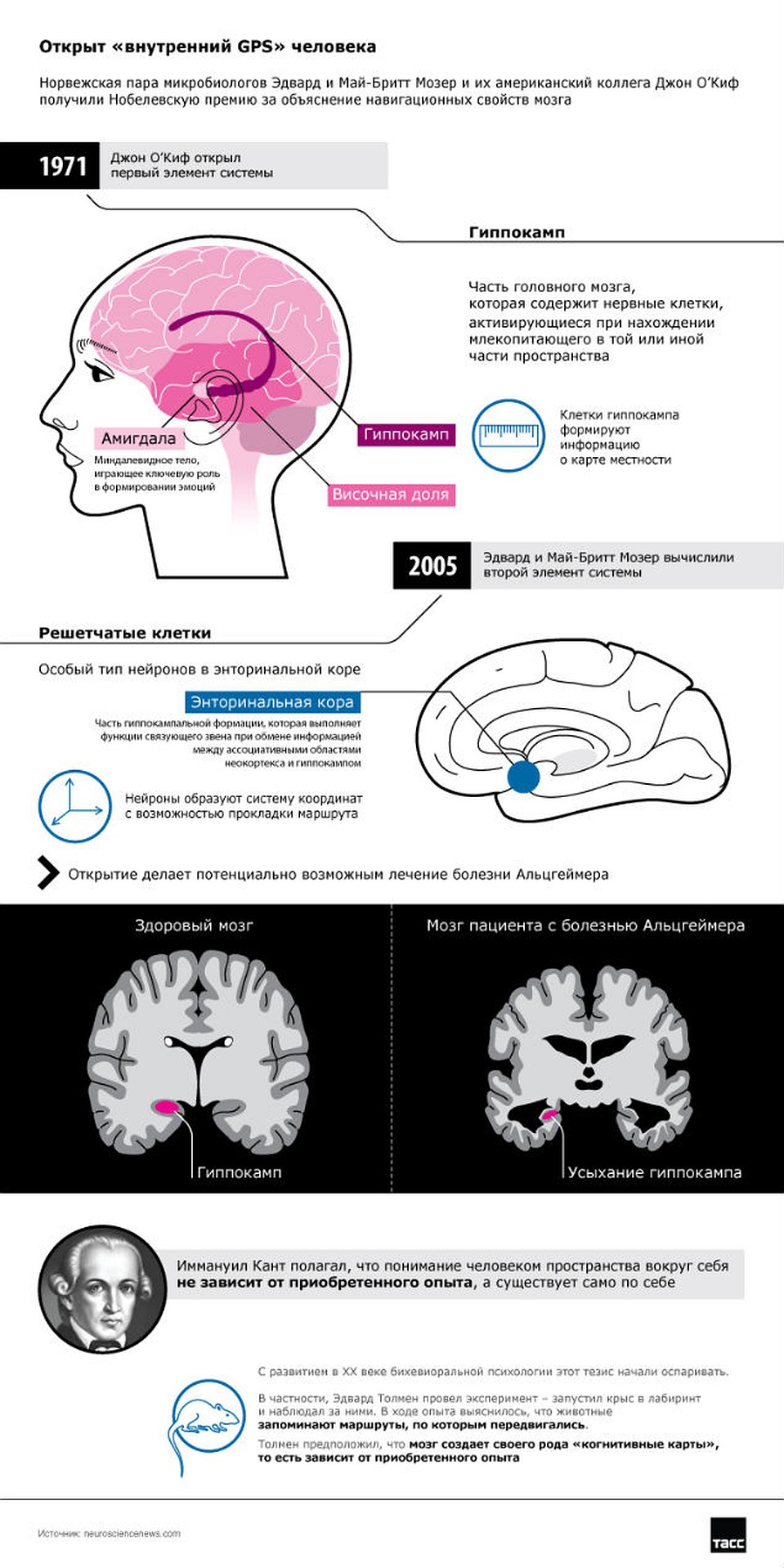
Так, например, Нобелевская премия по медицине за 2014 г присуждена троим исследователям: американцу Джону О’Кифу и исследователям из Норвегии – супругам Май-Бритт и Эдварду Мозерам. Исследования этих ученых в области лимбической системы головного мозга, в частности гиппокампа, привели к определению его роли в пространственной памяти и навигации, нарушение функций которого ведет к целому ряду нейрологических заболеваний. Еще в 1971 г. Дж. О’Киф установил, что гиппокамп является центром пространственной ориентации у млекопитающих. Супруги Май-Бритт и Эдвард Мозеры продолжили работу Дж. О’Кифа, изучая проблемы восприятия и запоминания мозгом ориентации тела в пространстве. В 2005 г. Мозеры в ходе экспериментов над крысами открыли grid-нейроны (клетки-решетки), расположенные в энторинальной области коры головного мозга. Эти клетки образуют универсальную картографическую систему, позволяющую млекопитающим найти свое место в любой местности. Такая система в случае ее нарушения приводит к утрате способности обучения, запоминания и ориентации, а следовательно и управления координацией движений. Тем самым, познав причины возникновения этих аномалий, ученые надеются найти средство борьбы с такими заболеваниями, как болезнь Паркинсона, болезнь Альцгеймера, болезнь Хантингтона и другими.
КЛЮЧ К ЛЕЧЕНИЮ БОЛЕЗНЕЙ АЛЬЦГЕЙМЕРА И ПАРКИНСОНА
В понедельник, 6 октября, Нобелевский комитет объявил имена лауреатов премии по физиологии и медицине. Победителями стали нейробиологи - ученые, исследующие устройство и работу головного мозга. Это супружеская пара из Норвегии Эдвард и Мэй-Бритт Мозеры , а также американец Джон О'Киф.
- Наш мозг состоит более чем из 100 миллиардов нейронов и пока еще изучен очень мало. То, что именно за работы нейробиологов вручена Нобелевская премия, подчеркивает важность таких исследований для науки, общества, всего мира, и меня как ученого это очень радует, - говорит известный нейробиолог, профессор Сколковского института науки и технологий (Сколтеха) и Санкт-Петербургского государственного университета Рауль Гайнетдинов. - Программа изучения мозга во многих странах мира считается сейчас одной из самых приоритетных, в России также планируется выделение значительных средств на ее развитие - надеюсь, будут успехи.
В частности, потеря пространственной ориентации наблюдается при болезни Альцеймера, Паркинсона , рассеянном склерозе и многих других нейродегенеративных заболеваниях. Результаты исследований нынешних нобелевских лауреатов открывают путь к разработке революционных средств лечения таких болезней.
РЕВОЛЮЦИЯ В УЧЕБЕ И ЧТЕНИЕ МЫСЛЕЙ
- Весь мир мы воспринимаем так, как он отображается нашим мозгом: цвета, запахи, ориентация в пространстве, - поясняет профессор. - Если понимать, как мозг распознает сигналы из окружающей среды, то мы можем поддерживать этот важнейший орган в здоровом состоянии, противостоять нарушениям, которые происходят с возрастом, из-за травм и болезней.
А еще расшифровка работы мозга может помочь кардинально улучшить, например, способы обучения, запоминания тех или иных навыков. Если известно, как мозг воспринимает, кодирует информацию, то можно строить обучение так, чтобы мозг был более активным и результаты - гораздо более эффективными.
С другой стороны, по активности определенных нейронов можно узнавать, чем мозг занимается в тот или иной момент. Так, нынешние лауреаты Нобелевской премии выяснили, что открытые ими нейроны отвечают за путь мыши в пространстве: о какой области пути мышь думает и где она находится. Так же, как сейчас по смартфону с помощью GPS-навигатора мы определяем, где находимся, теоретически можно узнать это и по нейронам: в зависимости от того, какие их виды в мозге активированы.
Если человек находится в коме, спит или без сознания, то появляется возможность считывать и расшифровывать информацию из его мозга. Также в дальнейшем это поможет понимать, как человек принимает решения, на чем основаны его те или иные поступки, почему возникают те или иные эмоции.
КСТАТИ
- Исторически Россия была одной из родоначальниц нейронауки, науки о мозге, - говорит профессор Хайтович . - Этот исторический задел сохранился до сих пор. Однако сейчас наша страна оказывает на мировую нейробиологию несравненно меньшее влияние, чем 100 лет назад. В то же время есть ряд научных центров, лабораторий, которые выходят на серьезный международный уровень. В частности, один из таких центров нейронауки сейчас формируется в рамках Центра биомедицинских технологий Сколтеха .
Читайте также:







