Образование и обезвреживание аммиака в нервной ткани
1. Источники и пути образования аммиака в организме. Возможные механизмы токсического действия аммиака.
2. Обезвреживание аммиака в тканях. Транспортные формы аммиака в крови (глутамин, аспарагин, аланин), их роль в организме.
3. Выведение аммиака почками: ферменты, участвующие в этом процессе, механизм транспорта, роль в организме.
4. Биосинтез мочевины в печени: локализация в клетке, ферменты, промежуточные продукты, энергетический баланс, регуляция, роль в организме.
5. Взаимосвязь цикла мочевинообразования и цикла трикарбоновых кислот.
6. Генетические дефекты ферментов цикла мочевинообразования: основные симптомы заболеваний, биохимическая диагностика, особенности диеты.
7. Клинико-диагностическое значение определения содержания мочевины в крови и моче.
Источники и пути образования аммиака.
24.1.1. Аммиак (NН 3 ) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование.
Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН 3 легко превращается в ион аммония NН 4 + , который не способен проникать через биологические мембраны и задерживается в клетке. Накопление NН 4 + вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака (см. рисунок 24.1).
Рисунок 24.1. Образование аммиака в организме и его обезвреживание.
Образование транспортных форм аммиака в тканях.
24.2.1 Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин.
24.2.2. Образование глутамина и аспарагина из глутамата и аспартата соответственно происходит во многих тканях, включая головной мозг:
Глутамин - нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина.
24.2.3. Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования , катализируемой глутаматдегидрогеназой(см. параграф 18.6.2):
Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой.
Глутамат + Пируват α-Кетоглутарат + Аланин
Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат.
α-Кетоглутарат + Аланин Глутамат + Пируват
Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину.
Экскреция аммиака с мочой.
24.3.1. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака.
Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака.
Аспарагин аналогичным образом подвергается гидролизу при участии аспарагиназы, присутствующей в клетках канальцев почек.
24.3.2. Аммиак секретируется в просвет почечных канальцев и выводится в виде солей минеральных и органических кислот, например:
NН 3 + НСl = NН 4 Сl
хлорид аммония
Образование солей аммония в почечных канальцах является важным механизмом регуляции кислотно-основного состояния организма. Оно резко возрастает при метаболическом ацидозе - накоплении в организме кислот и снижается при потере кислот организмом (алкалозе).
Биосинтез мочевины.
24.4.1. Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.
Последующие реакции протекают в цитоплазме клеток печени.
Общая схема орнитинового цикла представлена на рисунке 24.2:
Рисунок 24.2. Схема орнитинового цикла и его связь с превращениями фумаровой и аспарагиновой кислот.
Цифрами обозначены ферменты, катализирующие реакции орнитинового цикла: 1 – карбамоилфосфатсинтетаза; 2 – орнитин-карбамоилтрансфераза; 3 – аргининосукцинатсинтетаза; 4 – аргининосукцинатлиаза; 5 – аргиназа.
24.4.2. Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот:
- пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе;
- поступление СО 2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК;
- в цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината.
24.4.3. Регуляция активности ферментов цикла осуществляется главным образом на уровне карбамоилфосфатсинтетазы, которая малоактивна в отсутствие своего аллостерического активатора - N-ацетил-глутамата. Концентрация последнего зависит от концентрации его предшественников (ацетил-КоА и глутамата), а также аргинина, который является аллостерическим активатором N-ацетилглутаматсинтазы:
Ацетил-КоА + Глутамат N-ацетилглутамат + КоА-SH
Концентрация ферментов орнитинового цикла зависит от содержания белка в пищевом рационе. При переходе на диету, богатую белком, в печени повышается синтез ферментов орнитинового цикла. При возвращении к сбалансированному рациону концентрация ферментов снижается. В условиях голодания, когда усиливается распад тканевых белков и использование аминокислот как энергетических субстратов, возрастает продукция аммиака, концентрация ферментов орнитинового цикла увеличивается.
24.4.4. Нарушения орнитинового цикла. Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует.
Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH 4 + в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка.
Лабораторная диагностика заболеваний включает определение содержания аммиака и метаболитов орнитинового цикла в крови, моче и спинномозговой жидкости; в сложных случаях прибегают к биопсии печени.
Значительное улучшение наблюдается при ограничении белка в диете, при этом могут быть предотвращены многие нарушения мозговой деятельности. Малобелковая диета приводит к снижению содержания аммиака в крови и к улучшению клинической картины при мягких формах этих наследственных нарушений. Пищу следует принимать часто, небольшими порциями, для того чтобы избежать резкого повышения уровня аммиака в крови.
24.4.5. Клинико-диагностическое значение определения мочевины в крови и моче. В крови здорового человека содержание мочевины составляет 3,33 – 8,32 ммоль/л. За сутки с мочой выводится 20 – 35 г мочевины.
Изменения содержания мочевины в крови при заболеваниях зависят от соотношения процессов её образования в печени и выведения почками. Повышение содержания мочевины в крови (гиперазотемия) отмечается при почечной недостаточности, снижение – при недостаточности печени, при диете с низким содержанием белков.
Повышение экскреции мочевины с мочой наблюдается при употреблении пищи с высоким содержанием белков, при заболеваниях, сопровождающихся усилением катаболизма белков в тканях, при приёме некоторых лекарств (например, салицилатов). Снижение экскреции мочевины с мочой характерно для заболеваний и токсических поражений печени, заболеваний почек, сопровождающихся нарушением их фильтрационной способности.
В состоянии азотистого равновесия организм взрослого человека потребляет и выделяет около 15 г азота за сутки. Из экскретируемого с мочой азота на долю мочевины приходится 85%, креатинина – 5%, аммонийных солей – 3%, мочевой кислоты – 10%, другие формы – 3–6%. В образовании мочевины и аммонийных солей главную роль играет аммиак.
Основные источники NH3:
1. трансдезаминирование аминокислот;
2. дезаминирование биогенных аминов;
3. распад пуриновых и пиримидиновых азотистых оснований;
4. окислительное дезаминирование аминокислот (преимущественно глутамата);
5. дезамидирование глутамина и аспарагина;
6. поступление аммиака из кишечника в портальнюю вену (образуется при гниении белков в кишечнике).
Аммиак является высокотоксичным соединением. Он легко всасывается из кишечника в портальную венозную кровь, где его уровень намного выше, чем в общем кровотоке. В норме печень быстро захватывает аммиак из портальной крови, поэтому кровь, покидающая печень, практически свободна от аммиака.
Именно поэтому в организме есть системы обезвреживания аммиака, в результате функционирования которых в крови поддерживается его низкая концентрация (около 0,05 ммоль/л). Условно выделяют местные (тканевые), в результате которых происходит временное связывание аммиака; и общие (конечное обезвреживание) пути обезвреживания NH3, благодаря которым он выводится из организма.
Осуществляется в тканях (головной мозг, сетчатка, мышцы, печень, почки и др.) по трем основным путям:
1. Основной путь – это связывание NH3 c глутаминовой кислотой с образованием глутамина (фермент глутаминсинтетаза);
2. Похожая реакция возможна и с аспарагиновой кислотой, но она является энергетически невыгодной, так как АТФ в ней распадается до АМФ и пирофосфата:
Восстановительное аминирование α-кетоглутарата. В мышечной ткани этот процесс приводит к образованию еще одной транспортной формы аммиака. При интенсивной мышечной работе выделяющийся аммиак связывается с α-кетоглутаратом под действием глутаматдегидрогеназы. Образуется глутамат, который вступает в переаминирование с пируватом (образующимся при гликолизе). Синтезируется аланин, который является транспортной формой NH3, доставляемой кровью в печень, где он вступает в переаминирование с α-кетоглутаратом, в результате чего получаются пируват и глутамат. Глутаминовая кислота через аспартат (переаминирование со ЩУК) включает свою NH2-группу в мочевину. Пируват используется в глюконеогенезе для синтеза глюкозы, которая затем транспортируется в мышцы. Этот механизм имеет важное значение для выведения аммиака из мышечной ткани и получил название глюкозо-аланинового цикла.
В почках под действием глутаминазы происходит гидролиз глутамина с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой. Эта реакция защищает организм от излишней потери ионов Na + и К + , которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе активность глутаминазы в почках ингибируется.
Печень – единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, является единственным органом, где происходит ее образование.
В 40-х годах XX века немецкие ученые биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого является орнитин. Поэтому процесс синтеза мочевины получил название орнитиновый цикл, или цикл Кребса-Гензелейта.
Мочевина (карбамид) – полный амид угольной кислоты – содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I с затратой 2 молекул АТФ. Карбамоилфосфат взаимодействует с орнитином при участии орнитинкарбамоилтрансферазы с образованием цитруллина. Он вступает в конденсацию с аспарагиновай кислотой с затратой АТФ, которая распадается до АМФ и пирофосфата. Аспартат – источник второго азота мочевины. Образуется аргининоянтарная кислота, которая аргининосукцинатлиазой ращепляется на аргинин и фумарат. Аргинин аргиназой разрушается на орнитин и мочевину, которая простой диффузией выходит из клеток в кровь и выделяется с мочой.
Фумарат является промежуточным продуктом ЦТК, и фумаразой превращается в малат, который окисляется малатдегидрогеназой в ЩУК. Она вступает в реакцию трансаминирования с глутаминовой кислотой и превращается в аспартат, который вновь используется в синтезе мочевины. Образовавшийся из глутамата α-кетоглутарат вступает в реакцию трансаминирования с любыми аминокислотами. Следовательно, азот аминогруппы сатома азота в мочевине через цепь превращений: АК→α-кетоглутарат→глутамат→ЩУК→аспартат.
Быстрая регуляция происходит на уровне карбамоилфосфатсинтетазы I. Этот фермент аллостерически регулируется N-ацетилглутаминовой кислотой, которая синтезируется внутри митохондрий из глутамата и ацетил-КоА.
Долговременная регуляция зависит от синтеза новых ферментов. Индукция синтеза определяется уровнем пищевого белка. Повышение поступления белков с пищей повышает синтез всех ферментов орнитинового цикла.
Гипераммониемия – повышение концентрации аммиака в крови. Интоксикация аммиаком лежит в основе развития печеночной комы. Одной из главных причин токсичности NH3 на молекулярном уровне является его способность восстановительно аминировать α-кетоглутарат в глутамат. В результате происходит изъятие α-кетоглутаровой кислоты из ЦТК. Это может привести к замедлению регенерации оксалоацетата и, как следствие, к накоплению ацетил-КоА, а через него к кетонемии и ацидозу, а также к ослаблению потока протонов и электронов в ЦТД и снижению продукции АТФ.
Повышенная концентрация аммиака в организме приводит к активации глутаминсинтазы. При этом количество глутамата, который является нейромедиатором в ЦНС и предшественнком ГАМК, истощается. Если гиперамониемия не поддается лечению, то развиваются тяжелые нарушения психики.
Выделяют первичную (врожденную) и вторичную (приобретенную) гипераммониемию.
К настоящему времени описаны врожденные дефекты каждого фермента, участвующего в синтезе мочевины:
1. Гипреаммониемия I-го типа – дефект карбамоилфосфатсинтетазы I.
2. Гипреаммониемия II-го типа – дефект орнитинкарбамоилтрансферазы.
3. Цитруллинемия – отсутствует аргининосукцинатсинтаза.
4. Аргининосукцинатацидурия – дефект аргининосукцинатлиазы.
5. Гипераргининемия – дефект аргиназы.
6. Полная потеря активности хотя бы одного из ферментов орнитинового цикла мочевинообразования приводит в летальному исходу.
При заболеваниях печени (гепатиты) ее функции, в том числе и мочевинообразование снижается, что приводит к накоплению аммиака в организме, так как только в гепатоците присутствует весь набор ферментов для синтеза мочевины. При циррозе печени развиваются коллатерали между портальной веной и нижней полой веной, аммиак попадает в общий кровоток и вызывает интоксикацию, проявляющуюся поражением нервной системы. При усилении катаболических процессов (обширные травмы, опухоли, кахексия) – печень перегружается поступающим аммиаком, который не успевает превратится в мочевину.
Азотемия – повышенное накопление остаточного азота в крови. Остаточный азот крови – азот небелковых азотистых компонентов в сыворотке крови (мочевины, креатинина, креатина, мочевой кислоты, индикана, аминокислот, аммиака). Так как 85% его составляет азот мочевины, поэтому в клинике исследуют не суммарный остаточный азот, а уровень мочевины. Повышение уровня мочевины в крови называется уремия. Уровень мочевины в крови зависит от соотношения процессов ее синтеза и выведения из организма. Выделяют ретенционную и продукционную азотемию (уремию).
Ретенционная азотемия наступает в результате недостаточного выделения с мочой азотсодержащих продуктов (в основном мочевины) при их нормальном поступлении в кровяное русло. Ретенционная азотемия, в свою очередь, может быть почечной и внепочечной. При почечной ретенционной азотемии увеличение количества остаточного азота в крови происходит за счет ослабления экскреторной функции почек (острая и хроническая почечная недостаточность). Внепочечная ретенционная азотемия может возникнуть в результате тяжелой недостаточности кровообращения, снижения артериального давления и уменьшения почечного кровотока (при профузных кровотечениях, травматическом шоке, пороках сердца). Нередко внепочечная азотемия является результатом наличия препятствия оттоку мочи после ее образования в почке (камни и опухоли мочевого пузыря или мочевыводящих путей).
Продукционная азотемия возникает при избыточном поступлении азотсодержащих веществ в кровь, как следствие усиленного распада тканевых белков. Функция почек при этом, как правило, не нарушена.
Так как аммиак является чрезвычайно токсичным соединением, то в тканях (!) существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата:
· синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
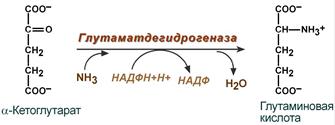
Реакция синтеза глутаминовой кислоты
· синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
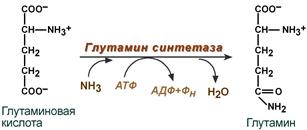
Реакция синтеза глутамина
Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л).
Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового кольца и гуанозинмонофосфата (ГМФ), синтеза цитидинтрифосфата (ЦТФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров).
· синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
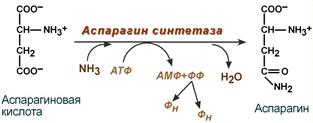
Реакция синтеза аспарагина
· синтез карбамоилфосфата, происходит в митохондриях печени. Реакция является первой в процессе синтеза мочевины - молекулы, в составе которой аммиак удаляется из организма.
Токсичность аммиака
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и, прежде всего на ЦНС.
Механизм токсического действия аммиака:
1. Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глу-ДГ, в сторону образования глу:
α-Кетоглутарат + НАДH2 + NH3 → глу + НАД + .
Уменьшение концентрации α-кетоглутарата вызывает:
o угнетение реакции трансаминирования АК и снижение синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
o снижения скорости ЦТК и развитие энергодефицита.
Недостаточность α-кетоглутарата ускоряет реакции синтеза ЩУК из ПВК, сопровождающейся интенсивным потреблением СО2(особенно характерны для клеток головного мозга).
1. Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону, вызывает алкалоз. Алкалоз увеличивает сродство гемоглобина к кислороду, что препятствует отдачи им кислорода. В результате развивается гипоксия тканей, энергодефицит, от которого главным образом страдает головной мозг.
2. Высокие концентрации аммиака, при участии глутаминсинтетазы, стимулируют синтез глутамина из глутамата в нервной ткани:
3. Глу + NH3 + АТФ → Глн + АДФ + Н3РО4. Накопление глн в клетках нейроглии приводит к повышению в них осмотического давления, набуханию астроцитов и в больших концентрациях вызвает отёк мозга. Снижение концентрации глу нарушает обмен АК и нейромедиаторов, в частности синтез γ-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
4. Ион NH4 + практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток NH4 + в крови нарушает трансмембранный перенос одновалентных катионов Na + и К + , конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
5. Низкие концентрации аммиака стимулируют дыхательный центр, а высокие – угнетают.
2.2.1. Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование.
Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4 + , который не способен проникать через биологические мембраны и задерживается в клетке. Накопление NН4 + вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака (см. рисунок 2.3).
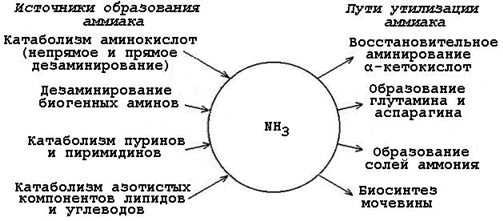
Рисунок 2.3. Образование аммиака в организме и его обезвреживание.
2.2.2. Образование транспортных форм аммиака в тканях. Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин.
Образование глутамина и аспарагина из глутамата и аспартата соответственно происходит во многих тканях, включая головной мозг:

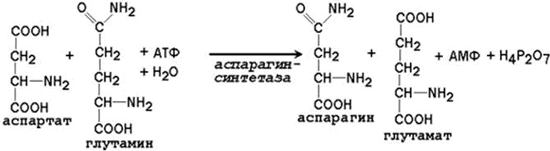
Глутамин - нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина.
Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования (см. параграф 2.1.2), катализируемой глутаматдегидрогеназой:

Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой.
Глутамат + Пируват 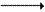
α-Кетоглутарат + Аланин
Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат.
α-Кетоглутарат + Аланин 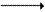
Глутамат + Пируват
Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину.
2.2.3. Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака.

Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака.
Аспарагин аналогичным образом подвергается гидролизу при участии аспарагиназы, присутствующей в клетках канальцев почек.
Аммиак секретируется в просвет почечных канальцев и выводится в виде солей минеральных и органических кислот, например:
NН3 + НСl 
NН4Сl хлорид аммония
Образование солей аммония в почечных канальцах является важным механизмом регуляции кислотно-основного состояния организма. Оно резко возрастает при метаболическом ацидозе - накоплении в организме кислот и снижается при потере кислот организмом (алкалозе).
2.2.4. Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.

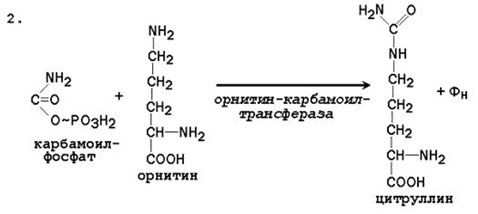
Последующие реакции протекают в цитоплазме клеток печени.
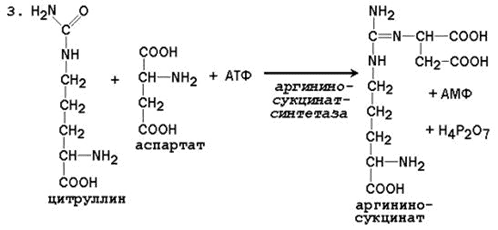
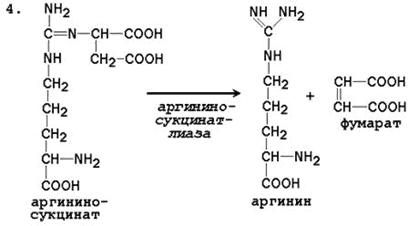

Общая схема орнитинового цикла представлена на рисунке 2.4:

Рисунок 2.4. Схема орнитинового цикла и его связь с превращениями фумаровой и аспарагиновой кислот. Цифрами обозначены ферменты, катализирующие реакции орнитинового цикла: 1 – карбамоилфосфатсинтетаза; 2 – орнитин-карбамоилтрансфераза; 3 – аргининосукцинатсинтетаза; 4 – аргининосукцинатлиаза; 5 – аргиназа.
2.2.5. Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот:
пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе;
поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК;
в цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината.
2.2.6. Регуляция активности ферментов цикла осуществляется главным образом на уровне карбамоилфосфатсинтетазы, которая малоактивна в отсутствие своего аллостерического активатора - N-ацетил-глутамата. Концентрация последнего зависит от концентрации его предшественников (ацетил-КоА и глутамата), а также аргинина, который является аллостерическим активатором N-ацетилглутаматсинтазы:
Ацетил-КоА + Глутамат 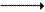
N-ацетилглутамат + КоА-SH
Концентрация ферментов орнитинового цикла зависит от содержания белка в пищевом рационе. При переходе на диету, богатую белком, в печени повышается синтез ферментов орнитинового цикла. При возвращении к сбалансированному рациону концентрация ферментов снижается. В условиях голодания, когда усиливается распад тканевых белков и использование аминокислот как энергетических субстратов, возрастает продукция аммиака, концентрация ферментов орнитинового цикла увеличивается.
2.2.7. Нарушения орнитинового цикла. Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует.
Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4 + в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка.
Лабораторная диагностика заболеваний включает определение содержания аммиака и метаболитов орнитинового цикла в крови, моче и спинномозговой жидкости; в сложных случаях прибегают к биопсии печени.
Значительное улучшение наблюдается при ограничении белка в диете, при этом могут быть предотвращены многие нарушения мозговой деятельности. Малобелковая диета приводит к снижению содержания аммиака в крови и к улучшению клинической картины при мягких формах этих наследственных нарушений. Пищу следует принимать часто, небольшими порциями, для того чтобы избежать резкого повышения уровня аммиака в крови.
2.2.8. Клинико-диагностическое значение определения мочевины в крови и моче. В крови здорового человека содержание мочевины составляет 3,33 – 8,32 ммоль/л. За сутки с мочой выводится 20 – 35 г мочевины.
Изменения содержания мочевины в крови при заболеваниях зависят от соотношения процессов её образования в печени и выведения почками. Повышение содержания мочевины в крови (гиперазотемия) отмечается при почечной недостаточности, снижение – при недостаточности печени, при диете с низким содержанием белков.
Повышение экскреции мочевины с мочой наблюдается при употреблении пищи с высоким содержанием белков, при заболеваниях, сопровождающихся усилением катаболизма белков в тканях, при приёме некоторых лекарств (например, салицилатов). Снижение экскреции мочевины с мочой характерно для заболеваний и токсических поражений печени, заболеваний почек, сопровождающихся нарушением их фильтрационной способности.
Читайте также:


