Результаты российского эпидемиологического исследования распространенности невропатической боли
1. Алексеев В.В. Невропатическая боль: симптомы, механизмы, терапия // Consiliummedicum. 2010. № 2. С. 52–9.
2. Баринов А.Н. Лечение невропатических болевых синдромов // РМЖ. 2003. № 25. С. 1419–22.
3. Баринов А.Н. Роль гомосинаптической стимулзависимой нейрональной пластичности (феномена “взвинчивания”) в хронификации болевых синдромов // Consilium Medicum. 2010. № 2.
4. Баринов А.Н. Современные достижения в понимании механизмов формирования и лечения хронической боли //Неврологический журнал. 2003. № 5б. С. 57–61.
5. Боль. Руководство для врачей и студентов /Под редакцией Яхно Н.Н. М., 2009. C. 304.
6. Данилов А.Б., Давыдов О.С. Нейропатическая боль. М., 2007. C. 192.
7. Кукушкин М.Л. Тактика ведения пациента с невропатической болью // Справочник поликлинического врача. 2009. № 10. С. 39–47.
8. Невропатическая боль: клинические наблюдения / Под редакцией Яхно Н.Н. и др. М., 2009.C. 264.
9. Романенко С.В., Костюк П.Г., Костюк Е.П. Перспективы применения препарата габагамма для лечения диабетических полинейропатий // Наука та інновації. 2009. № 6. С. 64–9.
10. Строков И.А., Ахмеджанова Л.Т. Лечение невропатической боли при диабетической полиневропатии // РМЖ 2008.Т. 16. № 28.
11. Чурюканов М.В. Основные положения рекомендаций Европейской федерации неврологических обществ (EFNS) по диагностике и медикаментозному лечению невропатической боли // Боль 2007. № 3.
С. 38–45.
12. Яхно Н.Н., Баринов А.Н., Подчуфарова Е.В. Невропатическая и скелетно-мышечная боль. Современные подходы к диагностике и лечению // Клиническая медицина 2008. № 11. С. 9–15.
13. Яхно Н.Н., Кукушкин М.Л., Давыдов О.С. и др. Результаты Российского эпидемиологического
исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу //Боль 2008. № 3. С. 24–32.
14. Яхно Н.Н., Кукушкин М.Л., Давыдов О.С. и др. Результаты Российского эпидемиологического исследования распространенности невропатической боли (EPIC Study). Лечение невропатической боли // Consilium-medicum. 2008. № 2.
15. Attal N, Cruccu G, Baron R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2009 revision. Eur J Neurol 2010.
16. Attal N, Cruccu G, Haanpaa M, et al. EFNS guidelines on pharmacological treatment of neuropathic pain. European Journal of Neurology 2006;13:1153–69.
17. Baron R, et al. Causalgia and reflex sympathetic dystrophy: does the sympathetic nervous system contribute to the generation of pain? Muscle Nerve 1999;22:678–95.
18. Baron R. Mechanisms of disease: neuropathic pain – a clinical perspective. Nature Clinical Practice Neurology 2006;2:95–106.
19. Belliotti TR, Capiris T, Ekhato IV, et al. Structureactivity relationships of pregabalin and analogues that target the α2β protein J Med Chem 2005;48:2294–07.
20. Bonhaus DW, Loo C, Secchi R, et al. Effects of the GABAB receptor antagonist CGP 55845 on the anticonvulsant and anxiolytic actions of gabapentin. (XIVth World Congress of Pharmacology, San Francisco: ASPET) Pharmacologist 2002;44:100.
21. Breivik H, Collett B, Ventafridda V, et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain 2006;10:287–333.
22. Catarina MJ, et al. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Science 2000;288:306–13.
23. Cheng JK, Ciou LC. Mechanisms of the antinociceptive action of gabapentin. J Pharmacol Sci 2006;100:471–86.
24. Chizh BA, Scheede M, Schlutz H. Antinociception and (R,S)-alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid antagonism by gabapentin in the rat spinal cord in vivo. Naunyn Schmiedebergs Arch Pharmacol 2000; 362:197–200.
25. Chou R, Norris SL, Carson S, et al. Drug Class Review on Drugs for Neuropathic Pain: Final Report. Portland (OR): Oregon Health & Science University. 2007.
26. Cruccua G, Sommera C, Anand P, et al. EFNS guidelines on neuropathic pain assessment: revised 2009. Eur J Neurol 2010.
27. Dissanayake VU, Gee NS, Brown JP, et al. Spermine modulation of specific [3H]-gabapentin binding to the detergentsolubilized porcine cerebral cortex α2β calcium channel subunit. Br J Pharmacol 1997;120:833–40.
28. Errante LD, Petroff OA. Acute effects of gabapentin and pregabalin on rat forebrain cellular GABA, glutamate, and glutamine concentrations. Seizure 2003;12:300–06.
29. Gu Y, Huang LY. Gabapentin potentiates N-methyl-D-aspartate receptor mediated currents in rat GABAergic dorsal horn neurons. Neurosci Lett 2002;324:177–80.
30. Hong S, Wiley JW. Early painful diabetic neuropathy is associated with differential changes in the expression and function of vanilloid receptor 1. J Biol Chem 2005;280:618–27.
31. Honmou O, Oyelese AA, Kocsis JD. The anticonvulsant gabapentin enhances promoted release
of GABA in hippocampus: a field potential analysis. Brain Res 1995;692:273–77.
32. Lai J, et al. The role of voltage-gated sodium channels in neuropathic pain. Curr Opin Neurobiol 2003;13:291–97.
33. Lindenlaub T, Sommer C. Cytokines in sural nerve biopsies from inflammatory and noninflammatory neuropathies. Acta Neuropathol 2003;105:593–602.
34. Marchand F, et al. Role of the immune system in chronic pain. Nat Rev Neurosci 2005; 6:521–53.
35. Moore KA, et al. Partial peripheral nerve injury promotes a selective loss of GABAergic inhibition in the superficial dorsal horn of the spinal cord. J Neurosci 2002;22:6724–31.
36. Patapoutian A, et al. ThermoTRP channels and beyond: mechanisms of temperature sensation. Nat Rev Neurosci 2003;4:529–39.
37. Price MP, et al. The DRASIC cation channel contributes to the detection of cutaneous touch and acid stimuli in mice. Neuron 2001; 32:1071–83.
38. Sarantopoulos C, McCallum B, Sapunar D, et al. ATP-sensitive potassium channels in rat primary afferent neurons: the effect of neuropathic injury and gabapentin. Neurosci Lett 2003;343:185–89.
39. Surges R, Freiman TM, Feuerstein TJ. Gabapentin increases the hyperpolarization-activated cation
current Ih in rat CA1 pyramidal cells. Epilepsia 2003;44:150–56.
40. Torrance N, Smith BH, Bennett MI, et al. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain 2006;7:281–89.
41. Treede RD, Jensen TS, Campbell JN, et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology 2008;70:1630–35.
42. Wamil AW, McLean MJ. Limitation by gabapentin of high frequency action potential firing by mouse central neurons in cell culture. Epilepsy Res 1994;17:1–11.
43. Wieseler-Frank J, et al. Central proinflammatory cytokines and pain enhancement. Neurosignals 2005;14:166–74.
44. Wood JN. Voltage-gated sodium channels and pain pathways. J Neurobiol 2004;61:55–71.
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

СТРОКОВ И.А., д.м.н., профессор, ГОЛОВАЧЕВА В.А., БРАНД П.Я., к.м.н., Кафедра нервных болезней Первого МГМУ им. И.М.Сеченова
Невропатическая боль вызывается первичным повреждением или болезнью соматосенсорной системы. В основе невропатической боли лежит патологическая активация путей проведения боли, что может быть связано с повреждением нервной системы на уровне периферических нервов, сплетений и задних корешков (периферическая невропатическая боль) или спинного и головного мозга (центральная невропатическая боль). Невропатическая боль снижает качество жизни больных, их социальную адаптацию и трудоспособность и во многих случаях боль плохо поддается лечению. Распространенность невропатической боли в популяции - 6 - 8% и она ассоциирована с хроническими болевыми синдромами, женским полом, пожилым возрастом больных, частым обращением за медицинской помощью и невысоким уровнем социального положения, которые могут рассматриваться как факторы риска.
По данным российского исследования EPIC из 85923 пациентов, обратившихся к врачам-неврологам, жалобы на боль были у 33664 больных (39%). По результатам тестирования с помощью опросника DN4, невропатическая боль выявлена у 15301 пациента (17,8%) [1]. Распространенность невропатической боли, среди всех обратившихся к врачам-неврологам больных в Испании была существенно меньше и составила всего 3,88% [2]. Причины формирования невропатической боли в исследовании EPIC были аналогичны большинству зарубежных исследований, т.е. в большинстве случаев (91.74%) причиной являлись периферические невропатические боли. По частоте доминировали боли в спине (50,58%), а на втором месте также традиционно располагался болевой синдром при ДПН (10,64%). Проблема диагностики и лечения невропатической боли одна из важнейших в современной медицине.
В клинической практике диагностика невропатического характера боли часто бывает затруднена. Ощущение боли всегда субъективно, его нельзя точно измерить и не существует абсолютных критериев, позволяющих выделить невропатическую боль. Судить о патофизиологических механизмах, лежащих в основе болевого синдрома, можно только ориентировочно, основываясь на характеристиках болевых ощущений, данных неврологического осмотра и результатах нейрофизиологического исследования. Причем выявление клинических признаков и изменений электрофизиологических показателей, показывающих патологическое изменение состояния ноцицептивной системы, достоверно не доказывает наличие невропатической боли. Невропатическая боль может возникать сразу после повреждения соматосенсорной системы, например, при острой невропатии тонких волокон, а может развиваться через годы и даже десятилетия после повреждения или появления болезни. Диагностировать невропатический характер боли можно в случае подтверждения нарушения функции соматосенсорной системы при наличии: 1) спонтанных сенсорных симптомов; 2) результатов клинического осмотра с выявлением симптомов поражения нервной системы: позитивная невропатическая симптоматика (стимулозависимая боль) и негативная невропатическая симптоматика (неврологический дефицит); 3) данных нейрофизиологических исследований (ЭМГ, количественное сенсорное тестирование, вызванные соматосенсорные потенциалы). При этом выбор методов исследования определяется результатами неврологического осмотра.
Неврологическая симптоматика позволяет определить наличие, степень и локализацию поражения нервной системы. Для диагностики феномена невропатической боли врача в первую очередь интересует состояние сенсорной системы. Понятно, что в зависимости от периферической или центральной локализации патологического процесса, большое значение для диагностики имеет исследование общего неврологического статуса, включая двигательную и вегетативную системы, в этом случае к негативной симптоматике будут относиться, например, снижение рефлексов, силы мышц, наличие атрофии мышц, сухость и изменение окраски кожи. При выявлении поражения сенсорной системы для диагностики невропатической боли ориентируются на состояние чувствительности, связанной с активацией тонких слабомиелинизированных Aδ- (холодовой стимул и укол тупой иглой) и тонких немиелинизированных С-волокон (болевые и тепловые стимулы). При этом следует помнить, что невропатическая боль обычно возникает в зоне снижения или отсутствия чувствительности, то есть зона болей и нарушений чувствительности в этих случаях совпадает. В последние годы проведение эпидемиологических исследований по изучению распространенности боли базируется на использовании специальных опросников, которые позволяют с высокой степенью точности определить характер боли [3,4].
Невропатическая боль возникает при широком спектре заболеваний периферической и центральной нервной систем (табл.1, табл.2), причем по распространенности периферическая невропатическая боль намного опережает центральную невропатическую боль.
Лечение невропатической боли базируется на современных представлениях о патофизиологических механизмах ее развития [5]. Используются фармакологические воздействия, направленные на уменьшение периферической афферентации, поддерживающей изменение возбудимости ноцицептивных структур спинного и головного мозга, препараты, уменьшающие возбудимость ноцицептивных нейронов, и препараты, усиливающие супраспинальные нисходящие тормозные антиноцицептивные влияния. В тяжелых случаях используется введение фармакологических препаратов близко к центральным рецепторам (интрадурально). Возможно применение электростимуляции периферических нервов, в первую очередь проприоцептивных волокон, для усиления тормозных влияний на возбудимость ноцицептивных нейронов спинного мозга, и иглорефлексотерапии. Хирургическое лечение в случаях, резистентных к фармакотерапии, может включать использование вживляемых электродов в головной или спинной мозг, освобождение нерва из спаек или его декомпрессию, химическое разрушение или перерезку нерва. В таблице 3 представлены европейские рекомендации по лечению невропатической боли, основанные на анализе Кокрановской базы данных контролируемых исследований, за период с 1966 года по 2006 год [6]. Эти рекомендации были разработаны группой экспертов по невропатической боли, возглавляемой французским неврологомв Н. Атталь и обсуждены на нескольких специализированных симпозиумах. При составлении отечественных рекомендаций по лечению невропатической боли было уделено особое внимание анализу европейских рекомендаций [7].
Прегабалин по химической структуре близок к ГАМК и обладает противосудорожным, противотревожным и противоболевым эффектом. Эффект прегабалина не реализуется через конвертацию в ГАМК или взаимодействие с ГАМК-рецепторами. По сравнению с габапентином прегабалин более быстро абсорбируется и имеет более высокую биодоступность (90% против 60%) [8]. Прием пищи не влияет на биодоступность препарата. Важными достоинствами прегабалина по сравнению с габапентином является четкая линейная зависимость концентрации препарата в крови в пределах терапевтического окна (75-600 мг), меньшая дневная доза, более быстрое титрование препарата, меньшее количество побочных эффектов [9].
Проведенные исследования показали, что прегабалин существенно уменьшает интенсивность невропатической боли в течение первых трех суток приема препарата. Длительные исследования (15 месяцев) применения прегабалина при невропатической боли показали, что он сохраняет свой обезболивающий эффект весь период приема без развития толерантности к препарату. Прекрасный противоболевой эффект прегабалина подтверждается улучшением у больных показателей сна,
настроения и качества жизни. Следует отметить, что доказательных данных о способе отмены препарата не имеется, хотя большинство исследователей, исходя из личного опыта, рекомендуют его постепенную отмену.
Основным механизмом действия прегабалина, как и габапентина, является связывание с α2-δ протеином пресинаптических вольтаж-зависимых кальциевых каналов, что приводит к уменьшению поступления кальция в нейрон и снижение уровня его возбудимости, снижению выделения таких нейротрансмиттеров как глютамат, допамин и специфического альгогена – субстанции Р. Этот механизм работает как на спинальном уровне, так и в структурах головного мозга. Следует отметить, что прегабалин обладает в шесть раз большей аффинностью к α2-δ протеину по сравнению с габапентином [10,11].
Время полувыведения препарата составляет 5,5-6,7 часов в зависимости от используемой дозы. Прегабалин не связывается с белками плазмы, не метаболизируется печенью и выводится в неизмененном виде с мочой. Элиминация через почки заставляет использовать меньшие дневные дозы препарата у больных с почечной патологией. Прегабалин не взаимодействует с другими препаратами и может быть использован в различных комбинациях, например с трициклическими антидепрессантами. Прегабалин обычно хорошо переносится больными, но возможны временные дозозависимые побочные эффекты в виде головокружения и сонливости (22-29% больных). Крайне редко возникает сухость во рту, нарушение концентрации внимания, прибавка веса, расплывчатость зрения, периферические отеки на ногах.
Наиболее изученным является противоболевой эффект прегабалина при болевой диабетической полиневропатии. У больных сахарным диабетом возможно развитие разнообразных форм болевой диабетической невропатии, которые отличаются локализацией болей, остротой возникновения и характером болей, хотя во всех случаях боль является невропатической. Классическим вариантом периферической невропатической боли является болевой синдром при диабетической дистальной симметричной сенсорно-моторной полиневропатия. Эпидемиологические исследования, проведенные в США, показали, что невропатическая боль возникает при диабетической полиневропатии чаще, чем при всех вместе взятых полиневропатиях другой этиологии. По данным российского исследования EPIC невропатические боли при диабетической полиневропатии по распространенности уступают только болям в спине [3].
Диабетическая полиневропатия (ДПН) наблюдается приблизительно у 50% больных сахарным диабетом, в то время как невропатическая боль отмечается у 11-24% больных с полиневропатией, что зависит от длительности сахарного диабета и полиневропатии, а также типа диабета. Уже при первом описании больного с ДПН в 1798г. английский врач J.Rollo выделил как основные симптомы боль и парестезии. Клинические проявления, частота, выраженность и продолжительность болевого синдрома при ДПН крайне разнообразны, объединяет их общий признак – невропатический характер боли. Среди пациентов страдающих СД, хроническая боль встречается в 25% случаев, тогда как в популяции распространённость хронических болевых синдромов составляет около 15%, причем разница формируется в большей степени за счёт невропатической боли [12].
Невропатическая боль при ДПН представлена двумя основными компонентами: спонтанной (стимулонезависимой) и вызванной (стимулозависимой) болью. Спонтанная боль может беспокоить постоянно (жгучая боль) или возникать пароксизмально с длительностью болей от секунд до часов (стреляющая боль). Спонтанная боль обусловлена эктопической активностью ноцицептивных С-волокон в результате появления на них в условиях патологии большого числа натриевых каналов и изменением возбудимости болевых рецепторов, приводящим к их активации при низкопороговых стимулах, чего не наблюдается в условиях нормы. Возможно также появление передачи возбуждения с одного волокна на другое – феномен эфаптического возбуждения. Таким образом, усиливается болевая афферентация, приводя в дальнейшем к изменению возбудимости ноцицептивных нейронов ганглия заднего корешка и заднего рога. Процессы нарушения функционального состояния нейронов заднего рога, связанные с механизмами окружающего, пре- и постсинаптического торможения, деафферентации, а также механизмы центральной сенситизации при поражении периферических нервов подробно описаны в обзорах зарубежных и отечественных авторов [3,13,14]. Ноцицептивные сигналы от нейронов заднего рога поступают в зрительный бугор и далее в соматосенсорную кору, где происходит осознание ощущения боли. Показано, что у больных с болевой ДПН в отличие от больных сахарным диабетом без болевого синдрома происходит изменение метаболизма в таламусе [15]. Нейроны центральных сенсорных структур также могут менять свою возбудимость с формированием феномена сенситизации. Все центральные структуры проведения и перцепции боли имеют тесные связи с нисходящими тормозными и активирующими путями. Основные тормозные (антиноцицептивные) влияния связаны с нисходящими путями из околоводопроводного серого вещества и ростро-вентральных отделов продолговатого мозга к заднему рогу. Эти нисходящие тормозные влияния реализуются через норадреналиновую и серотониновую нейротрансмиттерные системы.
В клинических исследованиях прегабалин показал свою высокую эффективность при невропатической боли, обусловленной диабетическим поражением периферических нервов. Уже в первых рандомизированных двойных слепых плацебо контролируемых исследованиях эффективности прегабалина при болевой ДПН, проведенных в начале века, было отмечено, что по сравнению с плацебо препарат достоверно уменьшает болевой синдром [16,17,18]. В рандомизированном двойном слепом плацебо-контролируемом исследовании у 146 больных с болевой ДПН было получено достоверное снижение интенсивности невропатической боли уже в течение первой недели исследования, которое поддерживалось в течение последующих 8 недель приема препарата. В качество качестве основного критерия в исследовании использовалась градуированная визуально-аналоговая шкала Ликерта. Отмечено также значительное улучшение сна и социальных возможностей больных [17]. В другом исследовании на 81 больном показано, что при неэффективности других фармакологических препаратов при болевой диабетической полиневропатии прегабалин в дозе 150-600 мг был достоверно эффективен [19]. В рандомизированном двойном слепом плацебо-контролируемом исследовании японские специалисты в 2011 году изучили эффективность доз 300 мг и 600 мг прегабалина по сравнению с плацебо у 317 больных с болевой ДПН [20]. Длительность курса лечения составила 14 недель, достоверное уменьшение болевого синдрома (p Литература.
15 ноября 2008 года
Исследование проходило в 2 этапа. На первом этапе 322 врача-исследователя из 18 городов России регистрировали всех пациентов, обратившихся к ним на приём в течение 30 рабочих дней. Пациенты, которые набирали 4 и более балла по вопроснику DN4, что соответствует вероятному синдромальному диагнозу нейропатической боли, врач принимал решение о включении больного во второй этап исследования. На втором этапе пациенты с признаками нейропатической боли подвергались детальному анкетированию.
Всего обратилось 85923 пациента, то есть в среднем на 1 врача пришлось 286 пациентов за 30 рабочих дней. Медиана возраста пациентов соответствовала 50 (диапазон от 16 до 91 года). Мужчины составили 40,2% женщины — 59,8% от всех обратившихся.
С жалобами на боль было 33 664 больных (39% от всех обратившихся к врачу). Из всех обратившихся к врачу-неврологу невропатическая боль, по данным вопросника DN4, была выявлена у 15 301 пациентов (17,8%). Из этой группы 6506 пациентов (или 8% от всей группы обратившихся) дали согласие для участия во 2-й фазе исследования.
Среди больных с невропатической болью впервые обратились к врачу 22% больных, повторно 78%. Мужчины составили 41,6%, женщины — 58,4%. Средний возраст этих больных составил 51±13 лет. Наибольший процент больных с невропатической болью составили пациенты в возрасте 50-59 лет (31,9%), а наименьший — пациенты в возрасте моложе 20 (0,4%).
Основные типы заболеваний, сопровождавшиеся невропатической болью, приведены в таблице:
Причина нейропатической боли
% больных
Боль в шейном отделе позвоночника
Боль в грудном отделе позвоночника
Боль в поясничном отделе позвоночника
Диабетическая невропатия
Алкогольная полиневропатия
Дисметаболическая невропатия
Токсическая невропатия
Синдром запястного канала
Другая туннельная невропатия
Невропатия при онкологических заболеваниях
Невропатия при химио/радиотерапии
Острая полирадикулоневропатия
Хроническая полирадикулоневропатия
Плексопатия
Постгерпетическая невралгия
Тригеминальная невралгия
Комплексный регионарный болевой синдром
Фантомная постампутационная боль
Инсульты
Травма спинного мозга
Другие миелопатии
Опухоль головного и спинного мозга
Рассеянный склероз
Сирингомиелия
Постмастэктомический синдром
Постторакотомический синдром
Другое
Из таблицы следует, что наиболее частые состояния, при которых диагностируется невропатическая боль, возникают у больных с болями в поясничном и шейном отделе позвоночника, диабетической полиневропатией, тригеминальной и постгерпетической невралгиями.
Анализ частоты встречаемости того или иного вида невропатической боли свидетельствует о схожести процентного распределения нозологических форм невропатической боли в различных го родах России.
Продолжительность болевого синдрома у обследованных пациентов значительно варьировала (от 4,2 до 28,9 месяцев) и во многом зависела от основного заболевания. Средняя интенсивность боли у пациентов с различными заболеваниями колебалась от 5 до 7,2 баллов по визуально-аналоговой шкале, что соответствует диапазону от умеренной до очень сильной боли. При этом большинство пациентов (59,2%) испытывало постоянные боли с ярко выраженными периодами обострения.
Наиболее частыми симптомами у пациентов с невропатической болью было онемение (79,7%), жгучие боли имелись у 64,8% пациентов, ощущение удара электрическим током отметили 63,4%, температурная аллодиния выявлялась у 51,1%.
Интенсивность испытываемой пациентами боли в значительной степени влияла и на качество жизни пациентов, и на степень нарушения сна. Негативную оценку своему здоровью дали 88% пациентов. Нарушение сна было отмечено у 83,9% пациентов.
Лечение невропатической боли является достаточно трудной задачей для любого врача. Данные, полученные в ранее проведенных эпидемиологических исследованиях за рубежом, свидетельствуют о редком использовании врачами принципов патогенетического лечения невропатической боли и широком применении нестероидных противовоспалительных препаратов (НПВП) и ненаркотических анальгетиков. Результаты российского исследования показали, что в качестве предшествующей медикаментозной терапии в 67% случаев ранее использовались НПВП, а в 49% ненаркотические анальгетики. Согласно рекомендациям Европейской федерации неврологических обществ, препаратами первой линии для лечения невропатической боли являются антиконвульсанты, антидепрессанты и местные анестетики. Данные исследования свидетельствуют о том, что российские неврологи хорошо знакомы с этими рекомендациями. Для лечения постгерпетической невралгии 80% врачей, участвовавших в настоящем исследовании, планировали использовать антиконвульсанты, 52% врачей — антидепрессанты, 31% врачей — местные анестетики. Лечение тригеминальной невралгии 90% неврологов планировали провести с помощью антиконвульсантов, 60% врачей предполагали использовать антидепрессанты, 18% применили бы местные анестетики. В комплекс лечения диабетической болевой невропатии 72% неврологов предполагали включить антиконвульсанты, 59% врачей — антидепрессанты и 12% — местные анестетики. Планируемая медикаментозная терапия центральной невропатической боли включала в себя антиконвульсанты (69% врачей), антидепрессанты (59% врачей), местные анестетики (19% врачей). Проведенный сравнительный анализ терапии невропатической боли, предшествующей первичному визиту, и лечения, планируемого в дальнейшем, показал формирование четкой тенденции в виде сокращения случаев назначения анальгетиков и НПВП, и увеличения доли больных, которым планируется назначить антиконвульсанты и антидепрессанты.
Таким образом, результаты российского эпидемиологического исследования свидетельствуют о большой распространенности невропатической боли в структуре больных с неврологическими заболеваниями, при этом большая длительность и интенсивность болевого синдрома существенно снижают качество жизни пациентов.
Помогите докторам узнать о мигрени больше. Ваше мнение и ощущения очень важны, чтобы мы могли лучше помогать вам справляться с мигренью!
Содержание
- 1 Эпидемиология и факторы риска боли в спине
- 1.1 Эпидемиология боли в спине
- 1.2 Факторы риска возникновения боли в спине
- 1.3 Классификации болей в спине
- 2 Читайте также
- 3 Список рекомендуемой литературы
Эпидемиология и факторы риска боли в спине [ править | править код ]
По результатам изучения эпидемиологии болевых синдромов у взрослого населения России распространенность хронической боли в спине и шее составляет 42,4-56,7% [И.Р. Шмидт, 1992; Д.С. Киселев и др., 2002; С.С. Павленко и др., 2002]. Примерно у 18% пациентов встречается сочетание хронической боли в спине, грудной клетке и головной боли. Головные боли, боли в шее и спине чаще выявляют у лиц с начальным и средним образованием. Все виды хронических болей чаще отмечаются у лиц с низкой самооценкой, овдовевших и разведенных, а также при низкой удовлетворенности жилищными условиями.
По данным недавно проведенного в Германии многоцентрового эпидемиологического исследования, распространенность боли в спине составляет 37,1%, заболеваемость в течение года - 76%. Примерно 7% населения в период исследования испытывали выраженную боль в спине, и 9% были инвалидизированы из-за нее. При этом боль в спине хотя бы раз на протяжении жизни отмечали 85,5% опрошенных [C. Schmidt и др., 2007].
Боль в спине - ведущее состояние в структуре обращаемости за медицинской помощью. По данным эпидемиологического исследования, проведенного в городских поликлиниках Москвы, из 1300 пациентов, первично обратившихся за амбулаторной медицинской помощью, у 24,9% основной причиной обращения была боль в пояснично-крестцовой области. Среди больных, обратившихся по другой причине, боль в спине отмечалась у 3,9%. На протяжении последнего года боль в поясничной области беспокоила 52,9% опрошенных пациентов, а последнего месяца - 38,5% [Ш.Ф. Эрдес и др., 2006]. Среди обратившихся за медицинской помощью в поликлиники г. Саратова (420 411 человек) хроническую боль в поясничной области отмечали 65,1%, в шейной области - 14,4% и грудном отделе - 10,4% случаев [Л.Я. Лившиц и др., 1997]. Другие исследования, проведенные в Саратове, свидетельствуют о том, что боль в спине в структуре болевых синдромов составляет 34% [Ю.А. Лабзин, 1989]. По данным исследования, проведенного в Нижнем Новгороде, боль в пояснично-крестцовой области отмечалась у 23,7% обратившихся за амбулаторной помощью, а в шее и грудном отделе - у 40,1% [М.С. Голод и др., 1997].
Данные обращаемости к врачам общей практики свидетельствуют о том, что за 2 нед примерно 90% пациентов с острой болью в пояснично-крестцовой области выздоравливают. [J. Coste и др., 1994]. В целом эти сведения справедливы, но они недостаточно подкреплены последующими длительными наблюдениями за больными. В упомянутое исследование были включены пациенты с болью в спине, продолжающейся до двух недель, а наблюдение продолжалось не больше месяца [N. Bogduk, B. McGuirk, 2002]. Результаты других исследований указывают на меньшую частоту выздоровления в указанный срок - от 28 до 62% [J.B. Dillane. и др., 1966; A. Chavannes и др., 1986]. В противовес мнению о хорошем прогнозе боли в спине М. Van Korff и др. (1993), основываясь на данных предыдущих исследований, указывают на менее благоприятный прогноз: до 40% пациентов после острого эпизода продолжают испытывать боль в поясничной области 6 мес, а 62% пациентов отмечают повторные обострения в течение ближайшего года. В исследовании, проведенном в Дании, среднее время выздоровления составило 7 нед, при этом до 70% пациентов продолжали испытывать боль в первый месяц наблюдения, 48% - до 8 нед и 35% - после 12 нед наблюдения. У 76% пациентов были отмечены повторные обострения (в среднем два) через 5-12 нед, средней длительностью 3 нед при первом обострении и 2 нед при втором и третьем [H. Van den Hoogen и др., 1998]. Таким образом, прогноз у пациентов с болью в спине может быть оптимистичным в отношении доброкачественного течения и завершения выздоровлением текущего эпизода, однако следует проявлять определенную осторожность относительно прогноза данного состояния в плане возможности его рецидивирования. Можно и нужно объяснять пациенту, что вероятность его выздоровления при первом эпизоде боли в спине высока. При этом врач должен планировать тактику своих действий при возможном повторном развитии такой боли.
К демографическим факторам риска развития боли в спине относят возраст, пол, социально-экономический статус и уровень образования. Первый эпизод боли в спине наиболее часто возникает на третьем десятилетии жизни [J.Kopec и др., 2004]. Высокая заболеваемость отмечается в возрасте от 30 до 60 лет. Повышенная физическая активность лиц молодого возраста, возможно, обусловливает возникновение эпизодов боли в спине. С другой стороны, большая обращаемость за медицинской помощью лиц трудоспособного возраста может быть связана с большим влиянием боли в спине на их повседневную активность по сравнению с людьми старших возрастных групп. С увеличением возраста позвоночник более подвержен повреждениям, даже в отсутствие большой нагрузки, из-за нарастания в нем дегенеративных изменений, что ведет к возникновению хронической боли в спине у пожилых людей.
Среди пожилых боль в спине наиболее часто отмечается у женщин, что, возможно, связано с большей распространенностью среди них остеопороза позвоночника. Важно и то, что женщины чаще мужчин обращаются за медицинской помощью и прекращают работу, в том числе по поводу боли в спине [B. Smith и др., 2004; S. Linton и др., 1998; D. Rubin, 2007]. Острая боль в шейном отделе позвоночника чаще отмечается у женщин, а распространенность хронической боли (длительностью более года) не имеет половых различий [A. Leclerc и др., 1999; J. Hill и др., 2004].
Более низкий социальный статус и уровень образования статистически связаны с более высокой инвалидизацией при боли в спине [K. Hagen и др., 2000; C.E. Dionne и др., 2001; L. Goubert и др., 2004]. Социальный статус и уровень образования тесно связаны между собой, а также с другими факторами - курением, ожирением, хроническим стрессом, характером питания, уровнем физической активности, оказывающими влияние на заболеваемость.
Ожирение (индекс массы тела >30) - независимый фактор риска боли в спине [G. Andersson, 1998]. Она чаще отмечается у курильщиков, но неизвестно, что повышает частоту эпизодов боли в спине в этих случаях - непосредственно курение или связанные с ним состояния (например, частый кашель) [D. Rubin, 2007].
Боль в спине чаще встречается при низкой самооценке состояния здоровья и при наличии ряда заболеваний: сердца, костей, суставов и желудочно-кишечного тракта (ЖКТ), а также мигрени [J. Hartvigsen и др., 2003].
В развитии боли в спине и шее имеет значение повторяющаяся однообразная физическая активность, связанная с работой или особенностями проведения досуга. К факторам риска возникновения боли в спине относят подъем тяжестей, длительные статические нагрузки, воздействие вибрации на рабочем месте [G. Andersson, 1998; Н.В. Торопцева и др., 1995; W. Hoogendoorn и др., 1999, Я.Ю. Попелянский и др., 1980; Е.А. Красникова и др., 1978]. Боль в шее обусловлена длительным пребыванием в положении с наклоном головы или туловища вперед, неудобной позой рук при работе, длительным (более 95% рабочего времени) сидением, а также воздействием вибрации на руки [G. Ariens и др., 2000, 2001]. Боль в спине наиболее часто встречается у операторов станков, работников сферы обслуживания, фермеров [W. Hoogendoorn и др., 1999]. В России изучение распространенности заболеваний рабочих и служащих завода среднего машиностроения показало, что 48% обследованных жаловались на боли в спине в течение жизни, 31,5% - за последний год, 11,5% - в период обследования. У работников автотранспорта и металлургического завода распространенность боли в спине составила 43,8 и 64,8% соответственно [Ш.Ф. Эрдес и др.]. За медицинской помощью по поводу боли в спине чаще обращаются женщины, которые поднимают или перемещают предметы массой более 11,3 кг и те, кто проводит на ногах более 2 ч за рабочую смену [G. Macfarlane и др., 1997]. Неудовлетворенность условиями труда также можно считать фактором риска возникновения боли в шее и пояснице [S. Linton, K. Kamwendo, 1989; P. Leino, G. Magni, 1993].
Есть данные, что и занятия определенными видами спорта (гребля и лыжный спорт) повышают частоту возникновения боли в спине [R. Bahr и др., 2004].
В исследованиях доказана независимая от других факторов значимая связь между психологическими факторами (стрессом, тревожностью, депрессией, пассивными способами преодоления боли, страхом, связанным с болью) и возникновением боли в спине. Психологические факторы имеют большее значение в развитии инвалидизации, связанной с болью в спине, чем биомеханические нарушения позвоночника и суставов конечностей [S. Linton, 2000].
Прогностическими факторами хронизации боли в спине считают признаки, которые можно выделить уже на ранней стадии заболевания. Все прогностические факторы развития хронической боли можно разделить на биологические (демографические характеристики, клиническая картина заболевания) и психосоциальные (представление пациента о болезни, его поведение). К немоди-
фицируемым биологическим факторам риска относят возраст, национальность и пол. Потенциально модифицируемые биологические факторы риска включают в себя вредные привычки, индекс массы тела, детренированность и связанную с ней слабость мышц. К немодифицируемым психосоциальным факторам относят личностные особенности и наличие психических расстройств в анамнезе. Относительно немодифицируемые факторы - это социально-экономический статус, интеллект, образование. Потенциально модифицируемые психосоциальные факторы включают представления о болезни, связанные с ней опасения, страхи пациента и стратегии их преодоления.
При обсуждении конкретных факторов риска хронизации боли в спине важно понимать, что их выявление основано на результатах эпидемиологических исследований с применением различных опросников. Для получения каких-либо статистически значимых результатов необходимо изучить нужные факторы. Соответственно, если исследователь не включил в опросник какой-либо фактор, он и не окажется значимым. При этом факторы, полученные при их выделении из небольшого количества возможных вариантов, могут оказаться значимыми для хронизации боли в одном исследовании и незначимыми при их включении в больший список факторов. Из-за этого наиболее корректными считают исследования, изначально включающие большое количество потенциальных факторов риска и оценивающие их значимость с помощью, например, регрессионного анализа. Пожалуй, в настоящее время практически нет ни одного совершенного в этом отношении исследования факторов риска развития хронической боли в спине. В табл. 1-1 строчными буквами обозначены прогностические факторы риска, которые, по мнению N. Bogduk и B. McGurk (2002), основаны на данных наиболее методически правильно проведенных исследований, результаты менее скрупулезно проведенных исследований приведены курсивом.
Таблица 1-1. Прогностические факторы хронизации боли в спине
Модифицируемость
биологические
психосоциальные
Немодифицируемые
Длительность эпизода боли в спине, боль в спине в анамнезе, иррадиация боли в ногу, частота обострений, занятия спортом во взрослом возрасте
Семейное положение, семейный статус
Выраженность боли, характер работы
Неудовлетворенность работой, образование, результаты теста MMPI * , финансовая компенсация, связанная с болью в спине, низкий уровень заработной платы, профессия, соматизация **
Нетрудоспособность, инвалидизация, курение, индекс массы тела
Депрессия, неадекватные способы преодоления боли, дистресс *** , страх боли, отсутствие понимания со стороны окружающих, признаки неадекватного болевого поведения ****
* MMPI - Minnesota Multiphasic Personality Inventory (Многофакторный миннесотский личностный опросник).
** Соматизация - озабоченность пациента телесными симптомами, не относящимися к соматическому заболеванию.
*** Дистресс - состояние стресса, сопровождающееся выраженными негативными эмоциями и оказывающее вредное влияние на здоровье, при котором истощаются адаптационные возможности.
**** Болевое поведение - совокупность вербальных, мимических, жестикуляционных проявлений, с помощью которых больной информирует окружающих о том, что испытывает боль, болевое поведение считают неадекватным, когда оно подчеркивает наличие боли при отсутствии или минимальной выраженности ее соматической причины.
Из табл. 1-1 видно, что психосоциальные факторы риска наиболее статистически значимы, и их можно считать потенциально модифицируемыми. Психологический портрет пациента, склонного к хронизации боли в спине, описывает человека, страдающего депрессией, страшащегося боли или повреждения позвоночника, сконцентрированного на собственном состоянии и неспособного найти оптимальный (активный) способ преодоления боли. Наличие только одного фактора риска практически не может определять прогноз течения острой боли в спине. Наиболее надежным предиктором хронизации боли может быть только сочетание факторов риска. В частности, в своем исследовании E. Thomas и др. (1999) показали, что основными факторами риска хронизации боли в спине были наличие боли в спине в анамнезе, неудовлетворенность условиями труда, наличие боли в других частях тела, иррадиация боли в ногу, ограничение объема движений в позвоночнике более чем в двух плоскостях и пол пациентов. У больных, имевших не более двух из перечисленных факторов риска, хроническая боль в спине развивалась менее чем в 6% случаев, при наличии 3 и 4 факторов риска - в 27 и 35% случаев соответственно. Однако при выявлении пяти и более факторов риска хронизацию боли отмечали в 70% случаев.
Боль в спине можно классифицировать по длительности, характеру течения, локализации, этиологии, ведущему патофизиологическому механизму, вызывающим ее причинам.
Боль длительностью менее 6 нед считают острой, от 6 до 12 нед - подострой и более 12 нед - хронической. Пациенты с острой, подострой и хронической болью в спине отличаются прогнозом на выздоровление и восстановление трудоспособности, а также подходами к диагностике и лечению.
Я.Ю. Попелянский (1997) предлагал также выделять стадии заболевания: обострение и ремиссия (полная и неполная); этапы обострения: прогрессирование, стационарный этап и регрессия; а также типы течения заболевания:
- эпизодический (единичные обострения боли в спине в течение жизни);
- хронически-рецидивирующий с редкими обострениями (не более одного обострения в год и не более двух недель нетрудоспособности);
- хронически-рецидивирующий с частыми и (или) более длительными обострениями;
- рецидивирующе-прогредиентный (отсутствие ремиссий и тенденция к ухудшению);
- перманентный (хроническое течение с периодическими ухудшениями).
По локализации выделяют локальную, отраженную и иррадиирующую боль.
Локальная боль может быть связана с любым патологическим процессом, который воздействует на болевые рецепторы кожи, мышц, сухожилий, связок, суставов, костей и других тканей. Она обычно постоянна, но может менять свою интенсивность в зависимости от изменения положения тела или при движении. Боль бывает острой, тупой или ноющей, может носить разлитой характер, но всегда ощущается в области тканевого повреждения. Причиной локальной боли в спине может быть, например, фасеточный болевой синдром, при котором пациенты описывают боль в поясничной области ноющего характера, локализующуюся в проекции пораженного сустава. Необходимо отметить, что дисфункция фасеточного (дугоотростчатого) сустава может одновременно быть причиной возникновения отраженной боли. Причиной локальной боли может стать и потенциально опасное заболевание позвоночника, например компрессионный перелом тела позвонка при остеопорозе или его опухолевое поражение.
Отраженная боль распространяется в области, лежащие в пределах дерматомов, связанных с иннервацией поврежденных структур. Обычно она проецируется в эти зоны из внутренних органов, например при заболеваниях поджелудочной железы, патологии ЖКТ, забрюшинного пространства, гинекологических заболеваниях (феномен Хеда-Захарьина). В ряде случаев причиной отраженной боли в позвоночнике могут быть заболевания сосудов. При аневризме брюшного отдела аорты может появляться боль в поясничном отделе позвоночника, которая не связана с физической активностью. Облитерирующее поражение верхней ягодичной артерии может приводить к боли в ягодичной области, которая носит перемежающийся характер и зависит от пройденного пациентом расстояния, напоминая нейрогенную перемежающуюся хромоту при поясничном стенозе (стеноз позвоночного канала на поясничном уровне). При этом боль не провоцируется активностью, увеличивающей нагрузку на позвоночник: наклонами, подъемом тяжести.
Иррадиирующая боль, обычно корешковая, или невральная, отличается высокой интенсивностью, дистальным распространением в соответствующие дерматомы и сопутствующими ей нарушениями чувствительности, рефлекторными и двигательными расстройствами. Механизм этой боли заключается в растяжении, раздражении, сдавлении корешка или соматического нерва. При радикулярной боли ее распространение почти всегда происходит в направлении от позвоночника к какому-либо участку конечности. Кашель, чихание или физическую нагрузку относят к характерным факторам, усиливающим эту боль.
На основании различных патофизиологических механизмов выделяют ноцицептивную, невропатическую и психогенную боль.
Ноцицептивная боль связана с активацией болевых рецепторов - ноцицепторов. Она, как правило, острая, соответствует степени тканевого повреждения и длительности действия повреждающих факторов. Ноцицептивные болевые синдромы возникают в результате активации ноцицепторов при травме, воспалении, ишемии, чрезмерном растяжении тканей. Примерами таких синдромов можно считать боли при воспалении суставов позвоночника. При вовлечении в патологический процесс костной или мышечной ткани возникает ощущение тупой, ноющей боли. Эта боль усиливается при движении, ослабевает в покое и обычно хорошо локализована.
Определение механизмов боли у конкретного больного позволяет выработать патофизиологически обоснованную стратегию лечения.
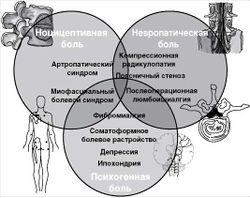
Боль в спине может быть обусловлена изменениями позвоночника (тел позвонков, межпозвоночных дисков, суставов, связочного аппарата) (вертеброгенная боль), повреждениями и заболеваниями мышц, поражением нервной системы (спинного мозга, корешков, периферических нервов), патологией внутренних органов грудной и брюшной полости, малого таза, психическими расстройствами. Считают, что наиболее частой причиной острой боли в спине становятся скелетно-мышечные изменения, связанные с растяжением, микротравматизацией, избыточной перегрузкой мышц, связок или суставов позвоночника [D. Wong, E. Transfeldt, 2007].
Невертеброгенные, связанные с соматической патологией, боли в спине отмечаются у 2% пациентов, обратившихся с жалобами на боль в спине, и обусловлены заболеваниями органов грудной и брюшной полости, таза и забрюшинного пространства [S. Kinkade, 2007].
Таблица 1-2. Основные причины боли в спине (по N. Bogduk, 2002)
Анатомическое образование и наиболее частый характер патологического процесса
Читайте также:


