Седалищный нерв у крысы
Недзвецкий С.В., Куренков Е.Л., Тарасов А.Н.
Челябинская государственная медицинская академия, кафедра нормальной анатомии (зав. кафедрой профессор Куренков Е.Л.), кафедра госпитальной хирургии, реаниматологии и интенсивной терапии (зав. кафедрой профессор Андриевских И.А)
Цель работы. Изучение морфологических изменений седалищного нерва крысы в эксперименте и морфометрическая оценка повреждения нервной ткани.
Материалы и методы. Экспериментальные исследования проведены в центральной научно-исследовательской лабораторииЧелГМА с соблюдением правил использования и содержания лабораторных животных (приказ № 755 МЗ СССР от 12.07.1977 г.), норм асептики и антисептики. Проведено 2 серии экспериментов на 42 беспородных, половозрелых крысах-самцах массой 150-200 г. Первой группе животных субневрально вводили местный анестетик Наропин 0,3 мл 0,22 мг. (n=10), второй 0.3 мл маркаин 0,15 мг (n=10), в третьей – предложенную нами оригинальную смесь 0,3мл лидокаин и маркаин 0,03мг и 0.05 мг соответственно алкалинизированная 3% раствором гидрокарбонатом натрия в объеме 0,1 мл.(n=10). Контролем служили две группы животных, которым вводили изотонический раствор натрия хлорида (n=6) и 96% спирт (n=6) в идентичном объеме. Животных выводили из эксперимента в два этапа - на 1-е и 7-е сутки после введения анестетиков и в контроле (по 21 особи на каждом сроке). Для умерщвления крыс использовали передозировку эфирного наркоза.
Иссеченные участки седалищного нерва длиной 15-20 мм фиксировали в 10% нейтральном формалине в течение 24 часов. Далее кусочки нерва обезвоживали, обезжиривали и подвергали заливке в парафин. Серийные, плоскопараллельные тканевые срезы в количестве 3-6 , толщиной 5-7 мкМ помещали на предметных стеклах. Затем гистологическии срезы окрашивали гематоксилином и эозином по стандартной методике [9, 11].
Для идентификации миелиновых оболочек по Шпильмейеру отрезки нерва подвергались фиксации в 10% формалине в течение 5 суток, после чего из них готовили замороженные срезы, которые окрашивались гематоксилином Гейденгайна. Миелин в составе нервного волокна окрашивался в черный цвет. Объемное содержание миелиновых волокон, зон демиелинизации определяли методом точечного счета с использованием окулярных сеток [2].
Вместе с тем, объемная плотность демиелинизированных зон мякотного волокна на любом сроке увеличивалась только у животных, которым инъецировали спирт (рис. 4.10).
Толщина миелиновых волокон в 1-е и 7-е сутки статистически значимо меньше после анестезии, чем при введении спирта. Статистически значимые различия обнаружены между контрольной группой и животными, подвергшихся анестезии наропином (9,0±0,2 мкм и 9,9±0,1 мкм в 1-е сутки и 8,9±0,1 мкм и 9,8±0,1 мкм соответственно; р
Наименьшее количество нейролеммоцитов в единице площади эндоневрального пространства обнаружено в 1-е сутки после введения спирта (p
Таким образом, результаты нашего исследования согласуются основными патогенетическими механизмами воздействия инъекционных препаратов на периферические нервы. Среди них называют сдавление нервных волокон введенным раствором, ишемию нерва в результате химического повреждения сосудов, питающих нерв и нейротоксичность [5]. При этом считается, что повреждение нервно-тканевого барьера зависит от проникающей способности и экспозиции влияющего фактора [13].
Данные комплексного морфологического изучения показали, что альтеративные процессы в седалищном нерве присутствовали при субневральном введении использованных нами видов растворов. Их проявлением в 1-е сутки после воздействия стали отек стромы нерва, набухание миелиновых оболочек с увеличением диаметра, следовательно, объемной доли мякотных волокон, что согласуется с литературными данными [10, 14]. К 7-м суткам нарастание повреждения миелоархитектоники нерва и развитие экссудативной фазы воспаления имелось только в группе крыс, которым вводили спирт. Картина наблюдаемой нами уоллеровской дегенерации миелиновых волокон периферического нерва согласно литературным данным сохраняется до 14-16 дней после воздействия [1, 16]. В контрольной группе и у животных при введении анестетиков, смеси восстановление структуры нервного ствола происходило к концу первой недели. Отек, появление скудной лейкоцитарной инфильтрации эндоневрия на 7-е сутки после анестезии наропином, вероятно, обусловлены его физико-химическими свойствами, а именно, плохой растворимостью в воде [15]. Возможно, это приводит к более низкой утилизации (всасываемости) препарата в зоне инъекции по сравнению с маркаином и физиологическим раствором. Во всех группах к 7-м суткам наряду с увеличением зон демиелинизации нарастало количество шванновских клеток. Это свидетельствует о репаративных процессах в нервных волокнах, обусловленных пролиферацией клеток-сателлитов нейронов [4, 8, 17].
Полученные нами морфометрические результаты демонстрируют отсутствие значительных различий при использовании в качестве анестетика предложенной смеси по сравнению с контрольной группой. Помимо кратковременности и слабой выраженности повреждения нервной ткани при ее применении морфофункциональное восстановление нерва происходило в короткие сроки, что, вероятно обусловлено влиянием компонентов смеси.
1. Абдуллаев М.-С., Изменения миелоархитектоники нервов человека в условиях хронической ишемии / М.-С. Абдуллаев // Арх. анатомии, гистологии и эмбриологии. – 1988. – Т. XCIV. - № 4. – С. 86-95.
2. Автандилов Г.Г., Медицинская морфометрия / Г.Г. Автандилов. - М.: Медицина, 1990. – 383 с.
3. Акоев Г.Н., Регенерация седалищного нерва кролика после перерезки и применения различных хирургических методов / Г.Н. Акоев, Г.С. Кокин, Е.И. Чумасов и др. // Вопросы нейрохирургии. – 1988. - № 6. – С. 32-37.
4. Архипова С.С., Клетки-сателлиты спинального ганглия крысы после имплантации эмбриональной нервной ткани в разрыв седалищного нерва / С.С. Архипова, И.С. Рагинов, Г.А. Фомина и др. // Морфологические ведомости. – 2007. - № 3-4. – С. 8-12.
5. Берснев В.П., Постинъекционные повреждения периферических нервов / В.П. Берснев, А.В. Бабин, Е.И. Чумасов, К.М. Светикова // Вопросы нейрохирургии. – 1991. - № 1. – С. 25-27.
6. Волчков.В.А. Болевые синдромы в анестезиологии и реаниматологии/ Волчков.В.А., Игнатов.Ю.Д., Страшнов.В.И.// М.; МЕДпресс-информ,2006.-320 с.
7. Евтушенко В.П., Клинико-морфологическая характеристика хронического эндоцервицита: дис. … канд. мед. наук / В.П. Евтушенко. - Челябинск. – 2003. – С. 46.
8. Жук О.Н., Влияние фактора роста нервов на регенерацию волокон в седалищном нерве крыс / О.Н. Жук, В.Н. Калюнов // Морфология. – Т. 110. - № 4. – С. 113-115.
9. Лилли Р.Д., Патогистологическая техника и практическая гистохимия / Р.Д. Лилли. – М., 1969. – 645 с.
10. Мирошникова М.Е., Регенерация седалищного нерва крысы после его различных экспериментальных повреждений / М.Е. Мирошникова, Е.И. Чумасов // Арх. анатомии, гистологии и эмбриологии. – 1988. – Т. XCV. - № 1. – С. 30-35.
11. Пирс Э., Гистохимия теоретическая и прикладная: Пер. с англ. / Э. Пирс. – М., 1962. – 962 с.
12. Реброва О.Ю., Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTIKA / О.Ю. Реброва.- М.: Медиасфера, 2003. - 312 с.
13. Солнышкова Т.Г., Ультраструктурные изменения коры полушарий большого мозга при острой и подострой интоксикации природным сероводородсодержащим газом / Т.Г. Солнышкова, В.А. Шахламов // Арх. патологии. – 2003. – Т. 65. - № 2. – С. 17-20.
14. Солнышкова Т.Г., Патоморфологические изменения микроглии при хронической интоксикации сероводородсодержащим газом / Т.Г. Солнышкова, Ю.Г. Пархоменко // Арх. патологии. – 2003. – Т. 65. - № 3. – С. 41-44.
15. Справочник Видаль. Лекарственные препараты в России: Справочник. – М.: АстраФармСервис, 2004. – 1390 с.
16. Чумасов Е.И., Регенерация нервов под влиянием бализа-2 и лактовита / Е.И. Чумасов., А.Я. Шурыгин, С.Ю. Солдатова и др. // Морфология. – 1993. – Т. 104. - № 5-6. – С. 25-33.
17. Ramer M., Functional regeneration of sensory axon into adult cord / M. Ramer, J. Priestley, S. McMahon // Nature. – 2000. – V. 403. – P. 312-316.



ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Посттравматические процессы в двигательной системе, вызванные
повреждением нервного волокна.
1.2. Формирование компенсаторной иннервации мышц
1.3. Билатеральная организация рефлекторных отношений спинного мозга
1.3.1. Сгруктуриая основа билатеральной интегративной деятельности спинного
1.3.2. Контралатеральные эффекты при односторонней травме нерва.
1.4. Вызванные электрические ответы мышцы.
2. ОБЪЕКТЫ, МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ.
3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1. Состояние контралатерального нейромоторного аппарата при одностороннем пережатии седалищного нерва
3.1.1. Исследование центральных структур нервномышечного аппарата
3.1.1.1. Влияние одностороннего пережатия седалищного нерва на параметры рефлекторных ответов контралатеральной ИМ крысы.
3.1.1.2. Влияние одностороннего пережатия седалищного нерва на харакгер импульсации двигательных единиц контралатеральной ИМ крысы
3.1.1.3. Влияние одностороннего ограничения двигательной функции
трехглавой мышцы голени на параметры рефлекторных ответов
контралатеральной ИМ крысы
3.1.1.4. Влияние одностороннего ограничения двигательной функции
трехглавой мышцы голени на характер импульсации двигательных единиц контралатеральной ИМ крысы
3.1.2. Исследование периферических структур нервномышечного аппарата
3.1.2.1. Влияние одностороннего пережатия седалищного нерва на параметры моторных ответов контралатеральной ИМ крысы
3.1.2.2. Влияние одностороннего пережатия седалищного нерва на электрические ответы контралатеральной ИМ крысы при прямой стимуляции.
3.2. Состояние ипсилатерального нейромоторного аппарата при пережатии седалищного нерва
3.2.1. Исследование центральных структур нервномышечного аппарата
3.2.1.1. Влияние пережатия седалищного нерва на параметры рефлекторных
ответов ипсилатеральной ИМ крысы.
3.2.2. Исследование периферических структур нервномышечного аппарата
3.2.2.1. Влияние пережатия седалищного нерва на параметры моторных ответов ипсилатеральной ИМ крысы.
3.2.2.2. Влияние пережатия седалищного нерва на электрические ответы ипсилатеральной ИМ крысы при прямой стимуляции.
3.3. Качественный состав миозинов ипси и конгралатеральной КМ крысы после одностороннего пережатия седалищного нерва
3.3.1 Влияние одностороннего пережатия седалищного нерва на качественный состав миозинов контралатеральной КМ крысы.
3.3.2. Влияние пережатия седалищного нерва на качественный состав миозинов ипсилатеральной КМ крысы.
3.4. Состояние ипси и контралатерального нервномышечного аппарата при односторонней операционной травме
3.4.1. Влияние операционной травмы на характеристики моторных и рефлекторных ответов ипси и контралатеральной ИМ крысы
3.4.2. Влияние операционной травмы на качественный состав миозинов ипси и контралатеральной КМ крысы
4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ.
5. ВЫВОДЫ.
6. СПИОК ЛИТЕРАТУРЫ.
ВВЕДЕНИЕ
Актуальность
Целью работы явилось изучение влияния пережатия седалищного нерва крысы на состояние симметричного нейромоторного аппарата трехглавой мышцы голени. Рефлекторную возбудимость мотонейронного пула ипси на стороне операции и контралатеральной на противоположной стороне икроножной мышцы. Поведение двигательных единиц контралатеральной икроножной мышцы. Качественный состав миозинов симметричных камбаловидных мышц. II. Изучить воздействие тенотомии на рефлекторную возбудимость мотонейронного пула контралатеральной икроножной мышцы. Научная новизна. В работе показано, что одностороннее пережатие седалищного нерва изменяет состояние контралатерального двигательного центра трехглавой мышцы голени крысы. Эти изменения, в целом, соответствуют преобразованиям, происходящим в ипсилатеральном двигательном центре. Впервые описана трансформация состояния мотонейронного пула и отдельных мотонейронов контралатерального двигательного центра в различные сроки после пережатия седалищного нерва. Установлено влияние механической травмы нерва на эффекторное звено контралатерального нейромоторного аппарата. Результаты исследования уточняют сведения о взаимосвязи ипси и контралатерального двигательного центра, опосредуемой различными внутриспинальными связями, в частности, латентными в норме и активирующимися после повреждающих воздействий. Теоретическая и практическая значимость полученных результатов. Полученные результаты дополняют существующие представления о некоторых механизмах управления движениями и раскрывают новые стороны дифференцированного влияния повреждения нерва на спинальные двигательные центры. Выявленный в работе характер воздействия травмы нервного волокна на рефлекторную возбудимость мотонейронов симметричных спинальных двигательных центров может лежать в основе процессов в центральной нервной системе, развивающихся в процессе восстановительной реорганизации системы моторного контроля. Полученные результаты могут стать новым инструментом для понимания билатерального характера процесса восстановления двигательной функции. Проделанная работа может представлять интерес для физиологов и врачей, а также может быть использована в учебных курсах по физиологии центральной нервной системы. Положение, выносимое на защиту. Пережатие седалищного нерва изменяет состояние центрального и периферического звена не только ипси, но и контралатерального нейромоторного аппарата трехглавой мышцы голени крысы. Изменение состояния контралатерального спинального двигательного центра обусловлено активацией внутриспинальных нейронных систем. Еще в середине прошлого века было установлено, что пересеченные нервные волокна подвергаются распаду на всем протяжении дистальнее места повреждения А. Валлеровская вторичная дегенерация нервных волокон дистальнее места их перерезки происходит неизбежно, независимо от сроков соединения концов пересеченного нерва, даже если шов наложить в первые секунды после повреждения. В периферическом отрезке волокна с течением времени происходит полный распад аксонов и их окончаний, а также миелиновых оболочек. При повреждении аксона его открытый проксимальный конец подвергается рефакции, несколько утолщается и в течение нескольких минут закрывается за счет слипания мембран . Морфологические изменения нервных волокон дистальнее места повреждения возникают уже в первые часы после травмы и постепенно нарастают. У крыс на 3и сутки после травмы седалищного нерва на расстоянии 5 мм дистальнее зоны повреждения миелиновые оболочки набухают и разволокняются, а следующие в разных направлениях коллагеновые волокна увеличиваются в количестве при отсутствии значительных альтераций базальных мембран Жук О. II. В.Н. Нарушается структура осевого цилиндра он фрагментируется, наблюдается распад входящих в его состав органелл. В течение суток набухают, вакуолизируются митохондрии, распадаются другие структуры аксона. Все эти изменения первоначально более отчетливо выражены в толстых миелинизированных волокнах. Безмиелиновые волокна оказываются устойчивыми и распадаются на суток позднее .
Ввиду глобального увеличения диабета и того факта, что недавние данные показывают, что диабетическая невропатия чаще встречается у мужчин, крайне важно оценить любые гендерные различия в регенерации нервов при диабете. Наша цель состояла в том, чтобы оценить в краткосрочных экспериментах гендерные различия в аксоновском разрастании у здоровых и у генетически развитых диабетиков 2-го типа Goto-Kakizaki (GK), а также исследовать связь между активированными (то есть ATF-3, активация транскрипционного фактора 3 ) и апоптотические (расщепленные каспазы 3) клетки Шванна после травмы и восстановления седалищного нерва. Женских и мужских диабетических крыс GK, спонтанно развивающегося диабета типа 2, сравнивали с соответствующими здоровыми крысами Wistar. Серийный нерв был подвергнут трансплантации и мгновенно восстановлен. Через шесть дней нерв собирали для измерения роста аксонов (то есть окрашивания нейрофиламентом) и для количественного определения количества ATF-3 (то есть активированного) и расщепленного каспазы 3 (то есть апоптотического) окрашивали клетки Шванна с использованием иммуногистохимии.
Аксональный рост обычно был более выраженным у мужчин, чем у самок крыс, а также более длительный у здоровых, чем у крыс с диабетом. Различия наблюдались в числе активированных клеток Шванна как в сегменте дистального нерва, так и вблизи участка поражения. В частности, у женщин диабетических крыс было меньшее число. Не было гендерных различий в количестве расщепленных каспаз 3 окрашенных клеток Шванна, но крысы с диабетом проявляли больше (такие расщепленные каспазы 3 окрашенные Шванн) клетки как на участке поражения, так и в дистальной части седалищного нерва. Аксональный рост коррелировал с количеством окрашенных ATF3 клеток Шванна, но не с уровнями глюкозы в крови или расщепленными каспазами 3 окрашенных клеток Шванна. Однако количество расщепленных каспаз 3 окрашенных клеток Шванна коррелировало с уровнем глюкозы в крови.
Мы пришли к выводу, что существуют гендерные различия в регенерации нервов у здоровых крыс и у крыс с диабетом типа 2 у 2-го типа.
Нейропатия, которая является общим осложнением как при диабете типа 1, так и типа 2, может вызвать серьезные проблемы у пациентов, особенно у мужчин с диабетом 2 типа [1]. Мужские пациенты также, как представляется, развивают невропатию раньше, чем женщины [1, 2]. Механизмы развития нейропатии сложны и не полностью поняты, и почему пациенты мужского пола не выражают нейронные осложнения раньше, чем женщины. Гендерные различия также имеют отношение к травматическим повреждениям нервов, поскольку такие травмы чаще затрагивают мужчин.
Более ранние исследования показали, что нейроактивные гормоны или стероиды (влияющие на нервные системы), такие как тестостерон и прогестерон, играют активную роль в регенерации нервов и что уровни нейроактивных стероидов различаются у самцов и самцов крыс, среди здоровых и диабетических крыс [ 3-5]. Недавние результаты показывают, что разрастание аксонов через шесть дней после повреждения и ремонта нервов не отличается между здоровым и диабетическим ВВ (т.е. генетически развитым и похожим на диабет 1 типа [6]) (самки). Однако оба числа активированных и апоптотических клеток Шванна, которые присутствуют в сегменте дистального нерва, были значительно выше у женщин-диабетических крыс-крыс, чем у здоровых крыс у женщин [6]. Интересно, что сообщалось о положительной корреляции между аксональным выростом и активацией клеток Шванна (т. Е. Окрашиванием ATF 3), что указывает на важность клеток Шванна для регенерации нервов и что момент времени для восстановления нервов имеет решающее значение для роста аксонов 9. Необходимо уточнить процесс регенерации нервов с гендерной точки зрения, а также в отношении модели крысы с генетически развитым диабетом, подобным типу 2, в отличие от модели диабета, индуцированной стрептозотоцином [10]. Это актуально с учетом глобального увеличения числа пациентов с диабетом типа 2, где часто присутствует невропатия, и того факта, что самцы часто страдают травматическими повреждениями нервов, особенно в верхней конечности, которые требуют ремонта или реконструкции нервов , Таким образом, наши цели были в два раза; исследовать любые гендерные различия в регенерации нервов после травмы нервов и восстановления здоровых крыс с краткосрочной точки зрения и выяснить, отличается ли этот процесс у генетически развитых диабетических крыс Goto-Kakizaki типа 2. В заключение мы обнаружили различия между здоровыми и диабетическими крысами с использованием подходящей модели диабетического животного, а также между самцами и самками крыс с интересными корреляциями.
Номер работы: 68696
Без учета скидки. Вы получаете файл формата pdf
Вы получаете первые страницы диссертации в формате txt
Просмотр 1 страницы = 3 руб
Оглавление диссертации:
Актуальность исследования. Ежегодно в мире проводится более 2 млн. реконструктивных операций с целью восстановления посттравматического дефекта периферических нервов (Sharon, Fishfeld, 2002). Несмотря на широкое применение различных подходов и методов лечения, остается достаточно высока степень инвалидизации больных (Шевелев, 1983; Lee, Wolfe, 2000). Одним из перспективных подходов для улучшения результатов реконструктивных операций на нерве считается использование фармакологических стимулято
. К наиболее старым попыткам пластического замещения обширных дефектов нервов относятся разнообразные способы так называемой тубуляции, имевшие целью соединить концы нерва трубками из мертвых тканей или инородных материалов. В разное время предлагалось пересаживать в дефект нерва куски артерий, вен, декальцинированную кость, трубки из магнезии, резины, желатины, агар-агара и т.п. (Григорович, 1981). Подобные предложения были основаны на старых представлениях о свободном росте аксонов по линии
. Одним из подходов в лечении больных с дефектами нервных стволов является метод интраоперационного (кратковременного) удлинения отрезков поврежденного нерва с последующим сшиванием его концов (Богов и др., 2000). Как показывают исследования, данный метод позволяет за 20 минут за счет тракционной нагрузки 100 г достичь удлинения седалищного нерва крысы на 11,5% его длины. При этом выживает достаточно большое количество чувствительных нейронов в спинномозговом узле L5. Функциональное состояние
. Данные, полученные при исследовании методов вытяжения периферического нерва, позволили с новых позиций подойти к вопросу о допустимости растяжения сшитого нерва. Как указывают исследователи, способ компенсации дефекта дозированным встречным вытяжением его отрезков по результативности превосходит аутонервную пластику и сопоставим с нейрорафией (Skoulis et al., 1995; Щудло и др., 1996). Хотя по данным G. Hall и С. Van-Way (1994) не выявлено достоверной разницы в эффективности регенерации нерв
. Биодеградирующие материалы структурируют ткань и поддерживают ее регенерацию на заданном этапе, а затем, выполнив свою задачу, подвергаются рассасыванию и исчезают, не ухудшая впоследствии функцию восстановленных биологических структур. В эксперименте для восстановления целостности нерва используют полые проводники (кондуиты) на основе широкого 17 спектра синтетических биодеградирующих материалов. Среди них полиэфиры полилактидкогликолид (Widner et al., 1999), — наиболее широко используемый
. В клинической практике дефект, возникающий при повреждении периферического нерва, замещают путем формирования прямых анастомозов между центральным и периферическим отрезками нерва. Нередко соединить отрезки поврежденного нерва невозможно, так как фрагмент отсутствует. Натяжение отрезков нерва и их последующее сшивание, как указывают многие исследователи (Seddon, 1963; Millesi, 1972; Terzis, 1975; Григорович, 1981; Белоусов, 1988; Kalomiri, 1994), приводят к развивающейся ишемии и образовани
. Перспективным методом для улучшения результатов реконструкции периферического нерва считается применение различных фармакологических стимуляторов его регенерации. Фармакологический стимулятор регенерации должен поддерживать посттравматическое выживание нейронов и регенерацию периферического нерва. Данными свойствами в разной степени обладают факторы роста (Tanabe et al., 2003), нейротрофические факторы (Hirata et al., 2002; Marcol et al., 2004), гормоны (Voinesco et al., 1998; Blacklock et
. В спинальном ганглии крысы по морфо-функциональным и цитохимическим критериям различают три основные субпопуляции нейронов: малые, средние и большие. Малые нейроны преимущественно являются болевыми и подразделяются на:
1) непептидергические, связывающие изолектин Griffonia simplicifolia 29 (IB4) (Silverman, Kruger, 1990), экспрессирующие рецепторы глиального нейротрофического фактора (GDNF) и, как правило, нечувствительные к нейротрофинам (Molliver et al., 1997);
. Успех регенерации периферического нерва в значительной мере определяется способностью нейронов выживать после травмы. Становится все более очевидным, что псевдоуниполярные нейроны спинального ганглия по-разному реагируют на перерезку и лигирование периферического отростка. В первом случае регенерация отростка разрешена, а при лигировании нерва она запрещена (Челышев, Рагинов, 2002; Рагинов, Челышев, 2003). При травме периферического нерва незначительная часть нейронов спинальных ганглиев ги
. После повреждения периферического нерва изменяется количество чувствительных нейронов, вырабатывающих нейротрофические факторы. Так, после перерезки нерва увеличивается количество нейронов, экспрессирующих мРНК BDNF (Zhou et al., 1999b). Выработка м-РНК BDNF в ответ на травму нерва показана не только в нейронах, но и в клетках-сателлитах (Zhou et al., 1999с). После лигирования спинномозговых нервов уровень м-РНК NGF в спинальных ганглиях возрастает в 4 раза и поддерживается в течение 3 неде
. У животных под уретановым наркозом (600 мг/кг, в/б) производили оперативный доступ к левому седалищному нерву. На уровне середины бедра иссекали фрагмент нерва, формируя диастаз длиной 5 мм. Центральный и периферические концы нерва соединяли силиконовой трубкой (НИИРП, Россия) длиной 7 мм и внутренним диаметром 2,2 мм. Трубку на каждом конце фиксировали к периферическому и центральному отрезкам при помощи четырех эпиневральных швов мононитью
8.0 с атравматической иглой (Целита, Россия
. Реконструктивную операцию на седалищном нерве крысы проводили в соответствии с нижеописанным протоколом эксперимента. 1. Получение эмбрионального материала.
а) Под уретановым наркозом (600 мг/кг, в/б) у самок с датированной 14-и дневной беременностью производили оперативный доступ к плодному пузырю, путем срединной лапаротомии.
б) Выделяли плодный пузырь, содержащий в себе эмбрионы, который помещали в оксигенированный раствор Рингера-Кребса (95% 02 + 5% ССЬ), охлажденный до 4°С.
. Хроническое вытяжение периферического отрезка седалищного нерва производили при помощи аппарата оригинальной конструкции (рис. 4). Рис. 4. Аппарат для хронического вытяжения нерва. Аппарат представляет собой изготовленную из твердого материала вертикальную планку, имеющую в основании, перпендикулярно выполненную небольшую пластину (1). Именно благодаря этой пластине аппарат твердо фиксируется на поверхности подлежащей костной ткани в одной точке при помощи кортикального шурупа, который вк
. У животных под уретановым наркозом (600 мг/кг, в/б) производили оперативный доступ к левому седалищному нерву. На уровне середины бедра формировали диастаз длиной 5 мм, после чего собственный иссеченный фрагмент нерва тотчас подшивали в сформированный диастаз, накладывали по 6 эпиневральных швов на каждом конце вставки (рис. 6). Далее рану ушивали послойно, животных оставляли на 30 суток в стандартных условиях вивария. Рис. 6. Аутонервная вставка. Иссеченный 5 мм фрагмент нерва подшивали
. Через 30 суток после реконструктивных операций на нерве во всех опытных и контрольных группах под уретановым наркозом (600 мг/кг, в/б) выделяли спинальный ганглий L5 на стороне операции. Материал фиксировали в 10% нейтральном формалине, обезвоживали и заливали в парафин. Каждый 5-й серийный срез толщиной 7 цм окрашивали метиленовым синим, подсчитывали количество нейронов с видимыми ядрышками (Henken et al., 1990). Непрямым стрептавидин-биотиновым методом, используя LSAB-kit (DAKO), исследов
(ФИСН). Функциональный индекс седалищного нерва использовали для оценки восстановления двигательной функции оперированной конечности (Bain et al., 1989; Inserra et al., 1998). Индекс определяли по следующей формуле: ФИСН =
118.9 ЭШП-НШП1 НИШ -
7.5 где, ЭШП — расстояние между первым и пятым пальцами в эксперименте, НШП — расстояние между первым и пятым пальцами у интактных животных, ЭДС — длина стопы в эксперименте, НДС — длина стопы у интактных живо
. Во всех экспериментальных группах с тубуляцией нерва силиконовой трубкой, содержащей в качестве депонирующей среды карбоксиметилцеллюлозу, функциональный индекс седалищного нерва резко возрастал начиная со 2-х суток после операции. Практически на всех сроках наблюдений его наибольшие значения зарегистрированы в случае воздействия на нерв ксимедона в концентрации 0,95%. К 21- и 28-м суткам после операции эти значения достоверно возрастали на 57,1% (Р Гистология, цитология, клеточная биология . Диссертация Посттравматическая регенерация седалищного нерва крысы в условиях его тубуляции и вытяжения : диссертация . кандидата медицинских наук : 03.00.25, Саранск, 2006
Помочь может простейшая растяжка.
Что такое защемление седалищного нерва
Седалищный нерв — самый длинный What is Sciatica нерв в человеческом теле. Он начинается в нижней части спины, в районе поясницы, и, расщепляясь на две части, тянется через ягодицы, бёдра, икры к ступням. Именно этот нерв обеспечивает подвижность ног, связывая расположенные в них мускулы с ЦНС.
Но всё хорошо лишь до тех пор, пока однажды седалищный нерв не оказывается раздражён или защемлён. Чаще всего причиной этого становится межпозвоночная грыжа.
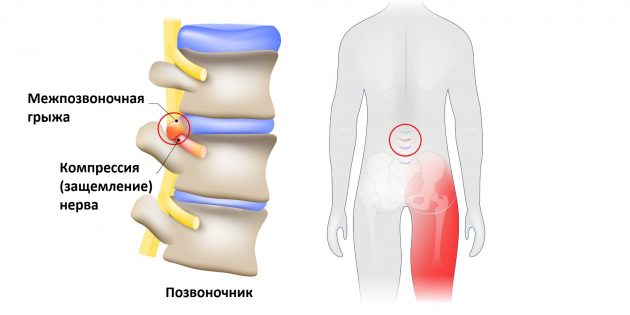
Фото: Designua / Shutterstock
Выпятившаяся часть межпозвоночного диска давит на седалищный нерв. Это приводит к болезненным ощущениям в пояснице или по всей длине ноги. Такую ситуацию называют защемлением седалищного нерва, или ишиасом What You Need To Know About Sciatica .
Впрочем, ишиас можно заработать и другими способами. Травма, костная шпора (чрезмерный рост кости) на позвонках, диабет (это заболевание повреждает нервы) или, положим, опухоль — всё это тоже может спровоцировать защемление.
Как понять, что у вас защемление седалищного нерва
Предположить ишиас можно по следующим симптомам Sciatica Symptoms :
- Болезненные ощущения затрагивают только одну ногу (сторону тела).
- Кажется, что боль распространяется от поясницы в ягодицу и далее вниз по ноге. Если говорить о ногах, то неприятные ощущения чаще всего проявляются в задней части бедра и голени.
- Боль носит разный характер — от слабой ноющей до жжения или внезапного простреливания. Иногда она бывает похожа Sciatica: Symptoms and Causes на удар током.
- Кроме боли, а в некоторых случаях вместо неё могут присутствовать онемение, покалывание или мышечная слабость в пострадавшей ноге.
- Ваше состояние зависит от позы или движений. Так, боль обостряется, когда вы кашляете или чихаете. А после некоторого времени, проведённого сидя, дела у поясницы или ноги явно становятся хуже.
Когда надо обратиться к врачу
Как правило, приступы ишиаса длятся недолго, а их болезненность постепенно уменьшается и в течение нескольких недель исчезает вовсе. Этот процесс ускоряется, если выполнять упражнения на растяжку нижней части спины и бёдер (о них чуть дальше). Но так бывает не всегда.
Обязательно обратитесь к терапевту, если:
- болезненные ощущения длятся дольше недели, не уменьшаясь и не реагируя на домашний уход;
- боль так сильна, что ощутимо снижает качество жизни и вы вынуждены ежедневно принимать обезболивающие;
- с каждым днём приступы ишиаса становятся чаще, а боль — сильнее.
Защемление лечит не терапевт, но он, выслушав жалобы и проведя осмотр, направит вас к нужному узкому специалисту: неврологу, хирургу, ортопеду или, положим, эндокринологу. А уже эти медики поставят основной диагноз и помогут справиться с заболеванием и физическим дискомфортом.
Вызывайте скорую или обращайтесь в отделение неотложной помощи, если:
- у вас появилась внезапная и очень сильная боль в пояснице или ноге, при этом вы ощущаете отчётливое онемение и мышечную слабость;
- боль возникла сразу после серьёзной травмы, например ДТП или падения с высоты;
- помимо боли, появились проблемы с контролем над мочевым пузырём или кишечником.
Как лечить защемление седалищного нерва
Лечение требуется лишь в том случае, если у вас присутствуют опасные симптомы, которые перечислены выше. В зависимости от поставленного диагноза врач назначит Sciatica: Diagnosis and Treatment вам лекарственные препараты (это могут быть противовоспалительные или противосудорожные средства, мышечные релаксанты, инъекции кортикостероидов), отправит на физиотерапию или порекомендует подумать о хирургической операции.
Но чаще всего от неприятных ощущений при ишиасе вполне можно избавиться домашними методами. Вот что рекомендуют эксперты американской исследовательской организации Mayo Clinic.
Читайте также:





